Chapitre III Cristaux ioniques I EXISTENCE DES IONS
































![La coordinence • Leur coordinence est donc : • O/O = [12] • Na/O La coordinence • Leur coordinence est donc : • O/O = [12] • Na/O](https://slidetodoc.com/presentation_image_h2/b00593090c77fa59ff1e144c24643fe7/image-61.jpg)






















- Slides: 90

Chapitre III Cristaux ioniques I EXISTENCE DES IONS La présence des ions dans les solutions salines aqueuses et dans les sels fondus est mise en évidence, en particulier par l’étude de la conductivité électrique. Ce pendant, cette technique ne démontre pas leur existence dans le cristal. L’existence d’ions a été prouvée à partir des mesures de résonance magnétique nucléaire, puis confirmée par la mesure des intensités de rayons X diffractés par un cristal ionique.

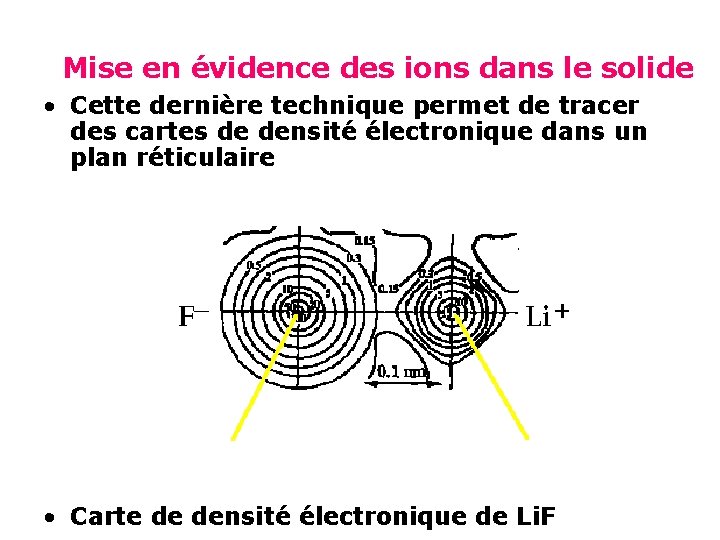
Mise en évidence des ions dans le solide • Cette dernière technique permet de tracer des cartes de densité électronique dans un plan réticulaire • Carte de densité électronique de Li. F

• Les lignes correspondent à des valeurs constantes de la densité électronique par Ǻ 3 • Par intégration, on peut déterminer le nombre total d’électrons entourant chaque ion. • On a ainsi trouvé approximativement 2 e- entourant le noyau du Lithium 10 e- entourant le noyau du Fluore; dans le cas de Li. F et 10 e- entourant le noyau du sodium, 18 e- entourant le noyau du chlore; dans le cas Na. Cl

• Ceci montre que les atomes neutres du lithium (3 e-)ou sodium(11 e-) et du fluore(9 e-)ou Cl(17 e-) n’existent pas ; ils sont remplacés par les ions Li+(2 e-) ou Na+(10 e-) et F- (10 e-) ou. Cl-(18 e-), par suite des deux demi réactions redox. • Li = Li+ + e • ½ F 2 + e- = F- • 2(Na = Na+ + e-) • Cl 2 + 2 e- = 2 Cl • Dans les cristaux ioniques, la liaison résulte alors des interactions électrostatiques entre ions de charges opposées. • La symétrie du nuage électronique s’avère le plus souvent sphérique, de sorte que le cristal ionique peut être considéré comme un assemblage de sphères inégales, électriquement chargées, centrées aux nœuds du réseau.

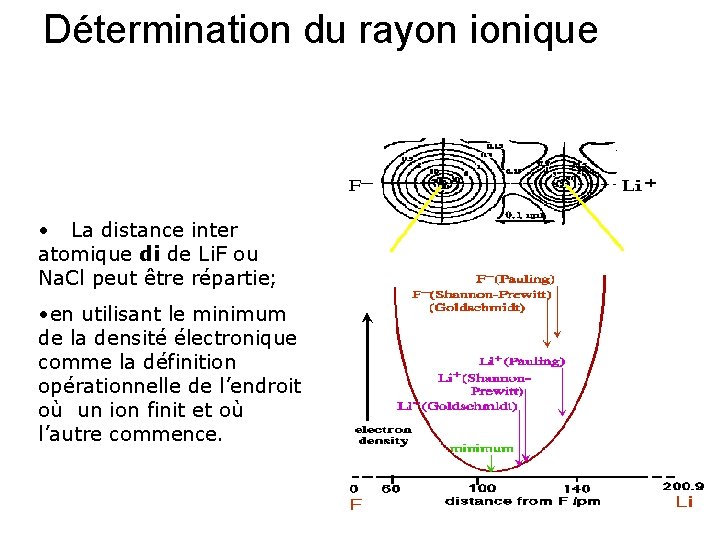
Détermination du rayon ionique • La distance inter atomique di de Li. F ou Na. Cl peut être répartie; • en utilisant le minimum de la densité électronique comme la définition opérationnelle de l’endroit où un ion finit et où l’autre commence.

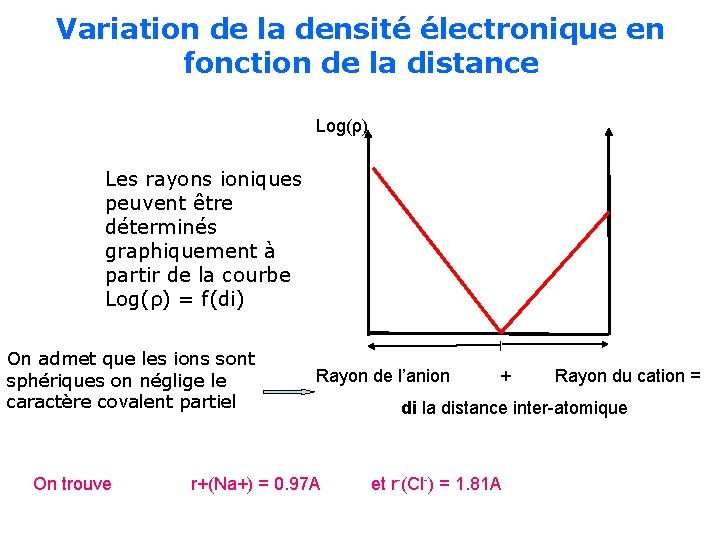
Variation de la densité électronique en fonction de la distance Log(ρ) Les rayons ioniques peuvent être déterminés graphiquement à partir de la courbe Log(ρ) = f(di) On admet que les ions sont sphériques on néglige le caractère covalent partiel On trouve Rayon de l’anion r+(Na+) = 0. 97 A + Rayon du cation = di la distance inter-atomique et r -(Cl-) = 1. 81 A

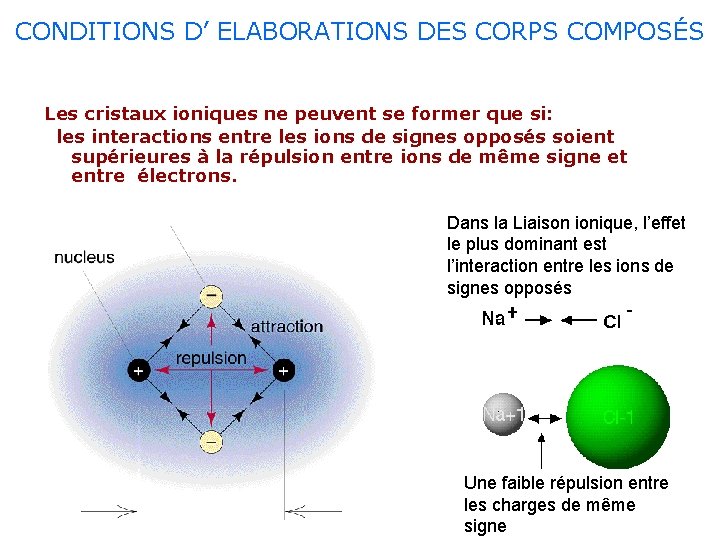
CONDITIONS D’ ELABORATIONS DES CORPS COMPOSÉS Les cristaux ioniques ne peuvent se former que si: les interactions entre les ions de signes opposés soient supérieures à la répulsion entre ions de même signe et entre électrons. Dans la Liaison ionique, l’effet le plus dominant est l’interaction entre les ions de signes opposés Une faible répulsion entre les charges de même signe

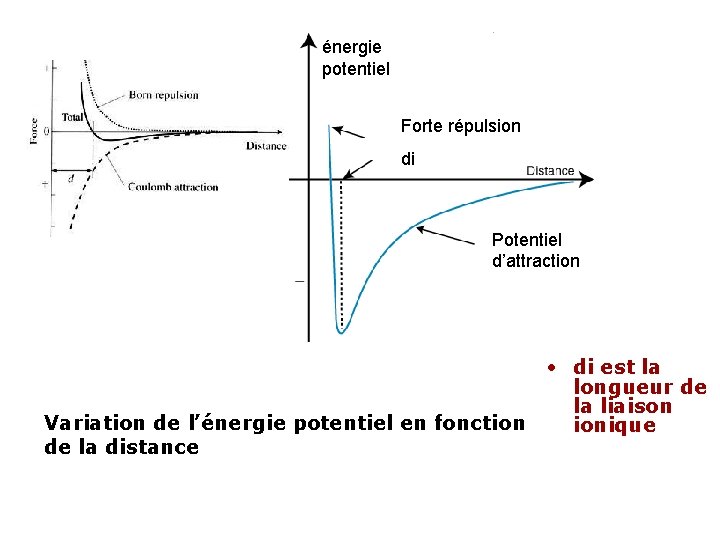
énergie potentiel Forte répulsion di Potentiel d’attraction • di est la longueur de la liaison Variation de l’énergie potentiel en fonction ionique de la distance

• Dans les composés chimiques, il existe au moins deux espèces chimiques différentes. • Leur formule est de type Ax. By A est élément métallique, B est l’élément non métallique de sorte qu’il convient de préciser le nombre et la position dans la maille. • Dans le cas des cristaux métalliques, pour déterminer la taille d’une sphère susceptible d’être introduite dans uns site cristallographique, seules considérations purement géométriques ont été pris en considération • Cependant, dans le cas des cristaux ioniques, aux considérations géométriques, se superposent les considérations électrostatiques.

Règles pour la formation de l’édifice cristallin des composés ioniques. • L’intensité des interactions électrostatiques modification des possibilités d’occupations des sites cristallographiques. • Il est cependant possible de donner quelques règles pour l’édification de l’édifice cristallin des composés ioniques. • Règle 1 : Le réseau d’accueil est constitué par les ions les plus gros (il ’agit généralement des anions de rayon R-).

• Règle 2 : Les ions les plus petits, de rayon r+, occupent les sites cristallographiques du réseau d’accueil, en tenant compte de leur aptitudes à être en contactes avec les atomes de rayon R-. • Ce ci implique le respect des inégalités suivantes : Site cubique Site octaédrique. Site tétraédrique.

Règle 3 • la fréquence f du site cristallographique dans la maille et son coefficient d’occupations ( ≤ 1) • en relation avec le nombre n(B) et p(A) • p = f’atomes A dans la maille. • La formule cristallographique de la maille s’écrit alors Ap. Bn. • p et n sont liés aux coefficient stœchiométriques x et y, du composé Ax. By, par les relations : • p = Z. x • n = Z. y • Où Z représente le nombre de motifs par maille.

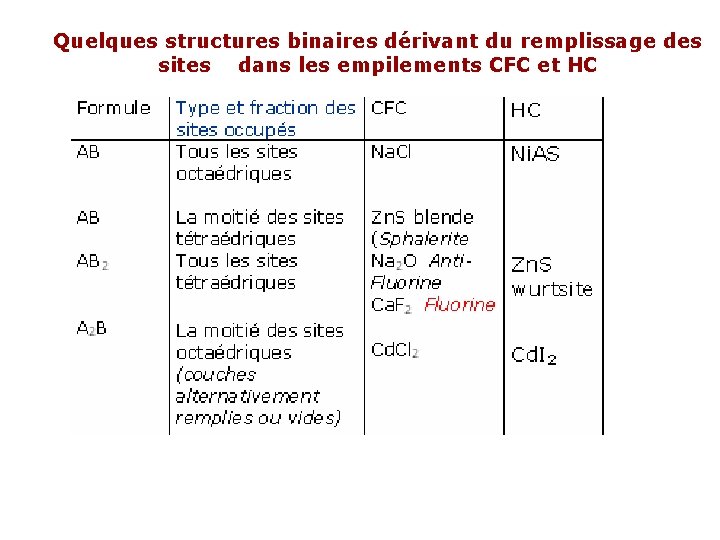
Quelques structures binaires dérivant du remplissage des sites dans les empilements CFC et HC

Règle 4 • Dans certains cas la règle 2 ne s’applique pas. • Ceci intervient si l’électro neutralité du réseau nécessite un rapport entre le nombre d’anions et le nombre de cations tel qu’il est interdit par l’occupation du site normalement considéré, parce qu’il conduit à un coefficient d’occupation >1. (ex. Na 2 O). • L’établissement de la structure de l’oxyde Na 2 O, oblige l’utilisation d’un site déconseillé par la règle 2, • mais compatible avec la condition ≤ 1, qui s’avère ainsi d’un ordre de priorité supérieure à la condition géométrique.

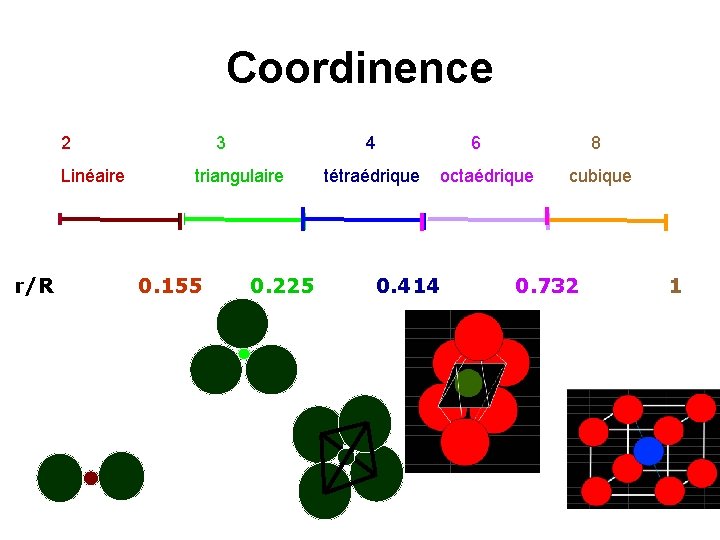
Coordinence 2 Linéaire r/R 3 4 triangulaire 0. 155 0. 225 tétraédrique 0. 414 6 8 octaédrique cubique 0. 732 1

STÉRÉOCHIMIE DE QUELQUE STRUCTURE DE TYPE AB • Dans ces structures, il y a autant d’atome A que d’atome B par maille élémentaire. • Pas d'électrons libres donc les cristaux ioniques sont des ISOLANTS • les charges de A et de B sont égales en valeur absolue. • On peut également considérer la structure du solide ionique comme l’association de deux réseaux décalés l’un par rapport à l’autre, le réseau des anions et le réseau des cations.


Structure de type chlorure de césium La différence d’électronégativité • = (Cl)- (Cs) = 2. 37 un caractère ionique marqué de ce composé. • Sa structure résulte donc d’un assemblage des ions Cs+ et Cl- de rayons • r (Cs+) =1. 69 et R (Cl-) = 1. 81Ả • En respectant la condition d’existence du composé Cs. Cl, • les ions Cs+ doivent occuper des sites cubiques.

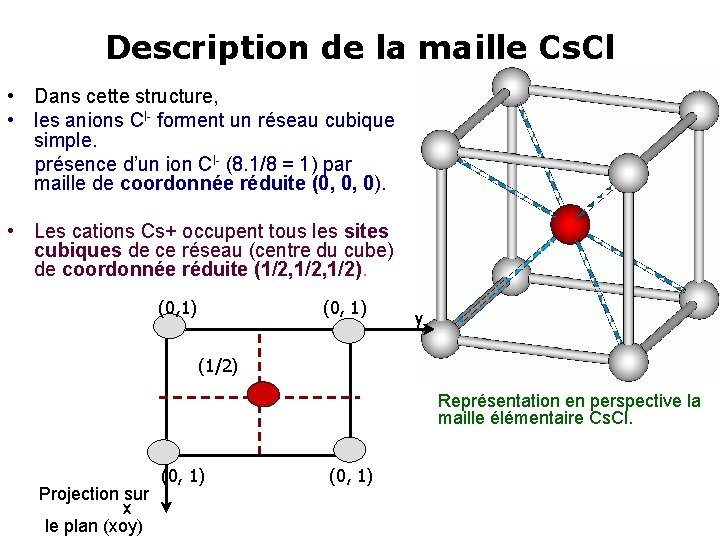
Description de la maille Cs. Cl • Dans cette structure, • les anions Cl- forment un réseau cubique simple. présence d’un ion Cl- (8. 1/8 = 1) par maille de coordonnée réduite (0, 0, 0). • Les cations Cs+ occupent tous les sites cubiques de ce réseau (centre du cube) de coordonnée réduite (1/2, 1/2). (0, 1) y (1/2) Représentation en perspective la maille élémentaire Cs. Cl. Projection sur x le plan (xoy) (0, 1)

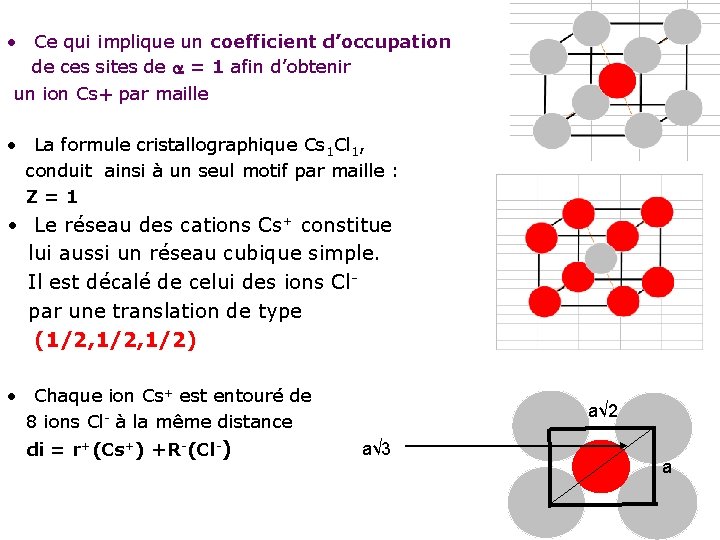
• Ce qui implique un coefficient d’occupation de ces sites de = 1 afin d’obtenir un ion Cs+ par maille • La formule cristallographique Cs 1 Cl 1, conduit ainsi à un seul motif par maille : Z=1 • Le réseau des cations Cs+ constitue lui aussi un réseau cubique simple. Il est décalé de celui des ions Clpar une translation de type (1/2, 1/2) • Chaque ion Cs+ est entouré de 8 ions Cl- à la même distance di = r+(Cs+) +R-(Cl-) a√ 2 a√ 3 a

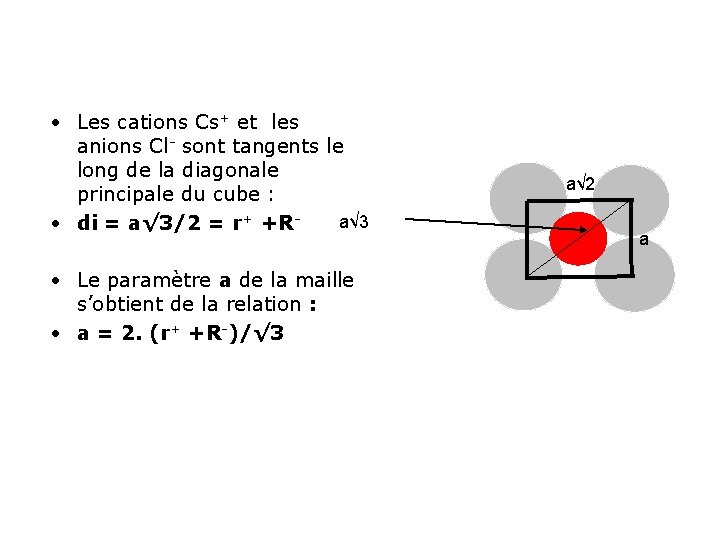
• Les cations Cs+ et les anions Cl- sont tangents le long de la diagonale principale du cube : a√ 3 • di = a√ 3/2 = r+ +R • Le paramètre a de la maille s’obtient de la relation : • a = 2. (r+ +R-)/√ 3 a√ 2 a

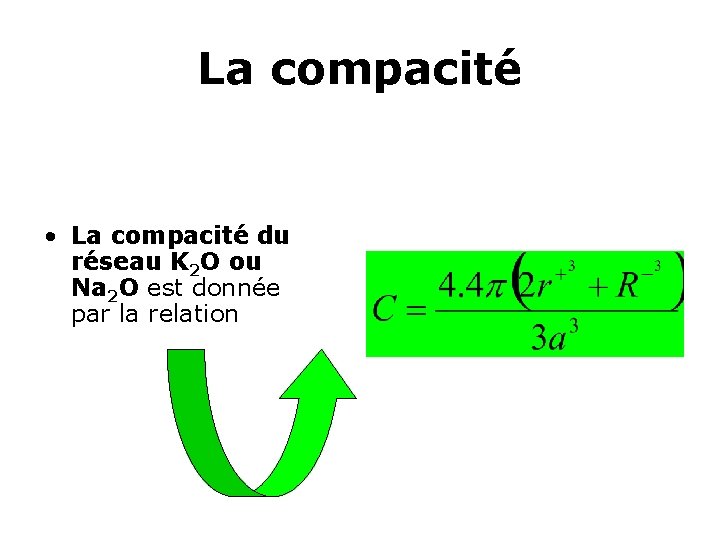
La compacité C • se calcule, en considérant le volume du motif comme la somme arithmétique des volumes individuels des ions: • C=

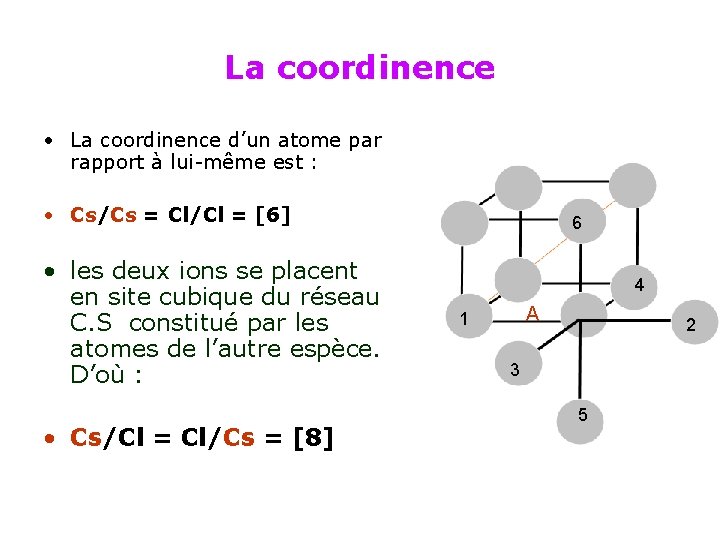
La coordinence • La coordinence d’un atome par rapport à lui-même est : • Cs/Cs = Cl/Cl = [6] • les deux ions se placent en site cubique du réseau C. S constitué par les atomes de l’autre espèce. D’où : • Cs/Cl = Cl/Cs = [8] 6 A 1 4 4 2 3 5

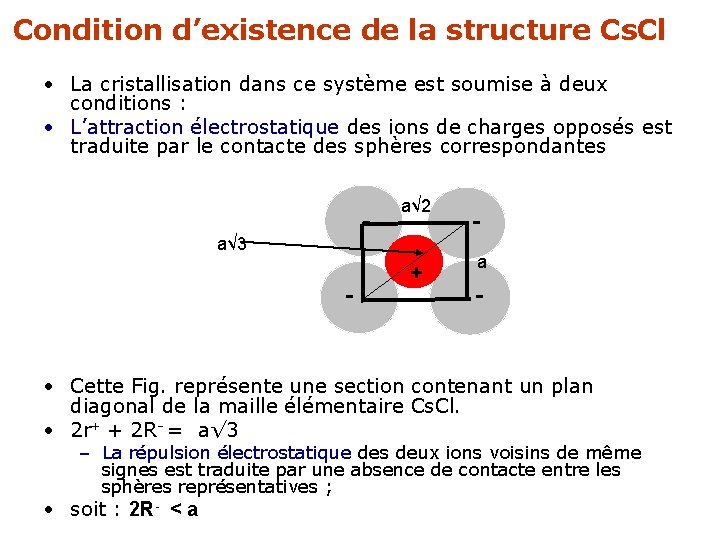
Condition d’existence de la structure Cs. Cl • La cristallisation dans ce système est soumise à deux conditions : • L’attraction électrostatique des ions de charges opposés est traduite par le contacte des sphères correspondantes - a√ 2 a√ 3 - + a - • Cette Fig. représente une section contenant un plan diagonal de la maille élémentaire Cs. Cl. • 2 r+ + 2 R- = a√ 3 – La répulsion électrostatique des deux ions voisins de même signes est traduite par une absence de contacte entre les sphères représentatives ; • soit : 2 R- < a

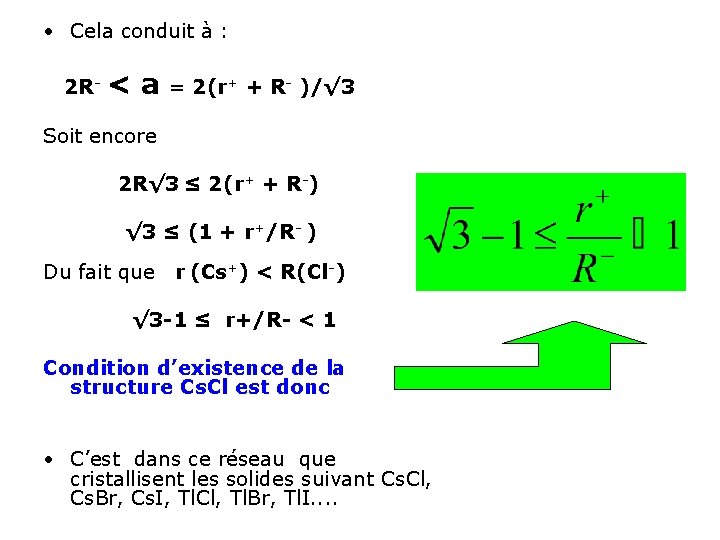
• Cela conduit à : 2 R- <a = 2(r+ + R- )/√ 3 Soit encore 2 R√ 3 ≤ 2(r+ + R-) √ 3 ≤ (1 + r+/R- ) Du fait que r (Cs+) < R(Cl-) √ 3 -1 ≤ r+/R- < 1 Condition d’existence de la structure Cs. Cl est donc • C’est dans ce réseau que cristallisent les solides suivant Cs. Cl, Cs. Br, Cs. I, Tl. Cl, Tl. Br, Tl. I. .

Structures de type sel gemme • Le sel gemme est la variété naturelle du chlorure de sodium. La différence d’électronégativité : = (Cl)- (Na) = 2. 23 • Implique la liaison chimique présente un caractère ionique marqué

• Les valeurs des rayons ioniques des ions Na+ et Cl- : • r(Na+) = 0. 97Ǻ et R(Cl-) = 1. 81Ǻ. d’où r+/R- = 0. 97/1. 81 = 0. 536. Soit 0. 414< r/R < 0. 732 • On appliquant la règle 2, les ions Na+ doivent occuper des sites octaédriques. • La structure sel gemme comporte globalement une symétrie Cubique.

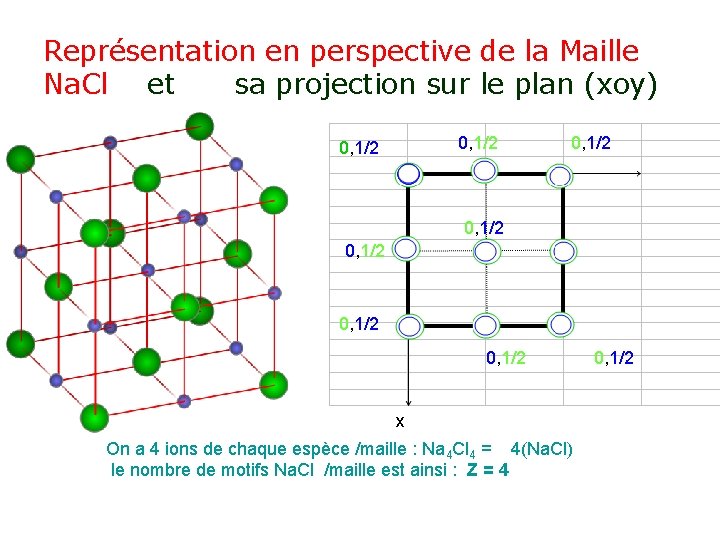
Description de la maille élémentaire Na. Cl • Dans cette structure les ions Cl- décrivent un réseau CFC, • 4 Cl- /maille : (8. (1/8) + 6. (1/2) = 4) • la formule chimique exige n. Cl- = n Na+ • Les cations Na+ doivent occuper tous les sites octaédriques: milieu des arêtes et centre du cube de ce réseau • le coefficient d’occupation =1.

Représentation en perspective de la Maille Na. Cl et sa projection sur le plan (xoy) 0, 1/2 y o 0, 1/2 0, 1/2 x On a 4 ions de chaque espèce /maille : Na 4 Cl 4 = 4(Na. Cl) le nombre de motifs Na. Cl /maille est ainsi : Z = 4 0, 1/2

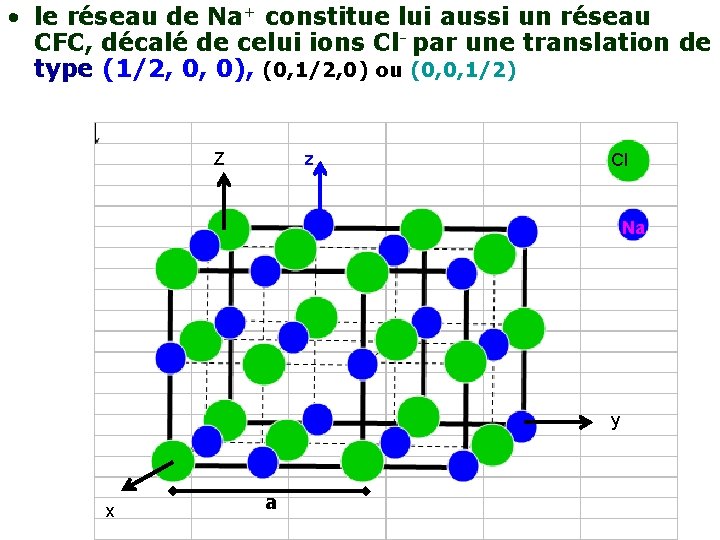
• le réseau de Na+ constitue lui aussi un réseau CFC, décalé de celui ions Cl- par une translation de type (1/2, 0, 0), (0, 1/2, 0) ou (0, 0, 1/2) Z z Cl Na y x x a

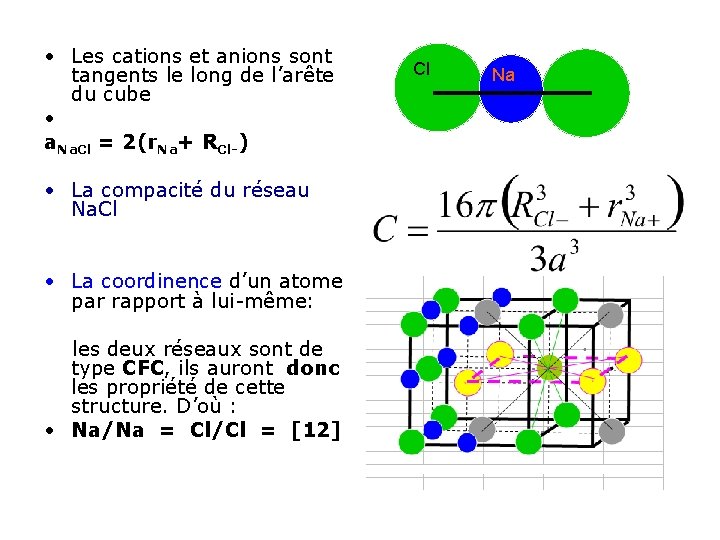
• Les cations et anions sont tangents le long de l’arête du cube • a. Na. Cl = 2(r. Na+ RCl-) • La compacité du réseau Na. Cl • La coordinence d’un atome par rapport à lui-même: les deux réseaux sont de type CFC, ils auront donc les propriété de cette structure. D’où : • Na/Na = Cl/Cl = [12] Cl Na

• La coordinence d’un atome par rapport à l’autre : tous deux occupent un site octaédrique du réseau constitué par l’autre. D’où : Na/Cl = Cl/Na = [6] • L’indice de coordination est donc 6 pour les deux ions (coordination 6 -6) • Les coordonnées réduites : Pour Cl- : (0, 0, 0) ; (1/2, 0 1/2) ; (0, 1/2) • Pour Na+ : (1/2, 1/2) ; (0, 1/2, 0) , (1/2, 0, 0). (0, 0, 1/2) ;

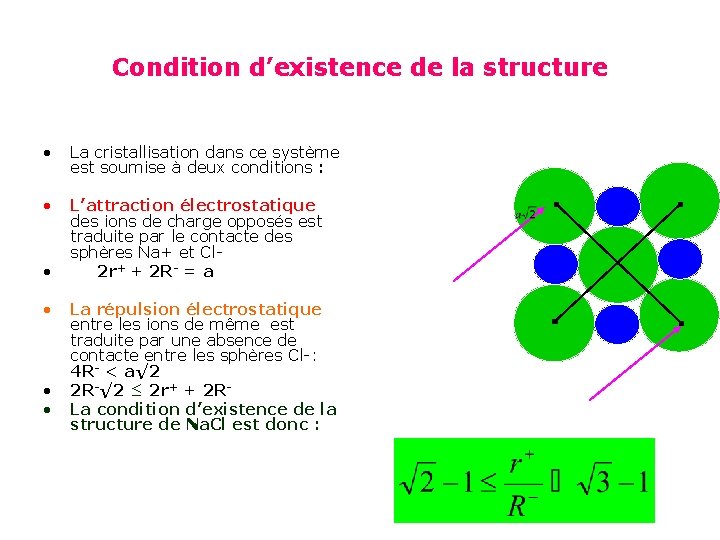
Condition d’existence de la structure • La cristallisation dans ce système est soumise à deux conditions : • L’attraction électrostatique des ions de charge opposés est traduite par le contacte des sphères Na+ et Cl 2 r+ + 2 R- = a • • La répulsion électrostatique entre les ions de même est traduite par une absence de contacte entre les sphères Cl-: 4 R- < a√ 2 2 R-√ 2 ≤ 2 r+ + 2 RLa condition d’existence de la structure de Na. Cl est donc :

Composés iso-type de Na. Cl • Cette structure est celle des composés : • -Tous les halogénures alcalins (sauf Cs. I, Cs. Br, Cs. Cl) • -Ag. F, Ag. Cl, Ag. I; • -Mn. O, Mn. Se ; • -Fe. O, Co. O, Ni. O, Cd. O…

Sphalérite

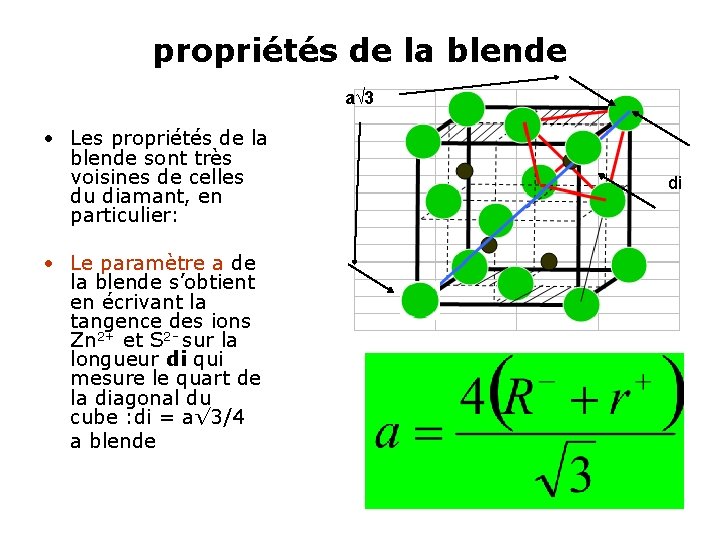
Structure de type blende • La structure blende est la structure des composés suivants : • -Be. S, Be. Se, Be. Te, Mn. Se ; • -Zn. O, Zn. Se ; • -Cd. S, Ag. I, Cu. Cl, Hg. S ; • Structure Zn. S • La blende est la variété cubique du sulfure de zinc. La liaison ne comporte qu’un faible caractère ionique (21% pour une différence d’électronégativité de 0. 93). • Les rayons ioniques r+ (Zn 2+) = 74 pm ; R-(S 2 - ) =184 pm conduisent au rapport r+/R- =74/184 = 0. 402 0. 225 – 1 ≤ r+/R- < 0. 414 • En appliquant l’équation 3 de la règle 2, les ions Zn 2+ doivent occuper des sites tétraédriques d’un réseau compact.

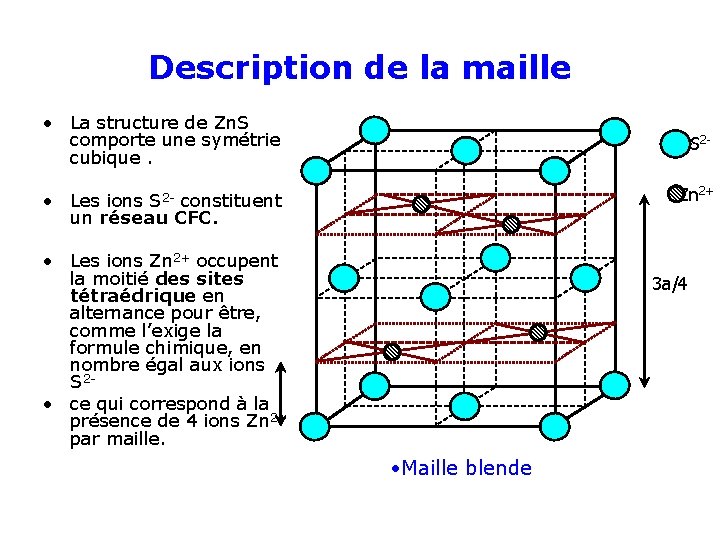
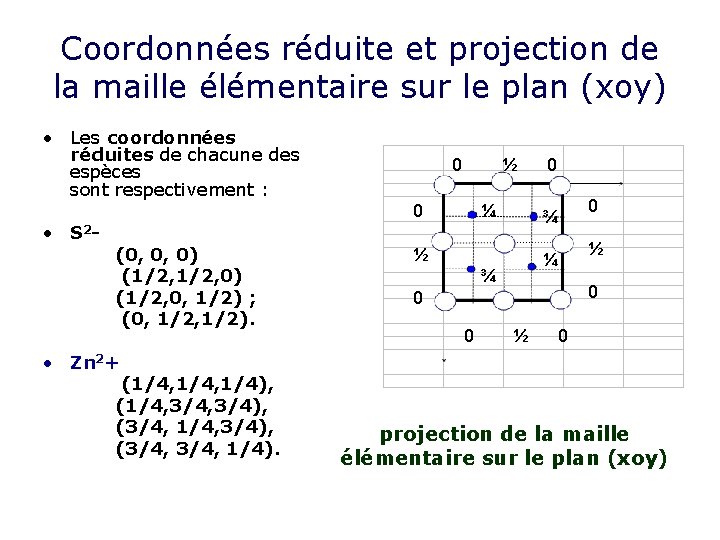
Description de la maille • La structure de Zn. S comporte une symétrie cubique. S 2 Zn 2+ • Les ions S 2 - constituent un réseau CFC. • Les ions Zn 2+ occupent la moitié des sites tétraédrique en alternance pour être, comme l’exige la formule chimique, en nombre égal aux ions S 2 • ce qui correspond à la présence de 4 ions Zn 2+ par maille. 3 a/4 • Maille blende

Nombre de motif par maille • 8 S 2 - aux sommets du cube comptant chacun pour un 1/8 : 8. 1/8 = 1 • 6 S 2 - aux centre des faces comptant chacun pour ½ : 6. ½ = 3 • Avec quatre ions de chaque espèce par maille, le nombre de motifs Zn. S par maille est ainsi Z=4

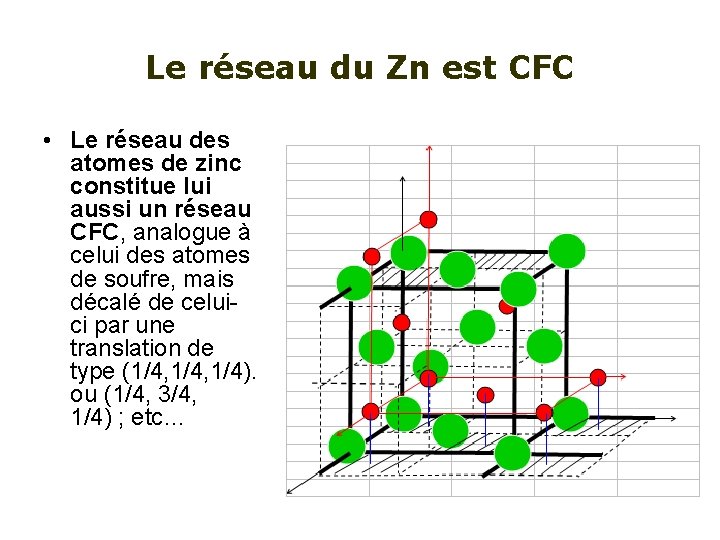
Le réseau du Zn est CFC • Le réseau des atomes de zinc constitue lui aussi un réseau CFC, analogue à celui des atomes de soufre, mais décalé de celuici par une translation de type (1/4, 1/4). ou (1/4, 3/4, 1/4) ; etc…

Coordonnées réduite et projection de la maille élémentaire sur le plan (xoy) • Les coordonnées réduites de chacune des espèces sont respectivement : • S 2 - 0 ½ 0 (0, 0, 0) (1/2, 0, 1/2) ; (0, 1/2). • Zn 2+ (1/4, 1/4), (1/4, 3/4), (3/4, 1/4). ¼ 0 0 ¾ ½ ½ ¼ ¾ 0 0 0 y ½ 0 x projection de la maille élémentaire sur le plan (xoy)

propriétés de la blende a√ 3 • Les propriétés de la blende sont très voisines de celles du diamant, en particulier: • Le paramètre a de la blende s’obtient en écrivant la tangence des ions Zn 2+ et S 2 - sur la longueur di qui mesure le quart de la diagonal du cube : di = a√ 3/4 a blende di

• Les angles S-Zn-S= 109, 47° s’avèrent caractéristique des liaisons fortement covalentes et d’une hybridation sp 3 de l’atome de zinc. Avec comme origine prise sur atome de zinc, cela conduirait de même à une hybridation sp 3 du soufre. • La coordinence d’un atome par rapport à l’autre est la même, puisque tous occupent des sites tétraédriques. Zn/S = S/Zn = [4] • L’indice de coordination est donc 4 pour les deux ions (coordination 4 -4) • En revanche, comme les deux sous réseaux sont CFC, il en résulte que : • S/S = Zn/Zn = [12]

• La Compacité de Zn. S • La masse volumique :

Conditions d’existence • • • L’attraction électrostatique des ions de charges opposées est traduite par le contacte des sphères Zn 2+ et S 2 -. . Les ions Zn 2+ et S 2 - sont tangents sur la diagonale d’un cube d’arête a/2. On a donc : (r+ + R-) = a√ 3/4 • La répulsion électrostatique des deux ions voisins de même signes est traduite par une absence de contacte entre les sphères S 24 R- < a√ 2 2 R-√ 2 <a 2 R-√ 2. √ 3/4 ≤ (r+ + R-) R-. √ 3/√ 2 ≤ (r+ + R- ) • La condition d’existence de la structure de type Zn. S est donc : S 2 di Zn 2+ a√ 3

Fluorine

Structure type fluorine • Structure Ca. F 2 La différence d’électronégativité : = (F) - (Ca) = 2. 98 présente un caractère ionique marqué Les valeurs des rayons ioniques sont : r(Ca 2+) = 99 pm ; R(F-) = 133 pm Il en résulte que : r(Ca 2+)/R(F-) = 0. 744

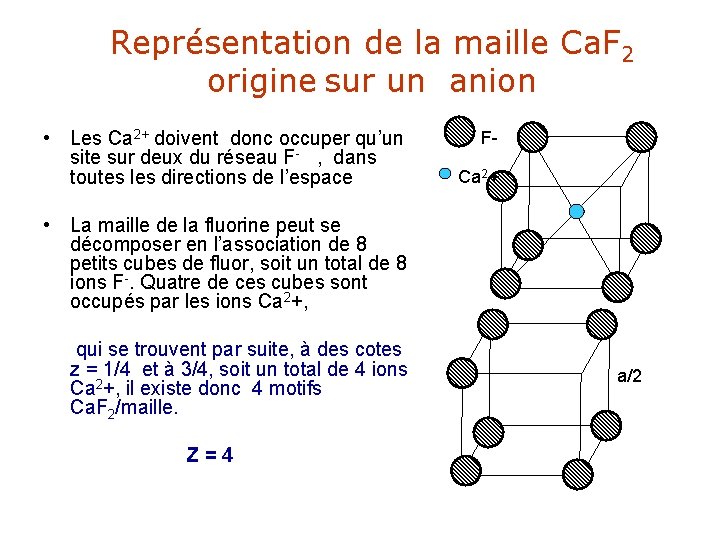
• En appliquant la règle n° 2, 0. 732 ≤ r+ (Ca 2+)/R-(F-) < 1 • Les cations doivent occuper des sites cubiques. • Le seul réseau susceptible de les accueillir est le réseau cubique simple ; ce qui implique la structure de Ca. F 2 dérive de la structure de Cs. Cl Dans la structure Cs. Cl , • n site cubique = n atomes constituant le réseau(anion) La formule nécessite 2 F 1 Ca 2+ • le taux d’occupation de ces sites est par conséquent = 0. 5.

Représentation de la maille Ca. F 2 origine sur un anion • Les Ca 2+ doivent donc occuper qu’un site sur deux du réseau F- , dans toutes les directions de l’espace FCa 2+ • La maille de la fluorine peut se décomposer en l’association de 8 petits cubes de fluor, soit un total de 8 ions F-. Quatre de ces cubes sont occupés par les ions Ca 2+, qui se trouvent par suite, à des cotes z = 1/4 et à 3/4, soit un total de 4 ions Ca 2+, il existe donc 4 motifs Ca. F 2/maille. Z=4 a/2

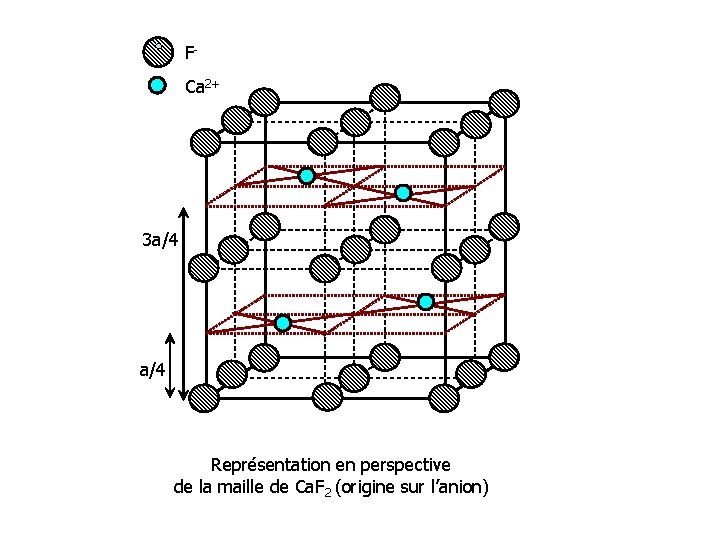
FCa 2+ 3 a/4 Représentation en perspective de la maille de Ca. F 2 (origine sur l’anion)

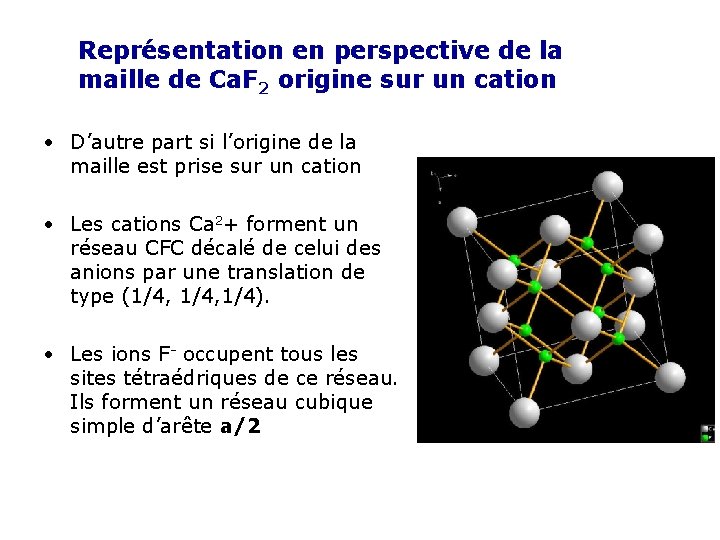
Représentation en perspective de la maille de Ca. F 2 origine sur un cation • D’autre part si l’origine de la maille est prise sur un cation • Les cations Ca 2+ forment un réseau CFC décalé de celui des anions par une translation de type (1/4, 1/4). • Les ions F- occupent tous les sites tétraédriques de ce réseau. Ils forment un réseau cubique simple d’arête a/2

Ca 2+ F- F- (0, 1) (1/2) (0, 1) y (1/4, 3/4) (0, 1) (1/2) (0, 1) x La projection de la maille de Ca. F 2 sur le plan (xoy) Représentation en perspective de la maille de Ca. F 2


coordinences • La coordinence du fluore par rapport à lui-même est celle d’un réseau CS. D’où : F/F = [6] • La coordinence de calcium vis-à-vis de lui-même est celle d’un réseau CFC Ca/Ca =[12] • La coordinence de calcium par rapport au fluor est celle d’un site cubique Ca/F = [8] • La coordinence du fluor par rapport au calcium est celle d’un site tétraédrique. F/Ca = [4]

Indices de coordination • Les indices de coordination sont donc • 8 pour les ions Ca 2+ et • 4 pour les ions FIndice de coordination 8 -4 La compacité de la fluorine

Conditions d’existence L’attraction électrostatique des ions de charges opposées est traduite par le contacte des sphères Ca 2+ et F-. . Les ions Ca 2+ et F- sont tangents sur la diagonale d’un cube d’arête a/2. On a donc : r+ + R- = a√ 3/4 La répulsion électrostatique des deux ions voisins de même signes est traduite par une absence de contacte entre les sphères F-: 2 R- < a/2 • ce qui implique 4 R- < a D’où : r+ + R- ≥ 4 R-√ 3/4 • comme pour Cs. Cl

Composés iso-type de Ca. F 2 • Cette structure existe dans : • - Ca. F 2, Sr. F 2, Ba. F 2, Sr. Cl 2, …. • - Hg. F 2, Sn. F 2, Cd. F 2, Pd. F 2, … • - Ce. O 2, Zr. O 2, Th. O 2, UO 2….

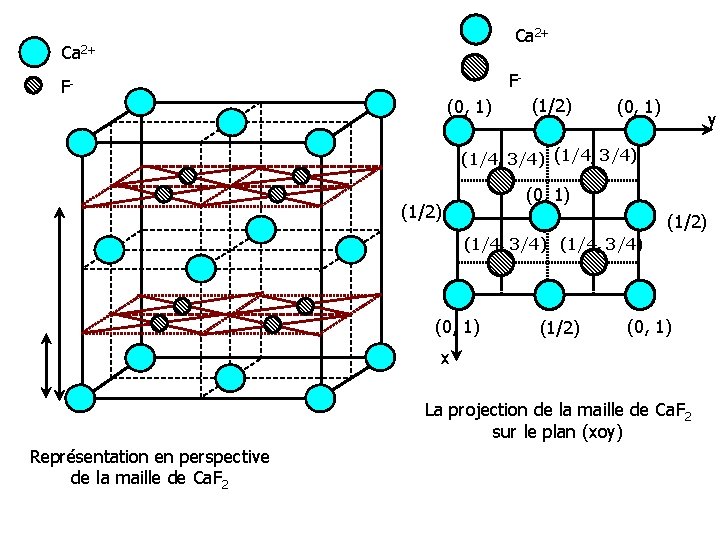
Structure anti-fluorine • Le préfixe anti présente, en chimie structurale, une signification bien précise. • Il exprime le fait que la structure considérée dérive de celle du composé de référence par permutation des positions des cations et des anions. • C’est par exemple, le cas de la structure de Na 2 O, K 2 O, Na 2 S… • Les O 2 - remplacent les ions Ca 2+ et constituent ainsi un réseau CFC.

O 2 - Li+ (0, 1) (1/2) (0, 1) (1/4, 3/4) (0, 1) (1/2) (0, 1) x Représentation en perspective de la maille de Li 2 O La projection de la maille de Li 2 O sur le plan (xoy)

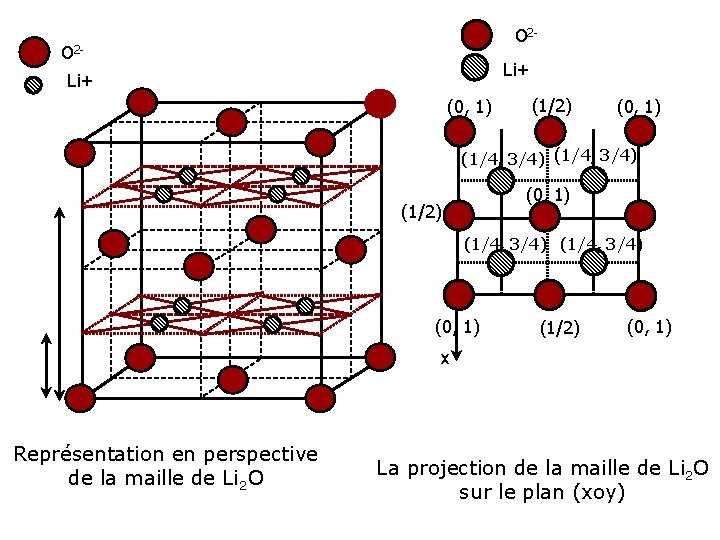
Le réseau des cations O 2 - • Les cations viennent occuper tous les sites tétraédriques du réseau CFC, pour former un réseau cubique simple de cote a/2. • La structure, avec 8 cations et 4 anions par maille, comporte donc 4 motifs Na 2 O ou K 2 O par maille: • Z= 4 Li+

La compacité • La compacité du réseau K 2 O ou Na 2 O est donnée par la relation
![La coordinence Leur coordinence est donc OO 12 NaO La coordinence • Leur coordinence est donc : • O/O = [12] • Na/O](https://slidetodoc.com/presentation_image_h2/b00593090c77fa59ff1e144c24643fe7/image-61.jpg)
La coordinence • Leur coordinence est donc : • O/O = [12] • Na/O = [4] • Na/Na = [6] • O/Na = [8] • Cette structure de type anti-fluorine est celle de certains chalcogénures alcalins M 2 X(M= Li, Na, k, Rb , X =O, S, Se)

Remarque : • Avec des valeurs de rayons ioniques : • r(Na+) = 97 pm ; R(O 2 -) =140 pm • r+/R- = 97/140 = 0. 693. • Imposerait normalement une occupation de sites octaédriques par le sodium. • Cette différence de comportement provient de l’obligation de respecter la règle 4: • l’électroneutralité imposant un nombre de cations double de celui des anions, seuls les sites tétraédriques satisfont correctement cette contrainte.

ENERGIE DES CRISTAUX IONIQUES • La formation d’un édifice stable implique un équilibre entre les forces attractives et les forces répulsives. • L’énergie de cohésion devra tenir compte des deux. Méthodes directes • Il existe plusieurs méthodes qui visent au calcul direct de l’énergie de cohésion des cristaux. Parmi elles, deux méthodes: • méthodes de Born-Landé • méthodes de Born-Mayer. • Ces deux méthodes ne diffèrent que par l’analyse des forces de répulsions.

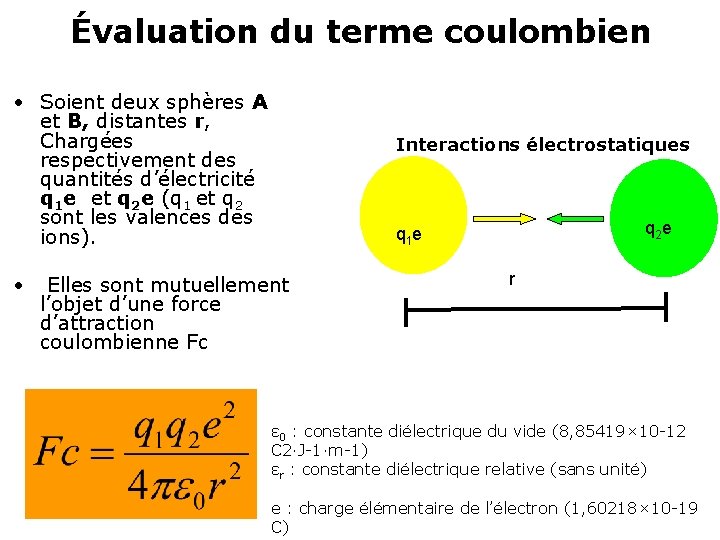
Évaluation du terme coulombien • Soient deux sphères A et B, distantes r, Chargées respectivement des quantités d’électricité q 1 e et q 2 e (q 1 et q 2 sont les valences des ions). • Interactions électrostatiques q 2 e q 1 e Elles sont mutuellement l’objet d’une force d’attraction coulombienne Fc r ε 0 : constante diélectrique du vide (8, 85419× 10 -12 C 2·J-1·m-1) εr : constante diélectrique relative (sans unité) e : charge élémentaire de l’électron (1, 60218× 10 -19 C)

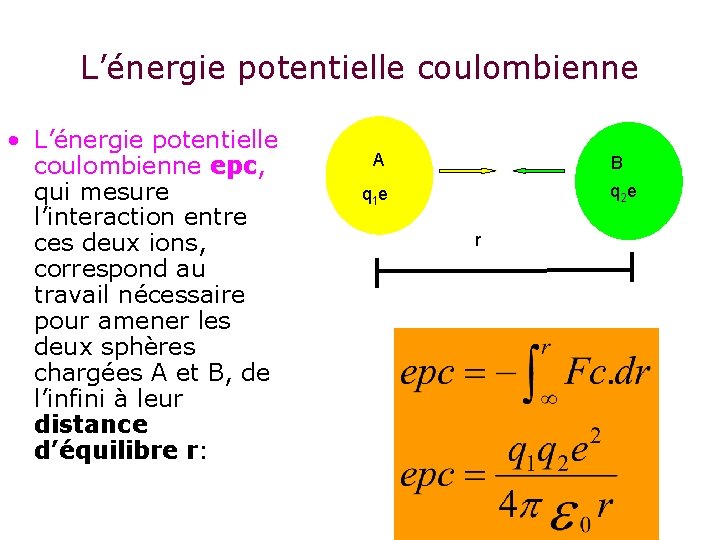
L’énergie potentielle coulombienne • L’énergie potentielle coulombienne epc, qui mesure l’interaction entre ces deux ions, correspond au travail nécessaire pour amener les deux sphères chargées A et B, de l’infini à leur distance d’équilibre r: A B q 2 e q 1 e r

Variation de l’énergie potentielle • Lorsque q 1 et q 2 sont de signes opposés, Fc est une force d’attraction, epc est alors négative. • Le système est stabilisé puisque son énergie diminue.

• La théorie électrostatique nous permet d’exprimer epc par: epc = q 1 e. V 2 • Où V 2 représente le potentiel électrostatique créé en A par la charge q 2 e placée à la distance r: V 2 = q 2 e/4πε 0 r • Un cristal étant constitué d’une infinité d’ions, il convient d’évaluer l’ensemble des énergies epc qui s’exercent entre l’ion A et tous les autres ions du système : EPC = ∑(epc)i

La solution est de la forme : Où qi représente la charge de l’ion i placé à la distance ri de A • La résolution de cette équation nécessite la connaissance des charges des ions et de la géométrie de la structure cristalline.

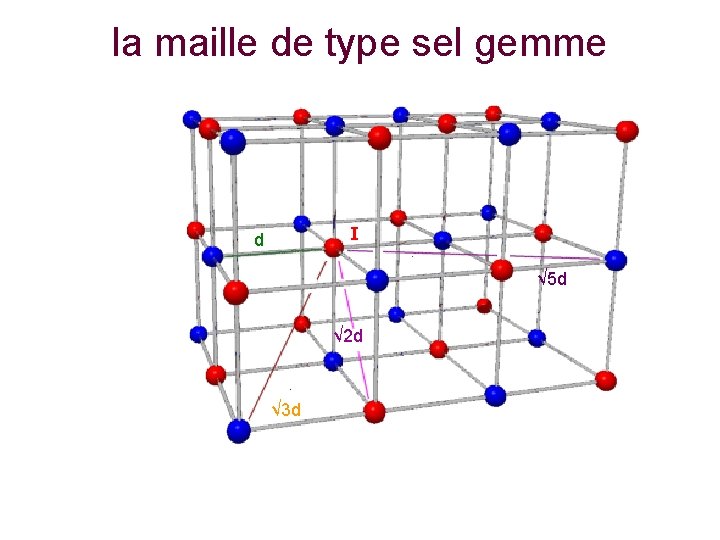
la maille de type sel gemme I d I √ 5 d √ 2 d √ 3 d

la maille de type sel gemme • Dans, la maille de type sel gemme représentée sur la figure suivante, le calcul s’avère relativement facile • L’ion An+ placé en I, au centre de la maille, est ainsi entouré : • Par 6 voisins Bn-, placés au centre des faces, à la distance d = d 1 = a/2. • Par 12 An+, placés aux milieux des arêtes, à la distance d 2 = a√ 2/2 • Par 8 voisins Bn-, placés aux sommets du cube, à la distance d 3 = a√ 3/2. • Par 6 voisins An+, placés au centre des cubes adjacents, à la distance d 4 = a

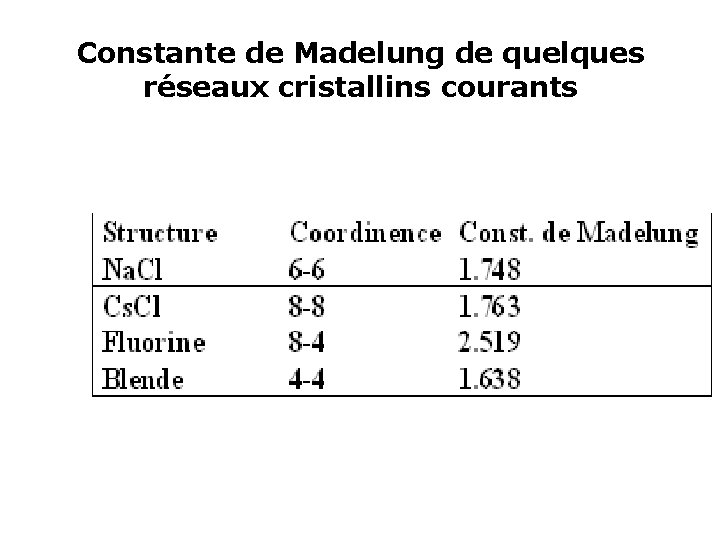
L’énergie potentielle qui s’exerce en A, découlant de l’équation précédente, s’exprime alors par : • Le terme entre crochet est uniquement fonction de la géométrie du cristal. Il constitue l’expression mathématique de sa constante de Madelung М.

Constante de Madelung de quelques réseaux cristallins courants

• L’énergie potentielle coulombienne EPC s’exerçant sur le cation An+ est donnée par : • Du fait les que les anions et les cations ont le même environnement, • EPC du cristal AB est donc exprimé par la même expression

• D’une manière générale, dans un cristal de formule Ax. By, les charges sont différentes (sauf, si x = y). • Si q 1 ou q et q 2 ou q’ sont les charges respectives de A et B • L’énergie potentielle du cristal • Il s’agit d’une énergie de stabilisation, puisque elle est toujours négative

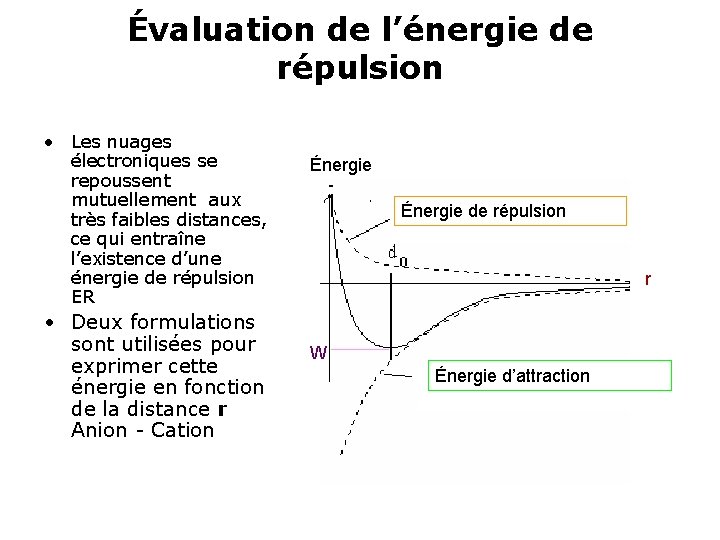
Évaluation de l’énergie de répulsion • Les nuages électroniques se repoussent mutuellement aux très faibles distances, ce qui entraîne l’existence d’une énergie de répulsion ER • Deux formulations sont utilisées pour exprimer cette énergie en fonction de la distance r Anion - Cation Énergie de répulsion r W Énergie d’attraction

• L’expression de Mayer : • L’expression de Landé • Dans ces deux relations, β représente une constante d’intégration ; • ρ qui s’exprime en fonction du coefficient de compressibilité de la structure, • et n nombre sans dimension. • ER est toujours positive, donc déstabilisante.

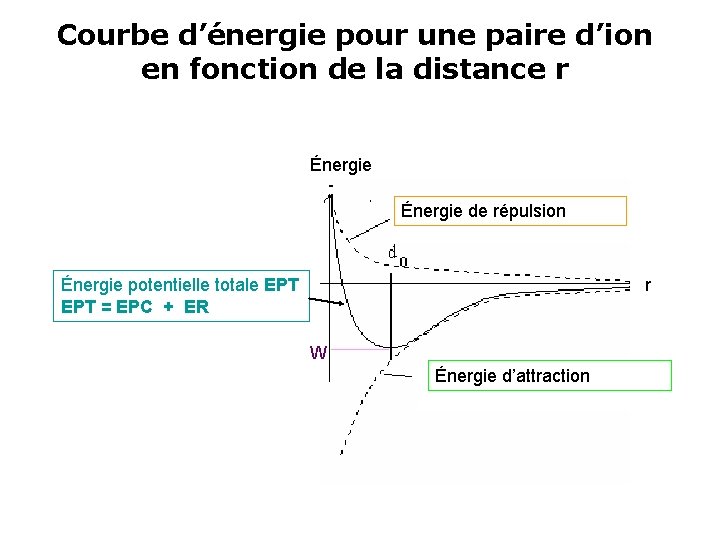
Courbe d’énergie pour une paire d’ion en fonction de la distance r Énergie de répulsion Énergie potentielle totale EPT = EPC + ER r W Énergie d’attraction

• Elle passe par un minimum W pour la distance d’équilibre r = d. • Dans les conditions de référence, EPT calculée pour une mole, constitue l’enthalpie de cristallisation H°cris du cristal : • H°cris = N. EPT(r=d) = N. W • Relation de Born – Mayer

la relation de Born – Landé La constante β s’élimine en écrivant la dérivé de EPT par rapport à r. Elle est nulle pour r = d. Ce qui conduit selon les cas :

A la relation de Born – Mayer : Le coefficient ρ est assimilé à une constante, il a la dimension d’une longueur. A la relation de Born – Landé n dépend du type de l’ion concerné. Il est généralement compris entre 7 et 12

Valeur de quelques exposant de Born Configu. l’ion He Ne Ar, Cu+ Kr, Ag+ Xe, Au+ n 5 7 9 10 12

Remarques La notion d’enthalpie de cristallisation n’est pas directement liée au caractère de la liaison. Par contre la Tf est une grandeur indicatrice de l’énergie de cohésion du cristal. • L’enthalpie de cristallisation ainsi définie est donc l’opposé de l’énergie réticulaire. • Énergie réticulaire est toujours positive, elle mesure l’énergie requise pour séparer les éléments du cristal en ion gazeux

Détermination de l’enthalpie de cristallisation • La mesure directe de l’enthalpie de cristallisation n’est pas possible. Prenons l’exemple de. Na. Cl, • Na+(g) • + Cl-(g) = Na. Cl(s) H°cris Cependant, il est possible, de recourir à une méthode indirecte, la méthode de Born - Fajans – Haber, basée sur l’application de la loi de Hess, qui évalue par deux voies différentes la formation de Na. Cl

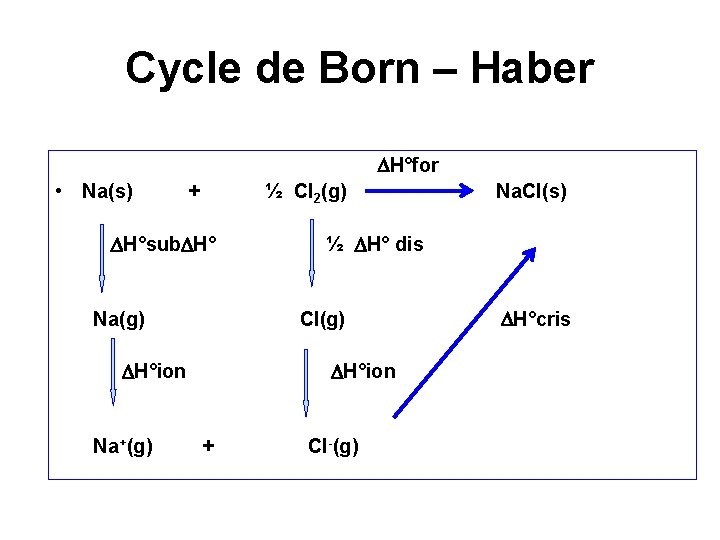
Cycle de Born – Haber Synthèse directe • Na(s) + ½ Cl 2(g) = Na. Cl(s) H°formation Na. Cl • Le Na. Cl étant stable dans les conditions normales de pression et de température,

Synthèse par étapes • • La sublimation de Na Na(s) = Na(g) H°sub(Na) Il faut fournir de l’énergie au système pour détruire le réseau métallique • L’enthalpie de sublimation H°sub(Na) > 0

• La libération d’un atome de Chlore • ½ Cl 2 = Cl ½ H°Dissociation • H°Dissociation mesure l’enthalpie positive nécessaire pour briser la liaison inter- atomique dans la molécule du dichlore. • Ionisation du chlore Cl(g) + 1 e = Cl-(g) H°ionisation(Cl) = A(Cl) Elle met en jeu l’enthalpie d’affinité électronique A(Cl) du chlore. Cette énergie est négative.

• Ionisation du sodium • Na (g) = Na+(g) + e : H° ionisation (Na); PI(Na) • Requiert une enthalpie PI(Na) positive, elle correspond à l’arrachement d’un électron de son cortège électronique

• L’association des ions • Na+(g) + Cl-(g) = Na. Cl(s) • H°formation du cristal Ce terme est nécessairement négatif, puisque il conditionne la formation du cristal

Cycle de Born – Haber H°for • Na(s) + ½ Cl 2(g) H°sub H° Na(g) Na+(g) ½ H° dis Cl(g) H°ion + Na. Cl(s) Cl-(g) H°cris

• Dans ce processus, toutes les valeurs des enthalpies sont connues et tabulées sauf • H° de cristallisation, qui devient ainsi évaluable.
 Les composés ioniques
Les composés ioniques Po3nh
Po3nh Linus pauling
Linus pauling Petit pays chapitre
Petit pays chapitre Tirez pas sur le scarabée résumé complet
Tirez pas sur le scarabée résumé complet Petit prince résumé
Petit prince résumé Le petit prince résumé simple
Le petit prince résumé simple What do the roman numerals in a cation's name indicate?
What do the roman numerals in a cation's name indicate? Site octaédrique hexagonal compact
Site octaédrique hexagonal compact Cristal de sulfate de cuivre
Cristal de sulfate de cuivre Des des des
Des des des Hamlet act iii scene iii
Hamlet act iii scene iii La fabrication des objets techniques chapitre 12
La fabrication des objets techniques chapitre 12 Migration des ions
Migration des ions Il existe des personnes qui sont des lumières pour tous
Il existe des personnes qui sont des lumières pour tous La diffusion des idées des lumières
La diffusion des idées des lumières Volume d un corps
Volume d un corps Robin des bois des alpes
Robin des bois des alpes Les valeurs des modes verbaux
Les valeurs des modes verbaux Mesure des liquides
Mesure des liquides Double des and triple des
Double des and triple des Affiche plan marshall
Affiche plan marshall Cartographie des flux de valeur
Cartographie des flux de valeur Budget des ventes méthode des moindres carrés
Budget des ventes méthode des moindres carrés Diversification des espaces et des acteurs de la production
Diversification des espaces et des acteurs de la production Je t'offrirai des fleurs et des nappes en couleurs
Je t'offrirai des fleurs et des nappes en couleurs The scarlet letter discussion questions
The scarlet letter discussion questions Chapter 5 logarithmic exponential and other
Chapter 5 logarithmic exponential and other Moral argument for god's existence
Moral argument for god's existence Er diagram dependency
Er diagram dependency Three marks of existence
Three marks of existence Australopithecus years of existence
Australopithecus years of existence Factors of natural selection
Factors of natural selection Gst 113
Gst 113 Existence
Existence Existence before essence
Existence before essence Explanation experience existence exciting
Explanation experience existence exciting Sila samadhi panna
Sila samadhi panna Harmony in the nature and existence
Harmony in the nature and existence Exsistere
Exsistere Existence and uniqueness theorem linear algebra
Existence and uniqueness theorem linear algebra Existence precedes essence in french
Existence precedes essence in french účel (smysl) existence firmy určuje
účel (smysl) existence firmy určuje 3 marks of existence
3 marks of existence The three characteristics of existence
The three characteristics of existence Study of nature of existence
Study of nature of existence Existence
Existence Lesson 3 existence and uniqueness
Lesson 3 existence and uniqueness Harmony in the nature and existence
Harmony in the nature and existence Themes of existentialism
Themes of existentialism Universal soul theory
Universal soul theory Arctic fox niche
Arctic fox niche Weak entity crow's foot
Weak entity crow's foot Disembodied existence definition
Disembodied existence definition Marc chapitre 14
Marc chapitre 14 Ainsi parle le saigneur
Ainsi parle le saigneur Tite chapitre 2
Tite chapitre 2 Jean chapitre 4
Jean chapitre 4 Chapitre 7 vocabulaire 1 french 2
Chapitre 7 vocabulaire 1 french 2 Jean, chapitre 6
Jean, chapitre 6 Situation de passage le dernier jour d'un condamné
Situation de passage le dernier jour d'un condamné Daniel chapitre 11
Daniel chapitre 11 Le petit prince chapitre 6
Le petit prince chapitre 6 Daniel chapitre 5
Daniel chapitre 5 Vocabulaire chemise
Vocabulaire chemise Chapitre 7 évaluer le risque client
Chapitre 7 évaluer le risque client Le dernier jour d'un condamné chapitre 49
Le dernier jour d'un condamné chapitre 49 Le faucon déniché chapitre 2
Le faucon déniché chapitre 2 Chapitre 3 l'énergie et ses manifestations
Chapitre 3 l'énergie et ses manifestations Matthieu chapitre 1
Matthieu chapitre 1 Mathieu chapitre 3
Mathieu chapitre 3 Jean chapitre 7
Jean chapitre 7 Le petit prince chapitre 16
Le petit prince chapitre 16 Allons en ville chapitre 9 vocabulaire 1
Allons en ville chapitre 9 vocabulaire 1 Le petit prince chapitre 14
Le petit prince chapitre 14 La route de chlifa chapitre 1 résumé
La route de chlifa chapitre 1 résumé Résumé chapitre 26 le dernier jour d'un condamné
Résumé chapitre 26 le dernier jour d'un condamné Le monde du travail chapitre 2 answers
Le monde du travail chapitre 2 answers Histoire seconde periodisation
Histoire seconde periodisation Vocabulaire statistique 4ème
Vocabulaire statistique 4ème Qualiroute chapitre g
Qualiroute chapitre g Jean chapitre 11
Jean chapitre 11 Grammaire 1 chapitre 5
Grammaire 1 chapitre 5 Le bilan thermique du corps humain exercice
Le bilan thermique du corps humain exercice The pronoun y chapitre 3
The pronoun y chapitre 3 Jean chapitre 8
Jean chapitre 8 1 pierre chapitre 5
1 pierre chapitre 5 Chapitre 2 vocabulaire 1
Chapitre 2 vocabulaire 1 Chapitre 2 richesse et pauvreté dans le monde
Chapitre 2 richesse et pauvreté dans le monde Daniel chapitre 1
Daniel chapitre 1 Chapitre 14 cinquieme rencontre
Chapitre 14 cinquieme rencontre