Chapitre II Les cristaux mtalliques Introduction Il y
















![• La coordinence • Dans cette empilement la coordinence est [X] = [8] • La coordinence • Dans cette empilement la coordinence est [X] = [8]](https://slidetodoc.com/presentation_image_h/bd113677267e9e1b67301f52bc1bfc07/image-33.jpg)







- Slides: 50

Chapitre II Les cristaux métalliques

Introduction • Il y a deux ou trois décennies seulement, un bon critère du développement industriel d’un pays était l’importance de sa production de métaux. • L’intérêt des matériaux métalliques. • Nous allons tous d’abord essayer de dégager les caractères généraux des métaux puis nous étudierons leurs structures

Caractères généraux des métaux • état naturel En général, dans la nature, les métaux se trouvent à l’état de corps composés tels qu’oxydes, sulfure, carbonates… • élément métallique • Les symboles des éléments métalliques se trouvent vers la gauche et vers le bas du tableau de la classification périodique. • Ce qui rend leurs électrons de valences relativement peu attirés par le noyau PI des atomes métalliques sera faible.

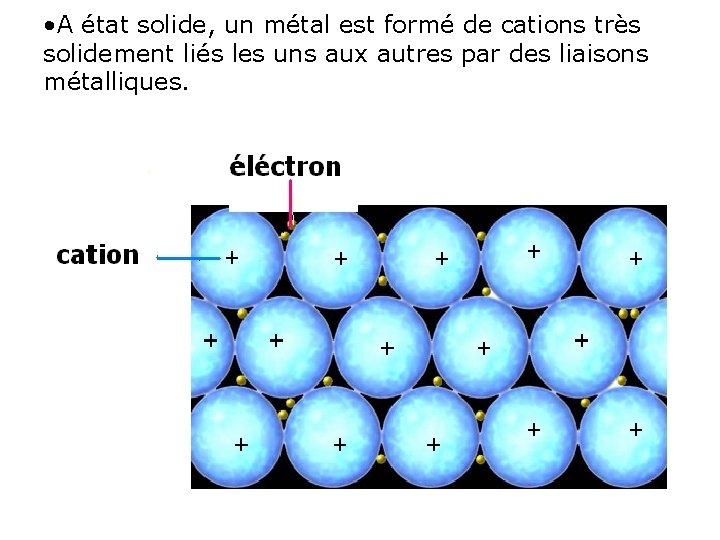
• A état solide, un métal est formé de cations très solidement liés les uns aux autres par des liaisons métalliques. + + +

Liaison métallique • La liaison métallique concerne les éléments possédant peu d’électrons de valence • la force cohésion des métaux provient des interactions électrostatiques entre les ions positifs et le nuage d'électrons délocalisés sur tout le cristal. • Les é peuvent circuler dans tout la structure solide. • L’ensemble reste constamment neutre. • Ce qui confèrent aux métaux leurs remarquables propriétés physiques et mécaniques.

Propriétés physiques Propriétés mécaniques • Ductilité et malléabilité possibilité d'obtenir des - fils par tirage - feuilles par forgeage ou laminage

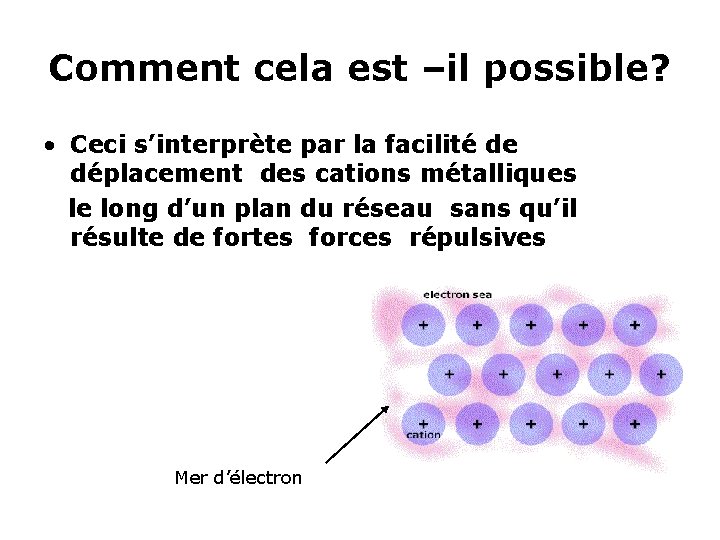
Comment cela est –il possible? • Ceci s’interprète par la facilité de déplacement des cations métalliques le long d’un plan du réseau sans qu’il résulte de fortes forces répulsives Mer d’électron

Propriétés thermiques • Les é de valences sont libres de se déplacer dans toutes les directions du réseau. Ces électrons libres peuvent passer d’un atome à un autre Ils sont appelés des é de conduction • d’excellentes conductivités thermiques et électriques • Le sodium est utilisé comme vecteur thermique dans certaines centrales nucléaires.

Propriété électriques • Les métaux sont d’excellents conducteurs de l’électricité. Une faible différence de potentiel provoque un courant d’électricité relativement important. • Certains métaux sont ferromagnétiques. Cette propriété est de première importance dans l’industrie électrique.

Propriétés optiques • Les métaux sont de bon réflecteurs de la lumière. • Les é libres du métal sont excités par le champs électromagnétique du rayon lumineux incident, • par désexcitation ils réémettent les radiations lumineuses sans perte d’énergie ( Ag; Hg…). • C’est pour cette raison que les métaux brillent. • Parfois ils absorbent certaines radiations lumineuses visibles; le cuivre et l’or absorbent le bleu, ils paraissent alors jaunes

STRUCTURE DES MÉTAUX À L’ÉTAT SOLIDE Les cristaux métalliques cristallisent dans trois systèmes cristallins principaux: • Le cubique à faces centrées • L’hexagonale compacte • Le cubique centré que l'on peut décrire par deux types d'assemblages de sphères rigides: - les empilements compacts - les empilements semi compacts.

Empilements compacts • Dans l’empilement compact, chaque sphère est tangente à six autres sphères identiques formant ainsi un hexagone régulier autour de l’atome central. 6 5 B 4 B 1 B 3 2 Association des atomes dans le plan A

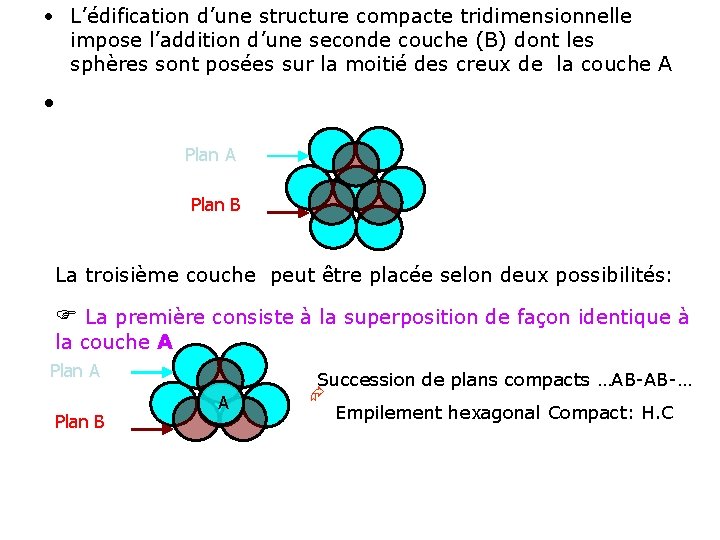
• L’édification d’une structure compacte tridimensionnelle impose l’addition d’une seconde couche (B) dont les sphères sont posées sur la moitié des creux de la couche A • Plan A Plan B La troisième couche peut être placée selon deux possibilités: La première consiste à la superposition de façon identique à la couche A Plan B A Succession de plans compacts …AB-AB-… Empilement hexagonal Compact: H. C

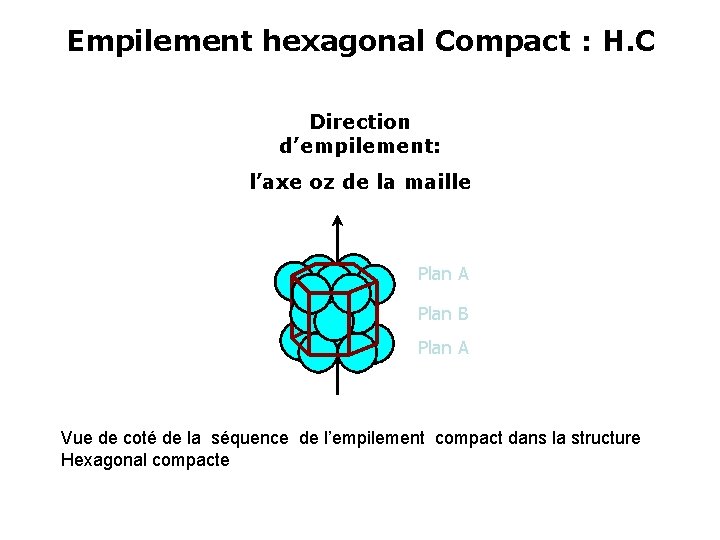
Empilement hexagonal Compact : H. C Direction d’empilement: l’axe oz de la maille Plan A Plan B Plan A Vue de coté de la séquence de l’empilement compact dans la structure Hexagonal compacte

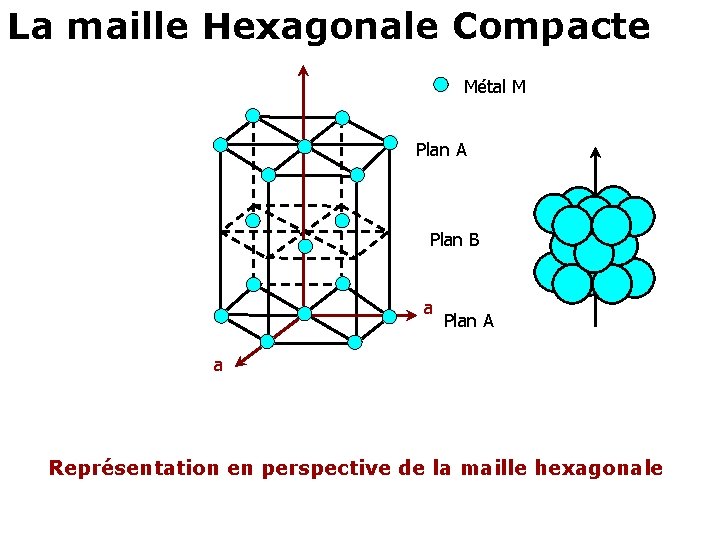
La maille Hexagonale Compacte Métal M Plan A Plan B a Plan A a Représentation en perspective de la maille hexagonale

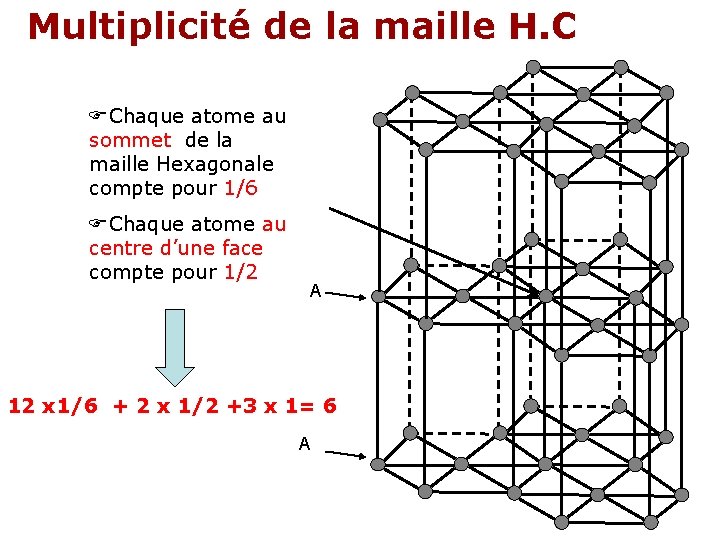
Multiplicité de la maille H. C Chaque atome au sommet de la maille Hexagonale compte pour 1/6 Chaque atome au centre d’une face compte pour 1/2 A 12 x 1/6 + 2 x 1/2 +3 x 1= 6 A

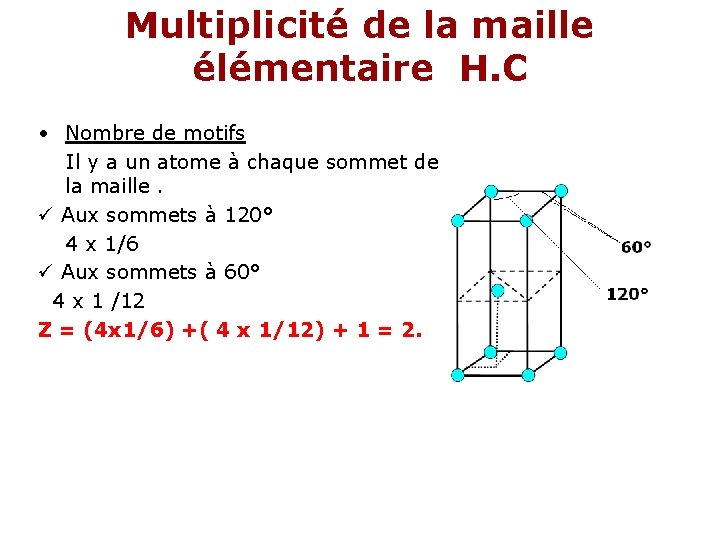
Multiplicité de la maille élémentaire H. C • Nombre de motifs Il y a un atome à chaque sommet de la maille. Aux sommets à 120° 4 x 1/6 Aux sommets à 60° 4 x 1 /12 Z = (4 x 1/6) +( 4 x 1/12) + 1 = 2.

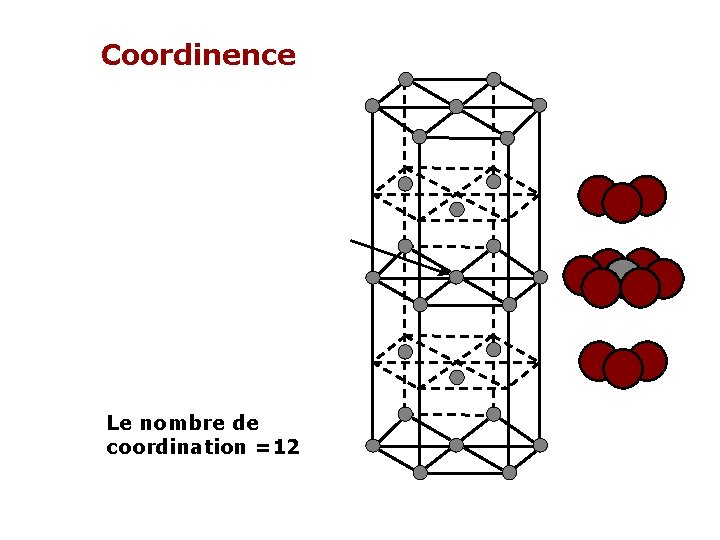
Coordinence Le nombre de coordination =12

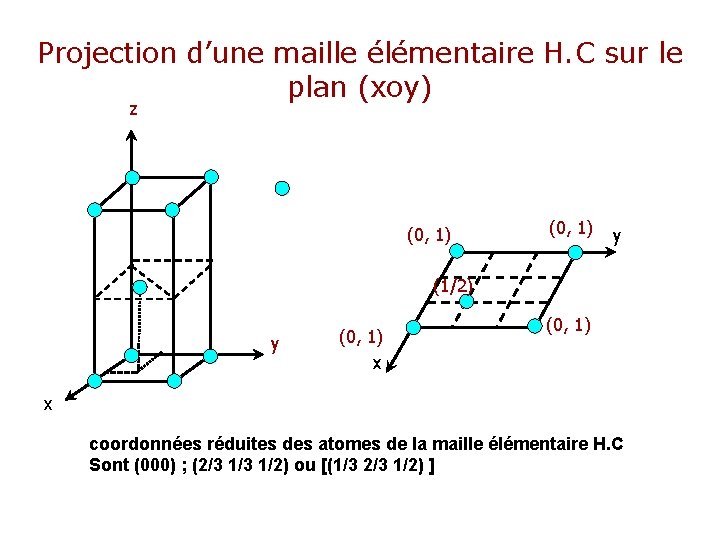
Projection d’une maille élémentaire H. C sur le plan (xoy) z (0, 1) y (1/2) y (0, 1) x coordonnées réduites des atomes de la maille élémentaire H. C Sont (000) ; (2/3 1/2) ou [(1/3 2/3 1/2) ]

Compacité de la maille H. C • Le volume de la maille H. C est : • V = a 2. c. sin 120° avec a = 2 r , et n = 2 • Le volume total des sphères de rayon r sur le volume de la maille élémentaire est avec La compacité est Soit C=0. 74

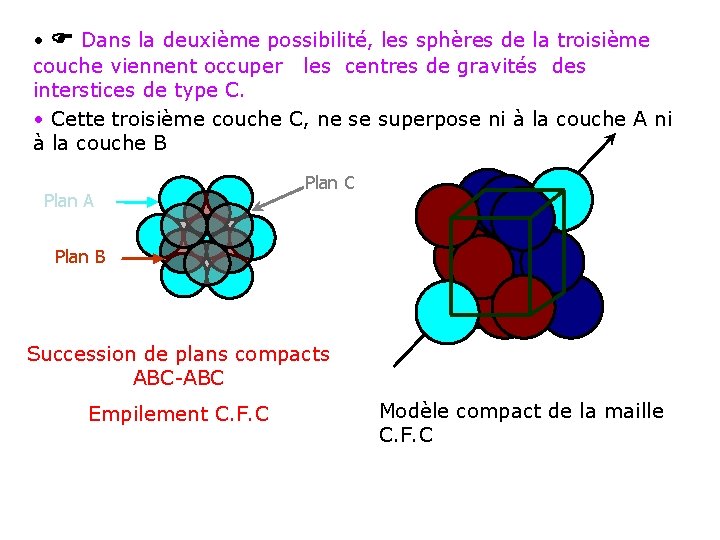
• Dans la deuxième possibilité, les sphères de la troisième couche viennent occuper les centres de gravités des interstices de type C. • Cette troisième couche C, ne se superpose ni à la couche A ni à la couche B Plan A Plan C Plan B Succession de plans compacts ABC-ABC Empilement C. F. C Modèle compact de la maille C. F. C

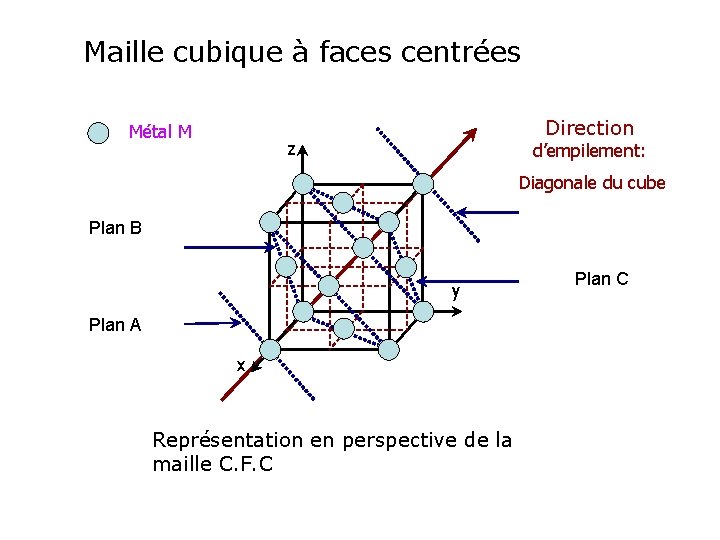
Maille cubique à faces centrées Métal M Direction z d’empilement: Diagonale du cube Plan A Plan B y Plan A x Représentation en perspective de la maille C. F. C Plan C

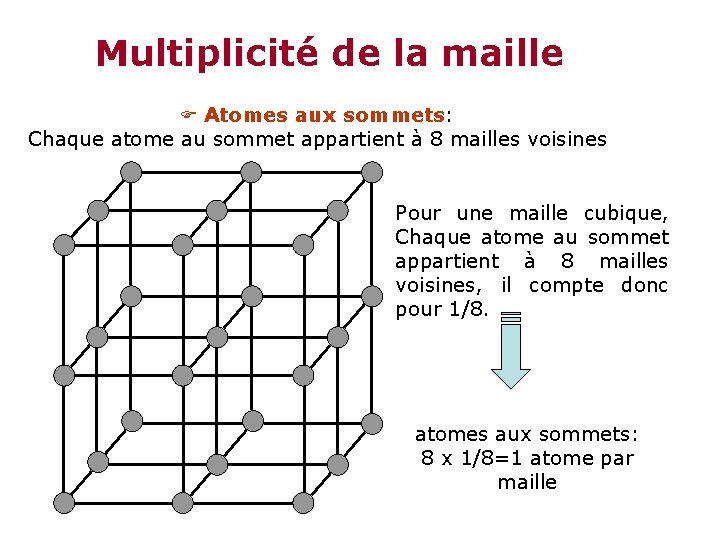
Multiplicité de la maille Atomes aux sommets: Chaque atome au sommet appartient à 8 mailles voisines Pour une maille cubique, Chaque atome au sommet appartient à 8 mailles voisines, il compte donc pour 1/8. atomes aux sommets: 8 x 1/8=1 atome par maille

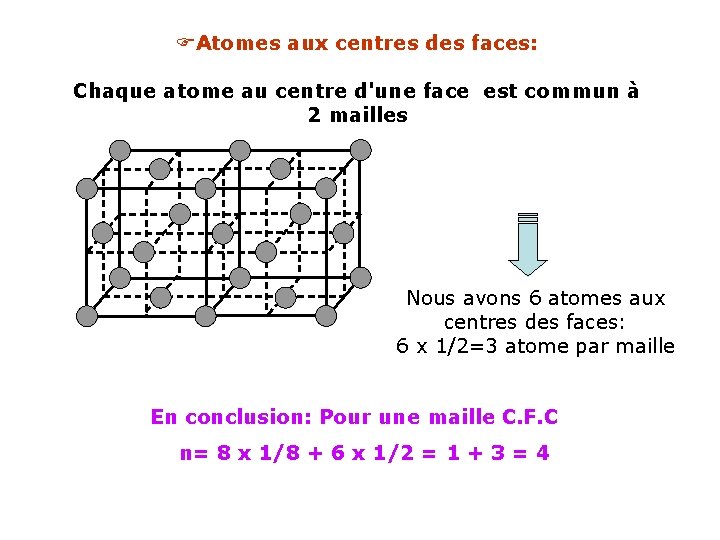
Atomes aux centres des faces: Chaque atome au centre d'une face est commun à 2 mailles Nous avons 6 atomes aux centres des faces: 6 x 1/2=3 atome par maille En conclusion: Pour une maille C. F. C n= 8 x 1/8 + 6 x 1/2 = 1 + 3 = 4

Coordonnées réduites des atomes de la maille élémentaire • Une maille cubique à faces centrées Contient des atomes aux • 8 sommets du cube de coordonnée réduite (000). • 6 centres des faces de coordonnées réduites: (1/2 0), (1/2 0 1/2), (0 1/2),

La coordinence Dans les deux types d’empilements compacts, chaque sphère est entourée de 12 sphères voisines 6 dans le même plan , 3 dans le plan inférieur et 3 dans le plan supérieur La coordinence est donc = 12 Plan C Plan B Plan A Plan C

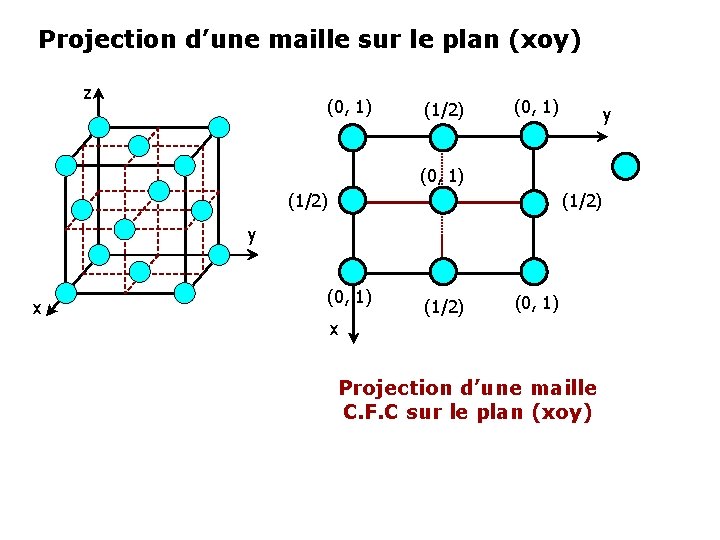
Projection d’une maille sur le plan (xoy) z (0, 1) (1/2) (0, 1) y (0, 1) (1/2) y x (0, 1) (1/2) (0, 1) x Projection d’une maille C. F. C sur le plan (xoy)

Compacité Le volume de la maille C. F. C est : a 3 avec n=4 et Le volume total des sphères de rayon r sur le volume de la maille élémentaire est : • L’empilement compact est la façon la plus efficace de remplir l’espace avec des sphères identiques. • Elles occupent 74% du volume. • Le taux de compacité de l’empilement est 74%. r. Soit exactement la même valeur que dans le système H. C C = 0. 74

Exemple de métaux cristallisant dans les structures H. C et C. F. C Structure Hexagonal compact • Le réseau hexagonal compact regroupe une vingtaine de métaux parmi lesquels : Li, Be, Mg, Y, Tc, Re, Ru, l Os, Sc, Ti, Zr, Hf, Mo, Co, Ni, Cd, Tl, He, …. Structure cubique à faces centrées. • Cette structure regroupe une vingtaine de métaux : Al, Ca, Sr, et certains métaux de transition (Fe , Co, Ni, Cu, Pd, Ag, Yb, Au, Pt…) et les gaz rares (sauf l’hélium) à l’état solide. • N. B Co , Ni, , …présentent deux variétés allotropiques HC et CFC Les structures HC et CFC sont très proches. Allotropie

Empilements non- compacts • Dans cette structure, les sphères d’un même plan sont disposées de sorte que leurs centres constituent les sommets d’un carré de côté a Un second plan est obtenu en plaçant une sphère dans chaque espace libre laissé par les sphères du premier plan; en donnant la succession AB, AB. . A B

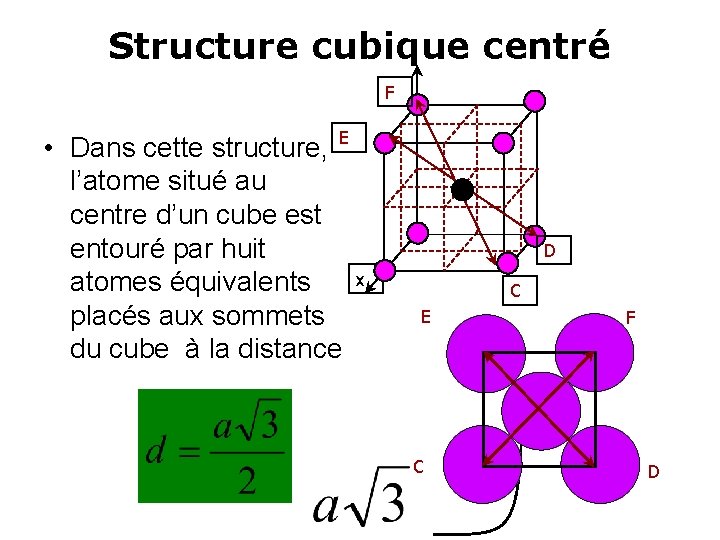
Structure cubique centré F • Dans cette structure, E l’atome situé au centre d’un cube est entouré par huit atomes équivalents x placés aux sommets du cube à la distance D C E C F D

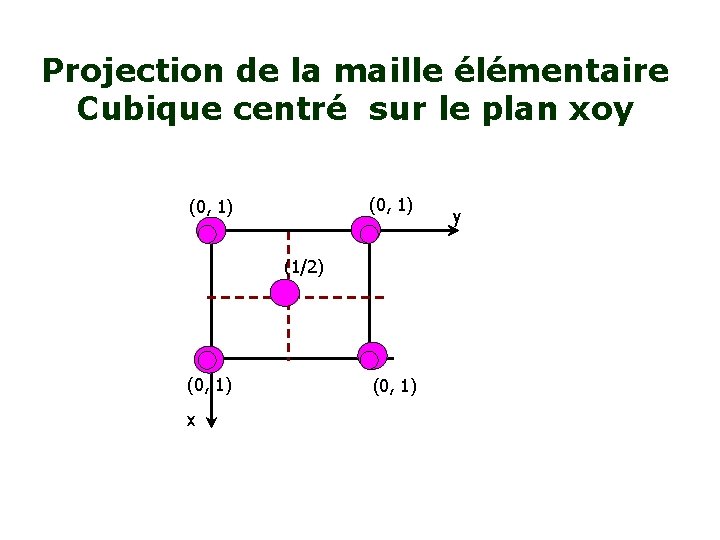
Projection de la maille élémentaire Cubique centré sur le plan xoy (0, 1) (1/2) (0, 1) x (0, 1) y
![La coordinence Dans cette empilement la coordinence est X 8 • La coordinence • Dans cette empilement la coordinence est [X] = [8]](https://slidetodoc.com/presentation_image_h/bd113677267e9e1b67301f52bc1bfc07/image-33.jpg)
• La coordinence • Dans cette empilement la coordinence est [X] = [8] • La multiplicité de la maille : 8 x 1/8 +1 =2 • Les coordonnées réduites les coordonnées réduites nécessaires pour décrire l’ensembles des positions atomiques dans un réseau C. C sont (000), (1/2, 1/2). • Compacité: La compacité de cette structure est inférieure à celle de HC et CFC Ex de structure CC: Li, Na, Cs, Ba, Feα, Mo, Zn, W…

Insertion dans les réseaux • L’existence d’interstices vides dans les cristaux métalliques permet d’envisager l’insertion d’atomes plus petits : on obtient ainsi des composés d’insertion comme les alliages métalliques. Ex. l’acier Fer- carbone. L’insertion du carbone permet de modifier les propriétés mécaniques du fer. • Étude des conditions d’insertion dans les empilements compacts CFC et HC. • Sites cristallographiques • Sites octaédriques. Le polyèdre de référence est l’octaèdre, polyèdre à 6 sommets dont les 8 faces sont des triangles équilatéraux. Le centre de cet octaèdre correspond au site octaédrique ce qui implique une coordinence 6 ]

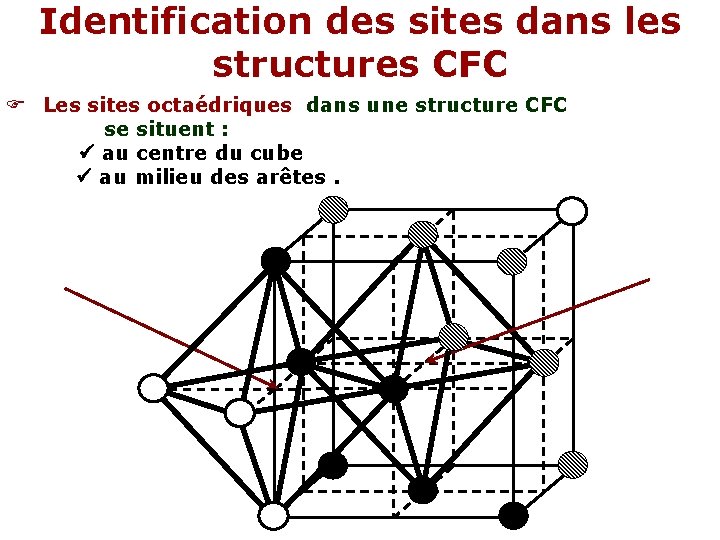
Identification des sites dans les structures CFC Les sites octaédriques dans une structure CFC se situent : au centre du cube au milieu des arêtes.

Le nombre des sites octaédriques est : (1 x 1) + (12 x ¼) = 4 Le nombre de sites octaédriques est égal au nombre de motifs/Maille. Coordonnées réduites des sites octaédriques (1/2, 1/2); (1/2, 0, 0); (0, 1/2, 0)et (0, 0, 1/2) Le rayon maximum ro d’une sphère susceptible d’être introduite en site octaédrique ; sans que soit déformé le réseau, est tel que : 2(R + ro) = a a = 2 R 2 = 2 2 R Ce qui donne : 4 R=

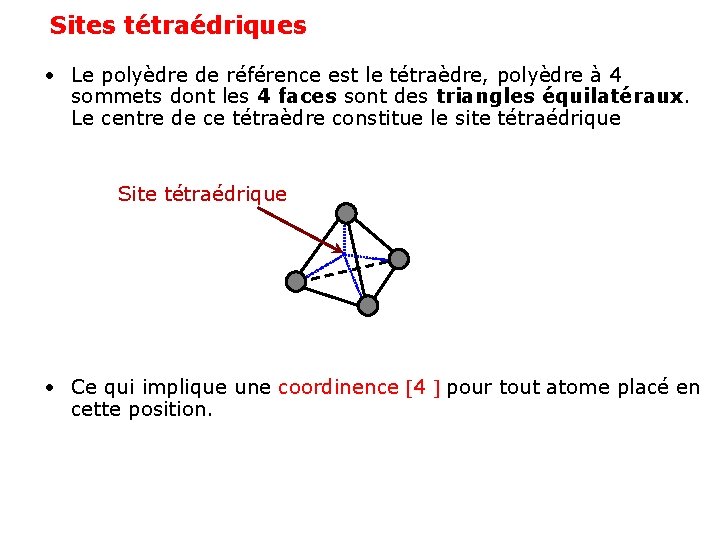
Sites tétraédriques • Le polyèdre de référence est le tétraèdre, polyèdre à 4 sommets dont les 4 faces sont des triangles équilatéraux. Le centre de ce tétraèdre constitue le site tétraédrique Site tétraédrique • Ce qui implique une coordinence 4 pour tout atome placé en cette position.

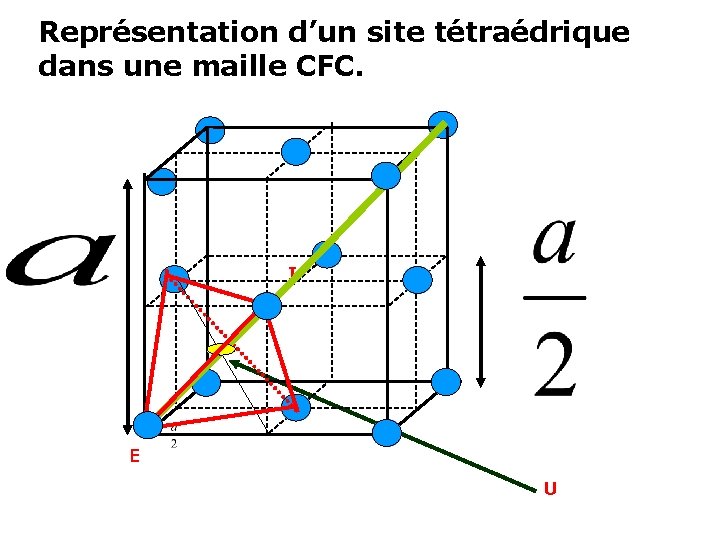
Représentation d’un site tétraédrique dans une maille CFC. I E U

• La maille CFC est formée de 8 petits cubes élémentaires d’arête a/2 portant 4 atomes. • Ces quatre atomes constituent un site tétraédrique, dont le centre U est à mi-chemin entre le point E pris comme origine , donc de coordonnées réduites (0, 0, 0) et le point I, centre de la maille de coordonnées réduites (1/2, 1/2). • Le point U a alors comme coordonnées (3/4, 1/4; 1/4). Il se situe donc au quart de la diagonale du cube issue de E. Comme tous les sites sont internes à la maille. Il en résulte l’existence de : T = 8 • Les coordonnées réduites des autres sites tétraédriques sont: : (1/4, 1/4 ); (3/4, 1/4) (1/4, 3/4, 1/4) (3/4, 1/4) (1/4, 3/4); (3/4, 1/4, 3/4 ) (1/4, 3/4) (3/4, 3/4)

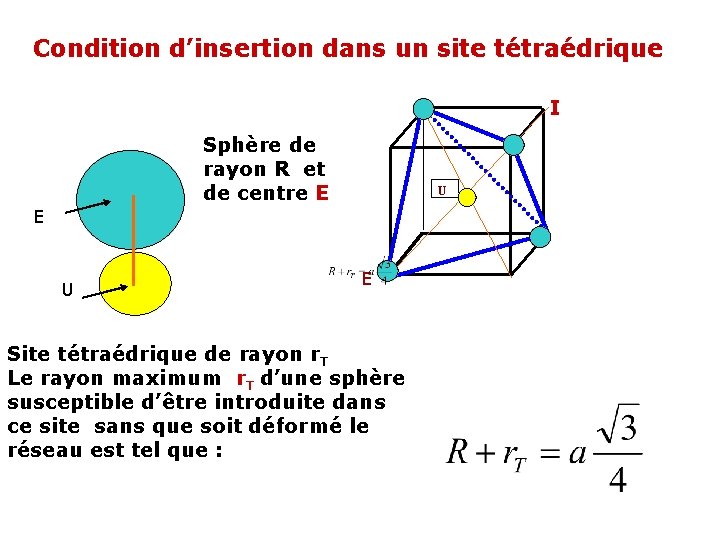
Condition d’insertion dans un site tétraédrique I Sphère de rayon R et de centre E U E Site tétraédrique de rayon r. T Le rayon maximum r. T d’une sphère susceptible d’être introduite dans ce site sans que soit déformé le réseau est tel que :

• En remplaçant a par sa valeur, on obtient : R + r. T = a ( 3)/4) = 2 R 2 ( 3)/4) = R 3/ 2 • r. T/R = ( 3/ 2) - 1 = 0. 225 • Ce qui donne : r. T = 0. 225 R • Un site T ne pourra donc être occupé que par un atome plus petit que celui qui s’insère dans un site octaédrique.

En Conclusion • la condition d’insertion dans un CFC • En site Octaédrique ro / R = 2 -1 = 0, 414 • En site tétraédrique r. T/R = ( 3/ 2) -1 = 0. 225

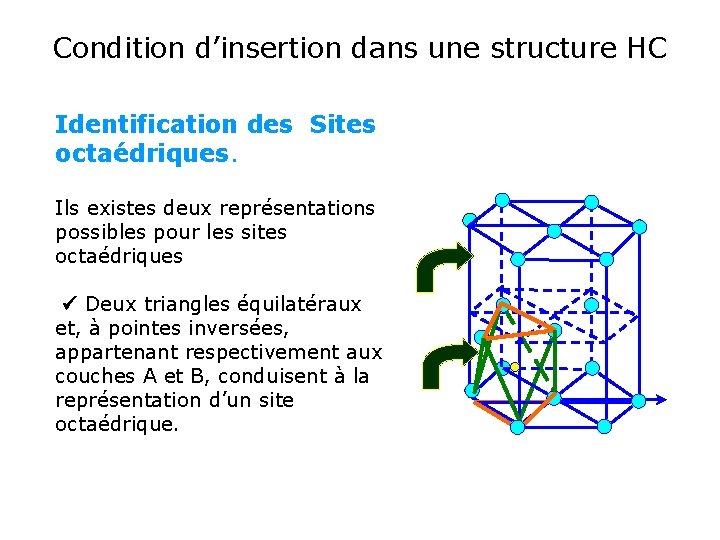
Condition d’insertion dans une structure HC Identification des Sites octaédriques. Ils existes deux représentations possibles pour les sites octaédriques Deux triangles équilatéraux et, à pointes inversées, appartenant respectivement aux couches A et B, conduisent à la représentation d’un site octaédrique.

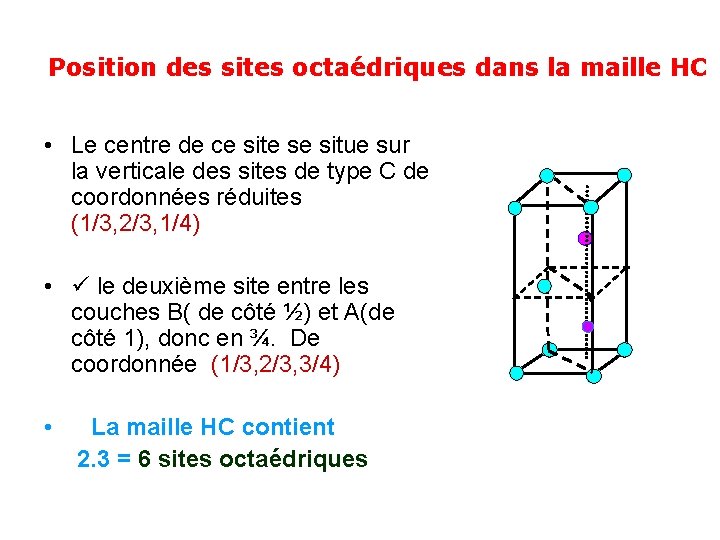
Position des sites octaédriques dans la maille HC • Le centre de ce site se situe sur la verticale des sites de type C de coordonnées réduites (1/3, 2/3, 1/4) • le deuxième site entre les couches B( de côté ½) et A(de côté 1), donc en ¾. De coordonnée (1/3, 2/3, 3/4) • La maille HC contient 2. 3 = 6 sites octaédriques

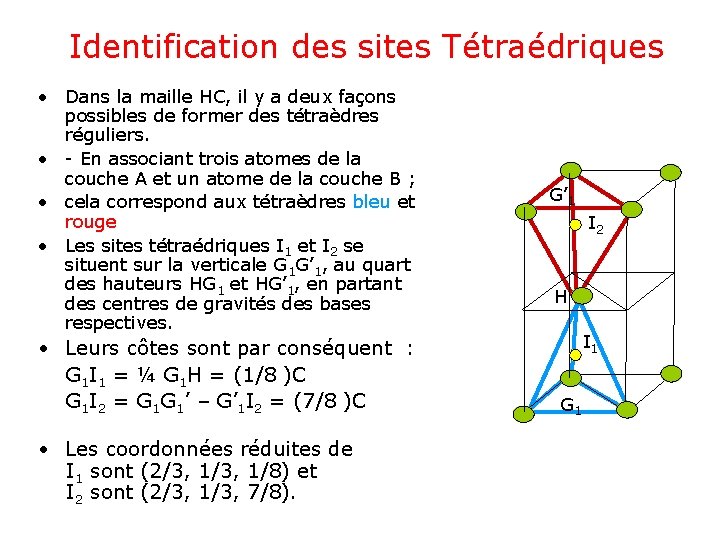
Identification des sites Tétraédriques • Dans la maille HC, il y a deux façons possibles de former des tétraèdres réguliers. • - En associant trois atomes de la couche A et un atome de la couche B ; • cela correspond aux tétraèdres bleu et rouge • Les sites tétraédriques I 1 et I 2 se situent sur la verticale G 1 G’ 1, au quart des hauteurs HG 1 et HG’ 1, en partant des centres de gravités des bases respectives. • Leurs côtes sont par conséquent : G 1 I 1 = ¼ G 1 H = (1/8 )C G 1 I 2 = G 1 G 1’ – G’ 1 I 2 = (7/8 )C • Les coordonnées réduites de I 1 sont (2/3, 1/8) et I 2 sont (2/3, 1/3, 7/8). G’ 1 I 2 H I 1 G 1

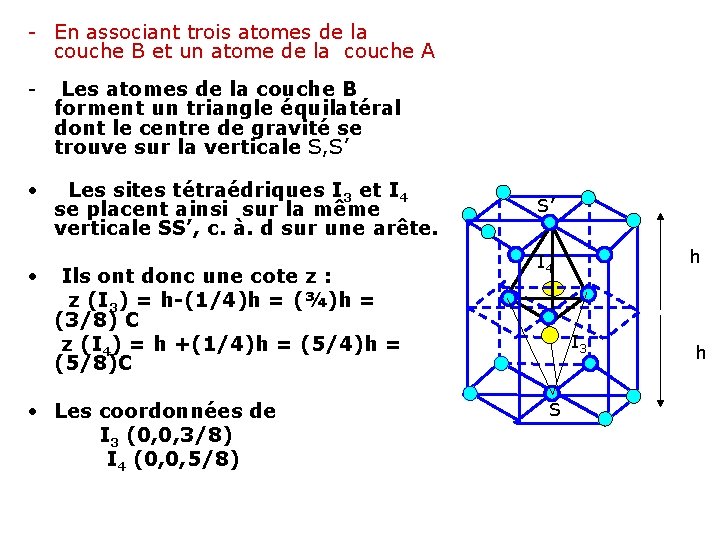
- En associant trois atomes de la couche B et un atome de la couche A - Les atomes de la couche B forment un triangle équilatéral dont le centre de gravité se trouve sur la verticale S, S’ • Les sites tétraédriques I 3 et I 4 se placent ainsi sur la même verticale SS’, c. à. d sur une arête. • Ils ont donc une cote z : z (I 3) = h-(1/4)h = (¾)h = (3/8) C z (I 4) = h +(1/4)h = (5/8)C • Les coordonnées de I 3 (0, 0, 3/8) I 4 (0, 0, 5/8) S’ h I 4 I 3 S h

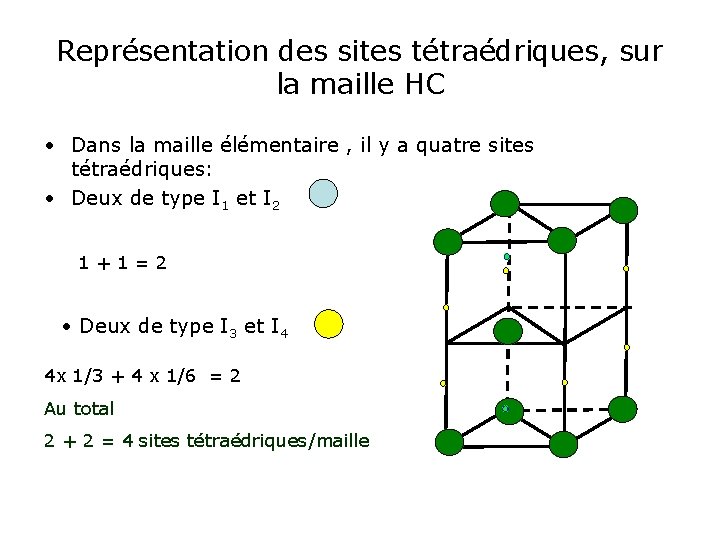
Représentation des sites tétraédriques, sur la maille HC • Dans la maille élémentaire , il y a quatre sites tétraédriques: • Deux de type I 1 et I 2 1 + 1 = 2 • Deux de type I 3 et I 4 4 x 1/3 + 4 x 1/6 = 2 Au total 2 + 2 = 4 sites tétraédriques/maille

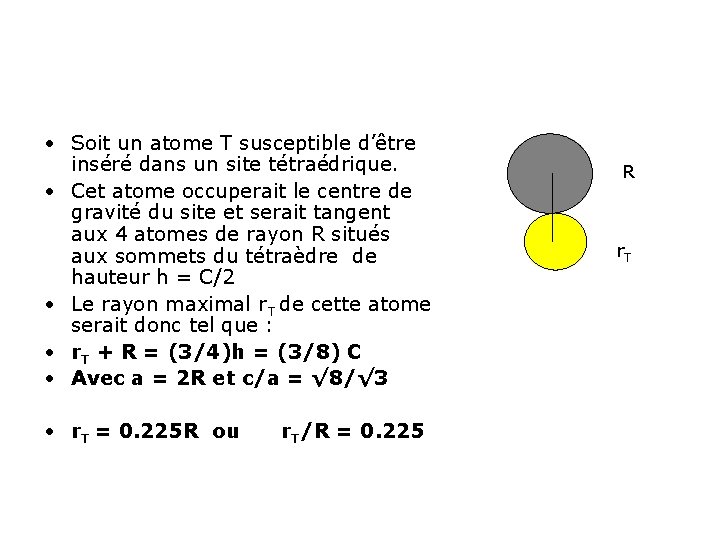
• Soit un atome T susceptible d’être inséré dans un site tétraédrique. • Cet atome occuperait le centre de gravité du site et serait tangent aux 4 atomes de rayon R situés aux sommets du tétraèdre de hauteur h = C/2 • Le rayon maximal r. T de cette atome serait donc tel que : • r. T + R = (3/4)h = (3/8) C • Avec a = 2 R et c/a = √ 8/√ 3 • r. T = 0. 225 R ou r. T/R = 0. 225 R r. T

• De même si un atome O peut s’insérer dans un site octaédrique sans déformer la structure, il occuperait le centre de gravité du site càd le centre du carré de côté a délimité par les atomes formant un octaèdre • Le rayon maximal ro de l’atome à insérer doit être au maximum tel que: • ro+ R = a√ 2/2 avec a =2 R • ro /R = 0. 414 • NB : les conditions d’insertion sont les mêmes pour les deux types de structures CFC et HC

Relation entre les paramètres a et c F A B E D C a
 Rayon site tetraedrique
Rayon site tetraedrique Histoire le petit prince résumé
Histoire le petit prince résumé Lecture analytique petit pays chapitre 30
Lecture analytique petit pays chapitre 30 Tirez pas sur le scarabée résumé complet
Tirez pas sur le scarabée résumé complet Le petit prince résumé
Le petit prince résumé Cristaux de sulfate de cuivre
Cristaux de sulfate de cuivre Le dernier jour d'un condamné chapitre 26 analyse
Le dernier jour d'un condamné chapitre 26 analyse Parts de les flors
Parts de les flors Les lettres en français
Les lettres en français Les 10 volcans les plus dangereux du monde
Les 10 volcans les plus dangereux du monde Le paratexte de la ficelle
Le paratexte de la ficelle Les constellations les plus connues
Les constellations les plus connues Remplacez les mots soulignes par les pronoms convenable
Remplacez les mots soulignes par les pronoms convenable Parts d una planta
Parts d una planta Classe de mot variable et invariable
Classe de mot variable et invariable Mots variables et mots invariables
Mots variables et mots invariables Trouvez les réponses. écrivez-les en chiffres (numbers).
Trouvez les réponses. écrivez-les en chiffres (numbers). Les trains grand corps malade
Les trains grand corps malade Allez vous en sur les places paroles
Allez vous en sur les places paroles Preactionneurs
Preactionneurs Les trois obstacles et les quatre démons
Les trois obstacles et les quatre démons Quand le ciel est bleu mon garçon
Quand le ciel est bleu mon garçon Les avantages et les inconvénients de la matrice adl
Les avantages et les inconvénients de la matrice adl Tu aimes manger
Tu aimes manger Les mots qu'on ne dit pas sont les fleurs du silence
Les mots qu'on ne dit pas sont les fleurs du silence Marqueur de relation ordre
Marqueur de relation ordre Composition dragibus
Composition dragibus C'est quoi un texte expressif
C'est quoi un texte expressif Fonction technique scooter
Fonction technique scooter Les voitures les plus rapides du monde
Les voitures les plus rapides du monde Intro victor hugo
Intro victor hugo Introduction sur les tice
Introduction sur les tice Biocapteur optique
Biocapteur optique Introduction sur les fruits et légumes
Introduction sur les fruits et légumes Introduction sur les capteurs
Introduction sur les capteurs Introduction sur les matériaux de construction
Introduction sur les matériaux de construction Mathieu chapitre 3
Mathieu chapitre 3 Jean chapitre 8
Jean chapitre 8 Jean chapitre 5
Jean chapitre 5 Jean, chapitre 6
Jean, chapitre 6 La route de chlifa chapitre 1 résumé
La route de chlifa chapitre 1 résumé Maria chapdelaine résumé par chapitre
Maria chapdelaine résumé par chapitre Le dernier jour d'un condamné chapitre 49 examen corrigé
Le dernier jour d'un condamné chapitre 49 examen corrigé Le friauche
Le friauche Le petit prince le roi analyse
Le petit prince le roi analyse Le dernier jour d'un condamné chapitre 49
Le dernier jour d'un condamné chapitre 49 Bilan énergétique du corps
Bilan énergétique du corps Kay haugaard
Kay haugaard Chapitre 7 vocabulaire 1 french 2
Chapitre 7 vocabulaire 1 french 2 Allons en ville chapitre 9 vocabulaire 1
Allons en ville chapitre 9 vocabulaire 1 Daniel chapitre 1
Daniel chapitre 1