Chapitre 12 Lanalyse des lois des gaz 12




































- Slides: 42

Chapitre 12 L’analyse des lois des gaz

12. 1 La loi combinée des gaz Résultats d’apprentissage: • Je peux expliquer les lois régissant le comportement des gaz. • Je peux déterminer expérimentalement le rapport entre la pression, le volume et la température des gaz et résoudre des problèmes qui portent sur les lois des gaz et leur volume ainsi que la quantité de matière en moles et en masse molaire. Critères de réussite Je peux expliquer la loi des pressions partielles de Dalton. (F 1. 5) Je peux énoncer l’hypothèse d’Avogadro et reconnaitre sa contribution à l’approfondissement des connaissances sur le comportement des gaz. (F 1. 3) Je peux déterminer expérimentalement le volume molaire d’un gaz. (F 2. 6)

Mise en situation L’implosion de la cannette de boisson gazeuse: http: //phymain. unisciel. fr/faire-imploser-une-canette/

Loi combinée des gaz Combinaison des relations exprimées par les lois de Boyle. Mariotte et de Charles. On considère que la quantité de gaz demeure constante. T= température en Kelvins. P 1 V 1 = P 2 V 2 T 1 T 2 Voir exemple page 541 de ton manuel. Modélisation de résolution de problème 1: https: //nouvelon. apprentissageelectroniqueontario. ca/d 2 l/lor/viewe r/view. d 2 l? ou=8201&lo. Ident. Id=176443 Modélisation de résolution de problème 2: https: //nouvelon. apprentissageelectroniqueontario. ca/d 2 l/lor/viewe r/view. d 2 l? ou=8201&lo. Ident. Id=176444

Pratique-toi Complète les exercices #1, 2 et 5 de la page 542

La loi d’Avogadro Loi des gaz selon laquelle, à volume égal, les gaz parfaits, à la même température et la même pression, renferment le même nombre de molécules. n 1 = n 2 V 1 V 2 Où n 1 représente le nombre de moles initial d’un gaz. et n 2 représente le nombre de moles final d’un gaz. Le volume augmente proportionnellement avec le nombre de moles de gaz, si à une température et pression constantes (Voir fig 12. 4 page 545 du manuel. ) http: //www 1. tfo. org/education/episode/24986/hypothese-davogadro

La loi d’Avogadro ( suite) Le volume molaire (v): quantité d’espace occupé par une mole d’une substance gazeuse lorsque mesurer dans les mêmes conditions de température et de pression. v=V n Où v= volume molaire en L/mol; V=Volume et n=mole

La loi d’Avogadro ( suite) À TAPN, soit une température de 298 K et pression de 100 k. Pa, le volume pour un gaz parfait sera 24, 8 L/mol. Vérifies tes connaissances sur la loi d’Avogadro: https: //nouvelon. apprentissageelectroniqueontario. ca/d 2 l/lor/viewer/view. d 2 l? ou=8201&lo. Ident. Id=17 6442 Exemples de calcul voir page 547 et 548 du manuel.

La loi d’Avogadro ( suite) Pratiquons-nous: Page 549 #11 À TPN, 1, 0 mol de dioxyde de carbone gazeux a un volume de 22, 41 L. Quelle et la masse de 3, 0 L de ce gaz. Pratique-toi: Complète les exercices #12, 13, 16 et 19 de la page 549. Questions de révision #1, 2, 4, 5, 6, 7, 8, 9, 11, 12 et 14 de la page 550 de leur manuel de chimie.

12. 2 La loi des gaz parfaits met en relation la pression (P), le volume (V), la température absolue (T) et la quantité de gaz en moles (n) à un moment donné. PV=n. RT où P représente la pression (en k. Pa) V représente le volume (en L) n représente la quantité de gaz (en mol) R représente la constante des gaz parfaits (en k. Pa • L/mol • K) T représente la température absolue (en K)

La loi des gaz parfaits La valeur de la constante des gaz parfaits (R) peut être déterminer en utilisant la valeur du volume molaire d'un gaz à TPN. Dans ces conditions, on trouve la valeur suivante: PV=n. RT que l'on reformule de la façon suivante: R = P×V n×T où l'on remplace les termes de l'équation par les valeurs à TPN: R= 101, 325 k. Pa× 22, 4 L 1, oomol× 273, 15 K R=8, 314 k. Pa⋅L/mol⋅K La constante des gaz parfaits est égale à 8, 314 k. Pa⋅L/mol⋅K. Il est toutefois important que les unités de mesure des différentes caractéristiques soient respectées afin de pouvoir utiliser cette constante.

La loi des gaz parfaits permet de décrire l'interdépendance entre la pression, la température, le volume et le nombre de moles d'un gaz à un moment donné. On peut donc l'utiliser pour trouver une variable inconnue lorsque les trois autres sont connues. Source : http: //www. alloprof. qc. ca/BV/Pages/c 1009. aspx

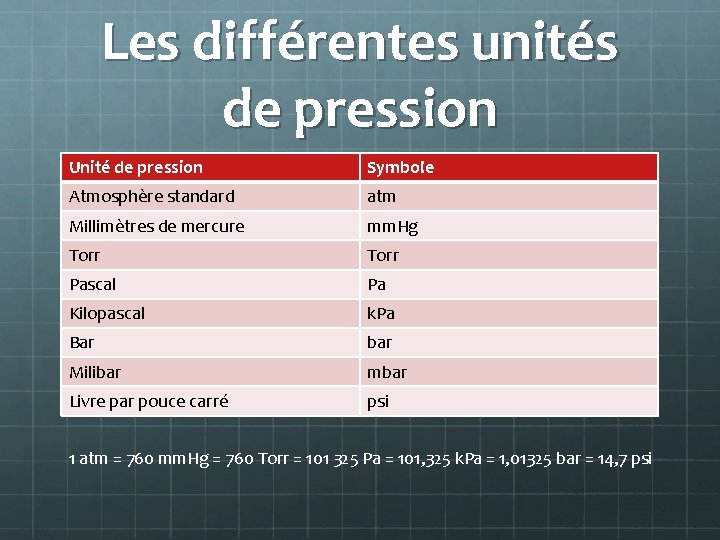
Les différentes unités de pression Unité de pression Symbole Atmosphère standard atm Millimètres de mercure mm. Hg Torr Pascal Pa Kilopascal k. Pa Bar bar Milibar mbar Livre par pouce carré psi 1 atm = 760 mm. Hg = 760 Torr = 101 325 Pa = 101, 325 k. Pa = 1, 01325 bar = 14, 7 psi

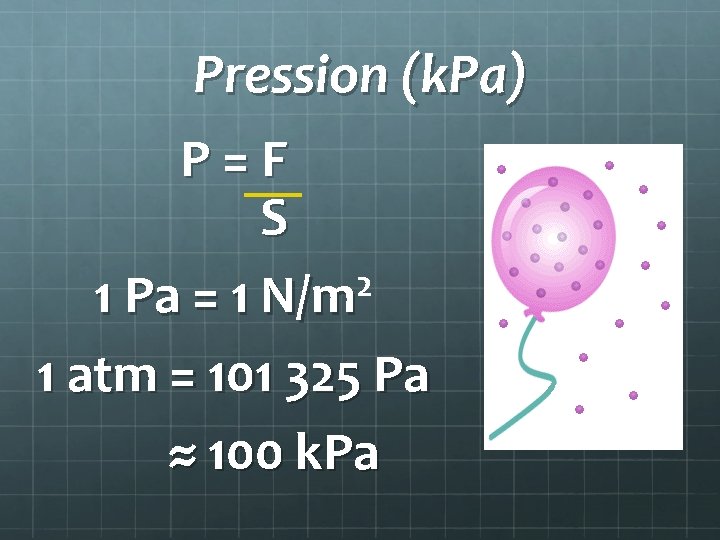
Pression (k. Pa) P = F S 2 1 Pa = 1 N/m 1 atm = 101 325 Pa ≈ 100 k. Pa

Volume (L)

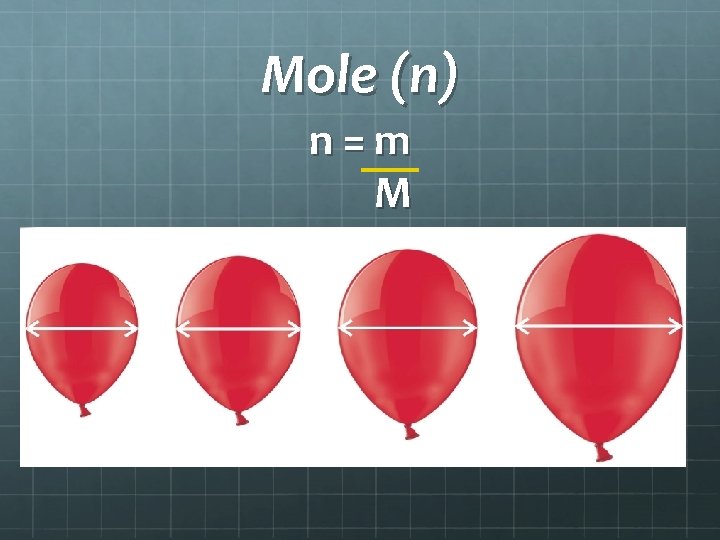
Mole (n) n = m M

La constante universelle des gaz parfaits (k. Pa L / mol K) R = 8, 314 k. Pa L mol K

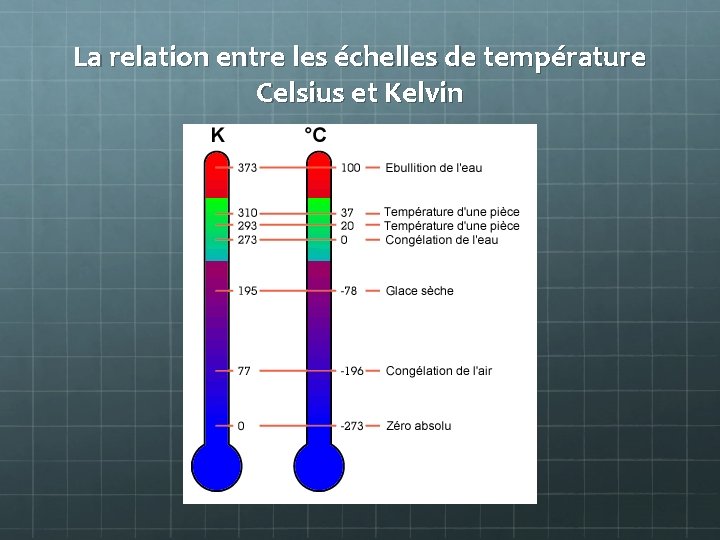
Température (°C) L’énergie cinétique, ou bien, comment rapidement les particules se déplacent dans le système. K = °C + 273, 15 °C = K – 273, 15

La relation entre les échelles de température Celsius et Kelvin

La loi des gaz parfaits PV = n. RT P(k. Pa)V(L) = n(mol)R(8, 314 k. Pa L)T(K) mol K On utilise l’équation à TPN c. à. d. 0 °C et 100 k. Pa ou bien 273, 15 K et 100 k. Pa

Les conditions normales de température et de pression Conditions Pression Température Volume (°C) (K) molaire d’un gaz parfait Température et pression normales (TPN) 101, 325 k. Pa 0 °C 273, 15 K 22, 4 L/mol Température ambiante et pression normale (TAPN) 100, 0 k. Pa 25 °C 298, 15 K 24, 8 L/mol

Les unités de volume molaire, de masse volumique et de masse molaire. Unité Signification Calculs L/mol volume/quantité v=V n Masse volumique g/L masse/volume D=m V Masse molaire masse/quantité M=m n Volume molaire g/mol Pour un tableau plus détaillé, voir tableau 12. 3 à la page 552 de ton manuel

Exemple 1 Détermine le volume de 100, 0 g d’oxygène gazeux à TAPN. PV = n. RT m = 100, 0 g T = 298, 15 K Si la masse molaire de l’oxygène est 32 g/mol n = m/M = 100, 0 g / (16 x 2) g/mol P = 100, 0 k. Pa = 3, 125 mol V = ? V = (3, 125 mol) (8, 314 R) (298, 15 K) PV = n. RT 100, 0 k. Pa V = n. RT/P = 77, 46 L

Exemple 2 Détermine la température, en °C, de 2, 50 mol d’un gaz qui occupe un volume de 56, 6 L à une pression de 1, 20 atm. n = 2, 50 mol P = 1, 20 atm (101, 325 k. Pa/1 atm) = 121, 59 k. Pa V = 56, 6 L PV = n. RT ou PV/n. R = T T = (121, 59 k. Pa) (56, 5 L) 2, 50 mol (8, 314 R) = 330, 519 K – 273, 15 = 57, 4 °C

Exemple 3 Un gaz inconnu est composé de 80, 0% de carbone et de 20, 0% d’hydrogène. Si un échantillon de 4, 60 g de ce gaz occupe un volume de 2, 50 L à 25, 00 °C et à 152 k. Pa, quelle est la formule moléculaire de ce gaz? T = 25, 00 °C + 273, 15 = 298, 15 K P = 152 k. Pa V = 2, 50 L m = 4, 60 g R = 8, 314 k. Pa L/mol K Pourcentage de composition = 80, 0 % carbone et 20, 0% hydrogène

1. Pour un échantillon de 100 g… 80, 0% x 100 g = 80 g de carbone 20, 0% x 100 g = 20 g d’hydrogène Pour le carbone: n = 80 g / 12, 01 g/mol = 6, 661 mol Pour l’hydrogène: n = 20 g / 1, 01 g/mol = 19, 801 mol 2. Le rapport le plus simple… Carbone: 6, 661 mol / 6, 661 mol = 1 Hydrogène: 19, 801 mol / 6, 661 mol = 3 Donc, la formule empirique est CH 3

T = 25, 00 °C + 273, 15 = 298, 15 K P = 152 k. Pa V = 2, 50 L m = 4, 60 g R = 8, 314 k. Pa L/mol K Formule empirique = CH 3 3. Trouve la formule moléculaire Il faut trouver la masse molaire (M) de l’échantillon. Pour trouver la masse molaire de l’échantillon, il faut connaître la quantité en moles (n) de l’échantillon. • Nous avons la masse (m) de l’échantillon. PV = n. RT n = PV/RT n = (152 k. Pa) x (2, 50 L) (8, 314 k. Pa L/mol K) x (298, 15 K) = 0, 153299 mol • •

Formule empirique = CH 3 n = 0, 153299 mol m = 4, 60 g Donc, M = m/n = 4, 60 g / 0, 153299 mol = 30, 007 g/mol

Formule empirique = CH 3 M de l’échantillon = 30, 007 g/mol Compare la masse molaire du gaz inconnu à celle de la formule empirique… M de la formule empirique = 12, 01 g/mol + 3 x 1, 01 g/mol = 15, 04 g/mol Rapport des masses molaires = 30, 007 g/mol/ 15, 04 g/mol = 2 Donc, multiplie la formule empirique par 2… CH 3 x 2 = C 2 H 6

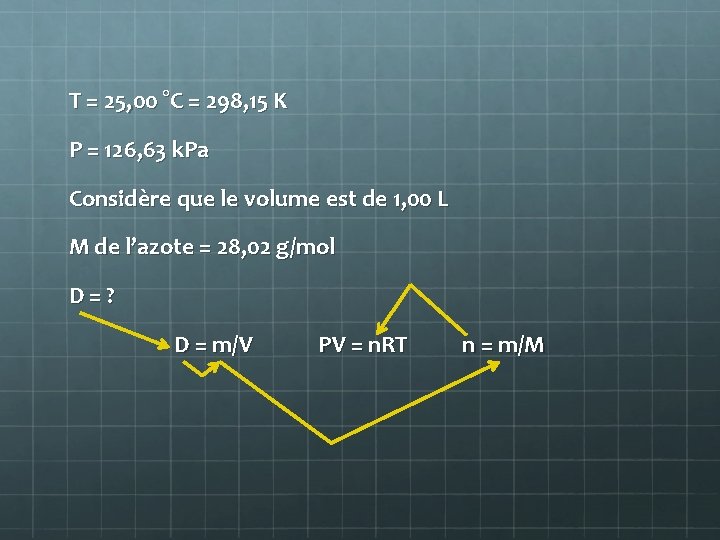
Exemple 4 Quelle est la masse volumique de l’azote gazeux en grammes par litre, à 25, 00 °C et à 126, 63 k. Pa? T = 25, 00 °C P = 126, 63 k. Pa M de l’azote = 2 x 14, 01 g/mol = 28, 02 g/mol D = ?

T = 25, 00 °C = 298, 15 K P = 126, 63 k. Pa Considère que le volume est de 1, 00 L M de l’azote = 28, 02 g/mol D = ? D = m/V PV = n. RT n = m/M

1. Avec l’équation PV = n. RT trouve la valeur de n: n = PV/RT = (126, 63 k. Pa) x (1, 00 L) (8, 314 k. Pa L/mol K) x (298, 15 K) = 5, 1085 x 10 -2 mol 2. Avec l’équation n = m/M trouve la valeur de m: m = n x M = 5, 1085 x 10 -2 mol x 28, 02 g/mol = 1, 4314 g

3. Avec l’équation D = m/V trouve la masse volumique: D = m/V = 1, 4314 g / 1, 00 L = 1, 431 g/L

Exemple 5 Un échantillon de 1, 58 g de gaz occupe un volume de 500, 0 m. L à TPN. Calcule la masse molaire de ce gaz. À TPN, donc… T = 273, 15 K P = 101, 325 k. Pa Nous savons aussi… V = 500, 0 m. L = 0, 5000 L m = 1, 58 g M = ?

T = 273, 15 K P = 101, 325 k. Pa V = 0, 5000 L m = 1, 58 g PV = n. RT n = m/M n = PV/RT = (101, 325 k. Pa) x (o, 500 L) (8, 314 k. Pa L/mol K) x (273, 15 K) = 0, 02231 mol M = m/n = 1, 58 g / 0, 02231 mol = 70, 8 g/mol

Pratique-toi Complète les exercices # 21, 22, 23, 24 , 25, 28 et 29 de la page 556 de ton manuel.

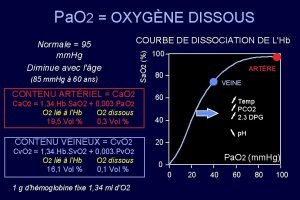
La loi des pressions partielles de Dalton La pression partielle indique qu’une partie de la pression totale d’un mélange de gaz est attribuable à un seul des composants de ce mélange. Ptotale = Pair sec + Pvapeur d’eau La loi des pressions partielles de Dalton indique la pression d’un mélange de gaz qui ne réagissent pas chimiquement ensemble est la somme des pressions individuelles de chaque gaz. Voir fig 12. 5 page 557 de ton manuel Voir tableau 12. 4 page 558 pour trouver les pressions partielles de la vapeur d’eau à différentes températures. Vérifie tes connaissances: complète #7, 8, 10, 11 et 12 de la page 557.

La stoechiométrie des gaz (page 559). ** N’oublie pas que les produits gazeux d’une réaction chimique sont souvent recueillis par déplacement d’eau en laboratoire (voir page 558). Lorsque tu utilises la loi de gaz parfaits pour un gaz recueilli de cette façon, tu dois te servir de la formule ci-dessus pour corriger la P avant de la remplacer dans ton équation. Pgaz sec = Ptotale – Pvapeur d’eau Si des volumes de réactifs et de produits gazeux ne sont mesurés dans les mêmes conditions de T et de P, tu dois te servir de la loi des gaz parfaits pour déterminer les quantités de ces réactifs ou produits qui participent à cette réaction.

Exemple (voir page 560 de ton manuel): Quel est le volume d’hydrogène gazeux produit lorsque suffisamment d’acide sulfurique pour qu’il soit en excès réagit avec 40, 0 g de fer à 18, 0 °C et à 100, 3 k. Pa? T = 18, 0 °C = 291, 15 K P = 100, 3 k. Pa m Fer = 40, 0 g M Fer = 55, 85 g/mol Fe(s) + H 2 SO 4(aq) H 2(g) + Fe. SO 4(aq) m = 40, 0 g M = 55, 85 g/mol n= m= M= n= Calcul le nombre de moles de fer: n=m/M n = 40, 0 g/55, 85 g/mol= 0, 716 20 mol Rapport molaire est 1 mol de H 2 : 1 mol de Fe. Donc le nombre de moles d’hydrogène est 0, 716 20 mol H 2 PV = n. RT =(100, 3 k. Pa)V =0, 716 20 mol (8, 415) (291, 15 K) V= (0, 716 20 mol (8, 415) (291, 15 K))/ 100, 3 k. PA =17, 3 L

Pratique-nous Complètons les exercices #31 et 39 de la page 560. Pratique-toi Complète les exercices #32, 33, 34, 37 et 40 de la page 560

Les formules pour les calculs relatifs aux gaz Formule Masse molaire M = m/n Masse volumique D = m/V Pression P = F/A Loi de Boyle-Mariotte P 1 V 1 = P 2 V 2 Loi de Charles V 1/T 1 = V 2/T 2 Loi de Gay-Lussac P 1/T 1 = P 2/T 2 Loi combinée des gaz P 1 V 1/T 1 = P 2 V 2/T 2 Loi d’Avogadro n 1/V 1 = n 2/V 2 Volume molaire v = V/n Loi des gaz parfaits PV = n. RT Loi des pressions partielles de Dalton Ptotale = Pair sec + Pvapeur d’eau

Devoir Complète les exercices #7, 8, 10, 11 et 12 de la page 557. Complète les exercices #32, 33, 34, 37 et 40 de la page 560
 Tirez pas sur le scarabée résumé par chapitre
Tirez pas sur le scarabée résumé par chapitre Le petit prince chapitre 1
Le petit prince chapitre 1 Résumé le petit prince chapitre par chapitre
Résumé le petit prince chapitre par chapitre Petit pays chapitre 1
Petit pays chapitre 1 Lois des exposants
Lois des exposants Lois des exposants
Lois des exposants Loi des rendements décroissants
Loi des rendements décroissants La constante des gaz parfait
La constante des gaz parfait Loi des gaz parfaits
Loi des gaz parfaits Loi générale des gaz
Loi générale des gaz Compressibilité des gaz niveau 2
Compressibilité des gaz niveau 2 équation des gaz alvéolaires
équation des gaz alvéolaires Stoechiométrie allo prof
Stoechiométrie allo prof Pression cinétique gaz parfait
Pression cinétique gaz parfait Lieux de fabrication des objets techniques
Lieux de fabrication des objets techniques Des des des
Des des des Kentucky real estate commission percentage
Kentucky real estate commission percentage Joanna liivak
Joanna liivak Lois dohm
Lois dohm The giver by lois lowry chapter 1
The giver by lois lowry chapter 1 Lois kim
Lois kim Lois mailou jones facts
Lois mailou jones facts Lois fried
Lois fried What does the sled symbolize in the giver
What does the sled symbolize in the giver Lois ramondetta
Lois ramondetta Leaf man by lois ehlert
Leaf man by lois ehlert Les 3 lois de newton
Les 3 lois de newton Symbols in the giver
Symbols in the giver Lois ehlert
Lois ehlert 5 mars 2007
5 mars 2007 Lois olson sdsu
Lois olson sdsu Lois lowry born
Lois lowry born Lois malle
Lois malle Lois dohm
Lois dohm 4 lois spirituelles
4 lois spirituelles Lois lowery
Lois lowery Te se ra
Te se ra Lois levitan
Lois levitan Loi de proust
Loi de proust Tableau ohm
Tableau ohm Lois s hornsby
Lois s hornsby John lowry artist
John lowry artist Lois duncan locked in time
Lois duncan locked in time