Ausgewhlte Experimente der Elektrochemie Sara Metten Gliederung 1



































- Slides: 46

Ausgewählte Experimente der Elektrochemie Sara Metten

Gliederung 1. Begriffsklärung 2. Grundlagen 3. Galvanische Zellen § § Primärelement Sekundärelement 4. Elektrolysezelle 5. Einsatz in Alltag und Technik 6. Lehrplan 7. Didaktische Aspekte

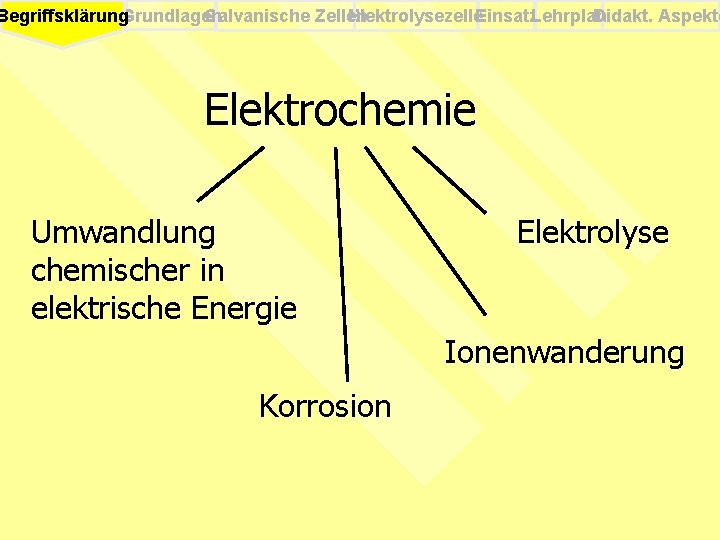
Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Begriffsklärung. Grundlagen Elektrochemie Umwandlung chemischer in elektrische Energie Elektrolyse Ionenwanderung Korrosion

Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Begriffsklärung Ø Teilgebiet der physikalischen Chemie Ø gegenseitige Umwandlung von chemischer in elektrischer Energie Ø Umfasst folgende Vorgänge: § Wanderung von Elektronen und Ionen § Ausbildung von elektrochemischen Potentialen

Demo 1 Spannungsreihe

Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Spannungsreihe Cu 2+ - (aq) +2 e Cu(s) - Fe(s) Fe 2+ Fe(s) + Cu 2+(aq) Fe 2+(aq) + Cu(s) 2 Ag+(aq) + 2 e - Ag(s) Cu 2+ Cu(s) + 2 Ag+(aq) +2 e (aq) - +2 e Cu 2+(aq) + 2 Ag(s)

Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Folgernde Spannungsreihe Ag/Ag+ Cu/Cu 2+ Starke Reduktionsmittel Fe/Fe 2+ Starke Oxidationsmittel

Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Elektrochemische Spannungsreihe Einordnung der Salze nach der Größe ihrer Potentialdifferenz, die sich an der Phasengrenze der Elemente ergibt Ø je unedler ein Metall um so: § negativer sein Potential § schneller oxidiert es § stärker wirkt es als Reduktionsmittel § stärker reagiert es mit Säuren und Wasser Ø

Demo 2 Ionenwanderung

Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Ionenwanderung Ø Permanganat Ionen wandern zur Anode Ø beim Anlegen eines Stroms bewegen sich Ionen im elektrischen Feld Ø wandern Ø in gemäß ihrer formalen Ladung flüssigen Lösungen nicht Elektronen sondern Ionen Ladungsträger

Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Elektrochemische Zellen Ø bestehen aus zwei Leitern (Elektroden) Ø diese müssen mit einem elektrisch leitenden Medium (Elektrolyten) in Kontakt stehen Ø Zwei unterschiedliche Typen: § Galvanische Zelle § Elektrolysezelle

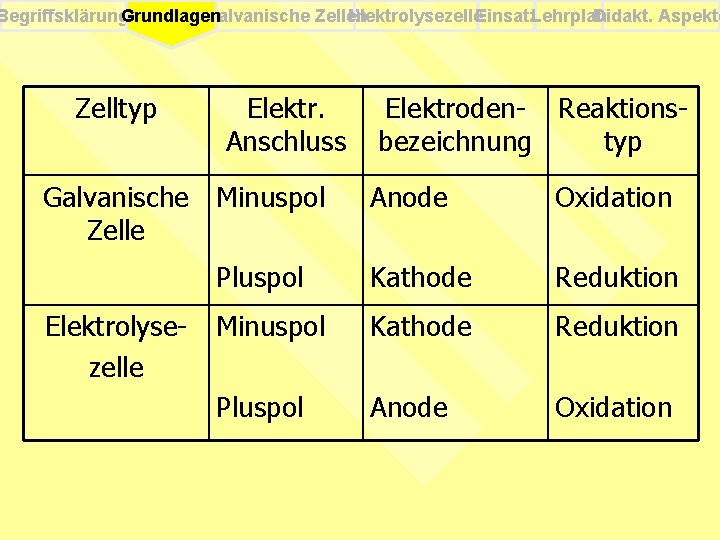
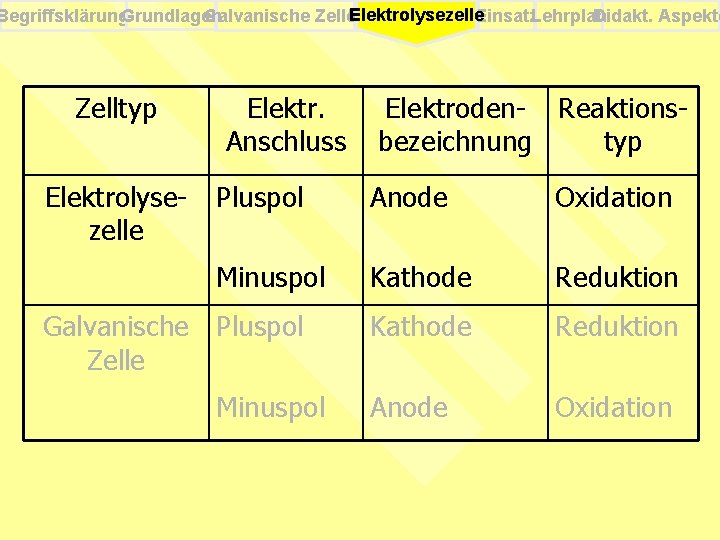
Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Zelltyp Elektr. Anschluss Galvanische Minuspol Zelle Elektrolysezelle Elektroden- Reaktionsbezeichnung typ Anode Oxidation Pluspol Kathode Reduktion Minuspol Kathode Reduktion Pluspol Anode Oxidation

Begriffsklärung. Grundlagen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Galvanische Zellen Galvanische Zelle Ø benannt nach Luigi Galvani Ø spontane chemische Reaktion wird zur Erzeugung des Stromes ausgenutzt Ø besteht im einfachsten Fall aus zwei verschiedenen Metallen § die elektrolytisch und metallisch leitend verbunden sind

Versuch 1 Daniell-Element

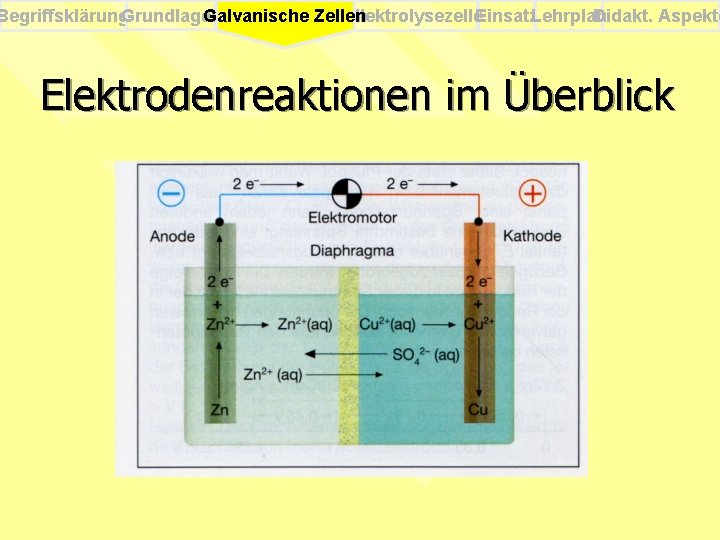
Begriffsklärung. Grundlagen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Galvanische Zellen Elektrodenreaktionen Anode: 0 Zn(aq) + 2 e 2+ Zn(s) 0 2+ Kathode: Cu(aq) + 2 e - Cu(s) Gesamtreaktion: 0 2+ Zn(s) + Cu(aq) 2+ 0 Zn(aq) + Cu(s)

Begriffsklärung. Grundlagen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Galvanische Zellen Elektrodenreaktionen im Überblick

Begriffsklärung. Grundlagen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Galvanische Zellen Elektromotorische Kraft (EMK) Ø Potential einer galvanischen Zelle Ø je größer die Tendenz zum Ablaufen der chemischen Reaktion, desto größer die EMK Ø ist abhängig von: § beteiligten Substanzen § Konzentrationen der Lösungen § Temperatur

Begriffsklärung. Grundlagen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Galvanische Zellen Berechnung der EMK Zn(s)/Zn 2+(aq) || Cu 2+(aq)/Cu(s) Nernst Gleichung

Begriffsklärung. Grundlagen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Galvanische Zellen Berechnung der EMK

Begriffsklärung. Grundlagen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Galvanische Zellen Kommerziell genutzte Zellen Ø Primärelement § nach Gebrauch nicht wieder aufladbar Ø Sekundärelement § wiederaufladbar

Versuch 2 Leclanché Element

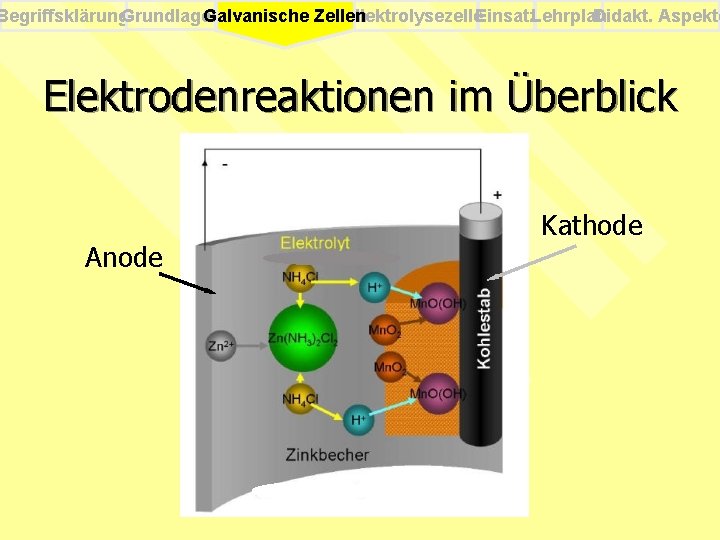
Begriffsklärung. Grundlagen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Galvanische Zellen Elektrodenreaktionen Kathode: +4 +3 + 2 Mn. O 2 (s) + 2 H(aq) + 2 e - 2 Mn. O(OH)(s) Anode: +2 0 Zn(s) + 2 NH 4 Cl(aq) Gesamtreaktion: 0 [Zn(NH 3)2 Cl 2](aq)+ 2 H +4 Zn(s) + 2 NH 4 Cl(aq) + 2 Mn. O 2(s) +2 + (aq) +2 e - +3 [Zn(NH 3)2 Cl 2](aq) + Mn. O(OH)(s)

Begriffsklärung. Grundlagen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Galvanische Zellen Elektrodenreaktionen im Überblick Anode Kathode

Begriffsklärung. Grundlagen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Galvanische Zellen Alkali-Mangan-Batterie Ø ähnlich wie das Leclanché Element Ø enthalten Na. OH oder KOH anstatt NH 4 Cl Ø längere Lebensdauer Ø höhere Spannung Ø teurer

Begriffsklärung. Grundlagen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Galvanische Zellen Sekundärelement Ø wiederaufladbar Ø Entladen: Galvanische Zelle Ø Laden: Elektrolysezelle Ø sorgfältig Ø Produkte ausgewählte Elektroden der Entladereaktion müssen schwer löslich sein

Versuch 3 Bleiakkumulator

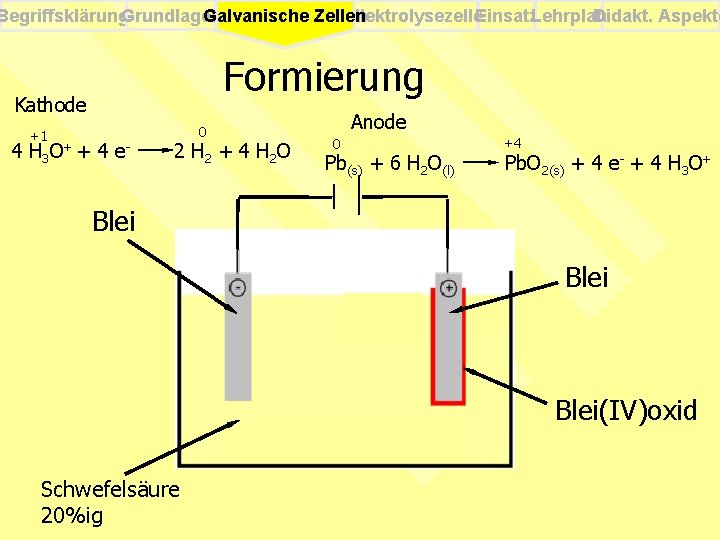
Begriffsklärung. Grundlagen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Galvanische Zellen Formierung Kathode +1 4 H 3 O+ + 4 e - 0 2 H 2 + 4 H 2 O Anode 0 Pb(s) + 6 H 2 O(l) +4 Pb. O 2(s) + 4 e- + 4 H 3 O+ Blei(IV)oxid Schwefelsäure 20%ig

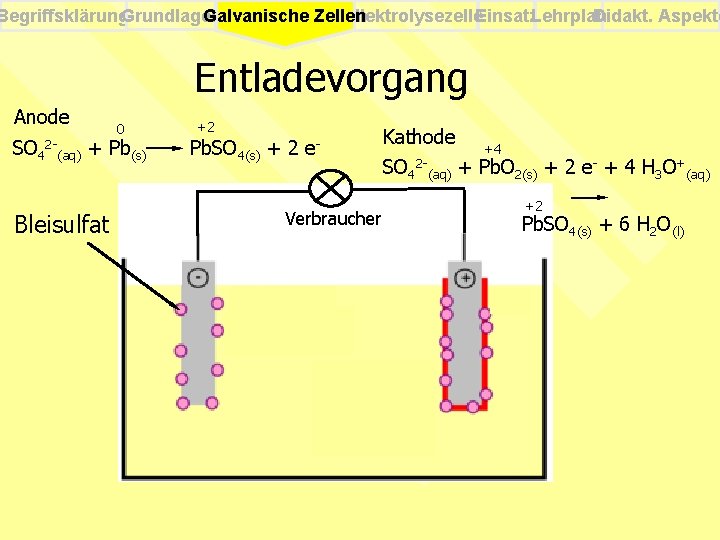
Begriffsklärung. Grundlagen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Galvanische Zellen Entladevorgang Anode 0 SO 42 -(aq) + Pb(s) Bleisulfat +2 Pb. SO 4(s) + 2 e. Verbraucher Kathode +4 SO 42 -(aq) + Pb. O 2(s) + 2 e- + 4 H 3 O+(aq) +2 Pb. SO 4(s) + 6 H 2 O(l)

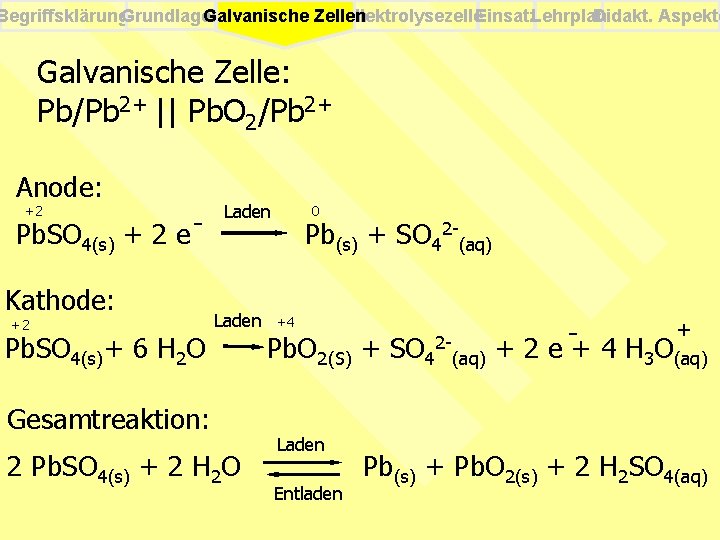
Begriffsklärung. Grundlagen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Galvanische Zellen Galvanische Zelle: Pb/Pb 2+ || Pb. O 2/Pb 2+ Anode: +2 Pb. SO 4(s) + 2 e Kathode: +2 Pb. SO 4(s)+ 6 H 2 O Laden Gesamtreaktion: 2 Pb. SO 4(s) + 2 H 2 O 0 Pb(s) + SO 42 -(aq) +4 Pb. O 2(S) + SO 42 -(aq) Laden Entladen + + 2 e + 4 H 3 O(aq) Pb(s) + Pb. O 2(s) + 2 H 2 SO 4(aq)

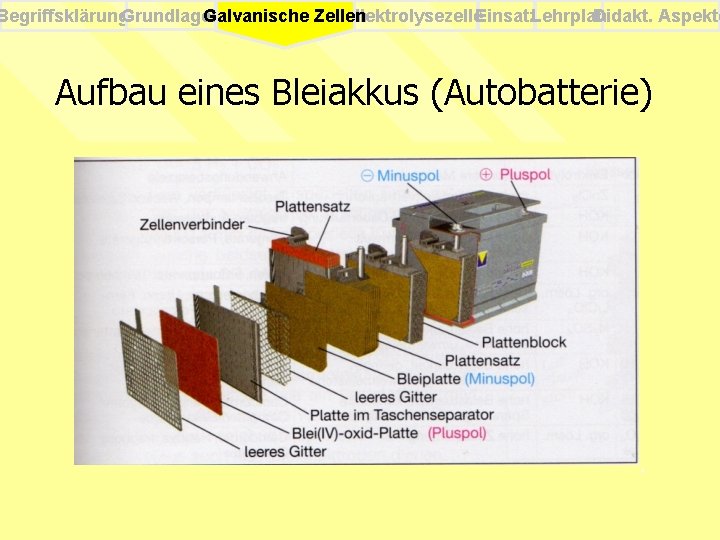
Begriffsklärung. Grundlagen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Galvanische Zellen Aufbau eines Bleiakkus (Autobatterie)

Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Elektrolyse Ø Redoxreaktionen, die nicht spontan ablaufen Ø Unterschiede zur galvanischen Zelle: § 2 Elektroden im selben Elektrodenraum § nur einen Elektrolyten

Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Prinzip der Elektrolyse Ø mit elektrischem Strom eine Reaktion entgegen ihrer spontanen Richtung zu erzwingen Ø größere Spannung anlegen, als Reaktion bei ihrer spontanen Richtung liefert Ø Entscheidend § für die Produkte: angelegte Spannung

Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Zelltyp Elektrolysezelle Elektr. Anschluss Elektroden- Reaktionsbezeichnung typ Pluspol Anode Oxidation Minuspol Kathode Reduktion Anode Oxidation Galvanische Pluspol Zelle Minuspol

Versuch 4 Elektrolyse von Wasser

Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Elektrodenreaktionen Anode: 4 OH(aq) O 2(g) + 2 H 2 O(l) + 4 e Kathode: 4 H 3 O(aq) + 4 e + Gesamtreaktion: 2 H 2 O(l) 2 H 2(g) + O 2(g) - 2 H 2(g) + 4 H 2 O(l)

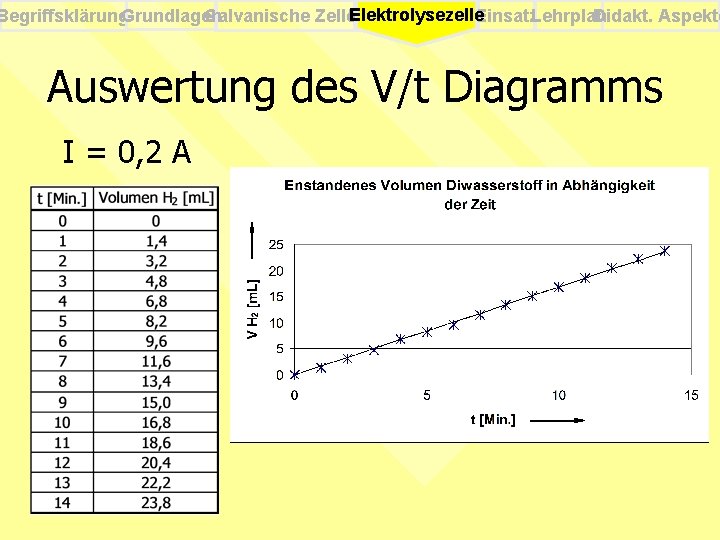
Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Auswertung des V/t Diagramms I = 0, 2 A

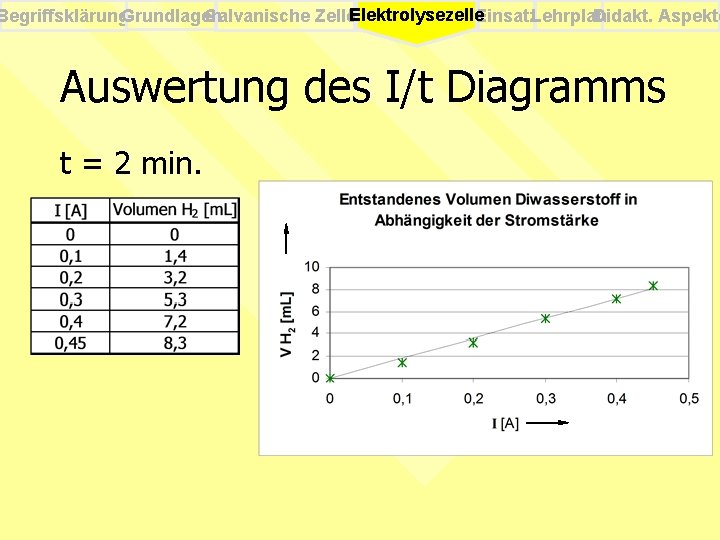
Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Auswertung des I/t Diagramms t = 2 min.

Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Ergebnis der quantitativen Elektrolyse Ø Anhand der Versuche ist folgendes gezeigt worden: § V ~ t (I = konst. ) § V ~ I (t = konst. ) Ø Volumina der abgeschiedenen Gase sind dem Produkt aus Stromstärke und Zeit proportional § V ~ I · t bzw. V ~ Q

Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Herleitung des 1. Faraday-Gesetzes Ø mit dem molaren Volumen Vm = V/n erhält man n § n ~ I · t bzw. n ~ Q Øz ist Anzahl der Elektronen, die für die Abscheidung eines Teilchens übertragen werden § Q=I·t=N·e·z

Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Herleitung des 1. Faraday-Gesetzes Ø mit N = n · NA § Q = N · e · z = n · NA · e · z = n · F · z § F = NA · e = 96485 C · mol-1 Ø um 1 Mol einfach geladener Ionen an einer Elektrode zu entladen braucht man: § Q = 1 mol · F = 96485 C 1. Faraday-Gesetz

Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Herleitung des 2. Faraday-Gesetzes Ø Das Verhältnis der Stoffmengen n 1/n 2 von Portionen verschiedener Elektrolyseprodukte, die durch die gleiche elektrische Ladung abgeschieden werden folgt aus: Q = n 1· z 1 · F = n 2 · z 2 · F 2. Faraday-Gesetz

Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte 2. Faraday-Gesetz Anode: 4 OH(aq) Kathode: 4 H 3 O(aq) + 4 e + O 2(g) + 2 H 2 O(l) + 4 e 2 H 2(g) + 4 H 2 O(l) n 1= 2 mol H 2 n 2= 1 mol O 2 z 1= 2 Elektronen z 2= 4 Elektronen 2. Faraday-Gesetz -

Einsatz Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle Einsatz. Lehrplan Didakt. Aspekte Einsatzgebiete Ø Industrie Ø Haushalt Ø Handys

Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Lehrplan (G 8) Ø 10. 1 Redoxreaktionen § Elektrochemische Spannungsquellen § Elektrolyse Ø 12. 2 § LK Elektrochemie (Wahlpflicht) Nernst Gleichung

Begriffsklärung. Grundlagen Galvanische Zellen Elektrolysezelle. Einsatz. Lehrplan Didakt. Aspekte Didaktische Aspekte Ø Fächerübergreifender § Physik § Politik/Wirtschaft Ø einfach Ø hoher Unterricht durchführbare Experimente Alltagsbezug

Vielen Dank für Ihre Aufmerksamkeit !
 Grundlagen der elektrochemie
Grundlagen der elektrochemie Elektrochemische doppelschicht daniell-element
Elektrochemische doppelschicht daniell-element Elektrochemie
Elektrochemie Elektrochemie graad 12
Elektrochemie graad 12 Gliederung der bergpredigt
Gliederung der bergpredigt Split brain patienten experimente
Split brain patienten experimente Experimente de laborator fizica
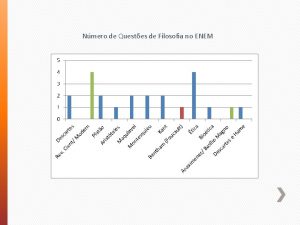
Experimente de laborator fizica Enem 1999 depois de longas investigações
Enem 1999 depois de longas investigações Kindergarten workshop experimente mit feuer
Kindergarten workshop experimente mit feuer Sara vanderwerf 100 numbers
Sara vanderwerf 100 numbers Sara van der paelt
Sara van der paelt Projektstrukturplan gliederung
Projektstrukturplan gliederung Gliederung in niveaus
Gliederung in niveaus Abschreibung rechnungswesen
Abschreibung rechnungswesen Unversteuerte rücklagen definition
Unversteuerte rücklagen definition Gutachterliche stellungnahme aufbau
Gutachterliche stellungnahme aufbau Vertikale gliederung fachsprache
Vertikale gliederung fachsprache Klimawandel gliederung
Klimawandel gliederung Standardschätzfehler regression
Standardschätzfehler regression Gliederung qualitative forschung
Gliederung qualitative forschung Gliederung einer biographie
Gliederung einer biographie Erkenntnisinteresse
Erkenntnisinteresse Inhaltsangabe aufbau
Inhaltsangabe aufbau Textinterpretation gliederung
Textinterpretation gliederung Michel de certeau praktiken im raum
Michel de certeau praktiken im raum Projektplan softwareeinführung
Projektplan softwareeinführung Was bedeutet gliederung
Was bedeutet gliederung Divisionale gliederung
Divisionale gliederung Gliederung facharbeit
Gliederung facharbeit Friedrich nietzsche biographie
Friedrich nietzsche biographie Georg simmel biographie
Georg simmel biographie Gliederung des wortschatzes
Gliederung des wortschatzes Mitarbeiterbindung gliederung
Mitarbeiterbindung gliederung W-seminar bayern gliederung
W-seminar bayern gliederung Horizontale gliederung fachsprache
Horizontale gliederung fachsprache Motivationsschreiben gliederung
Motivationsschreiben gliederung Gliederung gif
Gliederung gif Gliederung definition
Gliederung definition Gliederung foto
Gliederung foto Gliederung mathematik
Gliederung mathematik Das ist der daumen der pflückt die pflaumen
Das ist der daumen der pflückt die pflaumen Steuerung der atmung
Steuerung der atmung An der schwelle der ewigkeit
An der schwelle der ewigkeit Weltuntergangstheorie
Weltuntergangstheorie Skorpion und der frosch
Skorpion und der frosch Wer ist der gründer der modernen türkei
Wer ist der gründer der modernen türkei Der gott der stadt heym
Der gott der stadt heym