Agua estructura y propiedades El agua es el


















![Por definición p. H = - lg [ H+ ]. La escala de los Por definición p. H = - lg [ H+ ]. La escala de los](https://slidetodoc.com/presentation_image_h/dc3e2d99943862f777b5ba27f161407d/image-25.jpg)

















- Slides: 45

Agua, estructura y propiedades El agua es el componente más abundante en los seres vivos. En el cuerpo humano ocupa un porcentaje aproximado de 60%. Se puede considerar distribuido en dos tipos de líquidos celulares: Líquido intracelular y Líquido extracelular 1 -Líquido Intracelular: contiene la mayor parte del agua corporal. 2 -Líquido extracelular: contiene el resto del agua circundante, a su vez podemos subdividirlo en varios compartimientos: a-Líquido Intersticial: en un 25 % ocupa el espacio entre las células. b-Líquido plasmático: en un porcentaje del 7 -8%, se encuentra en los vasos sanguíneos y linfáticos. c-Otros líquidos extracelulares: líquido cefalorraquídeo, líquido pleural, líquido intraocular, cabe aclarar que este último presenta una composición bastante diferente de los otros líquidos extracelulares. -----------

Es importante considerar que una característica de las células vivas es que son capaces de mantener constantes las propiedades y la composición química de estos líquidos celulares. El agua que circula en el organismo proviene de una ingesta externa por medio de la dieta y en menor proporción, es sintetizada en las reacciones metabólicas que ocurren entre las células. Por otro lado es expulsada al exterior a través de la orina, las lágrimas y el sudor.


Funciones de agua en el organismo La importancia del agua en el organismo es debida a la diversidad de funciones que cumple, ya que no es un compuesto inerte, sino que interviene en numerosos procesos fisiológicos. Entre estas funciones se destacan: 1 -Es el disolvente universal de todas las sustancias, tanto orgánicas como inorgánicas que circulan en el cuerpo, esto es importante ya que para que se produzcan las reacciones metabólicas en el organismo las sustancias reaccionantes deben estar disueltas. De igual forma, el agua es fácilmente ionizable e interviene en mayor o menor medida manteniendo ciertos límites de alcalinidad ó acidez, y permite de esa manera que algunas reacciones enzimáticas por ejemplo, puedan llevarse a cabo.


2 -Es el vehículo necesario para la circulación de los nutrientes en el organismo. Por medio de la digestión los alimentos se disuelven en el agua corporal y de esta forma se facilita el intercambio de materiales a través de las membranas celulares. 3 -Además debido a sus propiedades físico-químicas es un líquido de acuerdo a la estructura de sus moléculas. Estructura química del agua Químicamente el agua está formada por un átomo de oxígeno y dos átomos de hidrógeno que se unen por medio de dos enlaces covalentes al oxígeno, su fórmula es H 2 O y su peso molecular 18 gr/mol. El agua se comporta como un dipolo eléctrico por la estructura que toman los tres átomos que existen en su molécula.

En general en un enlace covalente los dos electrones que forman dicho enlace se comparten. En el caso del agua al ser el átomo de oxígeno mucho más electronegativo que los iones hidrógeno, atrae hacia él gran parte de la nube electrónica de los enlaces covalentes, cargándose el oxígeno de una densidad de “carga negativa” y dejando en los átomos de hidrógeno una cierta densidad de “carga positiva”. Siendo en conjunto una molécula eléctricamente neutra, y por esta causa la molécula adopta forma de V, en la que el átomo de oxígeno ocupa el vértice y los átomos de hidrógeno los dos extremos. Además entre las moléculas de agua existen uniones débiles llamadas puente hidrógeno responsables de las fuerzas de cohesión entre moléculas y debido a eso el agua se comporta como un líquido.

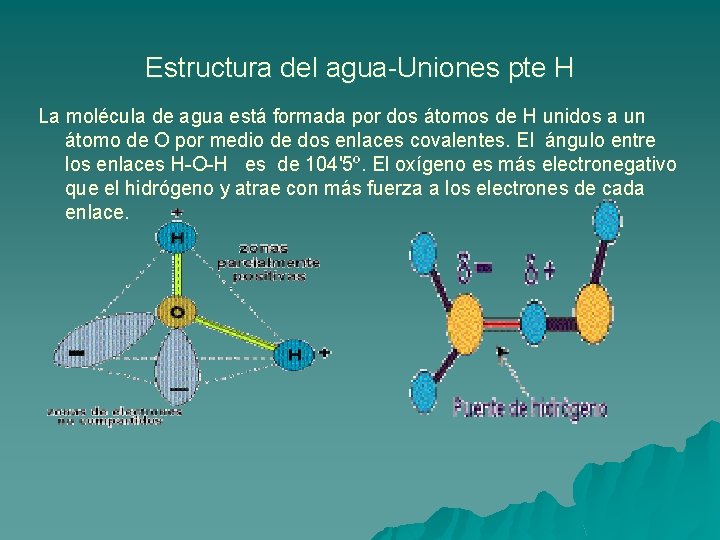
Estructura del agua-Uniones pte H La molécula de agua está formada por dos átomos de H unidos a un átomo de O por medio de dos enlaces covalentes. El ángulo entre los enlaces H-O-H es de 104'5º. El oxígeno es más electronegativo que el hidrógeno y atrae con más fuerza a los electrones de cada enlace.

Por ello se dan interacciones dipolo-dipolo entre las propias moléculas de agua formándose enlaces por puentes de hidrógeno, la carga parcial negativa del oxígeno de una molécula ejerce atracción electrostática sobre las cargas parciales positivas de los átomos de hidrógeno de otras moléculas adyacentes. Aunque son uniones débiles, el hecho de que alrededor de cada molécula de agua se dispongan otras cuatro molécula unidas por puentes de hidrógeno permite que se forme en el agua (líquida o sólida) una estructura de tipo reticular, responsable en gran parte de su comportamiento anómalo y de la peculiaridad de sus propiedades fisicoquímicas.

Propiedades físicas del agua. 1 -Transparencia. Como sabemos el agua es un líquido incoloro transparente a la luz, esto es de gran importancia, ya que gracias a esta característica la luz solar puede atravesar el agua en mares y ríos y permitir que exista la vida acúatica en las profundidades, y permitir el desarrollo de organismos que son los primeros eslabones en las cadenas tróficas, además del crecimiento de algas y líquenes. También permite que los cloroplastos de las células vegetales puedan realizar la función fotosintética que transforma materia inorgánica en orgánica, muy importante para el mantenimiento de los seres vivos.

2 -Densidad. Casi todas las sustancias presentan mayor densidad al estado sólido, este no es el caso del agua, en estado líquido el agua posee mayor densidad que el hielo, y por eso es que el mismo flota en el agua, y permite vida para las especies acuáticas animales y vegetales que viven en las zonas muy frías como la Antártida.

3 -Constantes Térmicas. En todos líquidos existen magnitudes líquidas de un valor constante. En el caso del agua, esos valores son más elevados en comparación con otros líquidos de estructura química similar. Esa diferencia responde a las uniones puente hidrógeno entre las moléculas de agua. De tal manera que el agua posee un punto de ebullición, punto de fusión, calor específico y calor de vaporización elevados. Desde el punto de vista fisiológico esto es muy importante ya que el agua cumple un efecto termorregulador, es decir conduce el calor rápidamente desde una zona a otra del organismo para igualar su temperatura y además actúa como amortiguador térmico protegiendo al organismo de temperaturas extremas.

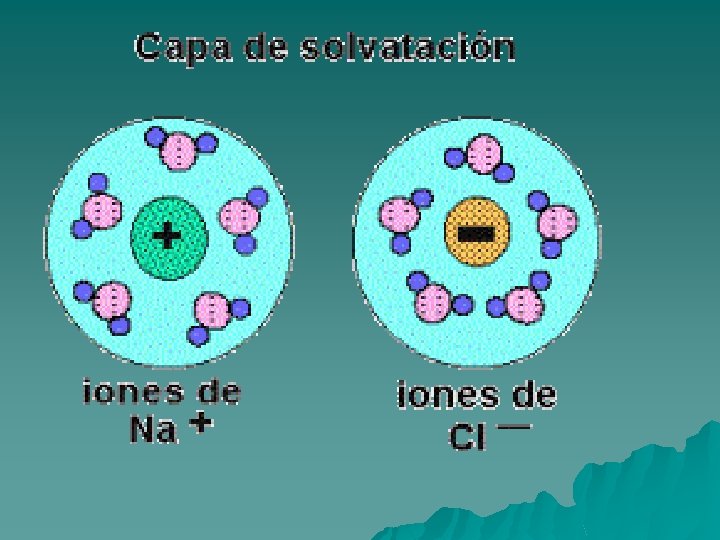
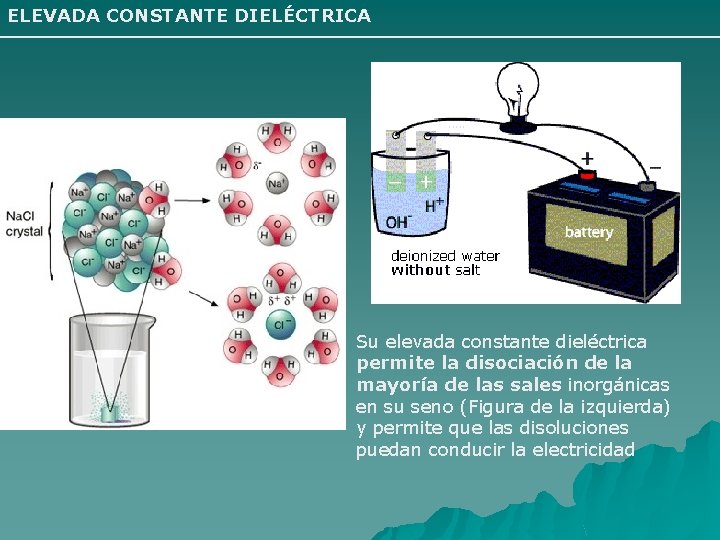
4 -Constante dieléctrica Es un parámetro que en el agua es elevado y esto hace que los electrolitos como Cl. Na se disuelvan fácilmente en ella y permanezcan disueltos. Difusión Podemos definir este proceso como el movimiento de partículas de un soluto en una solución para distribuirse homogéneamente en toda la solución. Si observamos un recipiente lleno de agua pura, en el que introducimos un poco de tinta, al poco tiempo todo el soluto se comienza a distribuir uniformemente en el solvente, agua, esto es debido a que las partículas de la solución se mueven continuamente al azar. Este movimiento se produce desde donde hay mayor concentración de soluto, tinta, hacia donde hay menos, entonces es un movimiento a favor de gradiente de concentración.

ELEVADA CONSTANTE DIELÉCTRICA Su elevada constante dieléctrica permite la disociación de la mayoría de las sales inorgánicas en su seno (Figura de la izquierda) y permite que las disoluciones puedan conducir la electricidad

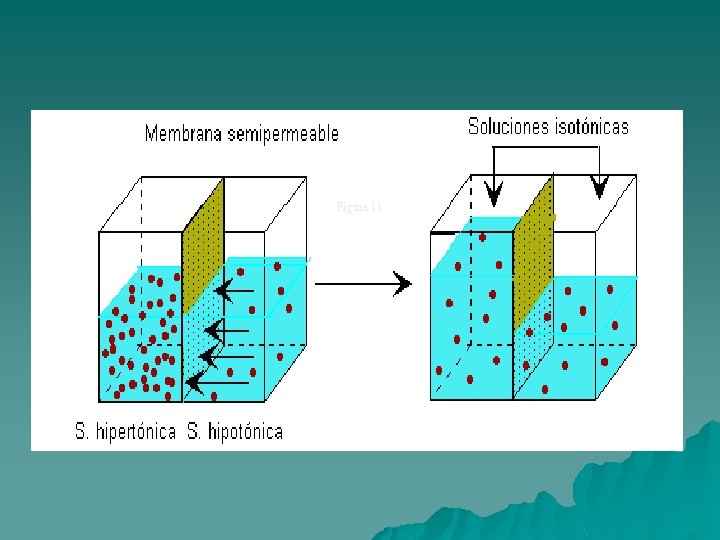
Osmosis Si tenemos un recipiente dividido en dos compartimientos por medio de una membrana semipermeable: Podemos decir que ósmosis es el pasaje del solvente desde el lado en donde la solución está más diluida hacia donde la solución está más concentrada, ya que las moléculas de soluto no pueden atravesar la membrana semipermeable, conservando la tendencia a igualar las concentraciones de ambos lados de la membrana. Membrana semipermeable: es una película porosa que sólo permite el paso de moléculas de solvente pero no de soluto, ej. pergamino, vejiga de animales.

Figura 11

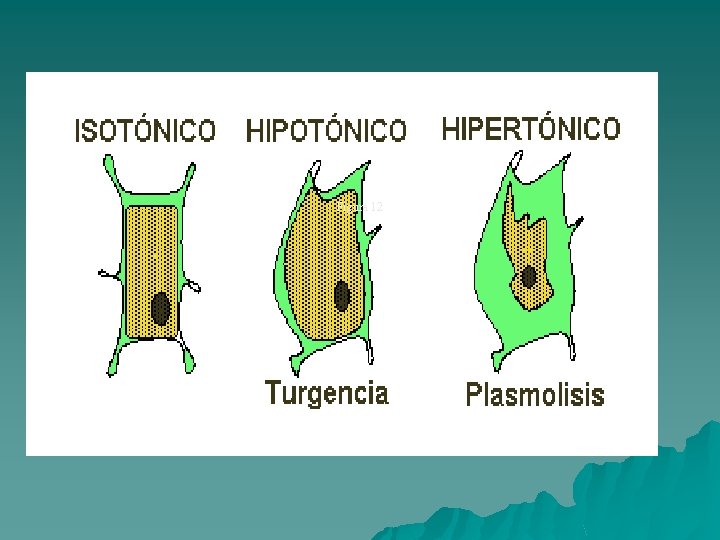
Presión osmótica. Es la presión que debe ejercerse sobre una solución para mantenerla en equilibrio con el disolvente puro y evitar que éste pase hacia la solución cuando ambos están separados por una membrana semipermeable. Esto tiene gran importancia en los seres vivos ya que debe mantenerse constante un equilibrio entre medio interno y el exterior. Si tenemos una solución con una presión osmótica determinada en comparación a ella habrá: Soluciones isotónicas: son las que tienen la misma Presión Osmótica que la solución dada porque la concentración de solutos puros no difusibles es igual en ambas. Soluciones hipotónicas : tienen menor presión osmótica porque su concentración de solutos no difusibles es menor que en la solución dada. Soluciones hipertónicas: tienen mayor presión osmótica porque su concentración de solutos no difusibles es mayor que en la solución dada.

Ej: Hematíe o glóbulo rojo en distintas soluciones: 1 -Medio hipotónico: agua destilada, entra agua hasta que se hincha y se rompe, esto se llama hemólisis. GR H 2 O destilada 2 -Medio Isotónico: plasma sanguíneo que conserva sus características normales. 3 -Medio Hipertónico: agua salada, sale agua de la célula de modo que se arruga, a esto se lo denomina plasmólisis.

Figura 12

Acidos y Bases. PH Acidos: se puede definir un ácido a las sustancias que al ionizarse liberan iones H+ al medio, que en sí no quedan libres, sino que son captados por otras sustancias. Se los puede clasificar en ácidos fuertes, que son aquellos que en un medio acuoso se disocian totalmente. Ej. Ácido clorhídrico, ácido nítrico, ácido sulfúrico. También existen los ácidos débiles cuya disociación se realiza en forma parcial, ej: ácido acético, ácido benzoico, al disociarse estos últimos en forma parcial podemos plantear un equilibrio entre la parte disociada y la sin disociar ej:

Nota Importante: como los ácidos fuertes se disocian totalmente, se dice que su constante de equilibrio tiende a infinito, es decir a un valor sumamente grande, y por eso NO SE PLANTEA NUNCA UNA CONSTANTE DE EQUILIBRIO DE UN ACIDO FUERTE. Bases: son sustancias capaces de captar los protones liberados por los ácidos ó liberar grupos oxidrilos, al igual que en los ácidos hablaremos de bases fuertes y bases débiles, ej de base fuerte Na. OH, KOH y de base débil NH 3. En el medio de reacción, que en la mayoría de los casos es acuoso, donde se producen estas reacciones, cuando un ácido de la molécula donante queda cargada negativamente se llama anión, en cambio cuando una base capta un protón H+ o cede un oxidrilo HO- esa molécula queda cargada positivamente y se llama catión En fórmula esto se puede expresa así:

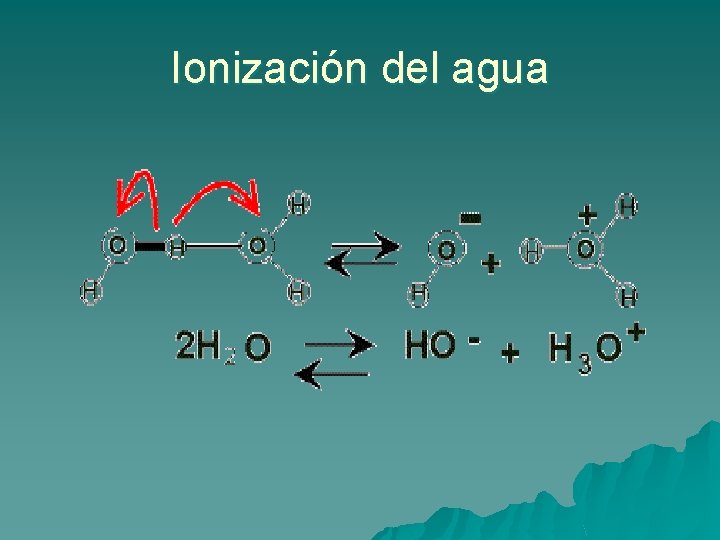
Sales: Son electrolitos que al disociarse no producen ni H+ ni HO- sino cationes y aniones Disociación del agua. Producto iónico El agua como tal no siempre se encuentra así, sino que es una mezcla de moléculas sin disociar: H 2 O, iones hidronio H 3 O+ e iones oxidrilo HO-. Las moléculas de agua se dice que son anfóteras, es decir que se pueden comportar como ácidos y bases liberando o captando protones en el medio. Una reacción entre dos moléculas de agua ocurre de la siguiente manera: O O

Ionización del agua

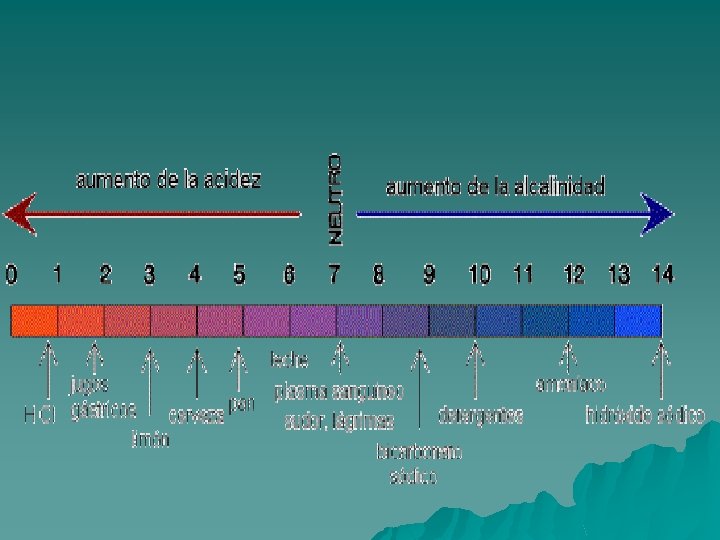
Esta reacción está muy desplazada hacia la izquierda, eso significa que existen muchas más moléculas sin disociar que ionizadas, entonces al ser el denominador tan grande y constante se puede incluir en la constante de equilibrio Keq, y se denomina producto iónico del agua, cuyo valor es de 1 x 10 -14 O En el agua pura la concentración de oxidrilos [HO- ] es igual a la [H+ ]= 1 x 10 -7, entonces podemos decir que el agua es químicamente neutra. Concepto de p. H Como vimos anteriormente los valores que determinan la acidez ó alcalinidad de una solución son muy bajos numéricamente hablando y es difícil trabajar con ellos, entonces fue conveniente tener una escala arbitraria de valores que nos indiquen la naturaleza de una solución. Así surgió el concepto de p. H, una escala para medir la concentración de protones [ H+] en una solución dada.
![Por definición p H lg H La escala de los Por definición p. H = - lg [ H+ ]. La escala de los](https://slidetodoc.com/presentation_image_h/dc3e2d99943862f777b5ba27f161407d/image-25.jpg)
Por definición p. H = - lg [ H+ ]. La escala de los valores varía de 0 a 14, entonces dependiendo del valor de p. H tendremos: p. H =7 la solución es neutra ya que [ H+ ] = [ HO- ]= 1 x 10 -7 p. H < 7 solución ácida porque la [ H+ ] es mayor que en una solución neutra ej: 10 -5 entonces el p. H es 5. p. H >7 solución básica ó alcalina, la [ H+ ] es menor que en una solución neutra ej: 10 -8 entonces el p. H es 8.


Soluciones reguladoras de p. H. Sistemas buffers El mantenimiento del p. H de los líquidos corporales es fundamental para que puedan realizarse en el organismo todas las reacciones metabólicas correctamente. En el organismo existen principalmente tres barreras defensivas: 1 -Las soluciones Buffers 2 -Los pulmones 3 -Los riñones En este capítulo solo nos interesan las soluciones buffers puesto que son las que se oponen a los cambios bruscos del valor de p. H de un organismo y permiten que este tenga un valor constante dentro de ciertos límites.

Por ejemplo si comparamos la variación del p. H de agua y de la sangre cuando a ambas se les agrega la misma cantidad de ácido, se observa una variación de p. H brusca en el agua, mientras que no ocurre lo mismo con la sangre. Estas soluciones amortiguadoras ó buffers están constituidas por una mezcla de dos sustancias: 1 -Un ácido débil y la sal de dicho ácido con una base fuerte, ej ácido acético CH 3 COOH , también lo simbolizamos Ac. H y acetato de sodio CH 3 COO- ó Ac- El acetato de sodio se obtiene de hacer reaccionar: 2 -Una base débil y su sal con un ácido fuerte, por ejemplo amoníaco NH 3 y cloruro de amonio Cl NH 4+ que se obtiene de hacer reaccionar amoníaco con ácido clorhídrico

En el organismo existen varias soluciones amortiguadoras cuya función es regular el equilibrio ácido-base, es decir mantener el p. H dentro de los límites fisiológicos, los más importantes son: 1 -Sistema ácido carbónico-bicarbonato. Este es el principal sistema buffer del plasma sanguíneo. Está constituido por una mezcla de ácido carbónico (H 2 CO 3) que actúa como dador de H+ y el ión bicarbonato (HCO 3 -) que actúa como aceptor de protones. Lo importante de este sistema de regulación es que actúa en forma conjunta con la respiración, ya que el ácido carbónico se forma a expensas de dióxido de carbono (CO 2) y H 2 O. Este sistema es muy eficaz para mantener el p. H plasmático aproximadamente en 7, 4 que es el p. H óptimo de la sangre. 2 -Sistema fosfato monobásico-fosfato dibásico, este es el segundo sistema amortiguador en importancia y actúa en el interior de las células, donde la concentración de fosfato es abundante. El fosfato monobásico actúa como dador de protones y el dibásico como aceptor de protones. El p. H que regula es de aprox. 7, 4 similar al del plasma sanguíneo.

3 -Sistema de proteínas plasmáticas. Las proteínas poseen carácter anfótero, lo que les permite actuar como ácidos en los sistemas básicos y bases en los sistemas ácidos y de esa forma pueden regular el p. H como en los sistemas anteriores. 4 -Sistema Hemoglobina: es un sistema amortiguador que a corto plazo es más potente que el sistema bicarbonato, su capacidad amortiguadora está basada en la diversidad de grupos ácidos y básicos existentes en los aminoácidos de sus moléculas. Efectos de las alteraciones del equilibrio ácido-base El p. H normal del plasma es de 7, 4, un p. H más bajo esta indicando una anomalía que se denomina acidosis. Si el p. H es más alto se denomina alcalosis.

El primer tipo es de origen respiratorio, cuando existe una disminución en la ventilación pulmonar, se produce una mayor producción de CO 2 lo que lleva a una mayor producción de ácido carbónico, al revés, si los pulmones realizan una hiperventilación eliminan demasiado CO 2 y se produce una alcalosis respiratoria. La acidosis metabólica se da cuando disminuye la concentración de bicarbonato en el plasma sanguíneo, ej en individuos con diarreas y vómitos hay una disminución en la excreción de protones a nivel de los túbulos renales. Por el contrario se da una alcalosis metabólica cuando se retienen grandes cantidades de bicarbonato plasmático ya sea por una alteración orgánica o por una ingesta excesiva de bicarbonato.

SOLUCIONES Al estudio de las soluciones se le asigna gran importancia, teniendo en cuenta que la mayoría de las reacciones químicas ocurren entre soluciones, particularmente en medios acuosos. Muchas sustancias no reaccionan entre sí en estado sólido, pero sí lo hacen cuando previamente se las disuelve en un solvente adecuado. Las reacciones que se producen en las células de los organismo animales y vegetales son también reacciones entre soluciones. SOLUCIONES - DEFINICIÓN Y CLASIFICACIÓN "Una solución es un sistema homogéneo formado por dos o más componentes cuya composición puede variar entre ciertos límites en forma continua".

Sus características principales son: • Las propiedades intensivas son constantes en cualquier punto del sistema. • Están formadas por una sola fase. • Son fraccionables. Los componentes de una solución son: soluto o solutos y solvente o disolvente. En general, se llama disolvente a la sustancia que está presente en mayor proporción en una solución y se considera como soluto/s a todas las otras sustancias que integran la misma.

El agua es considerada el disolvente universal, por lo tanto, aunque se encuentre en pequeña proporción, siempre será disolvente. Por ejemplo, una mezcla de 96 % de S 04 H 2 y 4 % de H 20, (ácido sulfúrico concentrado) implica una gran cantidad de ácido disuelto en una pequeña cantidad de agua. Sin embargo ésta se considera como disolvente y el ácido como soluto. La solución se presenta en el mismo estado físico que el disolvente. Por ejemplo, si se disuelve un soluto sólido o gaseoso en agua, se obtiene una solución líquida.

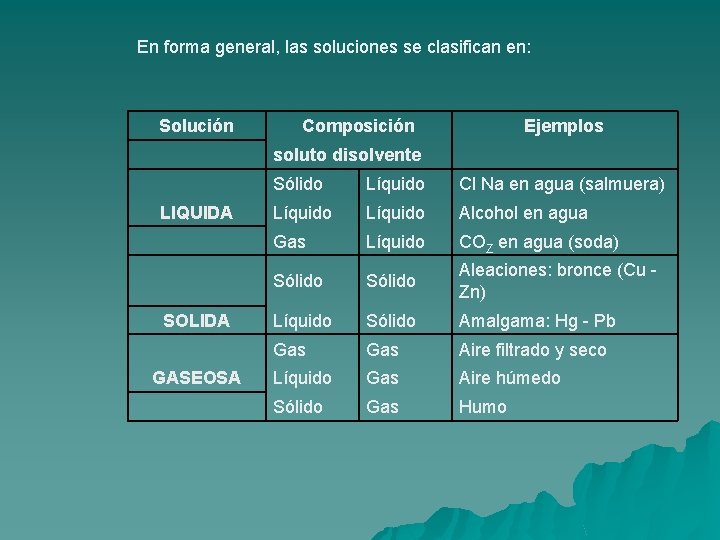
En forma general, las soluciones se clasifican en: Solución Composición Ejemplos soluto disolvente LIQUIDA SOLIDA GASEOSA Sólido Líquido Cl Na en agua (salmuera) Líquido Alcohol en agua Gas Líquido COZ en agua (soda) Sólido Aleaciones: bronce (Cu - Zn) Líquido Sólido Amalgama: Hg - Pb Gas Aire filtrado y seco Líquido Gas Aire húmedo Sólido Gas Humo

Las soluciones más comunes, en el laboratorio, son las soluciones líquidas formadas por un soluto disuelto en un disolvente líquido (generalmente agua). Los químicos trabajan tanto con disoluciones acuosas como con disoluciones no acuosas, por ejemplo disoluciones en hidrocarburos, alcoholes, éteres, etc. CONCENTRACION DE LAS SOLUCIONES La preparación y el empleo de soluciones de concentración conocida, constituye una práctica habitual en el laboratorio y en la industria química. Se denomina concentración a la relación entre la cantidad de soluto y la cantidad de solución o solvente. La concentración de las soluciones puede expresarse de varias maneras y cada una de ellas tiene sus ventajas para aplicaciones específicas.

En general se expresan: a) Cualitativamente Frecuentemente se usan los términos diluida o concentrada para indicar que la cantidad relativa de soluto es muy pequeña o muy elevada, respectivamente, con respecto a la cantidad de disolvente o de solución. Por supuesto esta forma de expresión sólo tiene un valor relativo; todo lo que puede afirmarse es que una solución es más o menos diluida o más o menos concentrada que otra. Solución saturada: la capacidad de un solvente para incorporar un soluto tiene, en general, un límite. Se dice que una solución es saturada cuando el solvente ha incorporado la máxima cantidad posible de soluto. La cantidad de soluto con la cual se alcanza la saturación de un determinado volumen de solvente, varía con la clase de soluto, y para un determinado soluto, varía con la temperatura.

- Se define solubilidad como la cantidad de gramos de soluto que saturan cien gramos de disolvente a una determinada temperatura. -Las soluciones que contienen menor cantidad de soluto de la que podrían admitir, se denominan insaturadas - En ciertas condiciones (por ejemplo, aumentando la temperatura), es posible incorporar más soluto que el correspondiente al límite de saturación; se dice entonces que la solución es sobresaturada -Estas soluciones son inestables, pues el exceso de soluto tiende a separarse como precipitado. -Los términos saturadas e insaturadas no están relacionados con los términos concentradas y diluidas; ya que los conceptos de saturación e insaturación dependen de la solubilidad del soluto en cuestión, mientras que los conceptos diluido y concentrado dependen de la cantidad de soluto con respecto al disolvente o a la solución

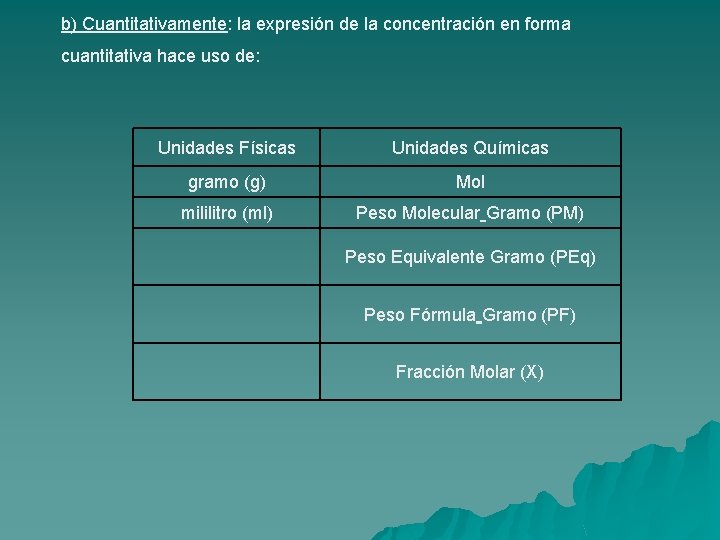
b) Cuantitativamente: la expresión de la concentración en forma cuantitativa hace uso de: Unidades Físicas Unidades Químicas gramo (g) Mol mililitro (ml) Peso Molecular Gramo (PM) Peso Equivalente Gramo (PEq) Peso Fórmula Gramo (PF) Fracción Molar (X)

Expresiones de la concentración en Unidades Físicas a) Porcentual peso en peso: "gramos de soluto puro en 100 gramos de solución" o "gramos de soluto puro en 100 gramos de disolvente". de solución de disolvente ó b) Porcentual volumen en volumen: "mililitros de soluto puro en 100 mililitros de solución" o "mililitros de soluto puro en 100 mililitros de disolvente". de solución de disolvente ó c) Porcentual peso en volumen: "gramos de soluto puro en 100 mililitros de solución" ó "gramos de soluto puro en 100 mililitros de disolvente". de solución ó de disolvente

d)Otras: g / l "gramos de soluto puro en un litro de solución" mg/ l "miligramos de soluto puro en un litro de solución" ug/ l "microgramos de soluto puro en un litro de solución (1 ug/ l= 10 -6 g)" p. p. m. "una parte de soluto puro en un millón de partes de solución (esta unidad se usa frecuentemente para expresar concentraciones muy bajas). Expresiones de la concentración en Unidades Químicas a) Normalidad (N) : se define como el "número de equivalentes de soluto por litro de solución N = número de Eq de soluto (1) litro de solución

siendo el n° de equivalentes: n° de Eq = gramos de soluto PE q del soluto Reemplazando (2) en (1): CALCULO DEL PESO EQUIVALENTE GRAMO DE DISTINTAS SUSTANCIAS • Hidruros PEq =_ PM del hidruro n° de hidrógenos • Óxidos PEq =_ PM del óxido 2 x n° de oxigenos

• Ácidos • Bases • Sales neutras PEq = PM del ácido n° de hidrógenos ácidos PEq = PM de la base n° de oxhidrilos PEq = PM de la sal n° de oxidación del metal x n° de átomos del metal b) Molaridad (M) : se define como el "número de moles de soluto puro por litro de solución". M= número de moles de soluto (1) litro de solución

siendo el n° de moles(n) de soluto: n= gramos de soluto PM de soluto (2) Reemplazando (2) en (1): M = gramos de soluto / 1. 000 ml de solución PM del soluto c) Molalidad (m) : se define como el "número de moles de soluto en 1000 gramos de disolvente ". M= n° de moles de soluto kg de disolvente (1) siendo n° de moles (n) de soluto: n = gramos de soluto PM de soluto (2)

Reemplazando (2) en (1): m= gramos de soluto /_1. 000 g de disolvente PM de soluto
 Propiedades térmicas del agua
Propiedades térmicas del agua Cohesion molecular del agua
Cohesion molecular del agua Propiedades del agua
Propiedades del agua Propiedades fisicoquímicas del agua
Propiedades fisicoquímicas del agua Estructura del agua
Estructura del agua Estructura del agua
Estructura del agua Desaciertos de bohr
Desaciertos de bohr Propiedades de papel
Propiedades de papel Propiedad simetrica matematicas
Propiedad simetrica matematicas Compuestos orgnicos
Compuestos orgnicos Tipos de matrices
Tipos de matrices Propiedades físicas de la materia
Propiedades físicas de la materia Qu es texto
Qu es texto Cuales son sus propiedades
Cuales son sus propiedades Elementos representativos
Elementos representativos Propiedades de la turmalina negra
Propiedades de la turmalina negra Caracteristicas de acido clorhidrico
Caracteristicas de acido clorhidrico Ejemplos de sistemas continuos y discretos
Ejemplos de sistemas continuos y discretos Circulo de corredores de propiedades
Circulo de corredores de propiedades Jcc propiedades
Jcc propiedades Propiedades del despeje
Propiedades del despeje Pitatoria propiedades
Pitatoria propiedades Propiedades periodicas
Propiedades periodicas Tangencias 2 bachillerato
Tangencias 2 bachillerato Texto divulgativo
Texto divulgativo Propiedades de los materiales ejemplos
Propiedades de los materiales ejemplos Propiedades de las soluciones
Propiedades de las soluciones Propiedades de la integral
Propiedades de la integral Triangulo rectangulo
Triangulo rectangulo El comportamiento de un gas
El comportamiento de un gas Propiedades de los lipidos
Propiedades de los lipidos Propiedades fisicas de aldehidos
Propiedades fisicas de aldehidos Propiedades generales de la materia divisibilidad
Propiedades generales de la materia divisibilidad Propiedades de las sustancias puras
Propiedades de las sustancias puras Generalidades de los alquenos
Generalidades de los alquenos Propiedades quimicas de los alquinos
Propiedades quimicas de los alquinos Propiedades de inecuaciones con valor absoluto
Propiedades de inecuaciones con valor absoluto Propiedades analíticas básicas
Propiedades analíticas básicas Conceptos basicos de fisica
Conceptos basicos de fisica Propiedades que tienen los materiales
Propiedades que tienen los materiales Procedimientos de cohesión
Procedimientos de cohesión Efecto doppler
Efecto doppler Propiedades mecanicas
Propiedades mecanicas Vectores propiedades
Vectores propiedades Propiedades de producto cartesiano
Propiedades de producto cartesiano Logaritmo de una potencia
Logaritmo de una potencia