PROPIEDADES PERIDICAS Cuestiones resueltas Los radios atmicos e

















- Slides: 19

PROPIEDADES PERIÓDICAS Cuestiones resueltas


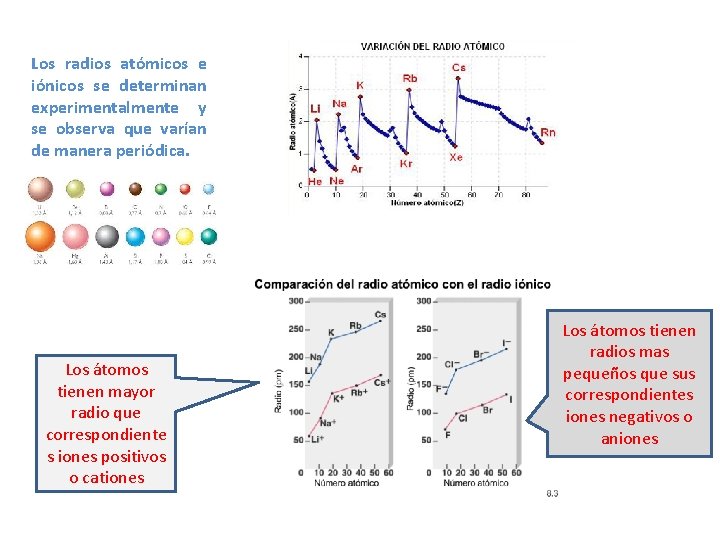
Los radios atómicos e iónicos se determinan experimentalmente y se observa que varían de manera periódica. Los átomos tienen mayor radio que correspondiente s iones positivos o cationes Los átomos tienen radios mas pequeños que sus correspondientes iones negativos o aniones

PROPIEDADES PERIÓDICAS: RADIOS ATÓMICOS Y RADIOS IÓNICOS 1. - 2010 FG Septiembre Escriba las configuraciones electrónicas de los elementos X (Z = 12) e Y (Z = 38) e indique el grupo y período de la tabla periódica al que pertenece cada uno de los elementos. A partir de estas configuraciones electrónicas, indique, de forma razonada, el elemento con el valor del radio atómico más alto. (1, 0 punto) 2. - 2011 FE Julio A. Escriba las configuraciones electrónicas de los elementos X (Z = 9) e Y (Z = 4) e indique el grupo y período de la tabla periódica al que pertenece cada uno de los elementos. A partir de esas configuraciones electrónicas, indique, de forma razonada, el elemento que presenta el valor más bajo del radio atómico. (1, 0 punto) 3. - 2012 FG Junio A. Indique si es correcta la afirmación: “El radio del catión Na+ es menor que el radio del catión K+”. Justifique su respuesta. (1, 0 punto) Datos: Na (Z = 11); K (Z = 19) 4. - 2013 FE junio Escriba las configuraciones electrónicas de los elementos X (Z = 8) e Y (Z = 34) e indique el grupo y período de la tabla periódica al que pertenece cada uno de los elementos. A partir de esas configuraciones electrónicas, indique, de forma razonada, el elemento que presenta el valor más bajo del radio atómico. (1, 0 punto) 5. - 2013 FG julio Ordene las siguientes especies de acuerdo con el valor creciente de los radios iónicos: S 2 -, Cl-, P 3 -. Justifique la respuesta. (1, 0 punto) Datos: S (Z = 16); Cl (Z = 17) y P (Z = 15)

¿Qué tienen en común, qué les diferencia? Grupo 2 Periodo 3 X Periodo 5 Y

Grupo 2 Y Periodo 2 Grupo 17 X ¿Qué tienen en común, qué les diferencia?

¿Qué tienen en común, qué les diferencia?

¿Qué tienen en común, qué les diferencia?

¿Qué tienen en común, qué les diferencia?

PROPIEDADES PERIÓDICAS: PRIMERA ENERGÍA DE IONIZACIÓN 6. - 2011 FG Junio A. Escriba las configuraciones electrónicas de los elementos X (Z = 7) e Y (Z = 33). Indique el grupo y período de la tabla periódica al que pertenece cada uno de los elementos. A partir de esas configuraciones electrónicas, indique, de forma razonada, el elemento que presenta el valor más bajo de la primera energía de ionización. (1, 0 punto) 7. - 2010 FE Junio Escriba las configuraciones electrónicas de los elementos X (Z = 13) e Y (Z = 49) e indique el grupo y período de la tabla periódica al que pertenece cada uno de los elementos. A partir de esas configuraciones electrónicas, indique, de forma razonada, el elemento que presenta el valor más alto de la primera energía de ionización. (1, 0 punto) 8. - 2012 FE Junio A. Escriba las configuraciones electrónicas de los elementos X (Z = 12) e Y (Z = 17) e indique el grupo y período de la tabla periódica a los que pertenecen los elementos. A partir de esas configuraciones electrónicas, indique, de forma razonada, el elemento que presenta el valor más elevado de la primera energía de ionización. (1, 0 punto) 8. - 2012 FE Julio A. Para los elementos X (Z = 5) e Y (Z = 9), escriba las configuraciones electrónicas respectivas. Indique el grupo y período de la tabla periódica al que pertenece cada uno de los elementos. A partir de su posición en la tabla periódica, indique, de forma razonada, el que presenta el valor más alto de la primera energía de ionización. (1, 0 punto) 9. - 2014 FE junio A partir de las siguientes configuraciones electrónicas: X 2+ = 1 s 2, 2 s 22 p 6, 3 s 23 p 6 Y 2 - = 1 s 2, 2 s 22 p 6, 3 s 23 p 63 d 10, 4 s 24 p 6. Escriba las configuraciones electrónicas de los átomos neutros de los que proceden estos iones. Indique el grupo y período de la tabla periódica al que pertenece cada uno de los elementos. Indique, de forma razonada, el elemento que presenta el valor más bajo de la primera energía de ionización. (1, 0 punto)

¿Qué tienen en común, qué les diferencia?

¿Qué tienen en común, qué les diferencia?

¿Qué tienen en común, qué les diferencia?

¿Qué tienen en común, qué les diferencia?

¿Qué tienen en común, qué les diferencia?

PROPIEDADES PERIÓDICAS: AFINIDAD ELECTRÓNICA 10. - 2011 FG Julio A. Para los elementos X (Z = 4) e Y (Z = 8), escriba las configuraciones electrónicas respectivas e indique, de forma razonada, el que presenta el valor más negativo de la afinidad electrónica. (1, 0 punto) 11. - 2010 FE Septiembre A. Defina la afinidad electrónica de un átomo. Para los elementos X (Z = 4) e Y (Z = 8), escriba las configuraciones electrónicas respectivas e indique, de forma razonada, el que presenta el valor más negativo de la afinidad electrónica. (1, 0 punto) 12. - 2014 FG julio Para los elementos X (Z = 6) e Y (Z = 9), escriba las correspondientes configuraciones electrónicas. Indique el grupo y período de la tabla periódica al que pertenece cada uno de los elementos. A partir de su posición en la tabla periódica, indique, de forma razonada, el que presenta el valor más negativo de la primera afinidad electrónica. (1, 0 punto)

¿Qué tienen en común, qué les diferencia?

¿Qué tienen en común, qué les diferencia?

¿Qué tienen en común, qué les diferencia?
 Electroafinidad
Electroafinidad Tenpomatic decisiones resueltas
Tenpomatic decisiones resueltas Fracciones algebraicas ejercicios resueltos
Fracciones algebraicas ejercicios resueltos La inspiración actividades resueltas
La inspiración actividades resueltas Resueltas
Resueltas Resueltas
Resueltas La manzana de la discordia actividades resueltas
La manzana de la discordia actividades resueltas Nadie nos juzgue por cuestiones comida bebida
Nadie nos juzgue por cuestiones comida bebida Planeamiento estrategico
Planeamiento estrategico Unlicensed two-way radios
Unlicensed two-way radios Rádiós műfajok
Rádiós műfajok Dos circunferencias secantes tienen radios de 6 cm y 10 cm
Dos circunferencias secantes tienen radios de 6 cm y 10 cm Matra taller
Matra taller Drats dstar
Drats dstar Aaw radios
Aaw radios Bloque p
Bloque p Propiedades aperiodicas
Propiedades aperiodicas Peridicas
Peridicas Peridicas
Peridicas Característica de los metales
Característica de los metales