METANO Y AGUA MARINA VEGA La molcula de





- Slides: 8

METANO Y AGUA MARINA VEGA

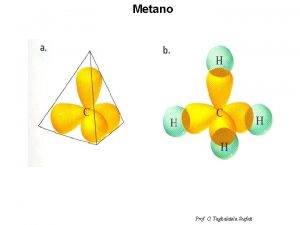
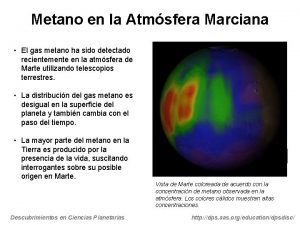
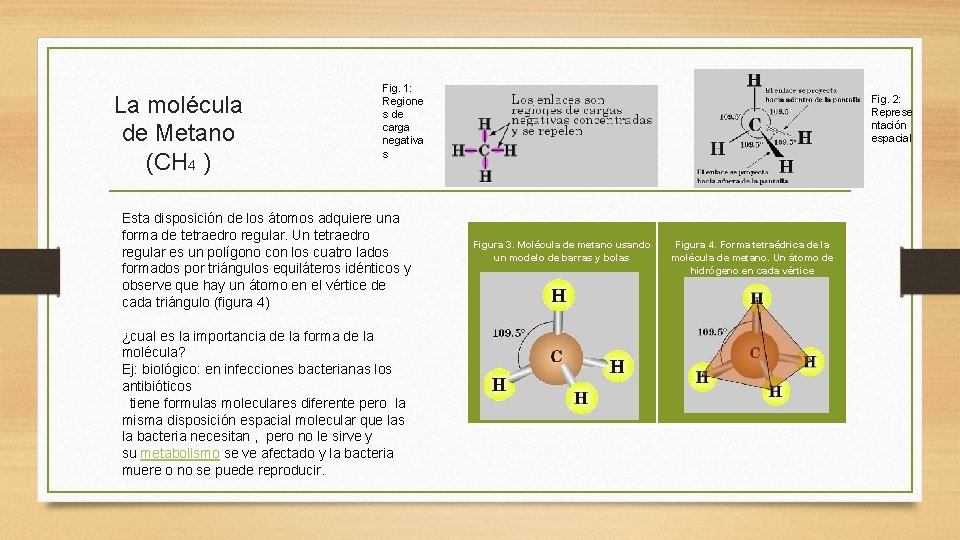
La molécula de Metano (CH 4 ) Fig. 1: Regione s de carga negativa s Esta disposición de los átomos adquiere una forma de tetraedro regular. Un tetraedro regular es un polígono con los cuatro lados formados por triángulos equiláteros idénticos y observe que hay un átomo en el vértice de cada triángulo (figura 4) ¿cual es la importancia de la forma de la molécula? Ej: biológico: en infecciones bacterianas los antibióticos tiene formulas moleculares diferente pero la misma disposición espacial molecular que las la bacteria necesitan , pero no le sirve y su metabolismo se ve afectado y la bacteria muere o no se puede reproducir. Fig. 2: Represe ntación espacial Figura 3. Molécula de metano usando un modelo de barras y bolas Figura 4. Forma tetraédrica de la molécula de metano. Un átomo de hidrógeno en cada vértice

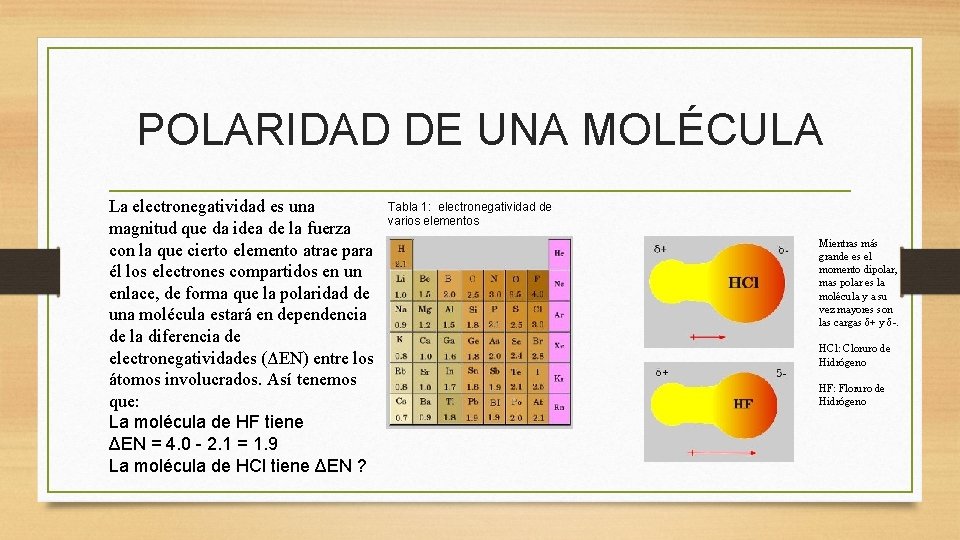
POLARIDAD DE UNA MOLÉCULA La electronegatividad es una magnitud que da idea de la fuerza con la que cierto elemento atrae para él los electrones compartidos en un enlace, de forma que la polaridad de una molécula estará en dependencia de la diferencia de electronegatividades (ΔEN) entre los átomos involucrados. Así tenemos que: La molécula de HF tiene ΔEN = 4. 0 - 2. 1 = 1. 9 La molécula de HCl tiene ΔEN ? Tabla 1: electronegatividad de varios elementos Mientras más grande es el momento dipolar, mas polar es la molécula y a su vez mayores son las cargas δ+ y δ-. HCl: Cloruro de Hidrógeno HF: Floruro de Hidrógeno

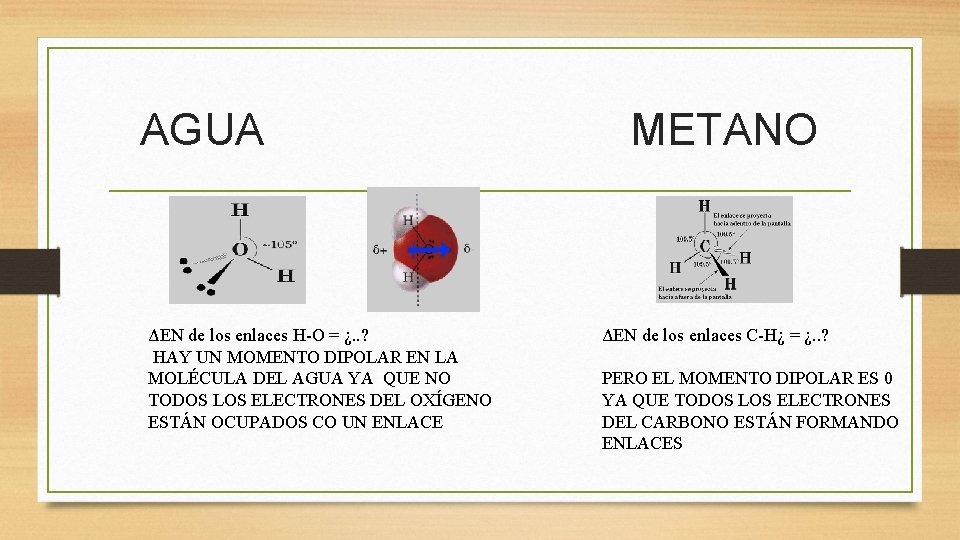
AGUA METANO ΔEN de los enlaces H-O = ¿. . ? HAY UN MOMENTO DIPOLAR EN LA MOLÉCULA DEL AGUA YA QUE NO TODOS LOS ELECTRONES DEL OXÍGENO ESTÁN OCUPADOS CO UN ENLACE ΔEN de los enlaces C-H¿ = ¿. . ? PERO EL MOMENTO DIPOLAR ES 0 YA QUE TODOS LOS ELECTRONES DEL CARBONO ESTÁN FORMANDO ENLACES

POLARIDAD Y PUENTES DE HIDRÓGENO • EL AGUA FORMA PUENTES DE HIDRÓGENO ENTRE SUS MOLÉCULAS • Para que se pueda formar un puente de hidrógeno entre moléculas se debe cumplir la condición de que el átomo de hidrógeno esté enlazado covalentemente con un átomo pequeño y mucho más electronegativo que él. • Esta condición se cumple para los enlaces covalentes O-H, N-H y F-H ya que el oxígeno, el nitrógeno y el flúor son los elementos que más se "apropian" de electrones, es decir son los más electronegativos de la tabla periódica. Con frecuencia no se incluye al cloro como capaz de inducir puentes de hidrógeno. • El fluoruro de hidrógeno, tiene un momento dipolar superior al del agua y es gas en condiciones normales ¿POR QUÉ? ? ? ? • El asunto radica en la distribución de electrones de este elemento. Hay una gran diferencia entre el oxígeno y el flúor. • El Oxígeno tiene seis electrones en su capa de valencia, de modo que cuando comparte dos con sendos átomos de hidrógeno le quedan dos pares de electrones en el último nivel “POR LO TANTO FORMA UNA NUBE ELECTRONEGATIVA ÁVIDA DE HIDRÓGENOS. ” • El Flúor solo tiene un electrón en el último nivel y este es el que está haciendo el enlace. Entonces la "nube" del átomo de flúor está vacía y por tanto el protón del hidrógeno no resulta atraído con fuerza por el átomo de flúor. El puente de hidrógeno es débil y esto permite una distancia relativamente grande entre las moléculas.

LOS PUENTES DE HIDRÓGENO DEL AGUA ACTIVIDAD 1: Compare las propiedades térmicas del agua con las propiedades del metano (importancia de los puentes de hidrógeno) Agua Metano Peso molecular 18, 015 g/mol 16. 043 g/mol Punto de ebullición 100°C -161. 48 °C Punto de fusión 0°C -182. 5 ° C Ver el link http: //www. biologia. arizona. edu/biochemistry/tutorials/chemistry/page 3. html estimar los diferentes puntos de ebullición de cada compuesto comparar con el metano

ACTIVIDAD 2 • RESUMA LAS PROPIEDADES TÉRMICAS, COHESIVAS Y DISOLVENTES DEL AGUA LUEGO DE CONSULTAR EL LINK: • • • http: //www. biologia. arizona. edu/biochemistry/tutorials/chemistry/page 3. html http: //www. ehu. eus/biomoleculas/agua. htm Explique por qué las sustancias pueden ser hidrofóbicas o hidrofílicas. Consulte SU LIBRO DE BIOLOGÍA y responda: Explique la relación existente entre las propiedades (FÍSICA Y QUÍMICAS: polaridad, alta cohesión molecular, elevado calor específico, altos puntos de ebullición, alta constante dieléctrica, tensión superficial) y su uso por los seres vivos como: • refrigerante • medio en el que tienen lugar las reacciones metabólicas • medio de transporte. (Utilizar ejemplos) Utilice el siguiente link http: //www. genomasur. com/BCH_libro/capitulo_02. htm para responder. Explique el transporte de glucosa, aminoácidos, colesterol, grasas, oxígeno y cloruro de sodio en relación con su solubilidad en agua. (explique significa que debe responder cómo sucede el transporte de dichas sustancias relacionado con la solubilidad del agua)

BIBLIOGRAFÍA • • http: //www. sabelotodo. org/quimica/molecula. html http: //www. ehu. eus/biomoleculas/agua. htm www. ehu. es/biomoleculas/cibert. htm http: //www. genomasur. com/BCH_libro/capitulo_02. htm