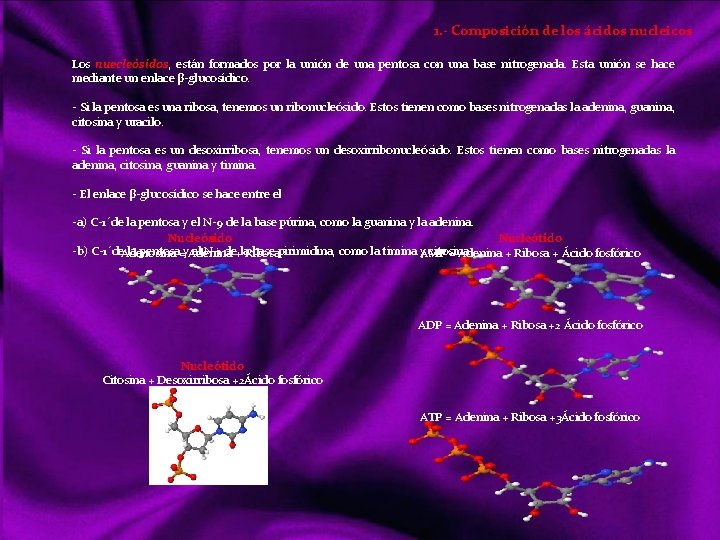
MOLCULAS En qumica una molcula es una partcula









![Escala de p. H El producto [H+]·[OH ]= 10 14, se denomina producto iónico Escala de p. H El producto [H+]·[OH ]= 10 14, se denomina producto iónico](https://slidetodoc.com/presentation_image_h/a384462fea410d06ac8b4f606a3c2364/image-15.jpg)



























































- Slides: 120

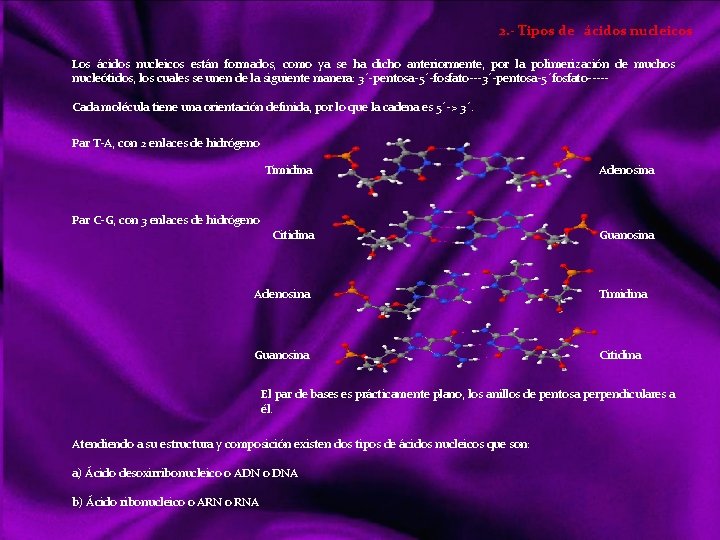
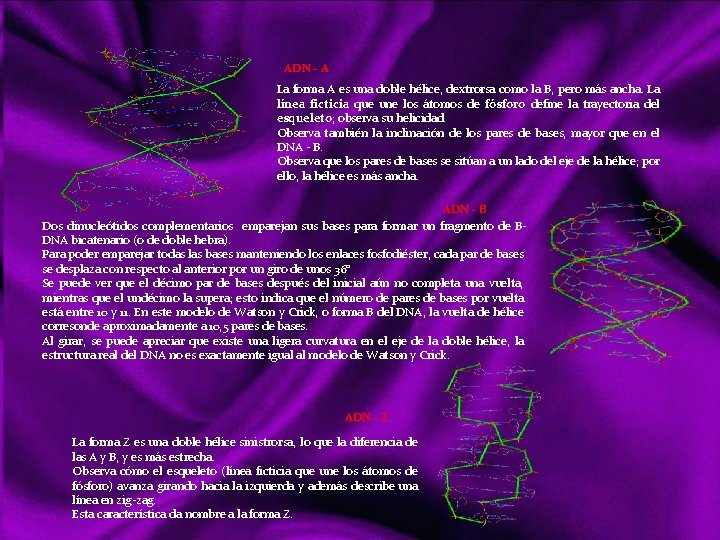
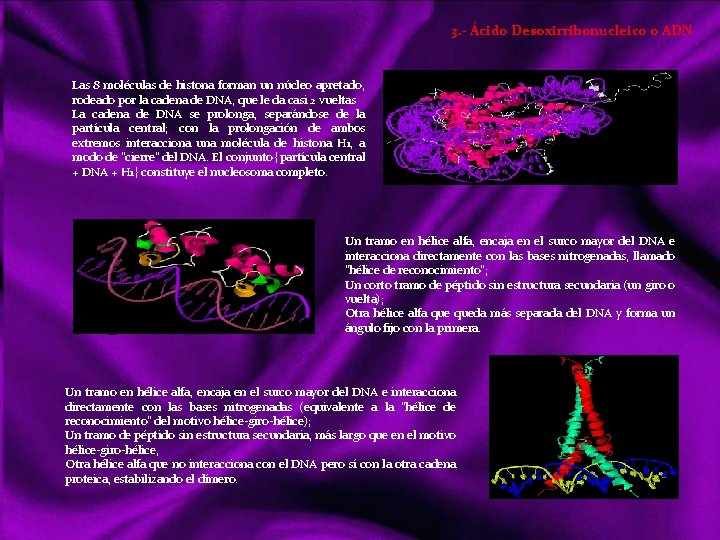
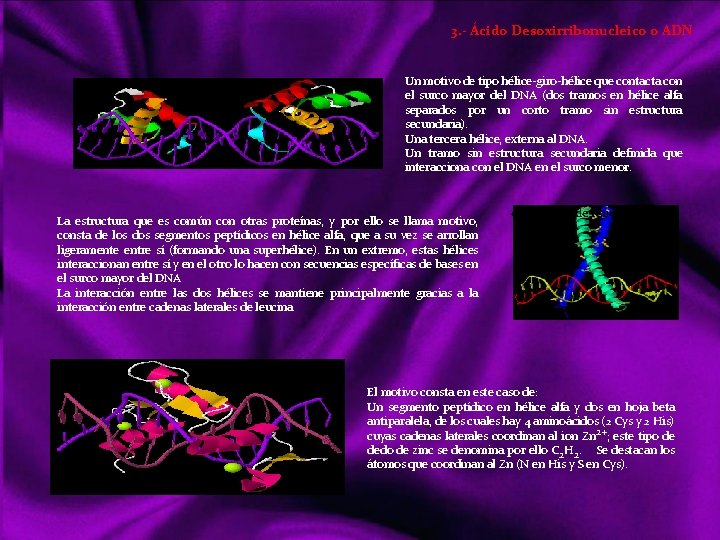
MOLÉCULAS En química, una molécula es una partícula formada por un conjunto de átomos ligados por enlaces covalentes o metálicos (en el caso del enlace iónico no se consideran moléculas, sino redes cristalinas), de forma que permanecen unidos el tiempo suficiente como para completar un número considerable de vibraciones moleculares. Hay moléculas de un mismo elemento, como O 2, O 3, N 2, P 4. . . , pero la mayoría de ellas son uniones entre diferentes elementos: la molécula. Se habla de “moléculas monoatómicas”, pese a lo contradictorio de la expresión, al referirse a los gases nobles y a otros elementos en los casos en que se hallan en forma de átomos discretos. Las moléculas diatómicas están formadas por dos átomos del mismo elemento o diferente elemento. Las moléculas poliatómicas están formadas por muchos átomos de diferente elemento Las moléculas pueden ser neutras o tener carga eléctrica; si la tienen pueden denominarse Ion molécula o Ion poliatómico. Una sustancia química formada por moléculas neutras contendrá un único tipo de tales moléculas, pero si contiene iones molécula necesariamente ha de contener también iones monoatómicos o poliatómicos de carga contraria. Links http: //ithacasciencezone. com/chemzone/lessons/03 bonding/mleebonding/covalent_bonds. htm http: //ithacasciencezone. com/chemzone/lessons/03 bonding/mleebonding/ionic_bonds. htm

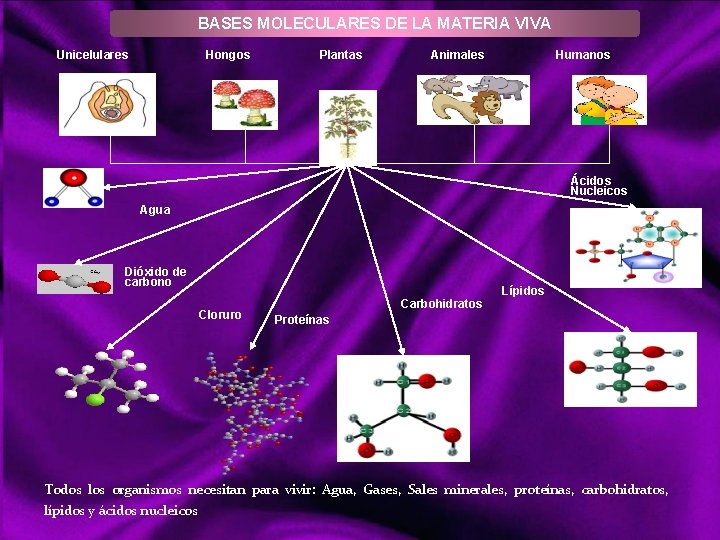
BASES MOLECULARES DE LA MATERIA VIVA Unicelulares Hongos Plantas Animales Humanos Ácidos Nucleicos Agua Dióxido de carbono Cloruro Carbohidratos Lípidos Proteínas Todos los organismos necesitan para vivir: Agua, Gases, Sales minerales, proteínas, carbohidratos, lípidos y ácidos nucleicos

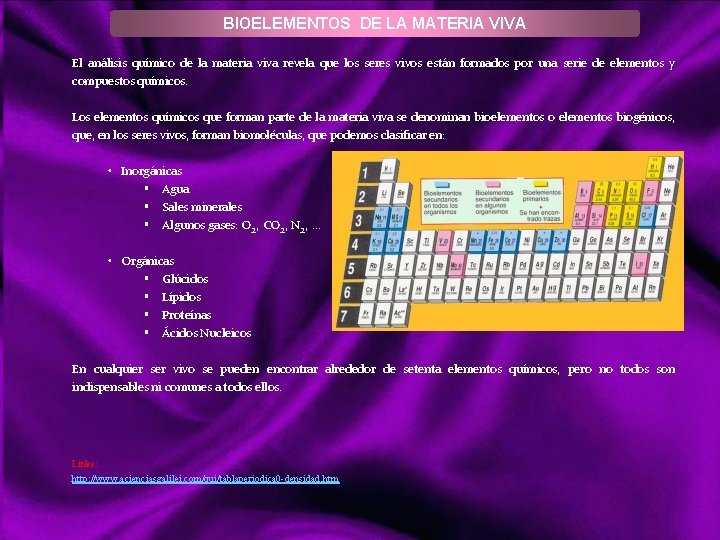
BIOELEMENTOS DE LA MATERIA VIVA El análisis químico de la materia viva revela que los seres vivos están formados por una serie de elementos y compuestos químicos. Los elementos químicos que forman parte de la materia viva se denominan bioelementos o elementos biogénicos, que, en los seres vivos, forman biomoléculas, que podemos clasificar en: • Inorgánicas § Agua § Sales minerales § Algunos gases: O 2, CO 2, N 2, . . . • Orgánicas § Glúcidos § Lípidos § Proteínas § Ácidos Nucleicos En cualquier ser vivo se pueden encontrar alrededor de setenta elementos químicos, pero no todos son indispensables ni comunes a todos ellos. Links: http: //www. acienciasgalilei. com/qui/tablaperiodica 0 -densidad. htm

Propiedades de los bioelementos Propiedades por las que el C, H, O, N, P y S componen los bioelementos que se encuentran en mayor proporción, en la materia viva: • Tienen capas electrónicas externas incompletas y pueden formar enlaces covalentes y dar lugar a las biomoléculas que constituirán las estructuras biológicas y llevarán a cabo las funciones vitales. • Poseen un nº atómico bajo, por lo que los electrones compartidos en la formación de los enlaces se hallan próximos al núcleo y las moléculas originadas son estables. • Como el O y el N son electronegativos, algunas biomoléculas son polares (hidrófilos) y por ello solubles en agua. • Pueden incorporarse a los seres vivos desde el medio externo (CO 2 , H 2 O, nitratos). Links http: //av. bmbq. uma. es/av_biomo/Mat 1. html

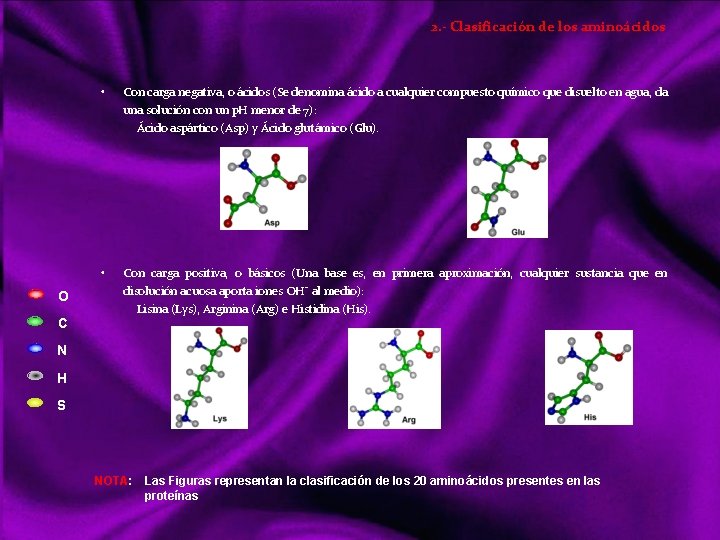
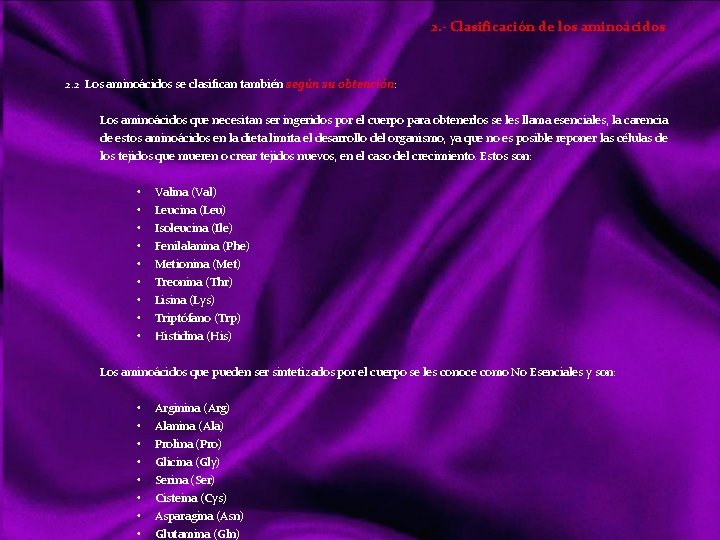
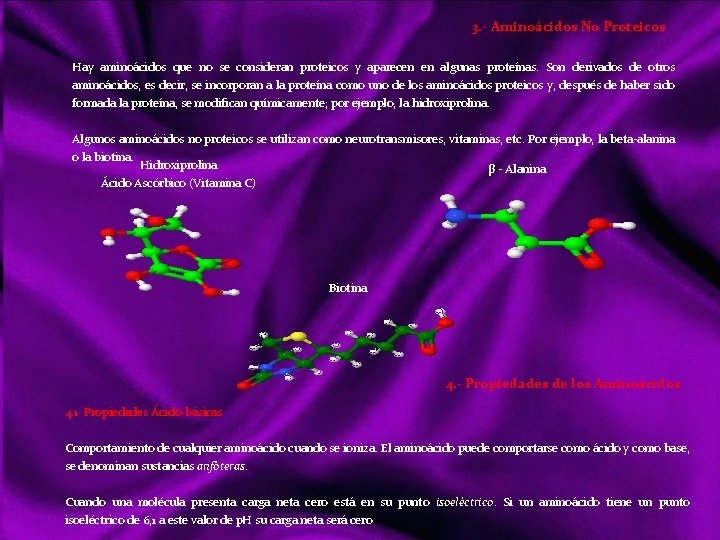
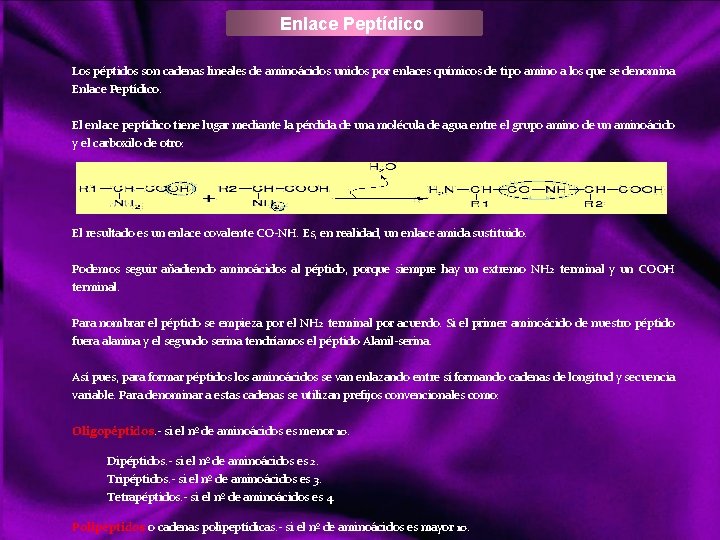
Clasificación de los bioelementos Atendiendo a su abundancia se pueden clasificar en: a) Bioelementos primarios, que aparecen en una proporción media del 96% en la materia viva, y son carbono (C), oxigeno (O), hidrógeno (H), nitrógeno (N), fósforo (P) y azufre (S). Estos elementos reúnen una serie de propiedades que los hacen adecuados para la vida: Forman entre ellos enlaces covalentes muy estables, compartiendo pares de electrones. El carbono, oxígeno y nitrógeno pueden formar enlaces dobles o triples. Siendo el más importante el C, ya que forma cadenas carbonadas. Facilitan la adaptación de los seres vivos al campo gravitatorio terrestre, ya que son los elementos más ligeros de la naturaleza. b) Bioelementos secundarios, aparecen en una proporción próxima al 3, 3%. Son: calcio (Ca), sodio (Na), potasio (K), magnesio (Mg) y cloro (Cl), desempeñando funciones de vital importancia en fisiología celular. c) Oligoelementos, micro constituyentes, o elementos vestigiales, que aparecen en la materia viva en proporción inferior al 0, 1% siendo también esenciales para la vida: hierro (Fe), manganeso (Mn), cobre (Cu), zinc (Zn), yodo (I), y cobalto (Co) aparecen en la mayoria de los organismos. Boro (B), silicio (Si), flúor (F), vanadio (V), selenio (Se), molibdeno (Mo) y estaño (Sn) sólo están presentes en grupos concretos. Aún participando en cantidades infinitesimales, no por ello son menos importantes, pues su carencia puede acarrear graves trastornos para los organismos. Ejemplo. Co; Cianocobalamina, vitamina b 12, imprescindible para fabricar hemoglobina

Agua Estructura de la molécula de AGUA El agua es la molécula más abundante en los seres vivos, y representa entre el 70 y 90% del peso de la mayor parte de los organismos. El contenido varia de una especie a otra; también es función de la edad del individuo (su % disminuye al aumentar la edad) y el tipo de tejido. Contenido en Agua del Cuerpo Humano Este contenido se mantiene constante por el equilibrio entre ingresos y pérdidas. Los ingresos diarios en un hombre con dieta mixta, actividad física moderada y que habite en clima templado son de 2, 6 litros (1, 31 de la bebida = 1 litro de alimentos + 0, 3 de agua metabólica) Las pérdidas son otros 2, 6 litros, de los cuales: 1, 41 de la orina, 1 por la evaporación por piel y pulmón y 0, 21 de pérdida fecal. El papel primordial del agua en el metabolismo de los seres vivos se debe sus propiedades físicas y químicas, derivadas de la estructura molecular. A temperatura ambiente es líquida, al contrario de lo que cabría esperar, ya que otras moléculas de parecido peso molecular (SO 2, CO 2, SO 2, H 2 S, etc) son gases. Este comportamiento se debe a que los dos electrones de los dos hidrógenos están desplazados hacia el átomo de oxigeno, por lo que en la molécula aparece un polo negativo, donde está el oxígeno, debido a la mayor densidad electrónica, y dos polos positivos, donde están los dos hidrógenos, debido a la menor densidad electrónica. La molécula de agua son dipolos. Links

Estructura de la molécula de AGUA Los enlaces por puentes de hidrógeno son, aproximadamente, 1/20 más débiles que los enlaces covalentes, el hecho de que alrededor de cada molécula de agua se dispongan otras moléculas unidas por puentes de hidrógeno, permite que se forme en el seno del agua una estructura ordenada de tipo reticular, responsable en gran parte del comportamiento anómalo y de sus propiedades físicas y químicas. El agua se presenta en las tres fases: Sólida, Líquida y Vapor como podemos observar en la siguiente figura La Estructura del Agua y la Vida en la Tierra La estructura reticular del agua, se debe a las interacciones entre sus moléculas que se establecen por puentes de hidrógeno. Esto permite, entre otras cosas, que el agua se mantenga en estado líquido entre 0º y 100ºC. Sin este comportamiento extraño, posiblemente no existiría vida en la Tierra. Esta recibe el nombre de planeta azul por su color azulado, vista desde el espacio, debido al agua liquida de su superficie, así como colores blanquecinos debido a las nubes Links http: //www. aula 21. net/Nutriweb/agua. htm

Propiedades Físico Químicas del AGUA a) Acción disolvente El agua es el líquido que más sustancias disuelve (disolvente universal), esta propiedad se debe a su capacidad para formar puentes de hidrógeno con otras sustancias, ya que estas se disuelven cuando interaccionan con las moléculas polares del agua. La capacidad disolvente es la responsable de dos funciones importantes para los seres vivos: es el medio en que transcurren las mayorías de las reacciones del metabolismo, el aporte de nutrientes y la eliminación de desechos se realizan a través de sistemas de transporte acuosos. Hidrofobia No puede considerarse este término únicamente como la aversión al agua de las personas o animales. Las moléculas que no son polares, como los hidrocarburos, no pueden establecer puentes de hidrógeno, por lo que interrumpen la estructura reticular del agua, que se reorganiza alrededor de cada molécula apolar y forma estructuras altamente organizadas en forma de jaulas. En el interior de cada jaula, las moléculas apolares repelidas por el agua incrementan su cohesión al aumentar las fuerzas que las mantienen juntas lo que se denomina interacción hidrofóbica

Propiedades Físico Químicas del AGUA b) Fuerza de cohesión entre sus moléculas Los puentes de hidrógeno mantienen a las moléculas fuertemente unidas, formando una estructura compacta que la convierte en un liquido casi incompresible. Compresión del Agua Lo cierto, es que es mucho más fácil comprimir materia en forma gaseosa que en cualquier otra modalidad. Los vapores están compuestos de moléculas muy separadas entre sí. En el caso de los líquidos y sólidos, los átomos y moléculas que los componen están más o menos en contacto. Esto se debe a la repulsión mutua de los electrones que existen en las regiones exteriores de los átomos, es una resistencia mucho más fuerte a la compresión que el movimiento molecular en un vapor. Una cierta cantidad de agua en un cilindro abierto por arriba y ajustamos un pistón en la abertura hasta tocar el agua. Si empujamos el pistón hacia abajo con todas nuestras fuerzas, veremos que apenas cederá. Por eso se dice a menudo que el agua es "incomprensible“, no se puede reducirá a un volumen más pequeño. Por ejemplo si comprimimos 100 litros de agua con una presión de 0. 1050 Pascal, su volumen se contraerá a 96 litros. Si la presión aumenta aún más, el volumen seguirá disminuyendo. Bajo tal compresión los electrones son empujados, por así decir, cada vez más cerca del núcleo, hasta que ya no se pueden mantener en órbita alrededor del núcleo y son desplazados, La materia se reduce entonces a núcleos atómicos desnudos y electrones volando de acá para allá en movimientos alocados (materia degenerada). Fenómeno que si se podría observar en el centro del Sol.

Propiedades Físico Químicas del AGUA c) Elevada fuerza de adhesión De nuevo los puentes de hidrógeno del agua son los responsables, al establecerse entre estos y otras moléculas polares, y es responsable, junto con la cohesión de la capilaridad, al cual se debe, en parte, la ascensión de la sabia bruta desde las raíces hasta las hojas. d) Gran calor específico El agua absorbe grandes cantidades de calor que utiliza en romper los puentes de hidrógeno. Su temperatura desciende más lentamente que la de otros líquidos a medida que va liberando energía al enfriarse. Esta propiedad permite al citoplasma acuoso servir de protección para las moléculas orgánicas en los cambios bruscos de temperatura. El Agua y el Clima Costero A causa del elevado calor específico del agua, los mares y océanos moderan los climas costeros. El contenido hídrico de los suelos influye en el intervalo de temperaturas (máxima y mínima) que alcanzan, lo cual afecta al riesgo de heladas y a lo temprano o tardío de los cultivos vegetales.

Propiedades Físico Químicas del AGUA e) Elevado calor de vaporización A 20ºC se necesitan 540 calorías para evaporar un gramo de agua, lo que da idea de la energía necesaria para romper los puentes de hidrógeno establecidos entre las moléculas del agua líquida y, posteriormente, para dotar a estas moléculas de la energía cinética suficiente para abandonar la fase líquida y pasar a la fase de vapor. Las sombras Cuando se evapora el agua o cualquier otro líquido, disminuye la temperatura, lo que constituye un método eficaz en los vertebrados para disipar calor por sudoración; también las plantas utilizan este sistema de refrigeración, sobre todo algunas como el tomillo, el romero, etc. Estas plantas están adaptadas a los ambientes calurosos del verano, mediante el almacenamiento de esencias volátiles, cuya evaporación provoca un ligero descenso de la temperatura en su entorno. El hielo flota en el agua La estructura del hielo, forma un retículo que ocupa más espacio y es menos denso que el agua líquida. Cuando el agua se enfría, se contrae su volumen, como sucede en todos los cuerpos, pero al alcanzar los 4ºC (punto de congelación)cesa la contracción y su estructura se dilata hasta transformarse en hielo. Por ser el hielo menos denso que el agua, flota en ella. Gracias a esta anomalía del agua, los lagos, ríos y mares, comienzan a congelarse desde la superficie hacia abajo, y esta costra de hielo superficial sirve de abrigo a los seres que viven, pues aunque la temperatura ambiental sea extremadamente baja ( 50 0 60º C), el agua de la superficie transformada en hielo mantiene constante su temperatura en 0ºC (hielo fundente). El agua del fondo queda protegida térmicamente del exterior,

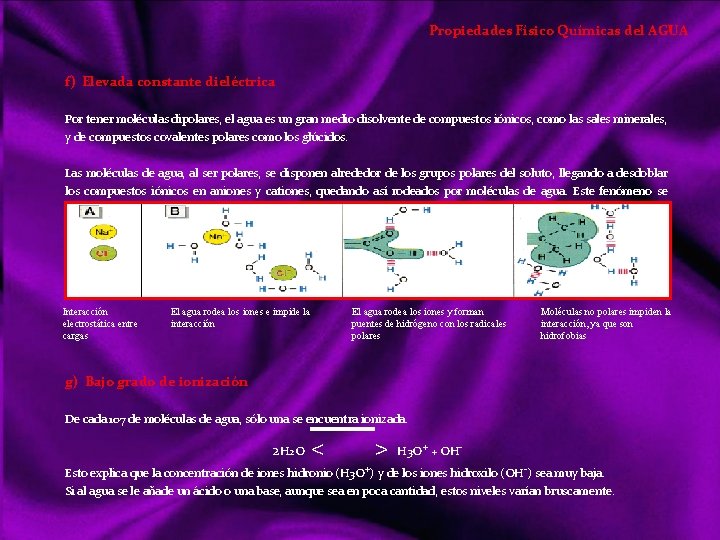
Propiedades Físico Químicas del AGUA f) Elevada constante dieléctrica Por tener moléculas dipolares, el agua es un gran medio disolvente de compuestos iónicos, como las sales minerales, y de compuestos covalentes polares como los glúcidos. Las moléculas de agua, al ser polares, se disponen alrededor de los grupos polares del soluto, llegando a desdoblar los compuestos iónicos en aniones y cationes, quedando así rodeados por moléculas de agua. Este fenómeno se llama solvatación iónica. Interacción electrostática entre cargas El agua rodea los iones e impide la interacción El agua rodea los iones y forman puentes de hidrógeno con los radicales polares Moléculas no polares impiden la interacción, ya que son hidrofobias g) Bajo grado de ionización De cada 107 de moléculas de agua, sólo una se encuentra ionizada. 2 H 2 O < > H 3 O+ + OH Esto explica que la concentración de iones hidronio (H 3 O+) y de los iones hidroxilo (OH ) sea muy baja. Si al agua se le añade un ácido o una base, aunque sea en poca cantidad, estos niveles varían bruscamente.

Propiedades Bioquímicas del AGUA a) En la fotosíntesis las enzimas utilizan el agua como fuente de átomos de hidrógeno. Por ejemplo: son necesarios 800 litros de agua para producir 1 kg. de trigo. Es decir son necesarios de 350 litros de agua a 800 litros, según el cultivo, para la formación de 1 kg. de materia. De ahí dependen las enormes cantidades de agua que requieren las plantas hasta alcanzar su normal desarrollo. Una cosecha de 4000 kg. de trigo por Ha. exige unos 5000 metros cúbicos de agua, lo que representa un elevado nivel de agua de 0, 5 m. b) En las reacciones de hidrólisis Las enzimas hidrolíticas han explotado la capacidad del agua para romper determinados enlaces hasta degradar los compuestos orgánicos en otros más simples, durante los procesos digestivos.

Ionización del AGUA Si observas la figura siguiente, comprobarás que dos moléculas polares de agua pueden ionizarse debido a las fuerzas de atracción por puentes de hidrogeno que se establecen entre ellas. Un ión hidrogeno se disocia de su átomo de oxigeno de la molécula (unidos por enlace covalente), y pasa a unirse con el átomo de oxígeno de la otra molécula, con el que ya mantenía relaciones mediante el enlace de hidrógeno. Como vemos, el agua no es un líquido químicamente puro, ya que se trata de una solución iónica que siempre contiene algunos iones H 3 O+ y OH . (Se utiliza el símbolo H+, en lugar de H 3 O+).
![Escala de p H El producto HOH 10 14 se denomina producto iónico Escala de p. H El producto [H+]·[OH ]= 10 14, se denomina producto iónico](https://slidetodoc.com/presentation_image_h/a384462fea410d06ac8b4f606a3c2364/image-15.jpg)
Escala de p. H El producto [H+]·[OH ]= 10 14, se denomina producto iónico del agua, y constituye la base para establecer la escala de p. H (potencial hidrógeno), que mide la acidez o alcalinidad de una disolución acuosa, es decir, su concentración de iones [H+] o [OH ] respectivamente. Definimos el p. H como: p. H= log[H+] El p. H del agua es 7 y lo consideramos neutro. Valores mayores serán básicos o alcalinos y valores menores ácidos. Por ejemplo, una concentración de [H+] = 1 × 10– 7 M (0, 0000001) es simplemente un p. H de 7 ya que : p. H = –log[10– 7] = 7 Links: http: //es. wikipedia. org/wiki/PH

Escala de p. H y medida del p. H El p. H típicamente va de 0 a 14 en disolución acuosa. Las disoluciones ácidas tienen p. H menores a 7 Las disoluciones básicas tienen p. H mayores a 7 El p. H = 7 indica la neutralidad de la disolución (siendo el disolvente agua) El p. H normal de los fluidos corporales suele oscilar alrededor de 7 Medición del p. H El valor del p. H se mide con un instrumenti llamado p. Hímetro, el cual mide la diferencia de potencial entre un electrodo de referencia (generalmente de plata/cloruro de plata) y un electrodo de vidrio sensible al ión hidrógeno. Fuente: Enciclopedia en línea Wikipedia También se puede medir de forma aproximada el p. H de una disolución empleando indicadores, ácidos o bases débiles que presentan diferente color según el p. H, como la Fenolftaleína. Generalmente se emplea papel indicador, que se trata de papel impregnado de una mezcla de indicadores. El p. H de disoluciones concentradas de ácidos sí puede ser negativo. Por ejemplo, el p. H de una disolución 2, 0 M de HCl es – 0, 30.

Sistemas tampón o buffer Los organismos vivos soportan muy mal las variaciones del p. H, aunque tan solo se trate de unas décimas de unidad, y por ello han desarrollado en la historia de la evolución sistemas tampón o buffer que mantienen el p. H constante, mediante mecanismos homeostáticos. Las variaciones de p. H, afectan a la estabilidad de las proteínas y, en concreto, en la actividad catalítica de los enzimas, pues en función del p. H, pueden generar cargas eléctricas que modifiquen su actividad biológica. Los sistemas tampón que tienden a impedir la variación del p. H cuando se añaden pequeñas cantidades de iones H+ o OH , consisten en un par ácido base conjugada que actúan como dador y receptor de electrones, respectivamente. Podemos citar otros tampones biológicos, como son el par carbonato bicarbonato y el par monofosfato bifosfáto. Links http: //www 2. uah. es/biomodel-misc/anim/inicio. htm

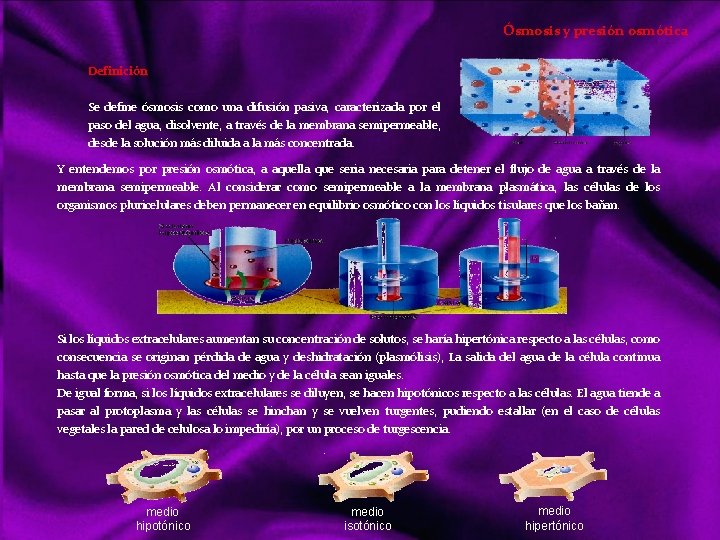
Ósmosis y presión osmótica Definición Se define ósmosis como una difusión pasiva, caracterizada por el paso del agua, disolvente, a través de la membrana semipermeable, desde la solución más diluida a la más concentrada. Y entendemos por presión osmótica, a aquella que seria necesaria para detener el flujo de agua a través de la membrana semipermeable. Al considerar como semipermeable a la membrana plasmática, las células de los organismos pluricelulares deben permanecer en equilibrio osmótico con los líquidos tisulares que los bañan. Si los líquidos extracelulares aumentan su concentración de solutos, se haría hipertónica respecto a las células, como consecuencia se originan pérdida de agua y deshidratación (plasmólisis), La salida del agua de la célula continua hasta que la presión osmótica del medio y de la célula sean iguales. De igual forma, si los líquidos extracelulares se diluyen, se hacen hipotónicos respecto a las células. El agua tiende a pasar al protoplasma y las células se hinchan y se vuelven turgentes, pudiendo estallar (en el caso de células vegetales la pared de celulosa lo impediría), por un proceso de turgescencia. medio hipotónico medio isotónico medio hipertónico

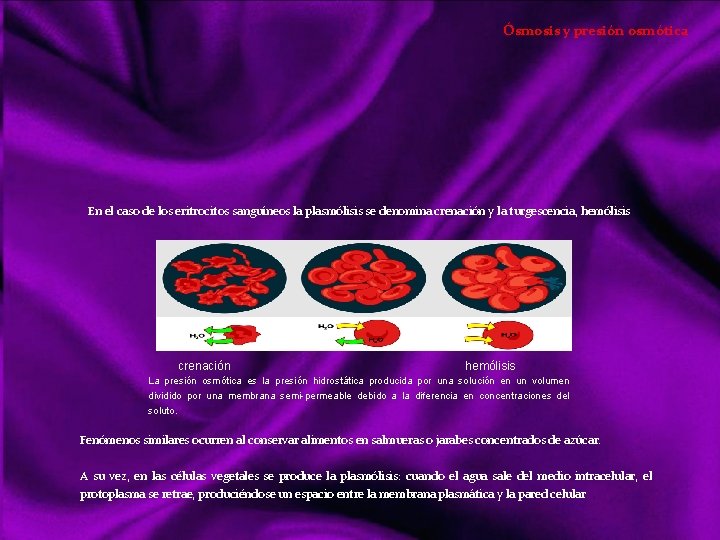
Ósmosis y presión osmótica En el caso de los eritrocitos sanguíneos la plasmólisis se denomina crenación y la turgescencia, hemólisis crenación hemólisis La presión osmótica es la presión hidrostática producida por una solución en un volumen dividido por una membrana semi-permeable debido a la diferencia en concentraciones del soluto. Fenómenos similares ocurren al conservar alimentos en salmueras o jarabes concentrados de azúcar. A su vez, en las células vegetales se produce la plasmólisis: cuando el agua sale del medio intracelular, el protoplasma se retrae, produciéndose un espacio entre la membrana plasmática y la pared celular

Ósmosis y presión osmótica Disoluciones acuosas Una dispersión es una mezcla homogénea de moléculas distintas. En ella aparecen una fase dispersante o disolvente y moléculas dispersas o solutos. En las dispersiones acuosas el agua constituye la fase dispersante, mientras que la fase dispersa presenta amplias variaciones: desde pequeñas moléculas como cloruro de sodio, hasta grandes proteínas como las albúminas. Las dispersiones cuya fase dispersa posee moléculas de baja masa molecular se denominan dispersiones coloidales. En el supuesto de que las moléculas de la fase dispersa posean masas moleculares elevadas (más de 10. 000 u. m. a. ) O tengan un tamaño comprendido entre 1 milimicra y 0, 2 micras, se denominan dispersiones coloidales. Las dispersiones coloidales pueden presentarse en forma fluida (sol) o con aspecto gelatinoso (gel). El paso de sol a gel siempre es posible, mientras que el paso inverso no lo es siempre. Reciclado del agua En 1. 993, la empresa G. W. comenzó a desarrollar en su fábrica un Plan de Gestión Medioambiental encaminado a reducir el consumo de recursos naturales y energéticos y a minimizar el impacto que sus actividades provocaban sobre el entorno. Hoy, las aguas residuales son completamente depuradas y son reutilizadas en un lago artificial donde nadan un millar de peces. donde sus aguas depuradas siguen los estándares de la Unión Europea.

SALES MINERALES a) Sales inorgánicas insolubles en agua Su función es de tipo plástico, formando estructuras de protección y sostén, por ejemplo: Caparazones de crustáceos y moluscos (Ca. CO 3) y caparazones silíceos de radiolarios y diatomeas. Esqueleto interno en vertebrados (fosfato, cloruro, fluoruro y carbonato de calcio) y los dientes. Determinadas células incorporan sales minerales, como las que se pueden encontrar en la pared de celulosa de los vegetales, o como forma de producto residual del metabolismo (cristales de oxalato cálcico, que puede contribuir al desarrollo de cálculos renales o biliares) El carbonato de calcio también se puede encontrar en el oído interno, formando los otolitos que intervienen en el mantenimiento del equilibrio interno o partículas de magnetita que, al parecer, pueden utilizar algunos animales con función de brújula para orientarse en sus desplazamientos.

El Calcio El calcio actúa como mediador intracelular cumpliendo una función de segundo mensajero; por ejemplo, el ion Ca 2+ interviene en la contracción de los músculos. También está implicado en la regulación de algunas enzimas quinasas que realizan funciones de fosforilación, por ejemplo la proteína quinasa C (PKC), y realiza funciones enzimáticas similares a las del magnesio en procesos de transferencia de fosfato (por ejemplo, la enzima fosfolipasa A 2). Algunas de sus sales son bastante insolubles, por ejemplo el sulfato (Ca. SO 4), carbonato (Ca. CO 3, oxalato, etc. , y forma parte de distintos biominerales. Así, en el ser humano, está presente en los huesos como hidroxiapatito cálcico, Ca 10(OH)2(PO 4)6 , en los dientes como fluorohidroxiapatito (algunos OH se sustituyen por F ), o como carbonato de calcio en el oído interno. Otra función del calcio está relacionada con la coagulación de la sangre, a través de su relación con la proteína protrombina. La competencia que se establece entre ciertos minerales puede inhibir la absorción del calcio; así, calcio y magnesio compiten por los mismos puntos de absorción, por lo que aquellas personas que estén tomando suplementos del segundo habrán de tener especial cuidado con el aporte diario de calcio. El déficit de calcio es susceptible de provocar osteoporosis e hipocalcemia, mientras que su exceso provoca hipercalcemia. Otros biominerales se encuentran presentes en exoesqueletos, en conchas o en cáscaras de huevo de distintos animales y en forma de distintas sales. En bioquímica, una quinasa (o cinasa) es un tipo de enzima que transfiere grupos fosfatos desde ATP a un sustrato específico o diana. El proceso se llama fosforilación. La diana puede activarse o inactivarse mediante la fosforilación. Todas las quinasas necesitan un ión metálico divalente como el Mg 2+ o el Mn 2+ para transferir el grupo fosfato. Estas enzimas son activadas por el AMP cíclico (Adenosín monofosfato cíclico), que cataliza la fosforilación de determinadas proteínas. Las quinasas están implicadas en los mecanismos de señalización celular

El Fósforo – El Cloruro Los compuestos de fósforo intervienen en funciones vitales para los seres vivos, por lo que está considerado como un elemento químico esencial. El fósforo, por ejemplo, como molécula de Pi ( «fosfato inorgánico» ), forma parte de las moléculas de ADN y ARN, las células lo utilizan para almacenar y transportar la energía mediante el adenosín trifosfato. Además, la adición y eliminación de grupos fosfato a las proteínas, fosforilación y desfosforilación, respectivamente, es el mecanismo principal para regular la actividad de proteínas intracelulares, y de ese modo el metabolismo de las células eucariotas. El Cloruro está presente en compuestos que llevan un átomo de cloro en estado de oxidación formal 1. Por lo tanto corresponden al estado de oxidación más bajo de este elemento ya que tiene completado la capa de valencia con ocho electrones. En los cloruros orgánicos el cloro está unido directamente a un átomo de carbono. El enlace es covalente aunque debido a la diferencia de electronegatividad entre los dos elementos está fuertemente polarizado. Por esta razón el cloro puede ser sustituido en muchos casos en reacciones de sustitución nucleofílica. Los cloruros orgánicos son menos inflamables que los hidrocarburos correspondientes. A menudo también son más tóxicos. Algunos cloroalcanos como el diclorometano tienen importancia como disolventes. Insecticidas como el lindano o el DDT también son cloruros orgánicos. También se encuentran en este grupo los clorodibenzodioxinas que se han hecho famosos y temidos por el accidente de edgar. En la naturaleza existen pocos cloruros orgánicos. Por lo tanto los cloruros orgánicos suelen tener mala biodegradabilidad y permanecer durante años en el medio ambiente. Debido a su carácter hidrofóbico se acumulan en las grasas, especialmente en los últimos eslabones de la cadena alimenticia y pueden provocar allí problemas de salud. Por lo que esto hace que el cloruro sea muy importante en la vida de las personas.

b) Sales inorgánicas solubles en agua La actividad biológica que proporcionan se debe a sus iones y desempeñan, fundamentalmente, las siguientes funciones: Funciones catalíticas. Algunos iones como Mn+2, Cu+2, Mg+2, Zn+2, etc. actúan como cofactores enzimáticos siendo necesarios para el desarrollo de la actividad catalítica de ciertas enzimas. El ion ferroso férrico forma parte del grupo hemo de la hemoglobina y mioglobina, proteínas encargadas del transporte de oxígeno. MIOGLOBINA HEMOGLOBINA A - OXIGENADA La hemoglobina es la encargada de transportar el oxígeno desde los pulmones al resto del cuerpo. Se encuentra dentro de los glóbulos rojos que circulan en la sangre. Si su concentración disminuye se produce una enfermedad conocida como anemia. LINKS http: //molmovdb. mbb. yale. edu/cgi-bin/morph. cgi? ID=96757 -5629 http: //milksci. unizar. es/bioquimica/temas/proteins/mioglobina. html

El Hierro – El Manganeso El hierro es un elemento fundamental para el buen funcionamiento del organismo. Y cuando falta, debido a una deficiencia en la alimentación, se produce la anemia. El hierro es necesario para la producción de la hemoglobina, una proteína que se encuentra en los glóbulos rojos, y cuya función es el transporte de oxígeno desde los pulmones hasta –todas las células del cuerpo. Los glóbulos rojos, para poder combinarse con el oxígeno, deben contener una cantidad suficiente de hemoglobina, y esto depende de los niveles de hierro que existan en el organismo. En los alimentos, el hierro se presenta bajo dos formas: uno que se denomina hem, presente en los productos de origen animal, y otro denominado no hem, que se encuentra en los vegetales. El manganeso, participa como cofactor en enzimas importantísimas, como la superoxido dismutasa, la RNA sintetasa, la piruvato cocarboxilasa, la arginasa. La superoxido dismutasa, contiene manganeso y es uno de los minerales más importantes para el organismo; su carencia provoca daños en el núcleo y en las mitocóndrias similares a los que produce el exceso de oxígeno. La tasa de superoxido dismutasa varía en las diferentes especies animales y es proporcional a la longevidad. Esta enzima cataliza la reacción 2 O 2 + H 2 = H 2 O 2. El manganeso está implicado en la síntesis del dna y del rna, (como cofactor de la dna sintetasa y de Ia rnasintetasa). Los diabéticos presentan con frecuencia bajos niveles de manganeso. Esto explica las alteraciones del recambio glucídico. Se han detectado altas dosis en los mineros de las minas de manganeso.

El Cobre El cobre como mineral se encuentra en todos los tejidos del cuerpo, es un importante componente de muchas enzimas del cuerpo. La más importante es la superóxido dismutasa citoplasmática que está asociada al zinc, otra enzima esencial es la ceruloplasmina. La síntesis de melatonina depende de una enzima que contiene cobre. El cobre participa en el metabolismo del colesterol, de la insulina y de las prostaglándinas. Buena parte del cobre se absorbe mediante el estómago y es transportado al hígado; la ceruloplasmina lo transporta desde el hígado a los tejidos; la excreción se produce por vía biliar. La carencia de cobre provoca retraso del crecimiento, anemia, falta de pigmentos en el cabello y en los tejidos, irritabilidad y retención hídrica, reduce las defensas inmunitarias. Existe una enfermedad hereditaria relacionada con el metabolismo del cobre: la enfermedad de Wilson. En esta enfermedad el hígado no es capaz de eliminar el cobre de cuerpo, el cobre se acumula en el hígado provocando cirrosis, el zinc y el molibdeno se utilizan para eliminar el exceso de cobre. Zinc y cobre compiten en la absorción, excesos de zinc pueden provocar una carencia de cobre, en carencia de zinc el cobre ejerce una acción prooxidante y acorta el tiempo de la lipoperoxidación de las ldl (lipoproteína de baja densidad). La superóxido dismutasa citoplasmática (cobre más zinc) está alterada en la artritis reumatoide, los individuos afectados por esta enfermedad tienen un mayor nivel de esta enzima.

El Magnesio El magnesio juega un papel crucial en el metabolismo de los seres vivos, de hecho, participa como coenzima en 350 enzimas. Desempeña un papel fundamental en el metabolismo de los lípidos, de los glúcidos y de las proteínas. Participa en la síntesis de ATP y lo estabiliza en el citoplasma. Preside los mecanismos de transporte iónico, permite la contracción muscular y la función de las bombas de las células. Su carencia determina astenia, nerviosismo, contracturas y muerte repentina. El magnesio también se usa para reducir de manera notable la mortalidad en casos de infarto agudo. Así mismo, recientes estudios han demostrado la importancia del magnesio para la prevención y terapia de la diabetes de segundo tipo. Se ha visto que cuanto más baja es la tasa de magnesio, más aumenta el riesgo de diabetes, esto se debe al hecho de que la carencia de magnesio reduce la sensibilidad de los receptores de membrana a la insulina. En la célula, el magnesio activa las bombas del sodio y del calcio que expulsan sodio y calcio fuera de la célula contra gradiente consumiendo grandes cantidades de energía. Por este motivo, el magnesio origina una actividad antiarrítmica. La carencia de magnesio es frecuente entre los alcohólicos y en las zonas donde los alimentos o el agua son pobres en magnesio. Hay tres grupos de síntomas de la carencia de magnesio: la carencia leve presenta irritabilidad, anorexia, cansancio, insomnio, calambres, apatía y confusión mental. Si la carencia se agrava encontraremos extrasistolia, aumento de la frecuencia cardiaca y aumento de la muerte repentina. La carencia grave se manifiesta mediante alucinaciones y delirio. La deficiencia de magnesio conlleva a nivel cardiaco, fibrosis, degeneración celular, necrosis y calcificación. El magnesio es vital para un funcionamiento óseo normal, ya que para la salud del hueso es necesaria una relación normal calcio/magnesio en los alimentos. En la hipertensión se ha observado una baja tasa de magnesio en la alimentación. En el síndrome premenstrual, los glóbulos rojos de las mujeres afectadas por este síndrome presentan una baja tasa de magnesio. En la litiasis renal, la carencia de magnesio provoca la formación de cálculos renales de calcio fosfato y de calcio oxalato. Durante el ejercicio físico, la carencia de magnesio produce un mayor consumo energético. Los atletas con baja introducción de magnesio presentan taquicardia y además consumen más energía para realizar el mismo trabajo. El magnesio, en el citoplasma participa en la síntesis de ATP, cada molécula del citoplasma celular de ADP y de ATP está conectada al magnesio que la estabiliza, y permite el uso en un momento de necesidad.

El Zinc Al zinc sólo el hierro lo supera en concentración en los tejidos. El zinc desempeña funciones importantes en los humanos: es necesario para las enzimas del crecimiento celular y además ejerce una importante función en el sistema inmunitario. El zinc juega un papel fundamental para agudizar sentidos como el gusto y el olfato; además participa en el metabolismo de los carbohidratos. Los síntomas de carencia de zinc son: retraso del crecimiento, ausencia de apetito, restablecimiento de las heridas más lento, pérdida del cabello, hipogonadismo en los varones; dificultad en la visión nocturna, alteración del gusto y del olfato. El zinc es poco tóxico, con fuertes introducciones se pueden producir diarrea, calambres abdominales y vómitos. El zinc participa como coenzima en la enzima de conversión y en la insulina, además es un cofactor de otras muchas enzimas entre las cuales la anidrasa carbónica, la fosfatasa alcalina y la lipoproteína de baja densidad (ldl). El zinc participa como coenzima en unas 200 enzimas, integrándose en el metabolismo de carbohidratos, grasas y proteínas. El zinc como parte de la enzima cobre zinc o superoxido dismutasa, protege las células de los radicales libres. El zinc es vital para las membranas celulares, para la formación del conectivo, y modula la acción de la hormona del crecimiento y desarrolla una acción importantísima en el sistema inmunitario y en el restablecimiento de las heridas. El zinc es necesario para la síntesis, la segregación y el empleo de la insulina e impide la destrucción de las células beta pancreáticas. La deficiencia de zinc durante el embarazo aumenta el riesgo de malformaciones, abortos espontáneos, y complicaciones para los neonatos. Un bajo nivel de zinc puede producir bajos niveles de testosterona e hipospermia, puede retrasar la pubertad y en los jóvenes se ha detectado que la restricción del zinc está asociada con un bajo nivel de testosterona.

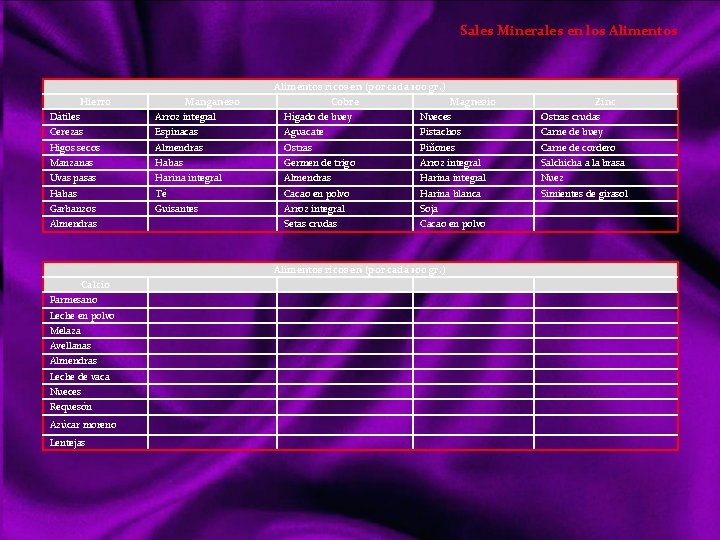
Sales Minerales en los Alimentos ricos en (por cada 100 gr. ) Hierro Manganeso Cobre Magnesio Zinc Dátiles Arroz integral Hígado de buey Nueces Ostras crudas Cerezas Espinacas Aguacate Pistachos Carne de buey Higos secos Almendras Ostras Piñones Carne de cordero Manzanas Habas Germen de trigo Arroz integral Salchicha a la brasa Uvas pasas Harina integral Almendras Harina integral Nuez Habas Té Cacao en polvo Harina blanca Simientes de girasol Garbanzos Guisantes Arroz integral Soja Setas crudas Cacao en polvo Almendras Alimentos ricos en (por cada 100 gr. ) Calcio Parmesano Leche en polvo Melaza Avellanas Almendras Leche de vaca Nueces Requesón Azúcar moreno Lentejas

b) Sales inorgánicas solubles en agua También el ion Mg+2 forma parte de las clorofilas y participa en los procesos de la fotosíntesis. El Ca+2, interviene en la contracción muscular y en los procesos relacionados con la coagulación de la sangre. Funciones osmóticas. Intervienen en la distribución del agua intra y extra celulares. Los iones Na+, K+, Cl , Ca+2, participan en la generación de gradientes electroquímicos, que son imprescindibles en el potencial de membrana y del potencial de acción en los procesos de la sinapsis neuronal, transmisión del impulso nervioso y contracción muscular Función tamponadora. Se lleva a cabo por los sistemas carbonato bicarbonato y monofosfato bifosfáto

El Calcio El calcio es el catión más difundido en el organismo, además, participa en la coagulación y en la estructura ósea. Es necesario para la contracción muscular y activa numerosas enzimas. El nivel de calcio sérico es de unos 10 mg. Mientras que en el interior de las células se encuentra en cantidades muy bajas en la relación 1/10000 con la tasa del plasma. Por lo tanto, las células vivientes están asediadas por el calcio, cuando el calcio intracelular aumenta masivamente se produce la muerte de la célula; cuando aumenta parcialmente se produce la isquemia. Nuestro cuerpo contiene 1200 gramos de calcio, el 99% está contenido en los huesos y los dientes. El papel fundamental del calcio en las células, es de regulador bioquímico intracelular. La concentración de los iones calcio en el citoplasma es muy baja (100 150 Nm), respecto a la del líquido extracelular (unos 2 2, 5 Mm ). Por lo tanto, este es el gradiente de membrana en condiciones fisiológicas para el calcio, excepto en los casos en los que exista daño o muerte celular. Numerosos sistemas requieren calcio para activarse. Dependen del calcio: la agregación plaquetaria, la división celular, el acoplamiento excitación / contracción y la secreción de hormonas y transmisores. El calcio entra en las células, atravesando la membrana celular mediante los canales del calcio, que se dividen en: canales L, canales T, canales N El núcleo celular contiene una gran cantidad de calcio, de ahí se versa en el citoplasma durante la contracción. Existe también un sistema de intercambio sodio calcio, mediante el cual se intercambian tres iones de sodio con un ión calcio, el sistema es bidireccional. Un aumento de la entrada del calcio mediante los canales L, contribuye a un aumento de las resistencias vasculares, porque induce vasoconstricción.

El Calcio y osteoporosis: buena parte del calcio del organismo está contenida en los huesos, unos 700 mgr de calcio se intercambian todos los días en los huesos de los adultos, por lo tanto si el aporte de calcio es insuficiente, considerando que la calcemia debe ser estable, el calcio necesario se extrae de los huesos, provocando la disminución del calcio óseo. Los huesos se vuelven tan porosos y frágiles que las fracturas son frecuentes. Las mujeres en el periodo de la post menopausia tienen un alto riesgo, debido a la carencia de estrógenos, y también los hombres ancianos. La osteoporosis tiene menos incidencia en los vegetarianos que en los carnívoros, debido a que el exceso de proteínas provoca calciuria. En la osteoporosis además de los suplementos de calcio es útil introducir magnesio en una relación de 2/1 calcio magnesio. Un exceso de fósforo alimentario puede provocar la pérdida de calcio. El fósforo se encuentra abundantemente en la carne, en algunos quesos y en algunos bebidas y por ello el consumo excesivo de estos alimentos puede provocar osteoporosis. En el organismo la tasa de calcio además que de la dieta, depende de hormonas y vitaminas. La parathormona es una hormona producida por las glándulas paratiroideas, que se encuentran debajo del polo inferior del tiroides, la parathormona humana está compuesta por 84 aminoácidos; el principal regulador de la síntesis y de la secreción de la parathormona es la tasa de calcio hemático. Apenas la calcemia desciende por debajo de los 9 mg/dl, se produce un incremento evidente de la síntesis de parathormona y la tasa del calcio hemático aumenta (mediante un aumento de la absorción intestinal de calcio y la movilidad ósea). Otra hormona que interviene en el metabolismo del calcio es la calcitonina. La calcitonina es un polipéptido de 32 aminoácidos, es sintetizada y segregada por las células parafoliculares del tiroides en el hombre; su nivel normal en la sangre es <20 pg/ml y los hombres poseen un 30% de esta sustancia más que las mujeres, a cualquier edad. Existe también una calcitonina sintética análoga a la calcitonina de salmón. El estímulo primario para la secreción de la calcitonina es el aumento del calcio sérico. La tasa de secreción de calcitonina es una función directa del nivel del calcio sérico superior a 9 mgr/dl. La calcitonina inhibe la reabsorción ósea y las células relacionadas con la reabsorción ósea.

El Sodio El sodio es un componente esencial de los líquidos extracelulares. El sodio desempeña importantes funciones como el mantenimiento de la presión osmótica, la protección del cuerpo de la pérdida excesiva de líquidos. Regula también la excitabilidad muscular y la permeabilidad de las membranas. Muchos pueblos usan cantidades muy reducidas de sal. Se aconseja una cantidad diaria de sodio que no sea superior a 2 g ni inferior a 500 mg. El exceso se traduce en un aumento de líquidos extracelulares, un aumento de las resistencias periféricas, del peso, y de los receptores de la angiotensina II. Provoca además, una disminución de capilares de hasta 2/3. El exceso, es una de las causas de la litiasis renal, de la osteoporosis y de la hipertensión. Una deficiencia de sodio puede surgir como consecuencia de una diarrea prolongada, de sudoración intensa, de intoxicación de agua debida a una gran introducción de agua, pero no de sal. Los hombres, se dividen en dos grupos: sensibles e insensibles al sodio; aproximadamente un tercio de la población es sensible al sodio, los ancianos se vuelven sensibles al sodio y los individuos melanodérmicos (negros) presentan una mayor sensibilidad al sodio. Los excesos de sodio provocan la excreción del calcio, que a su vez causa una reducida densidad ósea, aumentando el riesgo de osteoporosis (normalmente existe en todas las células un intercambio sodio calcio). Como ya se ha dicho anteriormente, a una fuerte introducción de sodio sigue una fuerte excreción de calcio urinario, el efecto hipertensivo del sodio aumenta cuando la introducción de calcio es baja. Una dieta sin sal añadida es suficiente para cubrir las necesidades de sodio, (una introducción de 500 mgr de sodio al día se considera adecuada). Los atletas y las mujeres embarazadas tienen una necesidad mayor de sodio.

El Potasio El potasio es el principal catión de los líquidos intracelulares. Desempeña un papel fundamental en el potencial de membrana, en el equilibrio ácido/base y en la presión osmótica. Es determinante en el metabolismo de los azúcares y de las enzimas de la glicolisis, necesarias para la síntesis de ATP. Se ha comprobado un aumento de hemorragias cerebrales e infartos en las poblaciones cuya alimentación tiene un bajo contenido de potasio. El potasio es muy frecuente en la naturaleza pero el abono, la cocción y el refinado, reducen el contenido celular, una dieta pobre en fruta y verdura reducen la introducción en el organismo de este mineral. El potasio es esencial para el equilibrio del agua en el organismo, para la contracción muscular, para la balanza ácido alcalina, para la transmisión del impulso nervioso, para el metabolismo energético, para el metabolismo de las proteínas y de los azúcares, para la salud del corazón y de los vasos. La deficiencia de potasio puede provocar hipertensión, hemorragia cerebral, extrasistolia y paro cardiaco por fibrilación ventricular. Los efectos tóxicos consisten en debilidad muscular, úlceras, baja presión arterial y en casos graves coma o paro cardiaco. Los pacientes con ulcera e insuficiencia renal no deben asumir suplementos de potasio. El cuerpo contiene una media de 140 gr de potasio. Éste, desempeña una acción fundamental en la síntesis de las proteínas y en la conversión del azúcar en glicógeno. El potasio activa un gran número de enzimas, particularmente aquellas conectadas con la producción de energía (la más importante es la fosfofructoquinasa). Entre los síntomas de la hipokalemia se encuentran la astenia, el vómito, la baja presión arterial y el coma. Las causas más frecuentes son una dieta rica en sodio, intervenciones en el intestino, diabetes, síndrome de Cushing, enfermedades renales, dietas inadecuadas, ayunos prolongados, anorexia nerviosa, etc. Numerosos fármacos pueden provocar hipokalemia: diuréticos tiacídicos, cortisona, laxantes, regaliz, insulina, infusiones de glucosa sin potasio. La depleción de potasio provoca mayor retención hídrica con un exceso de sal porque el potasio es hidrófobo; altas dosis de potasio pueden incrementar la eliminación de sodio y por lo tanto reducir el volumen de sangre y presión arterial.

El Potasio Aumentar la introducción de alimentos ricos en potasio puede llevar a un descenso de los valores de presión. La relación entre potasio y sodio es fundamental para la regulación de la presión arterial. La dieta de los países occidentales es demasiado rica en sodio y pobre en potasio. El potasio se elimina fácilmente con la cocción de los alimentos. La dosis diaria aconsejada en Australia varía de 1950 mgr a 5460 mgr. La dosis tóxica es superior a 18 gr diarios y puede provocar baja presión arterial, confusión mental y paro cardiaco. Hay que recordar que todos los seres vivientes (excluido el llamado hombre civilizado) siguen una dieta hiperpotásica. El potasio protege el aparato cardiovascular de numerosas maneras: reduciendo los radicales libres, modulando la proliferación de las células musculares lisas, la agregación de las plaquetas y la coagulación de la sangre. Se utilizan suplementos de potasio para las arritmias cardiacas y para la prevención de cálculos renales, sobretodo de calcio oxalato. El potasio se encuentra en grandes cantidades en la fruta, en la verdura cruda, en las legumbres y en los cereales integrales. El contenido de potasio varía según los alimentos, en relación parcial con el contenido de azúcar en los alimentos. (Debemos recordar también que el potasio estimula la secreción de insulina. )

Los Cloruros Los cloruros son compuestos que llevan un átomo de cloro en estado de oxidación formal 1. Por lo tanto corresponden al estado de oxidación más bajo de este elemento ya que tiene completado la capa de valencia con ocho electrones. Los cloruros inorgánicos contienen el anión Cl 1 y por lo tanto son sales del ácido clorhídrico (HCl). Se suele tratar de sustancias sólidas incoloras con elevado punto de fusión. podríamos decir que en algunos casos el cloro también se considera como un catión ya que contienen también pequeños iones con carga positiva. En algunos casos el enlace con el metal puede tener cierto carácter covalente. Esto se nota por ejemplo en el cloruro de mercurio (II) (Hg. Cl 2) que sublima a temperaturas bastante bajas. El cloruro de hierro (III) (Fe. Cl 3) igualmente muestra cierto carácter covalente. Así puede ser extraído de una disolución con elevada concentración de cloruro con éter y sin presencia de agua de cristalización sublima a elevadas temperaturas. La mayor parte de los cloruros con excepción principalmente del cloruro de mercurio (I) (Hg 2 Cl 2), el cloruro de plata (Ag. Cl), el cloruro de talio (I) (Tl. Cl) y el cloruro de plomo (II) (Pb. Cl 2) son bastante solubles en agua. En presencia de oxidantes fuertes (permanganato, bismutato, agua oxigenada, hipoclorito etc. ) los cloruros pueden ser oxidados a cloro elemental. Esta oxidación se puede llevar también a cabo por electrólisis. De hecho la electrólisis del cloruro sódico en disolución es el método más empleado para obtener este elemento además de hidróxido de sodio.

El Cloruro de Sodio (Na. Cl). Sal esencial para la vida en la Tierra. La mayoría de los tejidos biológicos y fluidos corporales contienen variadas concentraciones de cloruro de sodio. La cantidad de iones de sodio en la sangre está directamente relacionada con la regulación de los niveles de fluidos corporales. La propagación de los impulsos nerviosos mediante una transducción de señales es mediada por estos iones. La llamada solución fisiológica, solución del 0, 9% de cloruro de sodio, recibe su nombre porque es isotónica con el plasma sanguíneo. Esta solución fisiológica es el sostén principal de terapias médicas de reemplazo de fluidos, para la deshidratación o para prevenir shocks hipovolémicos (bajo volumen sanguíneo). Los humanos presentan la particularidad entre los primates de eliminar grandes cantidades de sal cuando sudan. Links http: //web. educastur. princast. es/proyectos/biogeo_ov/Animaciones/Indice_anim. htm

Carbonato - Bicarbonato Como hemos dicho antes , la vida se desarrolla en valores próximos a la neutralidad, por eso, los seres vivos necesitan que el PH de sus fluidos no cambie bruscamente. Un cambio en el PH de un animal, podría acarrear la desestabilización de sus moléculas orgánicas, o de sus reacciones celulares y metabólicas, o la respiración. Por ello, los seres vivos cuentan con unos sistemas que ayudan a regular el PH, son moléculas que actúan dando o quitando iones ''H '' con lo cual, hasta cierto limite, pueden manejar su PH correctamente. Estos sistemas reciben el nombre de Buffer, Sistemas Tampón o amortiguadores de PH, son disoluciones que están compuestas por el ión común de un ácido débil o una base débil. Y el mismo ión común en una sal conjugada, ambos componentes deben de estar presentes. Las dos moléculas más utilizadas por la vida son El Tampón Carbonato/Bicarbonato, que se encuentra fuera de la célula, y el Tampón Fosfato, que se encuentra dentro de ella. HCO 3 = Bicarbonato H = Iones Hidrógeno H 2 CO 3 = Ácido Carbónico CO 2 = Dióxido de Carbono H 2 O = Agua Bien, esto es un ciclo, va tanto en sentido descendente, como ascendente. Si tenemos el PH de nuestro estomago en 4, tenemos ''Acidez'', es decir, tenemos en los fluidos una gran concentración de Iones ''H '‘, al ingerir Bicarbonato, se une con los iones H , y se forma el escalón, Ácido Carbónico. Ya hemos conseguido subir el PH, pero ahora tenemos excedente de Ácido Carbónico, que ''rompemos'' en CO 2 eliminado en la respiración, y en H 2 O, agua. ¿Que es lo que ocurre si tenemos el PH en 9? Nuestra concentración de Alcohol es muy alta, y para eliminarlo, lo mezclamos con los pocos ''H '' que nos quedan y formamos agua. . . con lo que conseguimos bajar el PH. Pero la ausencia del ión ''H '' la suplimos ''rompiendo'' Ácido Carbónico. Que nos da bicarbonato. . . e iones ''H '', todo en un eterno equilibrio en los organismos.

LA ATMOSFERA La atmósfera terrestre es la capa gaseosa que rodea a la Tierra. Protege la vida de la Tierra absorbiendo en la capa de ozono parte de la radiación solar ultravioleta, reduciendo las diferencias de temperatura entre el día y la noche Troposfera: 0 8/16 km, la temperatura disminuye con la altitud. Estratosfera: 8/16 50 km, la temperatura permanece constante para después aumentar con la altitud. Mesosfera: 50 80/85 km, la temperatura disminuye con la altitud. Termosfera o Ionosfera: 80/85 500 km, la temperatura aumenta con la altitud. Exosfera: 500 1500/2000 km Las capas más importantes para el análisis de la contaminación atmosférica son las dos capas más cercanas a la Tierra: la troposfera y la estratosfera. El aire de la troposfera es el que interviene en la respiración y está compuesto por un 78, 08% de nitrógeno (N 2), un 20, 95% de oxígeno (O 2), un 0, 035% de dióxido de carbono (CO 2) y un 0, 94% de gases inertes como el argón y el neón. En esta capa se encuentran las nubes y casi todo el vapor de agua. Allí se producen todos los fenómenos atmosféricos que originan el clima. Más arriba, aproximadamente a 25 kilómetros de altura, en la estratosfera, se encuentra la importante capa de ozono que protege a la Tierra de los rayos ultravioletas (UV). En relación a esto, vale la pena recordar que, en términos generales, un contaminante es una substancia que está "fuera de lugar", y que un buen ejemplo de ello puede ser el caso del gas ozono (O 3). Cuando este gas se encuentra en el aire que se respira, esdecir, bajo los 25 kilómetros de altura habituales , es un contaminante que tiene un efecto dañino para la salud.

ALGUNOS GASES Dentro de las biomoléculas inorgánicas gaseosas que se estudiarán en este curso, se encuentran las que juegan un papel más relevante en la materia viva, a saber, el oxigeno, el dióxido de carbono y el nitrógeno. El Oxigeno El oxígeno es el elemento químico de número atómico 8 y símbolo O. En su forma molecular más frecuente, O 2, es un gas a temperatura ambiente. Representa aproximadamente el 21% en volumen de la composición de la atmósfera terrestre. Es uno de los elementos más importantes de la química orgánica y participa de forma muy importante en el ciclo energético de los seres vivos, esencial en la respiración celular de los organismos aeróbicos. Es un gas incoloro, inodoro e insípido. En su forma molecular formada por tres átomos de oxígeno, O 3, denominada ozono, existente en la atmósfera protege a la Tierra de la incidencia de radiación ultravioleta procedente del Sol. Un átomo de oxígeno combinado con dos de hidrógeno forman una molécula de agua. En condiciones normales de presión y temperatura, el oxígeno se encuentra en estado gaseoso formando moléculas diatómicas (O 2) que a pesar de ser inestables se generan durante la fotosíntesis de las plantas y son posteriormente utilizadas por los animales en la respiración. El oxígeno respirado por los organismos aerobios, liberado por la plantas mediante la fotosíntesis, participa en la conversión de nutrientes en energía (ATP). Su disminución provoca hipoxemia y la falta total de él anoxia pudiendo provocar la muerte del organismo.

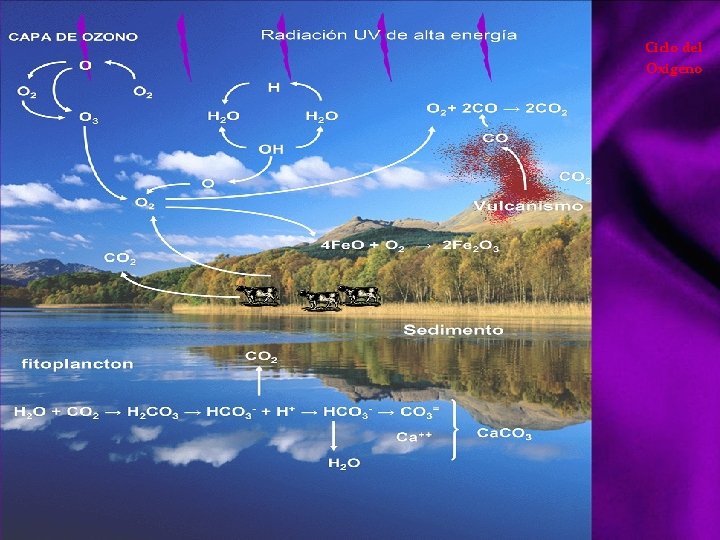
Ciclo del Oxigeno El ciclo del oxígeno es la cadena de reacciones y procesos que describen la circulación del oxígeno en la biosfera terrestre. El oxígeno es el elemento más abundante en la corteza terrestre y los océanos, y el segundo en la atmósfera. En la corteza terrestre la mayor parte del oxígeno se encuentra formando por parte de silicatos y en los océanos se encuentra formando por parte de la molécula de agua, H 2 O. En la atmósfera se encuentra como oxígeno diatómico, oxígeno molecular (O 2), dióxido de carbono (CO 2), y en menor proporción en otras moléculas como monóxido de carbono (CO), ozono (O 3), dióxido de nitrógeno (NO 2), monóxido de nitrógeno (NO), dióxido de azufre (SO 2), etc. En la atmósfera el O 2 le confiere un carácter oxidante. Se forma por fotólisis de H 2 O (disociación de moléculas orgánicas complejas por efecto de la luz), formándose H 2 y O 2: 2 H 2 O + hν → O 2 +2 H 2 (hν, radiación ultra violeta) El O 3 se forma a partir de O 2 por interacción con radiación ultravioleta, y parte del ozono formado vuelve a dar oxígeno: 3 O 2 + hν → 2 O 3 + hν' → O 2 + O La parte de radiación ultravioleta que es absorbida no llega a la superficie terrestre haciendo que la temperatura del planeta sea más baja. Un ciclo biogeoquímico es el movimiento de un sustancia química a través de los depósitos de la litosfera (la rocas, los sedimentos y los suelos), la atmósfera (los gases), la hidrosfera (los océanos, los lagos y los ríos) y la biosfera (las plantas y animales). El oxígeno molecular (O 2) representa el 20% de la atmósfera terrestre. Este oxígeno abastece las necesidades de todos los organismos terrestres que lo respiran para su metabolismo, además cuando se disuelve en agua, cubre las necesidades de los organismos acuáticos. En el proceso de la respiración, el oxígeno actúa como aceptor final para los electrones retirados de los átomos de carbono de los alimentos, siendo el producto agua.

Ciclo del Oxigeno El ciclo se completa en la fotosíntesis cuando se captura la energía de la luz para alejar los electrones respecto a los átomos de oxígeno de las moléculas de agua. Los electrones reducen los átomos de carbono (de dióxido de carbono) a carbohidratos. Al final se produce oxígeno molecular y así se completa el ciclo. Por cada molécula de oxígeno utilizada en la respiración celular, se libera una molécula de dióxido de carbono. Inversamente, por cada molécula de dióxido de carbono absorbida en la fotosíntesis, se libera una molécula de oxígeno. El oxígeno molecular presente en la atmósfera y el disuelto en el agua intervienen en muchas reacciones de los seres vivos. En la respiración celular se reduce oxígeno para la producción de energía, generándose dióxido de carbono, y en el proceso de fotosíntesis se origina oxígeno y energía, a partir de agua y radiación solar.

Ciclo del Oxigeno

El Dióxido de Carbono El dióxido de carbono (CO 2), es un gas cuya molécula está compuesta por dos átomos de oxígeno y uno de carbono. Es una molécula lineal y no polar, a pesar de tener enlaces polares, esto se debe a la hibridación del Carbono la molécula posee una geometría lineal y simétrica. Efecto Invernadero El dióxido de carbono es uno de los gases de efecto invernadero (G. E. I. ) que contribuye a que la Tierra tenga una temperatura habitable, siempre y cuando se mantenga dentro de un rango determinado. Sin dióxido de carbono, la Tierra sería un bloque de hielo. Por otro lado, un exceso de dióxido de carbono acentúa el fenómeno conocido como efecto invernadero, reduciendo la emisión de calor al espacio y provocando un mayor calentamiento del planeta. En los últimos años la cantidad de dióxido de carbono ha aumentado considerablemente y eso contribuye al calentamiento global del planeta

Ciclo del Carbono El ciclo del carbono comprende, en primer lugar, un ciclo biológico donde se producen intercambios de carbono (CO 2) entre los seres vivos y la atmósfera. La retención del carbono se produce a través de la fotosíntesis de las plantas, y la emisión a la atmósfera, a través de la respiración animal y vegetal. Este proceso es relativamente corto y puede renovar el carbono de toda la tierra en 20 años. En segundo lugar, tenemos un ciclo biogeoquímico más extenso que el biológico y que regula la transferencia entre la atmósfera, los océanos y el suelo (litosfera). El CO 2 emitido a la atmósfera, si supera al contenido en los océanos, ríos, etc. es absorbido con facilidad por el agua convirtiéndose en ácido carbónico. Este ácido influye sobre los silicatos que constituyen las rocas y se producen los iones bicarbonato. Los iones bicarbonato son asimilados por los animales acuáticos en la formación de sus tejidos. Una vez que estos seres vivos mueren quedan depositados en los sedimentos de los fondos marinos. Finalmente, el CO 2 vuelve a la atmósfera durante las erupciones volcánicas al fusionarse en combustión las rocas con los restos de los seres vivos. En algunas ocasiones la materia orgánica queda sepultada sin producirse el contacto entre ésta y el oxígeno lo que evita la descomposición y a través de, la fermentación, provoca la transformación de esta materia en carbón, petróleo y gas natural.

El Nitrógeno Elemento químico (N) en condiciones normales forma un gas diatómico (nitrógeno diatómico o molecular) que constituye el 78% del aire atmosférico. La más importante aplicación comercial del nitrógeno es la obtención de amoníaco empleándolo posteriormente en la fabricación de fertilizantes y ácido nítrico. Las sales del ácido nítrico incluyen el nitrato de potasio (nitro o salitre empleado en la fabricación de pólvora) y el nitrato de amonio fertilizante. El nitrógeno es el componente principal de la atmósfera terrestre (78, 1% en volumen) y se obtiene para usos industriales de la destilación del aire líquido. Está presente también en restos de animales, por ejemplo el guano, usualmente en la forma de urea, ácido úrico y compuestos de ambos. También ocupa el 3% de la composición elemental del cuerpo humano. El nitrógeno es componente esencial de los aminoácidos y los ácidos nucleicos, vitales para la vida. Las legumbres son capaces de absorber el nitrógeno directamente del aire, siendo éste transformado en amoníaco y luego en nitrato por bacterias que viven en simbiosis con la planta en sus raíces. El nitrato es posteriormente utilizado por la planta para formar el grupo amino de los aminoácidos de las proteínas que finalmente se incorporan a la cadena trófica. Los fertilizantes nitrogenados son una importante fuente de contaminación del suelo y de las aguas. Los compuestos que contienen iones de cianuro forman sales extremadamente tóxicas y son mortales para numerosos animales, entre ellos mamíferos.

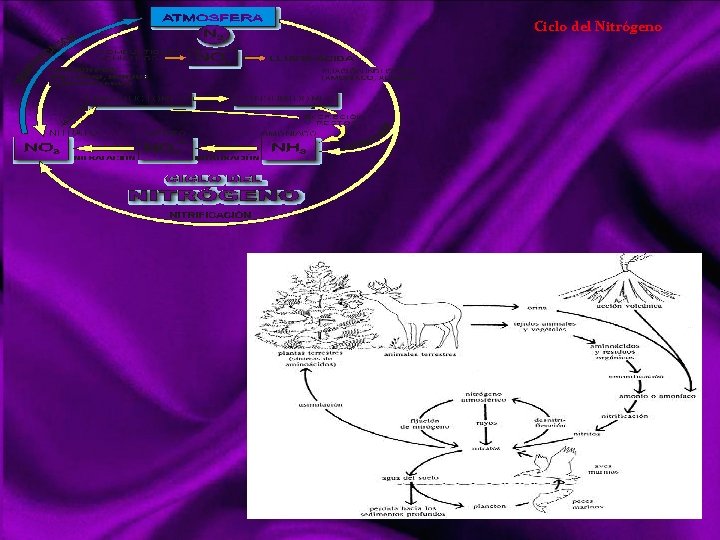
Ciclo del Nitrógeno Es uno de los ciclos biogeoquímicos importantes en que se basa el equilibrio dinámico de composición de la biosfera. Es bastante más complejo que el del carbono, dado que está presente en la atmósfera no sólo como N 2 (80%) sino también en una gran diversidad de compuestos. Se puede encontrar principalmente como N 2 O, NO y NO 2, los llamados NOx. También forma otras combinaciones con oxígeno tales como N 2 O 3 y N 2 O 5 (anhídridos), "precursores" de los ácidos nitroso y nítrico. Con hidrógeno forma amoníaco (NH 3), compuesto gaseoso en condiciones normales. Los seres vivos cuentan con una proporción de nitrógeno en su composición. Éste se encuentra en el aire en grandes cantidades (78% en volumen) pero en esta forma sólo es accesible a un conjunto muy restringido de formas de vida, como las cianobacterias y las azotobacteriáceas. Los organismos autótrofos requieren típicamente un suministro de nitrógeno en forma de nitrato (NO 3–), mientras que los heterótrofos lo necesitan en forma de grupos amino ( NH 2), y lo toman formando parte de la composición de distintas biomoléculas en sus alimentos. Los autótrofos reducen el nitrógeno oxidado que reciben como nitrato (NO 3–) a grupos amino, reducidos (asimilación). Para volver a contar con nitrato hace falta que los descomponedores lo extraigan de la biomasa dejándolo en la forma reducida de ion amonio (NH 4+), proceso que se llama amonificación; y que luego el amonio sea oxidado a nitrato, proceso llamado nitrificación. Para poder cerrar el ciclo biológico esencial y mantener la cantidad de nitrógeno necesario en la atmósfera se necesitan dos procesos paralelos y simultáneos, en los que está implicado el nitrógeno atmosférico (N 2). Se trata de la fijación de nitrógeno, en la que se originan compuestos solubles a partir del N 2, y la desnitrificación, una forma de respiración anaerobia que devuelve N 2 a la atmósfera.

Ciclo del Nitrógeno La fijación de nitrógeno es la conversión del nitrógeno del aire (N 2) a formas distintas susceptibles de incorporarse a la composición del suelo o de los seres vivos, como el ión amonio (NH 4+), nitrito (NO 2–), o nitrato (NO 3–); y también su conversión a sustancias atmosféricas químicamente activas, como el dióxido de nitrógeno (NO 2), que reaccionan fácilmente para originar alguna de las anteriores. Fijación abiótica. puede ocurrir por procesos químicos espontáneos. Fijación biológica de nitrógeno, la realizan tres grupos de microorganismos (diazotrofos): Bacterias gramnegativas de vida libre en el suelo, Bacterias simbióticas de algunas plantas, y Cianobacterias de vida libre o simbiótica. La amonificación es la conversión amonio del nitrógeno que en la materia viva aparece principalmente como grupos amino ( NH 2) o imino ( NH ). La nitrificación es la oxidación biológica del amonio a nitrato por microorganismos aerobios que usan el oxígeno molecular (O 2) como receptor de electrones. Nitrosación. Partiendo de amonio se obtiene nitrito (NO 2–). Lo realizan bacterias. Nitratación. Partiendo de nitrito se produce nitrato (NO 3–). Lo realizan bacterias. La combinación de amonificación y nitrificación devuelve a una forma asimilable por las plantas, el nitrógeno que ellas tomaron del suelo y pusieron en circulación por la cadena trófica. La desnitrificación es la reducción del ión nitrato (NO 3–), presente en el suelo o el agua, a nitrógeno molecular o diatómico (N 2). El proceso sigue los siguientes pasos: nitrato → nitrito → óxido nítrico → óxido nitroso → nitrógeno molecular 2 NO 3 + 10 e + 12 H+ → N 2 + 6 H 2 O la desnitrificación es fundamental para que el nitrógeno vuelva a la atmósfera. Sin él la fijación de nitrógeno, abiótica y biótica, habría terminado por provocar la depleción (eliminación) del N 2 atmosférico.

Ciclo del Nitrógeno

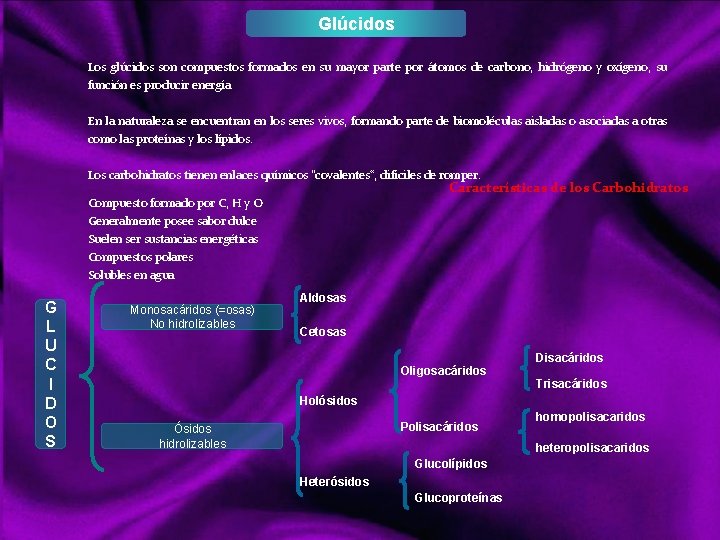
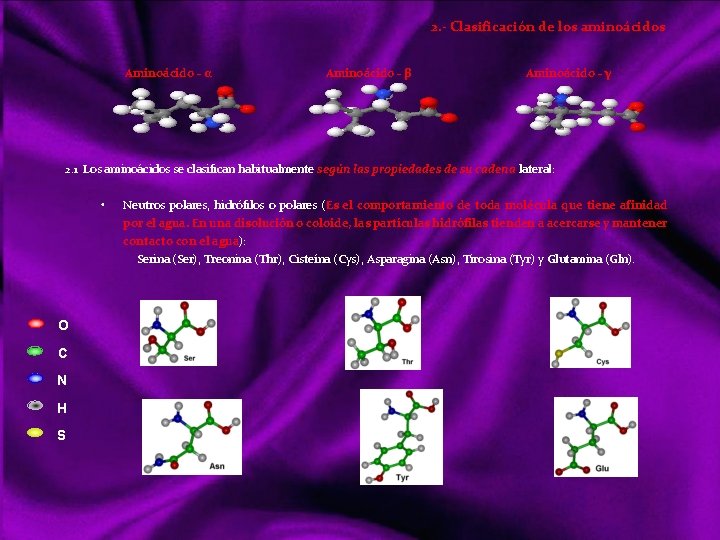
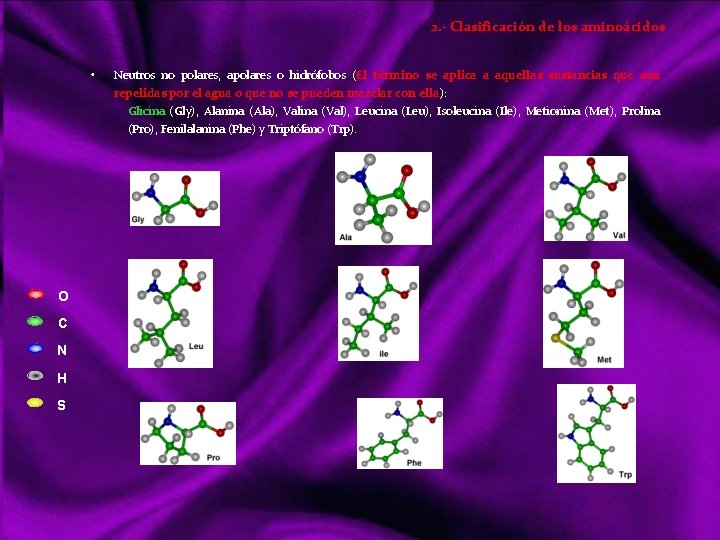
Glúcidos Los glúcidos son compuestos formados en su mayor parte por átomos de carbono, hidrógeno y oxígeno, su función es producir energía. En la naturaleza se encuentran en los seres vivos, formando parte de biomoléculas aisladas o asociadas a otras como las proteínas y los lípidos. Los carbohidratos tienen enlaces químicos "covalentes“, difíciles de romper. Características de los Carbohidratos Compuesto formado por C, H y O Generalmente posee sabor dulce Suelen ser sustancias energéticas Compuestos polares Solubles en agua G L U C I D O S Monosacáridos (=osas) No hidrolizables Aldosas Cetosas Disacáridos Oligosacáridos Trisacáridos Holósidos Polisacáridos Ósidos hidrolizables homopolisacaridos heteropolisacaridos Glucolípidos Heterósidos Glucoproteínas

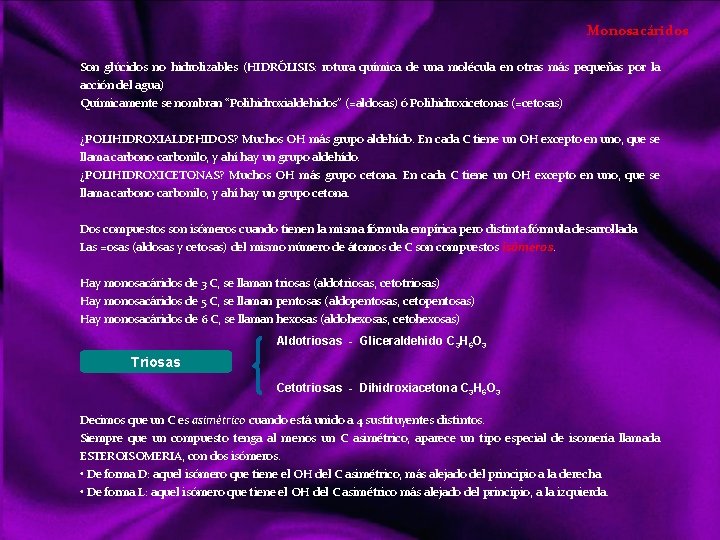
Monosacáridos Son glúcidos no hidrolizables (HIDRÓLISIS: rotura química de una molécula en otras más pequeñas por la acción del agua) Químicamente se nombran “Polihidroxialdehidos” (=aldosas) ó Polihidroxicetonas (=cetosas) ¿POLIHIDROXIALDEHIDOS? Muchos OH más grupo aldehído. En cada C tiene un OH excepto en uno, que se llama carbono carbonilo, y ahí hay un grupo aldehído. ¿POLIHIDROXICETONAS? Muchos OH más grupo cetona. En cada C tiene un OH excepto en uno, que se llama carbono carbonilo, y ahí hay un grupo cetona. Dos compuestos son isómeros cuando tienen la misma fórmula empírica pero distinta fórmula desarrollada. Las =osas (aldosas y cetosas) del mismo número de átomos de C son compuestos isómeros. Hay monosacáridos de 3 C, se llaman triosas (aldotriosas, cetotriosas) Hay monosacáridos de 5 C, se llaman pentosas (aldopentosas, cetopentosas) Hay monosacáridos de 6 C, se llaman hexosas (aldohexosas, cetohexosas) Aldotriosas - Gliceraldehido C 3 H 6 O 3 Triosas Cetotriosas - Dihidroxiacetona C 3 H 6 O 3 Decimos que un C es asimétrico cuando está unido a 4 sustituyentes distintos. Siempre que un compuesto tenga al menos un C asimétrico, aparece un tipo especial de isomería llamada ESTEROISOMERIA, con dos isómeros. • De forma D: aquel isómero que tiene el OH del C asimétrico, más alejado del principio a la derecha • De forma L: aquel isómero que tiene el OH del C asimétrico más alejado del principio, a la izquierda.

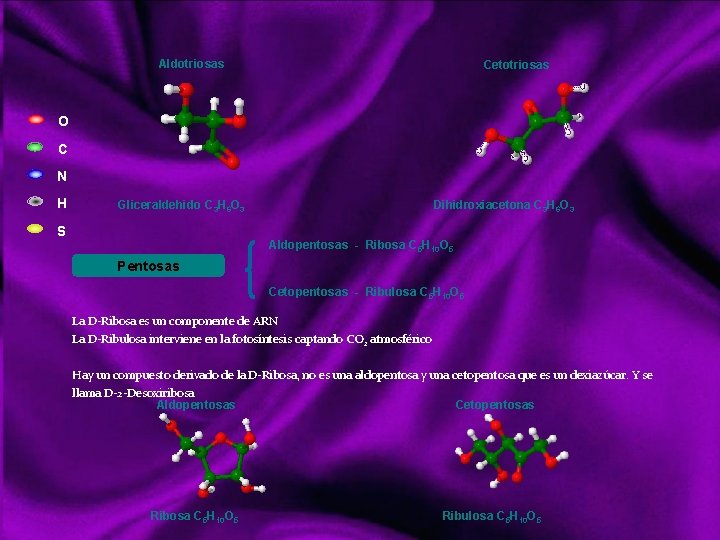
Aldotriosas Cetotriosas O C N H Gliceraldehido C 3 H 6 O 3 S Dihidroxiacetona C 3 H 6 O 3 Aldopentosas - Ribosa C 5 H 10 O 5 Pentosas Cetopentosas - Ribulosa C 5 H 10 O 5 La D Ribosa es un componente de ARN La D Ribulosa interviene en la fotosíntesis captando CO 2 atmosférico Hay un compuesto derivado de la D Ribosa, no es una aldopentosa y una cetopentosa que es un dexiazúcar. Y se llama D 2 Desoxiribosa Aldopentosas Cetopentosas Ribosa C 5 H 10 O 5 Ribulosa C 5 H 10 O 5

Monosacáridos Aldohexosas - Glucosa - Galactosa - Manosa Hexosas Cetohexosas - Fructosa • GLUCOSA – monosacárido más abundante, es el azúcar de la sangre (la única) y el azúcar de algunas frutas. • GALACTOSA – es un componente de la lactosa. • FRUCTOSA – es el azúcar de todas las frutas. Normalmente los monosacáridos se hallan ciclados, gracias a la formación de un puente de oxígeno (que sacas de la fórmula) entre el C carbonilo y el penúltimo de la cadena lineal En la forma ciclada, aparece un nuevo C asimétrico que se denomina C ANOMÉRICO, que determina la aparición de 2 anómeros. El anómero , en el cuál, el OH del C anomérico está por debajo del plano del ciclo. El anómero , el OH del C anomérico está por encima del plano del ciclo. Aldohexosas Cetohexosas O C N H S Glucosa C 6 H 12 O 6 Fructosa C 6 H 12 O 6

Ósidos Los Ósidos son Glúcidos formados por varios monosacáridos. La unión de monosacáridos se realiza a través de un enlace especial que libera una molécula de agua y que se llama enlace O glucosídico, ya que un monosacárido se une al siguiente a través de un Oxígeno Son aquellos que están constituidos por 2 o más monosacáridos que pueden ir o no acompañados de otras sustancias. El compuesto que reacciona con el monosacárido recibe el nombre de aglicona. Se subdividen en Holósidos y Heterósidos Los Holósidos : Cuando la aglicona es otro monosacárido, el glicósido resultante recibe el nombre de holósido, quedando constituidos solo por monosacáridos. *Oligosacáridos. Aquellos que poseen de 2 a 10 monosacáridos, siendo los más importantes los disacáridos. *Polisacáridos: Constituidos por más de 10 monosacáridos: Homopolisacáridos: unión del mismo monosacárido Heteropolisacáridos: unión de diferentes monosacáridos. Los Heterósidos: están formados por monosacáridos y otras moléculas distintas a los Glúcidos (no glucídicas), como pueden ser lípidos, que forman glucolípidos, o prótidos, que pueden formar glucoproteinas, entre otros. En general los glúcidos de bajo peso molecular son dulces en agua, mientras que los de alto peso molecular no son dulces ni solubles en agua.

Oligosacáridos Desde principios de este siglo sabemos que las células tienen cierta capacidad de reconocerse entre sí. Los espermatozoides distinguen a los ovocitos de su misma especie, las hormonas reconocen sus células blanco. . . O En los años sesenta se llegó a la conclusión de que las moléculas responsables de este reconocimiento eran los oligosacáridos superiores, presentes en las envolturas celulares, ligados a lípidos y proteínas. C N H S Inulina Los oligosacáridos son polímeros de monosacáridos con un número de unidades monoméricas entre 2 y 10. Los oligosacáridos más presentes en la naturaleza son la inulina, la oligofructosa (fructooligosacáridos) y los galactooligosacáridos. La inulina y oligofructosa están formados por cadenas de fructosa que pueden terminar en glucosa o fructosa. Están presentes en muchos vegetales: achicoria, cebolla, puerro, ajo, plátano, alcachofa, etc. . Los galactooligosacáridos están formados por cadenas de galactosa y están presentes en la leche y en algunas plantas. Los oligosacáridos forman parte de los glucolípidos y glucoproteínas que se encuentran en la superficie externa de la membrana plasmática y por lo tanto tienen una gran importancia en las funciones de reconocimiento celular.

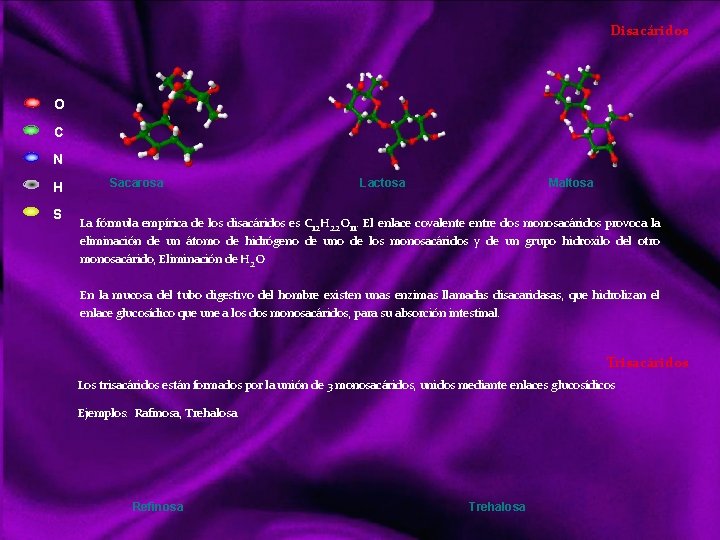
Disacáridos Son oligosacáridos formados por dos monosacáridos. Son solubles en agua, dulces y cristalizables. Pueden hidrolizarse y ser reductores cuando el carbono anomérico de alguno de sus componentes no está implicado en el enlace entre los dos monosacáridos. La capacidad reductora de los glúcidos se debe a que el grupo aldehído o cetona puede oxidarse dando un ácido. Son glúcidos hidrolizables, formado por monosacáridos (HOLÓSIDOS), concretamente por 2 monosacáridos unidos entre sí a través de un enlace O glucosídico, mono o dicarbonílico, con desprendimiento de una molécula de H 2 O. Los enlaces O glucosídico pueden ser mono dicarbonílico, también pueden ser α ó β en función del OH hemiacetal. Los disacáridos más comunes son: Sacarosa: Formada por la unión de una glucosa y una fructosa. A la sacarosa se le llama también azúcar común. Lactosa: Formada por la unión de una glucosa y una galactosa. Es el azúcar de la leche. Maltosa, Isomaltosa, Trehalosa, Celobiosa: Formadas todas por la unión de dos glucosas, son diferentes dependiendo de la unión entre las glucosas.

Disacáridos O C N H S Sacarosa Lactosa Maltosa La fórmula empírica de los disacáridos es C 12 H 22 O 11. El enlace covalente entre dos monosacáridos provoca la eliminación de un átomo de hidrógeno de uno de los monosacáridos y de un grupo hidroxilo del otro monosacárido, Eliminación de H 2 O En la mucosa del tubo digestivo del hombre existen unas enzimas llamadas disacaridasas, que hidrolizan el enlace glucosídico que une a los dos monosacáridos, para su absorción intestinal. Trisacáridos Los trisacáridos están formados por la unión de 3 monosacáridos, unidos mediante enlaces glucosídicos Ejemplos: Rafinosa, Trehalosa. Refinosa Trehalosa

Polisacaridos Glúcidos hidrolizables (ósidos), formados sólo por monosacáridos, en concreto por muchos a través de enlaces O glucosídicos. TIPOS: • Polimetizado (repetidos sucesivamente) en forma , son fáciles de hidrolizar ya que los sv poseemos enzimas para romper los enlaces O glucosídicos. Todo polisacárido polimerizado en forma tiene una función energética. • Polimetizados en forma , son difíciles de hidrolizar porque normalmente no poseemos enzimas para degradar esos enlaces. Son estructurales, dan soporte. O EJEMPLOS: • Almidón: polímero de D glucosa, al ser , tiene función energética, es de origen exclusivamente vegetal. La enzima que hidroliza el almidón se llama AMILASA, y está en todos los sv. Es producido en la fotosíntesis, en los cloroplastos. • Glucógeno: polímero de D glucosa, = energética. Su origen es exclusivamente animal, es fabricado en los músculos y en el hígado. Representa una reserva de glucosa. • Celulosa: polímero de D glucosa, = estructura, forma parte de todas las paredes celulares de todas las células vegetales. La enzima que hidroliza la celulosa se llama CELULASA y es muy rara en los sv. Únicamente la poseen algunos protozoos. • Quitina: es un polímero de N acetil glucosamina, = estructural, es el compuesto nitrogenado más abundante en la naturaleza, forma parte de la pared celular de hongos. Y sobretodo forma el exoesqueleto de artrópodos (invertebrados con patas articuladas) [cangrejo] C N H S Celulosa

Heteróxidos HETERÓSIDOS Comúnmente conocidos también como GLUCÓSIDOS. Glúcidos hidrolizables formados por monosacáridos y otras sustancias llamada AGLICÓN o GENINA. Dependiendo de la naturaleza del aglucón hay diversos tipos de heteróxidos. Ejemplos: Digitalina: utilizada en el tratamiento de enfermedades vasculares; antocianósidos, responsables del color de las flores. Tanósidos; de propiedades astringentes. Estreptomicina; antibiótico. Nucleotidos derivados de la ribosa, como la desoxirribosa que forman los ácidos nucleicos. Los Heterósidos: están formados por monosacáridos y otras moléculas distintas a los Glúcidos (no glucídicas), como pueden ser lípidos, que forman glucolípidos, o prótidos, que pueden formar glucoproteinas, entre otros. • GLUCOLÍPIDOS: son los que tienen como aglucón un lípido (glúcido + lípido) • GLUCOPROTEINAS: son los que tienen como aglucón una proteína (glúcido+proteína) El enlace puede realizarse a través de un oxígeno (O HETERÓSIDOS), un azufre (S HETERÓSIDOS) o un nitrógeno (N HETERÓSIDOS). En los tres casos hablamos de una unión débil que, por acción de enzimas o bien ácidos débiles, se rompe para dar uno o varios azúcares y el aglicón. Por otro lado, también existen C HETERÓSIDOS cuyo enlace, entre dos carbonos, es mucho más fuerte y estable. Los heterósidos están presentes en bastantes especies de plantas medicinales. Las moléculas pueden ser muy distintas unas a otras y las acciones, por tanto, también pueden ser muy diversas. A continuación se especifican algunos de los más comunes: SAPONINAS HETERÓSIDOS CARDIOTÓNICOS ANTRAQUINONAS FLAVONOIDES

Heteróxidos Glucolípidos. Están formados por monosacáridos u oligosacáridos unidos a lípidos. Se les puede encontrar en la membrana celular. Los mas conocidos son los cerebrósidos y gangliósidos. Glucoproteinas. Moléculas formadas por una fracción glucídica (del 5 al 40%) y una fracción proteica unidas por enlaces covalentes. Las principales son las mucinas de secreción como las salivales, Glucoproteinas de la sangre, y Glucoproteinas de las membranas celulares. Funciones de los Glúcidos Función Energética El glúcido más importante y de uso inmediato es la glucosa. Sacarosa, almidón (vegetales) y glucógeno (animales) son formas de almacenar glucosas. En una oxidación completa se producen 410 Kcal/100 grs. Función Estructural El enlace impide la degradación de estas moléculas y hace que algunos organismos puedan permanecer durante cientos de años. La celulosa, hemicelulosas y pectinas forman la pared vegetal.

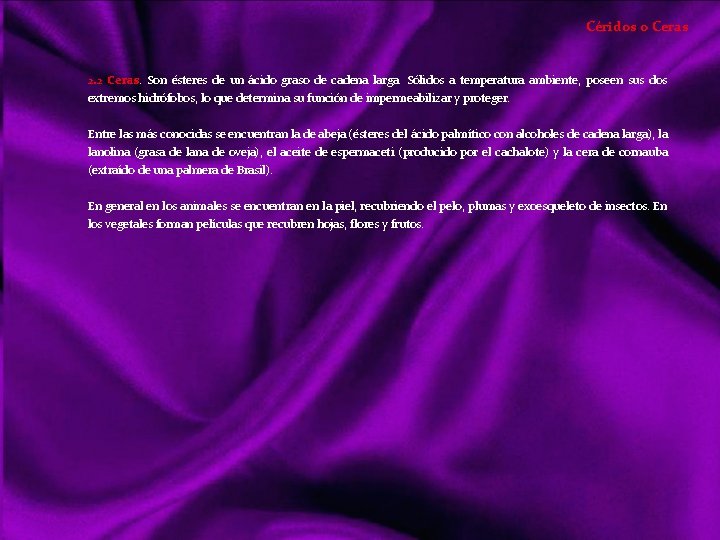
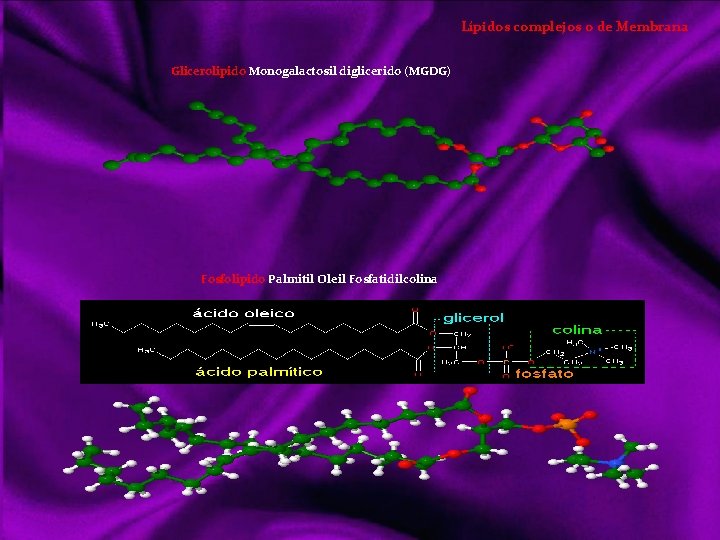
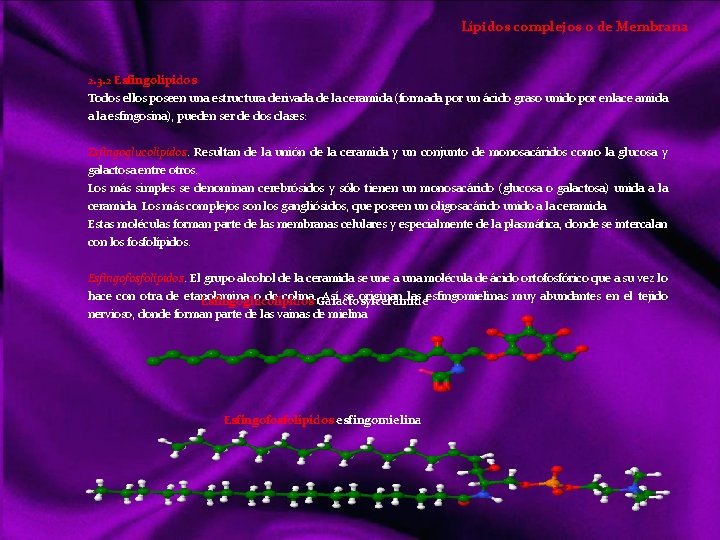
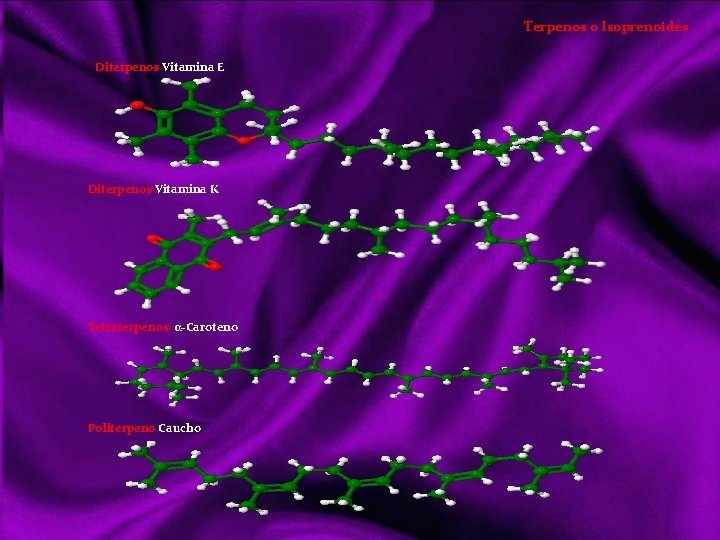
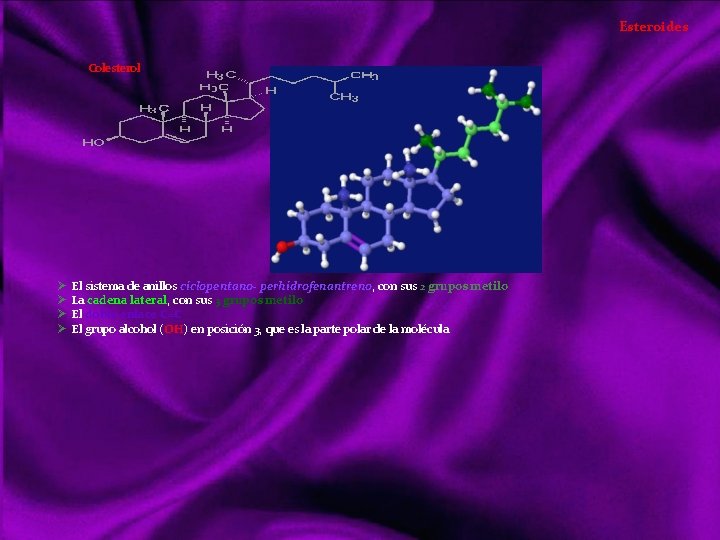
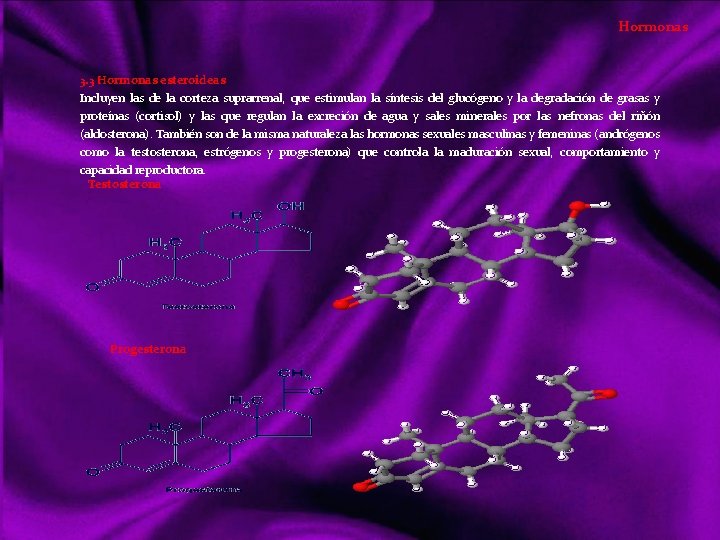
Lípidos Siendo otro tipo de compuestos orgánicos que los vistos anteriormente, realizan básicamente las mismas funciones que los glúcidos; tanto energéticas como estructurales. Sin embargo los lípidos es un grupo diversificado de sustancias con una serie de propiedades físicas y químicas comunes, y entran en mayor proporción en la formación de estructuras orgánicas. Con el nombre de lípidos (del griego lypos, grasa) denominamos a un grupo de compuestos orgánicos formados por C, H, y O mayoritariamente y ocasionalmente N, P y S. Con características químicas diversas, pero propiedades físicas comunes: poco o nada solubles en agua, siéndolo en los disolventes orgánicos (éter, benceno, cloroformo, acetona, alcohol). Clasificación de los lípidos Acidos Grasos Saturados Insaturados Triacilgliceroles o grasas Lípidos saponificables Ceras Lípidos complejos o de membrana Lípidos insaponificables Aceites Mantecas Sebos Glicerolípidos Esfingolípidos Terpenos Esteroides Hormonas eicosanoides Dada la diversidad de características químicas, su clasificación también lo es: puede hacerse atendiendo a criterios de saponificación, por simples o complejos o resaltando su importancia biológica, que será lo suficientemente destacada a lo largo de este tema. La saponificación reacción química entre un ácido graso y una base o álcali, en la que se obtiene como principal producto la sal de dicho ácido y la base.

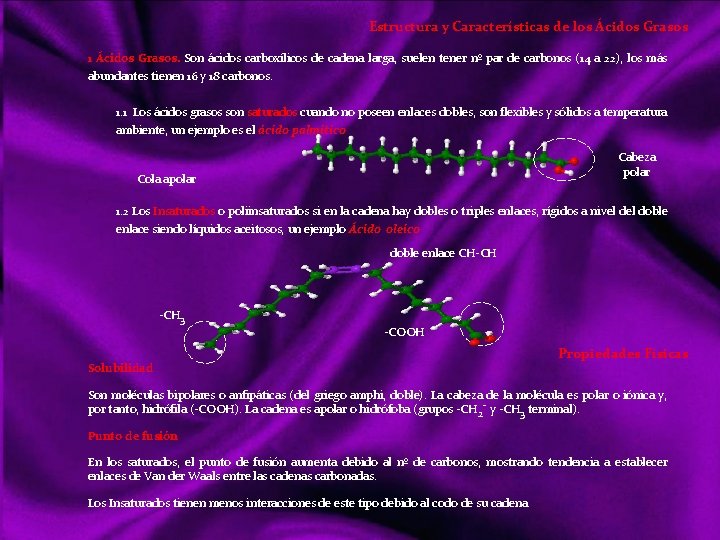
Estructura y Características de los Ácidos Grasos 1 Ácidos Grasos. Son ácidos carboxílicos de cadena larga, suelen tener nº par de carbonos (14 a 22), los más abundantes tienen 16 y 18 carbonos. 1. 1 Los ácidos grasos son saturados cuando no poseen enlaces dobles, son flexibles y sólidos a temperatura ambiente, un ejemplo es el ácido palmítico Cabeza polar Cola apolar 1. 2 Los Insaturados o poliinsaturados si en la cadena hay dobles o triples enlaces, rígidos a nivel doble enlace siendo líquidos aceitosos, un ejemplo Ácido oleico doble enlace CH CH 3 COOH Solubilidad Propiedades Físicas Son moléculas bipolares o anfipáticas (del griego amphi, doble). La cabeza de la molécula es polar o iónica y, por tanto, hidrófila ( COOH). La cadena es apolar o hidrófoba (grupos CH 2 y CH 3 terminal). Punto de fusión En los saturados, el punto de fusión aumenta debido al nº de carbonos, mostrando tendencia a establecer enlaces de Van der Waals entre las cadenas carbonadas. Los Insaturados tienen menos interacciones de este tipo debido al codo de su cadena

Propiedades Químicas Esterificación El ácido graso se une a un alcohol por enlace covalente formando un ester y liberando una molécula de agua. Los ésteres son compuestos orgánicos en los cuales un grupo orgánico (simbolizado por R') reemplaza a un átomo de hidrógeno (o más de uno) en un ácido oxigenado. Un ácido oxigenado es un ácido cuyas moléculas poseen un grupo OH– desde el cual el hidrógeno (H) puede disociarse como un ion protón (H+). En química orgánica y bioquímica los ésteres son un grupo funcional compuesto de un radical orgánico unido al residuo de cualquier ácido oxigenado, orgánico o inorgánico. Los ésteres más comúnmente encontrados en la naturaleza son las grasas, que son ésteres de glicerina y ácidos grasos, oleico, etcétera. Principalmente resultante de la condensación de un ácido carboxílico y un alcohol. El proceso se denomina esterificación Los ésteres más comunes utilizados en la medicina y en la industria son: el acetato de etilo, el acetato de butilo, el acetato de celulosa, el xantogenato de celulosa, el trinitrato de glicerilo (nitroglicerina), el acetato de vinilo y el nitrato de celulosa. El ácido acetilsalicílico (aspirina), es el más popular de los medicamentos sintéticos, debido a su acción analgésica, antipirética, anti inflamatoria y antirreumática, y por ser utilizado en la prevención y tratamiento del infarto agudo al miocardio, la benzocaína (p aminobenzoato de etilo) es un anestésico local, empleado como calmante del dolor.

Ésteres comunes nitroglicerina ácido acetilsalicílico benzocaina

Propiedades Químicas Saponificación Reaccionan los álcalis o bases dando lugar a una sal de ácido graso que se denomina jabón. El aporte de jabones favorece la solubilidad y la formación de micelas de ácidos grasos. Gracias a este comportamiento anfipático los jabones se disuelven en agua dando lugar a micelas monocapas, o bicapas si poseen agua en su interior. También tienen un efecto espumante cuando la monocapa atrapa aire y detergente o emulsionante si contienen pequeñas gotas de lípido.

Acilglicéridos, Grasa simples o neutras 2 Lípidos Saponificables Son lípidos simples formados por glicerol esterificado por uno, dos, o tres ácidos grasos, en cuyo caso: monoacilglicérido, diacilglicérido o triacilglicérido respectivamente.

Acilglicéridos, Grasa simples o neutras 2. 1 Los Lípidos Saponificables Triacilgliceroles, Antiguamente llamados triglicéridos, se representan gráficamente como: Son el resultado de la unión de una molécula de glicerol (glicerina) con 3 de ácido graso, iguales o no. Ejemplo: 1 palmitil 2 oleil 3 estearilglicerol formado por: Una molécula de glicerol (CH 2 OH) una molécula de ácido palmítico una molécula de ácido oleico una molécula de ácido esteárico glicerol molécula de ácido palmítico molécula de ácido oleico molécula de ácido esteárico

Acilglicéridos, Grasa simples o neutras Atendiendo a la temperatura de fusión se clasifican en: 2. 1. 1 Aceites Si los ácidos grasos son Insaturados o de cadena corta o ambas cosas a la vez, la molécula resultante es líquida a temperatura ambiente y se denomina aceite. Se encuentra en las plantas oleaginosas: el fruto del olivo es rico en ácido oleico (monoinsaturado), las semillas del girasol, maíz, soja etc. son ricos en poliinsaturados como el linoleico, algunas plantas que viven en aguas frías contienen linolénico y eicosapentanoico, que también se acumulan en las grasas de los pescados azules que se alimentan de ellas como el salmón. Ácidos grasos saturados y Enfermedades cardiovasculares Un exceso de ácidos grasos saturados en la dieta incrementa los niveles de triglicéridos y de colesterol en sangre y, por consiguiente, favorece la formación de placas de ateroma en las paredes de las arterias responsables de las trombosis y otras enfermedades cardiovasculares como la arteriosclerosis. Sin embargo los aceites de oliva, semillas y los ácidos grasos poli insaturados de los pescados azules, tiene el efecto contrario, ya que baja los niveles de colesterol en sangre y evita la formación de ateromas 2. 1. 2 Mantecas Son grasas semisólidas a temperatura ambiente. La fluidez de esta depende de su contenido en ácidos Insaturados y esto último relacionado a la alimentación. Los animales que son alimentados con grasas insaturadas, generan grasas más fluidas y de mayor aprecio en alimentación. (Seria el caso de un cerdo alimentado con bellotas) 2. 1. 3 Sebos Son grasas sólidas a temperatura ambiente, como las de cabra o buey. Están formadas por ácidos grasos saturados y cadena larga.

Céridos o Ceras 2. 2 Ceras. Son ésteres de un ácido graso de cadena larga. Sólidos a temperatura ambiente, poseen sus dos extremos hidrófobos, lo que determina su función de impermeabilizar y proteger. Entre las más conocidas se encuentran la de abeja (ésteres del ácido palmítico con alcoholes de cadena larga), la lanolina (grasa de lana de oveja), el aceite de espermaceti (producido por el cachalote) y la cera de cornauba (extraído de una palmera de Brasil). En general en los animales se encuentran en la piel, recubriendo el pelo, plumas y exoesqueleto de insectos. En los vegetales forman películas que recubren hojas, flores y frutos.

Lípidos complejos o de Membrana 2. 3 Lípidos complejos. En su composición intervienen ácidos grasos y otros componentes como alcoholes, glúcidos, ácido fosfórico, derivados aminados etc. Son moléculas anfipáticas con una zona hidrófoba, en la que los ácidos grasos están unidos mediante enlaces ester a un alcohol (glicerina o esfingosina), y una zona hidrófila, originada por los restantes componentes no lipídicos que también están unidos al alcohol. Encontramos los siguientes tipos: Glicerolípidos Esfingolípidos Gliceroglucolípidos Glicerofosfolípidos (fosfolípidos) Esfingoglucolípidos Esfingofosfolípidos 2. 3. 1 Glicerolípidos Poseen dos moléculas de ácidos grasos mediante enlaces ester a dos grupos alcohol de la glicerina (posiciones α y β). Según sea el sustituyente unido al tercer grupo alcohol de la glicerina se forman los: Gliceroglucolípidos. Si se un glúcido. Lípidos que se encuentran en membranas de bacterias y células vegetales. Fosfolípidos. Se une el ácido fosfórico y constituye el ácido fosfatídico. La estructura de los distintos Fosfolípidos se pueden considerar derivados del ácido fosfatídico, y por ello se nombran con el prefijo fosfatidil seguido del nombre del derivado aminado o polialcohol con el que se une. Así se obtienen los derivados fosfatidiletanolamina, fosfatidilcolina (lecitina), fosfatidilserina, fosfatidilglicerol y fosfatidilinositol. Los Fosfolípidos tienen un gran interés biológico por ser componentes estructurales de las membranas celulares.

Lípidos complejos o de Membrana Glicerolipido Monogalactosil diglicerido (MGDG) Fosfolípido Palmitil Oleil Fosfatidilcolina

Lípidos complejos o de Membrana 2. 3. 2 Esfingolípidos Todos ellos poseen una estructura derivada de la ceramida (formada por un ácido graso unido por enlace amida a la esfingosina), pueden ser de dos clases: Esfingoglucolípidos. Resultan de la unión de la ceramida y un conjunto de monosacáridos como la glucosa y galactosa entre otros. Los más simples se denominan cerebrósidos y sólo tienen un monosacárido (glucosa o galactosa) unida a la ceramida. Los más complejos son los gangliósidos, que poseen un oligosacárido unido a la ceramida. Estas moléculas forman parte de las membranas celulares y especialmente de la plasmática, donde se intercalan con los fosfolípidos. Esfingofosfolípidos. El grupo alcohol de la ceramida se une a una molécula de ácido ortofosfórico que a su vez lo hace con otra de etanolamina o de colina. Galactosylceramide Así se originan las esfingomielinas muy abundantes en el tejido Esfingoglucolípidos nervioso, donde forman parte de las vainas de mielina Esfingofosfolípidos esfingomielina

Terpenos o Isoprenoides 3. 1 Los isopreno, están formados por polimerización del isopreno. Son moléculas muy abundantes en los vegetales y su clasificación se determina por el nº de isoprenos que contienen. Monoterpenos (dos isoprenos) Se encuentran en los aceites esenciales de muchas plantas, a las que dan su olor sabor característicos: mentol, geraniol, limoneno, pineno, alcanfor etc. Diterpenos (cuatro isoprenos) Es de destacar el fitol que forma parte de la clorofila y ser precursor de la vitamina A. Las vitaminas A, E y K también son diterpenos. Tetraterpenos (ocho isoprenos) En este grupo son abundantes las xantofilas y carotenos, pigmentos vegetales amarillo y anaranjado respectivamente. Dan color a los frutos, raíces (zanahoria) flores etc. En la fotosíntesis desempeñan un papel clave absorbiendo energía luminosa de longitudes de onda distinta a las que capta la clorofila. El caroteno es precursor de la vitamina A. Politerpenos (muchos isoprenos) Es. Terpenos de destacar el caucho, obtenido del Hevea Brasiliensis, que contiene varios miles de isoprenos. Se usa en la o Isoprenos fabricación de objetos de goma.

Terpenos o Isoprenoides Diterpenos Vitamina E Diterpenos Vitamina K Tetraterpenos α-Caroteno Politerpeno Caucho

Esteroides 3. 2 Esteroides. Son lípidos que derivan del ciclopentano perhidrofenantreno, denominado gonano (antiguamente esterano). Su estructura la forman cuatro anillos de carbono (A, B, C y D). Los esteroides se diferencian entre sí por el nº y localización de sustituyentes, siendo los más característicos: Esteroles De todos ellos, el colesterol es el de mayor interés biológico. Forma parte de las membranas biológicas a las que confiere resistencia, por otra parte es el precursor de casi todos los demás esteroides. Otros esteroles constituyen el grupo de la vitamina D o calciferol, imprescindible en la absorción intestinal del calcio y su metabolización. Ácidos biliares Derivan de los ácidos cólico, desoxicólico y quenodesoxicólico, cuyas sales emulsionan las grasas por lo que favorecen su digestión y absorción intestinal. - perhidrofenantreno. Esta molécula origina moléculas tales Los esteroides son derivados del cilopentano como colesterol, estradiol, progesterona, testosterona, aldosterona o corticosterona. Todas ellas son esenciales para el funcionamiento de nuestro metabolismo.

Esteroides Colesterol Ø Ø El sistema de anillos ciclopentano- perhidrofenantreno, con sus 2 grupos metilo La cadena lateral, con sus 3 grupos metilo El doble enlace C=C El grupo alcohol (OH) en posición 3, que es la parte polar de la molécula

Hormonas 3. 3 Hormonas esteroideas Incluyen las de la corteza suprarrenal, que estimulan la síntesis del glucógeno y la degradación de grasas y proteínas (cortisol) y las que regulan la excreción de agua y sales minerales por las nefronas del riñón (aldosterona). También son de la misma naturaleza las hormonas sexuales masculinas y femeninas (andrógenos como la testosterona, estrógenos y progesterona) que controla la maduración sexual, comportamiento y capacidad reproductora. Testosterona Progesterona

Funciones de los Lípidos Los lípidos cumplen tres funciones, reserva energética, son estructurales, y participan en el transporte. Reserva Constituyen la principal reserva energética del organismo. Sabido es que un gramo de grasa produce 9, 4 Kc. En las reacciones metabólicas de oxidación, mientras que los prótidos y glúcidos solo producen 4, 1 Kc. /gr. La oxidación de los ácidos grasos en las mitocondrias produce una gran cantidad de energía. Los ácidos grasos y grasas (Acilglicéridos) constituyen la función de reserva principal. Estructural Forman las bicapas lipídicas de las membranas citoplasmáticas y de los orgánulos celulares. Fosfolípidos, colesterol, Glucolípidos etc. son encargados de cumplir esta función. En los órganos recubren estructuras y les dan consistencia, como la cera del cabello. Otros tienen función térmica, como los acilglicéridos, que se almacenan en tejidos adiposos de animales de clima frío. También protegen mecánicamente, como ocurre en los tejidos adiposos de la planta del pie y en la palma de la mano del hombre. Resumiendo: la función estructural está encargada a Glucolípidos, Céridos, Esteroles, Acilglicéridos y Fosfolípidos. Transportadora El transporte de lípidos, desde el intestino hasta el lugar de utilización o al tejido adiposo (almacenaje), se realiza mediante la emulsión de los lípidos por los ácidos biliares y los proteolípidos, asociaciones de proteínas específicas con triacilglicéridos, colesterol, fosfolípidos, etc. , que permiten su transporte por sangre y linfa.

Proteínas Las proteínas son las moléculas orgánicas más abundantes en las células, se encuentran formando estructuras, y realizando una diversidad de funciones especializadas. Están compuestos por átomos de C, H, O, N, y en menor proporción por otros elementos como S y P. Están constituidas por unidades llamadas Aminoácidos, los cuales están unidos entre sí por el Enlace Peptídico. http: //www. puc. cl/sw_educ/biologia/bio 100/html/portada. MIval 2. 1. 1. 3. html Son constituyentes químicos fundamentales e imprescindibles en la materia viva porque: • Son los "instrumentos moleculares" mediante los cuales se expresa la información genética; es decir, las proteínas ejecutan las órdenes dictadas por los ácidos nucleicos. • Son sustancias "plásticas" para los seres vivos, es decir, materiales de construcción y reparación de sus propias estructuras celulares. Sólo excepcionalmente sirven como fuente de energía. • Muchas tienen "actividad biológica" (transporte, regulación, defensa, reserva, etc. . . ). Esta característica diferencia a las proteínas de otros elementos, como glúcidos y lípidos que se encuentran en las células como simples sustancias inertes. Las proteínas se crean y se destruyen La renovación continua de las proteínas en el organismo supone que destruyamos diariamente de 200 a 300 gramos de ellas y que elaboremos otras tantas. Estos procesos requieren un importante aporte de energía.

1. - Composición Química y Clasificación Las proteínas son biopolímeros (macromoléculas orgánicas), de elevado peso molecular, constituidas básicamente por carbono (C), hidrógeno (H), oxígeno (O) y nitrógeno (N); aunque pueden contener también azufre (S) y fósforo (P) y, en menor proporción, hierro (Fe), cobre (Cu), magnesio (Mg), yodo (Y), etc. . . Estos elementos químicos se agrupan para formar unidades estructurales (monómeros) llamados AMINOACIDOS, a los cuales podríamos considerar como los "ladrillos de los edificios moleculares proteicos". Estos edificios macromoleculares se construyen y desmoronan con gran facilidad dentro de las células, y a ello debe precisamente la materia viva su capacidad de crecimiento, reparación y regulación. Las proteínas son, en resumen, biopolímeros de aminoácidos y su presencia en los seres vivos es indispensable para el desarrollo de los múltiples procesos vitales. Se clasifican, de forma general, en Holoproteínas y Heteroproteínas según estén formadas respectivamente sólo por aminoácidos o bien por aminoácidos más otras moléculas o elementos adicionales no aminoácidos

Aminoácidos 1. - Estructura general de los aminoácidos Un aminoácido es una molécula que contiene un grupo carboxilo ( COOH) y un grupo amino ( NH 2) libres. Los alfa aminoácidos pueden representarse en general por NH 2 CHR COOH, siendo R un radical o cadena lateral característica de cada aminoácido. Estos grupos R son muy variados químicamente. Muchos aminoácidos forman proteínas (aminoácidos proteicos), mientras otros nunca se encuentran en ellas. En todos los aminoácidos que componen proteínas excepto la glicina el carbono alfa es un carbono asimétrico. (El carbono alfa es el adyacente al grupo carboxilo). Existen aproximadamente 20 aminoácidos distintos componiendo las proteínas. La unión química entre aminoácidos en las proteínas se produce mediante un enlace peptídico. http: //www. stanford. edu/group/pandegroup/folding/spanis h/education/Amin. Acid_spanish. html Tridimensionalmente el carbono presenta una configuración tetraédrica en la que el carbono se dispone en el centro y los cuatro elementos que se unen a él ocupan los vértices. Cuando en el vértice superior se dispone el COOH y se mira por la cara opuesta al grupo R, según la disposición del grupo amino ( NH 2) a la izquierda o a la derecha del carbono α se habla de "α L aminoácidos o de "α D aminoácidos respectivamente. En las proteinas sólo se encuentran aminoácidos de configuración L.

2. - Clasificación de los aminoácidos Aminoácido - α Aminoácido - β Aminoácido - γ 2. 1 Los aminoácidos se clasifican habitualmente según las propiedades de su cadena lateral: • O C N H S Neutros polares, hidrófilos o polares (Es el comportamiento de toda molécula que tiene afinidad por el agua. En una disolución o coloide, las partículas hidrófilas tienden a acercarse y mantener contacto con el agua): Serina (Ser), Treonina (Thr), Cisteína (Cys), Asparagina (Asn), Tirosina (Tyr) y Glutamina (Gln).

2. - Clasificación de los aminoácidos • Neutros no polares, apolares o hidrófobos (El término se aplica a aquellas sustancias que son repelidas por el agua o que no se pueden mezclar con ella): Glicina (Gly), Alanina (Ala), Valina (Val), Leucina (Leu), Isoleucina (Ile), Metionina (Met), Prolina (Pro), Fenilalanina (Phe) y Triptófano (Trp). O C N H S

2. - Clasificación de los aminoácidos • Con carga negativa, o ácidos (Se denomina ácido a cualquier compuesto químico que disuelto en agua, da una solución con un p. H menor de 7): Ácido aspártico (Asp) y Ácido glutámico (Glu). • O C Con carga positiva, o básicos (Una base es, en primera aproximación, cualquier sustancia que en disolución acuosa aporta iones OH al medio): Lisina (Lys), Arginina (Arg) e Histidina (His). N H S NOTA: Las Figuras representan la clasificación de los 20 aminoácidos presentes en las proteínas

2. - Clasificación de los aminoácidos 2. 2 Los aminoácidos se clasifican también según su obtención: Los aminoácidos que necesitan ser ingeridos por el cuerpo para obtenerlos se les llama esenciales, la carencia de estos aminoácidos en la dieta limita el desarrollo del organismo, ya que no es posible reponer las células de los tejidos que mueren o crear tejidos nuevos, en el caso del crecimiento. Estos son: • • • Valina (Val) Leucina (Leu) Isoleucina (Ile) Fenilalanina (Phe) Metionina (Met) Treonina (Thr) Lisina (Lys) Triptófano (Trp) Histidina (His) Los aminoácidos que pueden ser sintetizados por el cuerpo se les conoce como No Esenciales y son: • • Arginina (Arg) Alanina (Ala) Prolina (Pro) Glicina (Gly) Serina (Ser) Cisteina (Cys) Asparagina (Asn) Glutamina (Gln)

3. - Aminoácidos No Proteicos Hay aminoácidos que no se consideran proteicos y aparecen en algunas proteínas. Son derivados de otros aminoácidos, es decir, se incorporan a la proteína como uno de los aminoácidos proteicos y, después de haber sido formada la proteína, se modifican químicamente; por ejemplo, la hidroxiprolina. Algunos aminoácidos no proteicos se utilizan como neurotransmisores, vitaminas, etc. Por ejemplo, la beta alanina o la biotina. Hidroxiprolina β Alanina Ácido Ascórbico (Vitamina C) Biotina 4. - Propiedades de los Aminoácidos 4. 1 Propiedades Ácido básicas Comportamiento de cualquier aminoácido cuando se ioniza. El aminoácido puede comportarse como ácido y como base, se denominan sustancias anfóteras. Cuando una molécula presenta carga neta cero está en su punto isoeléctrico. Si un aminoácido tiene un punto isoeléctrico de 6, 1 a este valor de p. H su carga neta será cero

4. - Propiedades de los Aminoácidos 4. 2 Propiedades Ópticas Todos los aminoácidos presentan un carbono asimétrico (exceptuando la glicina) por lo cual presentan isómeros. Uno de ellos se denomina D y el otro L. Salvo algunas excepciones, los aminoácidos en la naturaleza se encuentran en su forma L (grupo amino a la izquierda). Según el isómero, desviará el rayo de luz polarizada hacia la izquierda (levógiro) o hacia la derecha (dextrógiro) el mismo número de grados que su esteroisómero. El hecho de que sea dextrógiro no quiere decir que tenga configuración D. La configuración D o L depende de la posición del grupo amino (L si está a la izquierda según la representación de Fisher) 4. 3 Propiedades Químicas Las que afectan al grupo carboxilo (descarboxilación). Las que afectan al grupo amino (desaminación). Las que afectan al grupo R. Aminoácidos codificados en el genoma Los aminoácidos que están codificados en el genoma de la mayoría de los seres vivos son 20: alanina, arginina, asparagina, aspartato, cisteína, fenilalanina, glicina, glutamato, glutamina, histidina, isoleucina, lisina, metionina, prolina, serina, tirosina, treonina, triptófano y valina. Sin embargo, hay algunas pocas excepciones En algunos seres vivos el código genético tiene pequeñas modificaciones y puede codificar otros aminoácidos. Por ejemplo: selenocisteína y pirrolisina

Enlace Peptídico Los péptidos son cadenas lineales de aminoácidos unidos por enlaces químicos de tipo amino a los que se denomina Enlace Peptídico. El enlace peptídico tiene lugar mediante la pérdida de una molécula de agua entre el grupo amino de un aminoácido y el carboxilo de otro: El resultado es un enlace covalente CO NH. Es, en realidad, un enlace amida sustituido. Podemos seguir añadiendo aminoácidos al péptido, porque siempre hay un extremo NH 2 terminal y un COOH terminal. Para nombrar el péptido se empieza por el NH 2 terminal por acuerdo. Si el primer aminoácido de nuestro péptido fuera alanina y el segundo serina tendríamos el péptido Alanil serina. Así pues, para formar péptidos los aminoácidos se van enlazando entre sí formando cadenas de longitud y secuencia variable. Para denominar a estas cadenas se utilizan prefijos convencionales como: Oligopéptidos. si el nº de aminoácidos es menor 10. Dipéptidos. si el nº de aminoácidos es 2. Tripéptidos. si el nº de aminoácidos es 3. Tetrapéptidos. si el nº de aminoácidos es 4. Polipéptidos o cadenas polipeptídicas. si el nº de aminoácidos es mayor 10.

Dipéptido: el nº de aminoácidos es 2. Tripéptidos: el nº de aminoácidos es 3. Tetrapéptidos: el nº de aminoácidos es 4 Polipéptidos: el nº de aminoácidos es mayor a 10

Enlace Peptídico Cada péptido o polipéptido se suele escribir, convencionalmente, de izquierda a derecha, empezando por el extremo N terminal que posee un grupo amino libre y finalizando por el extremo C terminal en el que se encuentra un grupo carboxilo libre, de tal manera que el eje o esqueleto del péptido, formado por una unidad de seis átomos ( NH CH CO ), es idéntico a todos ellos. Lo que varía de unos péptidos a otros, y por extensión, de unas proteínas a otras, es el número, la naturaleza y el orden o secuencia de sus aminoácidos. Resumen El enlace peptídico es un enlace covalente y se establece entre el grupo carboxilo ( COOH) de un aminoácido y el grupo amino ( NH 2) del aminoácido contiguo inmediato, con el consiguiente desprendimiento de una molécula de agua. Por otra parte, el carácter parcial de doble enlace del enlace peptídico ( C N ) determina la disposición espacial de éste en un mismo plano, con distancias y ángulos fijos. Como consecuencia, el enlace peptídico presenta cierta rigidez e inmoviliza en el plano a los átomos que lo forman.

Funciones de las Proteínas Las proteínas determinan la forma y estructura de las células, dirigen casi todos los procesos vitales. Las funciones de las proteínas son específicas de cada una de ellas y permiten a las células mantener su integridad, defenderse de agentes externos, reparar daños, controlar y regular funciones. Todas las proteínas realizan su función de la misma manera: por unión selectiva con alguna molécula. Las proteínas estructurales se agregan a otras moléculas de la misma proteína para originar una estructura mayor. Sin embargo, otras proteínas se unen a moléculas distintas: los anticuerpos a los antígenos específicos, la hemoglobina al oxígeno, las enzimas a sustratos, los reguladores de la expresión genética al ADN, las hormonas a sus receptores específicos, entre otros. Ejemplos de proteínas sus funciones Función Estructural Algunas proteínas constituyen estructuras celulares: Ciertas glucoproteinas forman parte de las membranas celulares y actúan como receptores o facilitan el transporte de sustancias. Las histonas, forman parte de los cromosomas que regulan la expresión de los genes. Otras proteínas confieren elasticidad y resistencia a órganos y tejidos: El colágeno del tejido conjuntivo fibroso. La elastina del tejido conjuntivo elástico. La queratina de la epidermis. Las arañas y los gusanos de seda segregan fibroina para fabricar las telas de araña y los capullos de seda, respectivamente. Función Enzimática Las proteínas con función enzimática son las más numerosas y especializadas. Actúan como biocatalizadores de las reacciones químicas del metabolismo celular. Función Hormonal Algunas hormonas son de naturaleza proteica, como la insulina y el glucagón (que regulan los niveles de glucosa en sangre) o las hormonas segregadas por la hipófisis como la del crecimiento o la adrenocorticotrópica (que regula la síntesis de corticosteroides) o la calcitonina (que regula el metabolismo del calcio).

Funciones de las Proteínas Función Reguladora Algunas proteínas regulan la expresión de ciertos genes y otras regulan la división celular (como la ciclina). Función Homeostatica Las que mantienen el equilibrio osmótico y actúan junto con otros sistemas amortiguadores para mantener constante el p. H del medio interno. Función Defensiva Las inmunoglogulinas actúan como anticuerpos frente a posibles antígenos. La trombina y el fibrinógeno contribuyen a la formación de coágulos sanguíneos para evitar hemorragias. Las mucinas tienen efecto germicida y protegen a las mucosas. Algunas toxinas bacterianas, como la del botulismo, o venenos de serpientes, son proteínas fabricadas con funciones defensivas. Función de Transporte La hemoglobina transporta el oxígeno en la sangre de los vertebrados. La hemocianina transporta oxígeno en la sangre de los invertebrados. La mioglobina transporta oxígeno en los músculos. Las lipoproteínas transportan lípidos por la sangre. Los citocromos transportan electrones. Función Contractil La actina y la miosina constituyen las miofibrillas responsables de la contracción muscular. La dineina está relacionada con el movimiento de cilios y flagelos. Función de Reserva La ovo albúmina de la clara del huevo, la gliadina del grano de trigo y la hordeina de la cebada, constituyen la reserva de aminoácidos para el desarrollo del embrión. La lacto albúmina de la leche

Propiedades de las Proteínas Desnaturalización: Las proteínas se pueden desnaturalizar al perder su estructura. En tal situación, pierde solubilidad en el agua y precipita. Algunas proteínas desnaturalizadas pueden volver a su estado original a través de un proceso llamado renaturalización. La desnaturalización de una proteína se refiere a la ruptura de los enlaces que le mantenían sus estructuras cuaternaria, terciaria y secundaria, conservándose solamente la primaria. En estos casos las proteínas se transforman en filamentos lineales y delgados que se entrelazan hasta formar compuestos fibrosos e insolubles en agua. Los agentes que pueden desnaturalizar a una proteína pueden ser: calor excesivo; sustancias que modifican el p. H; alteraciones en la concentración; alta salinidad; agitación molecular; etc. . . El efecto más visible de éste fenómeno es que las proteínas se hacen menos solubles o insolubles y pierden su actividad biológica. La mayor parte de las proteínas experimentan desnaturalizaciones cuando se calientan entre 50 y 60 ºC; en cambio otras se desnaturalizan cuando se enfrían por debajo de los 10 a 15 ºC. La desnaturalización puede ser reversible (renaturalización) pero en la mayoría de los casos es irreversible Capacidad Electrolítica: Se determina a través de la electrólisis, en la cual si las proteínas se trasladan al polo positivo es porque su radical tiene carga negativa y viceversa. Especificidad: Cada proteína tiene una función específica, determinada por su estructura primaria. Esta propiedades se refiere a que cada una de las especies de seres vivos es capaz de fabricar sus propias proteínas (diferentes en cada especie), aún, dentro de una misma especie hay diferencias proteicas entre los distintos individuos. Esto no ocurre con los glúcidos y lípidos, que son comunes a todos los seres vivos. La enorme diversidad proteica interespecífica e intraespecífica es la consecuencia de las múltiples combinaciones entre los aminoácidos, lo cual está determinado por el ADN de cada individuo. La especificidad de las proteínas explica algunos fenómenos biológicos como: la compatibilidad o no de transplantes de órganos; injertos biológicos; sueros sanguíneos; procesos alérgicos e incluso algunas infecciones

Propiedades de las Proteínas Solubilidad: Esta propiedad se mantiene siempre y cuando los enlaces fuertes y débiles estén presentes. Si se aumenta la temperatura y el p. H, se pierde la solubilidad. Las proteínas son solubles en agua cuando adoptan una conformación globular. La solubilidad es debida a los radicales ( R) libres de los aminoácidos que, al ionizarse, establecen enlaces débiles (puentes de hidrógeno) con las moléculas de agua. Así, cuando una proteína se solubiliza queda recubierta de una capa de moléculas de agua (capa de solvatación) que impide se pueda unir a otras proteínas lo cual provocaría su precipitación (insolubilización). Esta propiedad es la que hace posible la hidratación de los tejidos de los seres vivos. Capacidad amortiguadora: Las proteínas tienen un comportamiento anfótero, esto las hace capaces de neutralizar las variaciones de p. H del medio, ya que pueden comportarse como un ácido o una base y por de tanto o retirar Estructura lasliberar Proteínas + iones (H ) del medio donde se encuentran. Presentan una serie de propiedades que vienen definidas por la disposición espacial de la cadena proteica, si se cambia la presión, temperatura, p. H, etc. pierde la conformación y su función que viene determinada por la secuencia de aminoácidos Existen 4 niveles estructurales, estando los dos primeros presentes en todas las proteínas y las dos segundas pueden encontrarse o no. Dichos niveles estructurales definen la especificidad de cada proteína. A saber: Estructura primaria. secundaria. Nivel de dominio. Estructura terciaria. cuaternaria. A partir del nivel de dominio sólo las hay globulares. La determinación de la estabilidad proteica, es un proceso mediante el cual se sabe la resistencia de desnaturalización de una proteína, esta ocurre cuando la proteína es sometida a determinadas temperaturas y cambios de ph en la cual se pierde su estructura espacial y, por tanto, su función. Ejemplo: Es útil para saber si una determinado tipo de leche puede ser procesada a pasteurización o si sus proteínas pueden ser calentarse. También se emplea en los alimentos, para utilizar las proteínas con la seguridad que no perderán su valor nutritivo al ser calentadas.

Estructura de las Proteínas 1º Estructura primaria: Se refiere al número y orden de colocación de los aminoácidos en la cadena peptídica llamándose a este orden, secuencia, la secuencia de aminoácidos es muy específica ya que variando un solo aminoácido en número o en orden se forman proteínas distintas. En toda cadena peptídica el primer aminoácido lleva el grupo amino libre y se llama extremo N terminal el último aminoácido lleva el grupo carboxilo libre y se le llama extremo C terminal la estructura primaria viene dada por control genético, es decir definido por el ADN y de ella van a depender el resto de las estructuras. Conocer la estructura primaria de una proteína es importante para: entender su función (ya que ésta depende de la secuencia de aminoácidos y de la forma que adopte), y en el estudio de enfermedades genéticas. Es posible que el origen de una enfermedad genética radique en una secuencia anormal. Esta anomalía, si es severa, podría resultar en que la función de la proteína no se ejecute de manera adecuada, incluso que no se ejecute. La secuencia de aminoácidos está especificada en el ADN por la secuencia de nucleótidos. Existe un sistema de conversión, llamado código genético, que se puede utilizar para deducir la primera a partir de la segunda. Modelo de estructura primaria Cadena de aminoácidos Estructura primaria, Aminoácido aromático, Fenilalanina Estructura primaria, Enlace peptídico, Tripéptido Lys – Ala - Ile

Estructura de las Proteínas 2ª Estructura secundaria: se refiere a la disposición espacial de la cadena de aminoácidos y consiste en un enrollamiento en espiral de la cadena debido a interacciones por puentes de hidrógeno entre enlaces peptídicos próximos. Estos pueden ser hélices alfa, hélice de colágeno o laminas beta. Hélice alfa: En esta estructura la cadena polipeptídica se enrolla en espiral sobre sí misma debido a los giros producidos en torno al carbono alfa de cada aminoácido. Esta estructura se mantiene gracias a los enlaces de hidrógeno intercatenarios formados entre el grupo NH de un enlace peptídico y el grupo C=O del cuarto aminoácido que le sigue. Hélice alfa: Ser- Glu- Ala- Ile- Asn- Arg- Gln- Ile- Asn- Leu- Glu- Leu- Tyr-Ala

Estructura de las Proteínas Hélice de colágeno: Es una variedad particular de la estructura secundaria es la que forma el colágeno, que esta presente en tendones y tejidos conectivos, y posee una estructura particularmente rígida. Cadena polipeptídica sencilla del tropocolágeno Modelo molecular Modelo cordón Modelo cinta Modelo de tropocolágeno [Gly-Pro-Hyp-]12 Modelo de Smith de fibrilla de colágeno Vista frontal

Estructura de las Proteínas Beta laminas o de láminas plegadas: Algunas proteínas conservan su estructura primaria en zigzag y se asocian entre sí estableciendo uniones mediante enlaces de hidrógeno intercatenarios. Todos los enlaces peptídicos participan en este enlace cruzado, confiriendo así gran estabilidad a la estructura. La forma en beta es una conformación simple formada por dos o más cadenas polipeptídicas paralelas o antiparalelas y se adosan estrechamente por medio de puentes de hidrógeno y diversos arreglos entre los radicales libres de los aminoácidos. Esta conformación tiene una estructura laminar y plegada, como un acordeón. Modelo de estructura secundaria, hélice alfa – hélice beta No todas las proteínas llegan a formar estructuras terciarias. En estos casos mantienen su estructura secundaria alargada dando lugar a las llamadas proteínas filamentosas, que son insolubles en agua y disoluciones salinas siendo por ello idóneas para realizar funciones esqueléticas. Entre ellas, las más conocidas son el colágeno de los huesos y del tejido conjuntivo; la queratina del pelo, plumas, uñas, cuernos, etc. . . ; la fibroina del hilo de seda y de las telarañas y la elastina del tejido conjuntivo, que forma una red deformable por la tensión.

Estructura de las Proteínas 3º Estructura terciaria: solo la poseen las esfero proteínas globulares y se refiere a la disposición espacial de la estructura secundaria, constituyendo formas tridimensionales geométricas muy complicadas que se mantienen por enlaces fuertes (puentes disulfuro entre dos cisteinas) y otros débiles (puentes de hidrógeno; fuerzas de Van der Waals; interacciones iónicas e interacciones hidrofóbicas). Las proteínas que presentan estructuras terciarias son solubles en agua y tienen gran actividad química y biológica, Van a ser por tanto proteínas funcionales por el contrario las escleroproteínas o proteínas fibrosas no presentan estructura terciaria son insolubles en agua presentando por tanto función estructural. Desde el punto de vista funcional, esta estructura es la más importante pues, al alcanzarla es cuando la mayoría de las proteínas adquieren su actividad biológica o función. Muchas proteínas tienen estructura terciaria globular caracterizadas por ser solubles en disoluciones acuosas, como la mioglobina o muchas enzimas. Estructura terciaria Lisozima Varias hélices alfa Una lámina beta, formada por 3 hebras beta Zonas sin estructura secundaria regular Modelo de estructura terciaria, Proteína globular

Estructura de las Proteínas 4º Estructura cuaternaria: está representada por el acoplamiento de varias cadenas polipeptídicas, iguales o diferentes, con estructuras terciarias (protómeros) quedan autoensambladas por enlaces débiles, no covalentes, que interacciona entre sí, funcionando como una sola molécula Esta estructura no la poseen, tampoco, todas las proteínas. Algunas que sí la presentan son: las enzimas alostéricos y la hemoglobina, esta última, constituida por cuatro cadenas peptídicas iguales dos a dos que interaccionan entre sí Estructura cuaternaria Hemoglobina formada por 4 sub unidades de globina: alfa 1, alfa 2, beta 1 y beta 2 Grupo hemo, histidina, hierro y oxigeno Modelo de estructura cuaternaria, Proteína globular de 4 globinas

Ácidos Nucleicos Los ácidos nucleicos están construidos por la polimerización de los nucleótidos. Funcionan como moléculas que almacenan y dan información para la producción de secuencias de aminoácidos Hay dos tipos de ácidos Nucleicos: El ácido desoxiribonucleico (ADN), funciona como una base de datos celular, al contener una inmensa cantidad de información sobre los polipéptidos que la célula pude hacer potencialmente. El ácido ribonucleico (ARN), el cual tiene formas diversas (mensajero, ribosomal, de transferencia) y es necesario para convertir la información de ADN en secuencias de polipéptidos. En algunos virus, el ARN funciona como la base de datos primaria sin que haya ADN. Algunos ARN tienen una habilidad catalítica similar a la de las enzimas y son llamadas ribosomas. Los ácidos Nucleicos están construidos de subunidades llamadas nucleótidos. Cada nucleótido tiene tres componentes: Un azúcar de 5 carbonos o pentosa Un molécula de anillo (base) que pertenece a las purinas o pirimidinas Uno o más grupos fosfato 1. - Composición de los ácidos nucleicos Son biopolímeros formados por unidades llamadas monómeros, que son los nucleótidos Base nitrogenada + Azúcar = Nucleósido Citosina + Desoxirribosa = Desoxicitidina Base nitrogenada + Azúcar + Ácido fosfórico = Nucleótido Adenina + Ribosa + Ácido fosfórico = Adenosin monofosfato (AMP)

1. - Composición de los ácidos nucleicos Los nucleótidos, están formados por la unión de: a) Una pentosa, que puede ser la D ribosa en el ARN; o la D 2 desoxirribosa en el ADN Desoxiribosa Beta Ribosa b) Una base nitrogenada, que puede ser: Púrina, como la Guanina (G) y la Adenina (A) Guanina Adenina Pirimidina, como la Timina (T), Citosina (C) y Uracilo (U) Timina Citosina Uracilo C) Ácido fosfórico, que en la cadena de ácido nucleico une dos pentosas a través de una unión fosfodiester. Esta unión se hace entre el C 3´de la pentosa, con el C 5´de la segunda. Ácido fosfórico

1. - Composición de los ácidos nucleicos Los nuecleósidos, están formados por la unión de una pentosa con una base nitrogenada. Esta unión se hace mediante un enlace β glucosídico. Si la pentosa es una ribosa, tenemos un ribonucleósido. Estos tienen como bases nitrogenadas la adenina, guanina, citosina y uracilo. Si la pentosa es un desoxirribosa, tenemos un desoxirribonucleósido. Estos tienen como bases nitrogenadas la adenina, citosina, guanina y timina. El enlace β glucosídico se hace entre el a) C 1´de la pentosa y el N 9 de la base púrina, como la guanina y la adenina. Nucleósido Nucleótido b) C 1´de. Adenosina la pentosa=y. Adenina el N 1 de+la. Ribosa base pirimidina, como la timina AMP y citosina = Adenina + Ribosa + Ácido fosfórico ADP = Adenina + Ribosa +2 Ácido fosfórico Nucleótido Citosina + Desoxirribosa +2Ácido fosfórico ATP = Adenina + Ribosa +3Ácido fosfórico

2. - Tipos de ácidos nucleicos Los ácidos nucleicos están formados, como ya se ha dicho anteriormente, por la polimerización de muchos nucleótidos, los cuales se unen de la siguiente manera: 3´ pentosa 5´ fosfato 3´ pentosa 5´fosfato Cada molécula tiene una orientación definida, por lo que la cadena es 5´ > 3´. Par T A, con 2 enlaces de hidrógeno Timidina Adenosina Citidina Guanosina Par C G, con 3 enlaces de hidrógeno Adenosina Timidina Guanosina Citidina El par de bases es prácticamente plano, los anillos de pentosa perpendiculares a él. Atendiendo a su estructura y composición existen dos tipos de ácidos nucleicos que son: a) Ácido desoxirribonucleico o ADN o DNA b) Ácido ribonucleico o ARN o RNA

3. - Ácido Desoxirribonucleico o ADN A. - ESTRUCTURA. Está formado por la unión de muchos desoxirribonucleótidos. La mayoría de las moléculas de ADN poseen dos cadenas antiparalelas (una 5´ 3´y la otra 3´ 5´) unidas entre sí mediante las bases nitrogenadas, por medio de puentes de hidrógeno. La adenina enlaza con la timina, mediante dos puentes de hidrógeno, mientras que la citosina enlaza con la guanina, mediante tres puentes de hidrógeno. El ADN es el portador de la información genética, se puede decir por tanto, que los genes están compuestos por Adenosina ADN. Timidina Citidina Guanosina En el exterior se ubican los fosfatos (esqueleto), seguidamente las pentosas, y en el interior paralelamente los pares de bases. ESTRUCTURA PRIMARIA DEL ADN Adenosina Nos muestra la secuencia de nucleótidos encadenados. Es en estas cadenas donde se encuentra la información genética, y dado que el esqueleto es el mismo para todos, la diferencia de la información radica en la distinta secuencia de bases nitrogenadas. Esta secuencia presenta un código, que muestra una información u otra, según el orden de las bases Citidina Timidina Guanosina

3. - Ácido Desoxirribonucleico o ADN ESTRUCTURA SECUNDARIA DEL ADN Es una estructura en doble hélice. Permite explicar el almacenamiento de la información genética y el mecanismo de duplicación del ADN. Fué postulada por Watson y Crick, basandose en: - La difracción de rayos X que habían realizado Franklin y Wilkins - La equivalencia de bases de Chargaff, que dice que la suma de adeninas más guaninas es igual a la suma de timinas más citosinas. Es una cadena doble, dextrógira o levógira, según el tipo de ADN. Ambas cadenas son complementarias, pues la adenina de una se une a la timina de la otra, y la guanina de una a la citosina de la otra. Ambas cadenas son antiparalelas, pues el extremo 3´de una se enfrenta al extremo 5´de la otra. Existen tres modelos de ADN. El ADN de tipo B es el más abundante y es el descubierto por Watson y Crick. ADN tipo B

ADN - A La forma A es una doble hélice, dextrorsa como la B, pero más ancha. La línea ficticia que une los átomos de fósforo define la trayectoria del esqueleto; observa su helicidad. Observa también la inclinación de los pares de bases, mayor que en el DNA B. Observa que los pares de bases se sitúan a un lado del eje de la hélice; por ello, la hélice es más ancha. ADN - B Dos dinucleótidos complementarios emparejan sus bases para formar un fragmento de B DNA bicatenario (o de doble hebra). Para poder emparejar todas las bases manteniendo los enlaces fosfodiéster, cada par de bases se desplaza con respecto al anterior por un giro de unos 36° Se puede ver que el décimo par de bases después del inicial aún no completa una vuelta, mientras que el undécimo la supera; esto indica que el número de pares de bases por vuelta está entre 10 y 11. En este modelo de Watson y Crick, o forma B del DNA, la vuelta de hélice corresonde aproximadamente a 10, 5 pares de bases. Al girar, se puede apreciar que existe una ligera curvatura en el eje de la doble hélice, la estructura real del DNA no es exactamente igual al modelo de Watson y Crick. ADN - Z La forma Z es una doble hélice sinistrorsa, lo que la diferencia de las A y B, y es más estrecha. Observa cómo el esqueleto (línea ficticia que une los átomos de fósforo) avanza girando hacia la izquierda y además describe una línea en zig zag. Esta característica da nombre a la forma Z.

3. - Ácido Desoxirribonucleico o ADN ESTRUCTURA TERCIARIA DEL ADN. Se refiere a como se almacena el ADN en un volumen reducido. Varía según se trate de organismos procariontes o eucariontes: a) En procariontes se pliega como una super hélice en forma, generalmente, circular y asociada a una pequeña cantidad de proteínas. Lo mismo ocurre en la mitocondrias y en los plastos. b) En eucariontes el empaquetamiento ha de ser más complejo y compacto y para esto necesita la presencia de proteínas, como son las histonas y otras de naturaleza no histona (en los espermatozoides las proteínas son las protaminas). A esta unión de ADN y proteínas se conoce como cromatina, en la cual se distinguen diferentes niveles de organización: Nucleosoma Collar de perlas Fibra cromatínica Bucles radiales Cromosoma.

3. - Ácido Desoxirribonucleico o ADN Las 8 moléculas de histona forman un núcleo apretado, rodeado por la cadena de DNA, que le da casi 2 vueltas La cadena de DNA se prolonga, separándose de la partícula central; con la prolongación de ambos extremos interacciona una molécula de histona H 1, a modo de "cierre" del DNA. El conjunto {partícula central + DNA + H 1} constituye el nucleosoma completo. hélice giro hélice Nucleosoma Un tramo en hélice alfa, encaja en el surco mayor del DNA e interacciona directamente con las bases nitrogenadas, llamado "hélice de reconocimiento"; Un corto tramo de péptido sin estructura secundaria (un giro o vuelta); Otra hélice alfa queda más separada del DNA y forma un ángulo fijo con la primera. hélice bucle hélice Un tramo en hélice alfa, encaja en el surco mayor del DNA e interacciona directamente con las bases nitrogenadas (equivalente a la "hélice de reconocimiento" del motivo hélice giro hélice); Un tramo de péptido sin estructura secundaria, más largo que en el motivo hélice giro hélice, Otra hélice alfa que no interacciona con el DNA pero sí con la otra cadena proteica, estabilizando el dímero.

3. - Ácido Desoxirribonucleico o ADN Un motivo de tipo hélice giro hélice que contacta con el surco mayor del DNA (dos tramos en hélice alfa separados por un corto tramo sin estructura secundaria). Una tercera hélice, externa al DNA. Un tramo sin estructura secundaria definida que interacciona con el DNA en el surco menor. homeodominio La estructura que es común con otras proteínas, y por ello se llama motivo, consta de los dos segmentos peptídicos en hélice alfa, que a su vez se arrollan ligeramente entre sí (formando una superhélice). En un extremo, estas hélices interaccionan entre sí y en el otro lo hacen con secuencias específicas de bases en el surco mayor del DNA La interacción entre las dos hélices se mantiene principalmente gracias a la interacción entre cadenas laterales de leucina cremallera de leucina dedo de zinc El motivo consta en este caso de: Un segmento peptídico en hélice alfa y dos en hoja beta antiparalela, de los cuales hay 4 aminoácidos (2 Cys y 2 His) cuyas cadenas laterales coordinan al ion Zn 2+; este tipo de dedo de zinc se denomina por ello C 2 H 2. Se destacan los átomos que coordinan al Zn (N en His y S en Cys).

3. - Ácido Desoxirribonucleico o ADN B. - DESNATURALIZACIÓN DEL ADN. Cuando la temperatura alcanza el punto de fusión del ADN, la agitación térmica es capaz de separar las dos hebras y producir una desnaturalización. Este es un proceso reversible, ya que al bajar la temperatura se puede producir una renaturalización. En este proceso se rompen los puentes de hidrógeno que unen las cadenas y se produce la separación de las mismas, pero no se rompen los enlaces fosfodiester covalentes que forman la secuencia de la cadena. La desnaturalización del ADN puede ocurrir, también, por variaciones en el p. H. Al enfriar lentamente puede renaturalizarse.

4. - Ácidos ribonucleico ARN A. - ESTRUCTURA Está formado por la unión de muchos ribonucleótidos, los cuales se unen entre ellos mediante enlaces fosfodiester en sentido 5´ 3´( igual que en el ADN ). Están formados por una sola cadena, a excepción. Eldel. RNA ARNes bicatenario de los reovirus. formado por uniones 3' 5' un polirribonucleótido, fosfodiéster entre nucleótidos de ribosa (ribonucleótidos). El ribonucleótido AMP, es diferente del desoxirribonucleótido d. AMP (componente del DNA) por la existencia del OH en 2'. ESTRUCTURA PRIMARIA DEL ARN Al igual que el ADN, se refiere a la secuencia de las bases nitrogenadas que constituyen sus nucleótidos Cadena de RNA de 12 nucleótidos, de hebra sencilla (un dodecarribonucleótido). Este oligonucleótido (que es sintético) adopta una disposición en hélice, que permite un apilamiento parcial de las bases, aunque no es muy estable y puede adoptar otras conformaciones. Esqueleto es hidrófilo y polar; y bases son hidrófoba y apolar.

4. - Ácidos ribonucleico ARN ESTRUCTURA SECUNDARIA DEL ARN Alguna vez, en una misma cadena, existen regiones con secuencias complementarias capaces de aparearse Ribozimas: Existen ciertas moléculas de ARN que ejercen actividad catalítica, por tanto, no todas las moléculas con actividad enzimática son proteínas. Un ejemplo, perteneciente al grupo de las ribozimas es la cabeza de martillo, debido a su estructura secundaria. El modelo consta de dos cadenas: una de ARN, que es la ribozima, y otra de DNA, que sería el sustrato. La ribozima corta un enlace fosfodiéster de este sustrato cuando está formado por ribonucleótidos (es un ARN); en este modelo dicho sustrato se ha sustituido por un ADN monocatenario, que, aunque se une a la ribozima, no es hidrolizado y así permite estudiar la estructura del complejo ribozima sustrato. Se representan en color más claro las regiones que forman puentes de hidrógeno entre sus bases complementarias (regiones de doble hélice).

4. - Ácidos ribonucleico ARN ESTRUCTURA TERCIARIA DE ARN Es un plegamiento, complicado, sobre al estructura secundaria.

4. - Ácidos ribonucleico ARN CLASIFICACIÓN DE LOS ARN. Para clasificarlos se adopta la masa molecular media de sus cadenas, cuyo valor se deduce de la velocidad de sedimentación. La masa molecular y por tanto sus dimensiones se miden en svedberg (S). Según esto tenemos: ARN Mensajero (ARNm) Sus características son la siguientes: Cadenas de largo tamaño con estructura primaria. Se le llama mensajero porque transporta la información necesaria para la síntesis proteica. Cada ARNm tiene información para sintetizar una proteína determinada. Su vida media es corta. a) En procariontes el extremo 5´ posee un grupo trifosfato b) En eucariontes en el extremo 5´ posee un grupo metil guanosina unido al trifosfato, y el extremo 3´ posee una cola de poli A En los eucariontes se puede distinguir también: Exones, secuencias de bases que codifican proteínas Intrones, secuencias sin información. Un ARNm de este tipo ha de madurar (eliminación de intrones) antes de hacerse funcional. Antes de madurar, el ARNm recibe el nombre de ARN heterogeneonuclear (ARNhn ).

4. - Ácidos ribonucleico ARN Ribosómico (ARNr) Sus principales características son: Cada ARNr presenta cadena de diferente tamaño, con estructura secundaria y terciaria. Forma parte de las subunidades ribosómicas cuando se une con muchas proteínas. Están vinculados con la síntesis de proteínas.

4. - Ácidos ribonucleico ARN Nucleolar (ARNn) Sus características principales son: Se sintetiza en el nucleolo. Posee una masa molecular de 45 S, que actúa como recursor de parte del ARNr, concretamente de los ARNr 28 S (de la subunidad mayor), los ARNr 5, 8 S (de la subunidad mayor) y los ARNr 18 S (de la subunidad menor)

4. - Ácidos ribonucleico ARNu Sus principales características son: Son moléculas de pequeño tamaño Se les denomina de esta manera por poseer mucho uracilo en su composición Se asocia a proteinas del núcleo y forma ribonucleoproteinas pequeño nucleares (RNPpn) que intervienen en: a) Corte y empalme de ARN b) Maduración en los ARNm de los eucariontes c) Obtención de ARNr a partir de ARNn 45 S.

4. - Ácidos ribonucleico ARN Transferente (ARNt) Sus principales características son. Son moléculas de pequeño tamaño Poseen en algunas zonas estructura secundaria, lo que va hacer que en las zonas donde no hay bases complementarias adquieran un aspecto de bucles, como una hoja de trebol. Los plegamientos se llegan a hacer tan complejos que adquieren una estructura terciaria Su misión es unir aminoácidos y transportarlos hasta el ARNm para sintetizar proteínas. El lugar exacto para colocarse en el ARNm lo hace gracias a tres bases, a cuyo conjunto se llaman anticodón (las complementarias en el ARNm se llaman codón).

4. - Ácidos ribonucleico ARN SINTESIS Y LOCALIZACIÓN DE LOS ARN En la célula eucarionte los ARN se sintetizan gracias a tres tipos de enzimas: ARN polimerasa I, localizada en el nucleolo y se encarga de la síntesis de los ARNr 18 S, 5, 8 S y 28 S. ARN polimerasa II, localizada en el nucleoplasma y se encarga de la síntesis de los ARNhn, es decir de los precursores de los ARNm ARN polimerasa III, localizada en el nucleoplasma y se encarga de sintetizar los ARNr 5 S y los ARNm.
 Molcula
Molcula Molculas
Molculas Molculas
Molculas Molculas
Molculas Dipolo
Dipolo Problemas de dinamica
Problemas de dinamica Que representa
Que representa Partcula
Partcula Encontrar
Encontrar Atomo propiedades
Atomo propiedades Partcula
Partcula Reacciones de los halogenuros de alquilo
Reacciones de los halogenuros de alquilo Qumica moderna
Qumica moderna Acidos organicos
Acidos organicos Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Tipos de carbono
Tipos de carbono (ch3)3cch3 tipo de hidrocarburo
(ch3)3cch3 tipo de hidrocarburo Nomenclatura das bases
Nomenclatura das bases Tabla qumica
Tabla qumica Qumica
Qumica Pilha de daniell
Pilha de daniell Philippe spitaleri kaufmann
Philippe spitaleri kaufmann Qumica
Qumica Qumica
Qumica Qumica
Qumica Metiletanamida
Metiletanamida Lista de atomos
Lista de atomos Hibridação
Hibridação Definição de alcinos
Definição de alcinos Qumica
Qumica Aplicaciones del cloro
Aplicaciones del cloro Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Entalpia de formação
Entalpia de formação Notação de lewis
Notação de lewis As interações entre os íons produzem aglomerados
As interações entre os íons produzem aglomerados Qumica
Qumica Solubilidad quimica
Solubilidad quimica Dipolo dipolo inducido
Dipolo dipolo inducido Entalpia
Entalpia Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Decantação
Decantação Truta
Truta Qumica
Qumica Qumica
Qumica Propiedades quimicas de los alquenos
Propiedades quimicas de los alquenos Qumica
Qumica Constante de henry
Constante de henry Epimeros
Epimeros Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Formula estrutural
Formula estrutural Lei de lavoisier
Lei de lavoisier Qumica
Qumica Qumica
Qumica Atomo de halogenio
Atomo de halogenio Oxissais
Oxissais Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Enlace covalente coordinado
Enlace covalente coordinado Qual a sentença verdadeira
Qual a sentença verdadeira Enxofre rombico e monoclinico diferença
Enxofre rombico e monoclinico diferença Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Ciclano
Ciclano Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Qumica
Qumica Cinética química
Cinética química Qumica
Qumica Como se nombran los eteres
Como se nombran los eteres Setas curvas
Setas curvas Que es el proyecto genoma humano
Que es el proyecto genoma humano Qumica
Qumica Funcion quimica y grupo funcional
Funcion quimica y grupo funcional Materia extensiva
Materia extensiva Qumica
Qumica Qumica
Qumica Etapas da gravimetria
Etapas da gravimetria Contraion
Contraion Qumica
Qumica Qumica
Qumica Os atomos sao formados por protons neutrons e eletrons
Os atomos sao formados por protons neutrons e eletrons Qumica
Qumica Qumica
Qumica Qumica
Qumica Una gimnasta agita una cinta con una frecuencia constante
Una gimnasta agita una cinta con una frecuencia constante Carta formal e informal diferencias
Carta formal e informal diferencias Una instruccion incrustada no puede ser una declaracion c#
Una instruccion incrustada no puede ser una declaracion c# Problema general de las trayectorias
Problema general de las trayectorias La hija de mi hermana es mi ___
La hija de mi hermana es mi ___ Descripción objetiva
Descripción objetiva Las circunferencias y sus elementos
Las circunferencias y sus elementos Variables cuantitativas ejemplos
Variables cuantitativas ejemplos Ejercicios de trabajo y potencia
Ejercicios de trabajo y potencia Baile es un hiato
Baile es un hiato Habia una vez una nina que se caperucita roja apex
Habia una vez una nina que se caperucita roja apex B
B La vida es una mala noche en una mala posada
La vida es una mala noche en una mala posada