10 HIDROLIZA Hydrolysis kisela reakcija sol H 2

















- Slides: 21

10. HIDROLIZA (Hydrolysis) kisela reakcija sol + H 2 O neutralna reakcija = f (priroda soli) alkalna reakcija Hidroliza: reakcija između iona soli i iona vode uz stvaranje slabe kiseline, slabe baze ili obje. Odjel za kemiju

Odjel za kemiju

10. 1. Hidroliza soli jakih kiselina i jakih baza Na. Cl + H 2 O ⇋ Na+ + Cl- + H+ + OH- [H+] = [OH-] = 10 -7 mol/L → p. H = 7 Zaključak: soli ne hidroliziraju; neutralna reakcija Odjel za kemiju

Odjel za kemiju

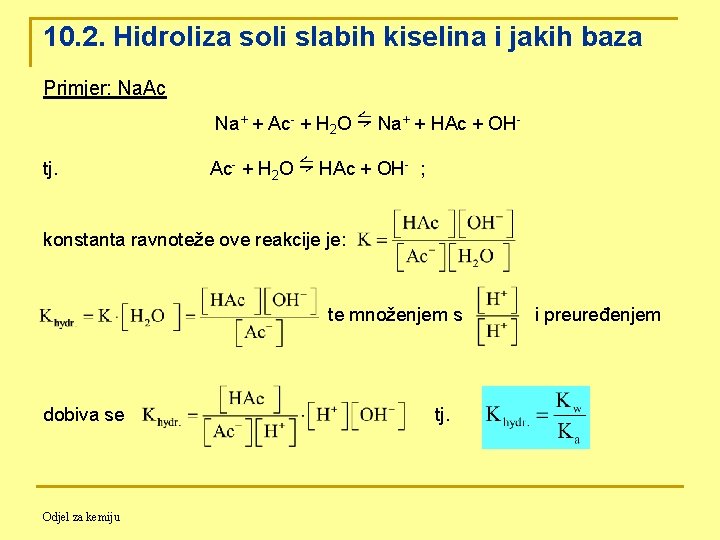
10. 2. Hidroliza soli slabih kiselina i jakih baza Primjer: Na. Ac Na+ + Ac- + H 2 O ⇋ Na+ + HAc + OHtj. Ac- + H 2 O ⇋ HAc + OH- ; konstanta ravnoteže ove reakcije je: te množenjem s dobiva se Odjel za kemiju tj. i preuređenjem

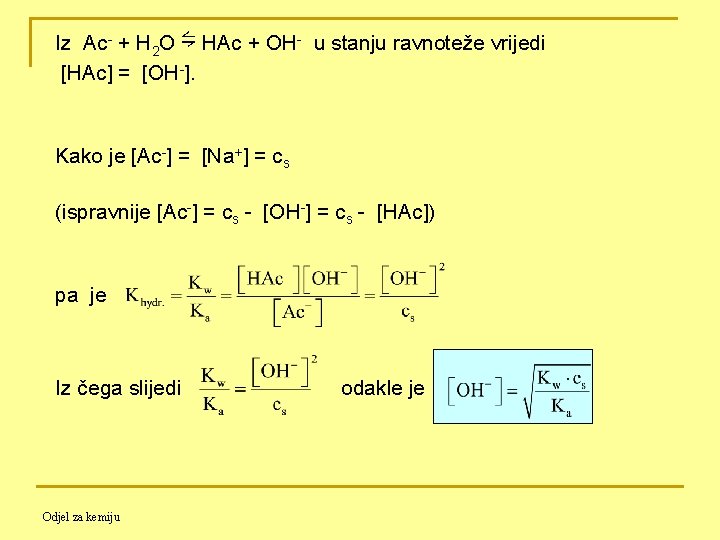
Iz Ac- + H 2 O ⇋ HAc + OH- u stanju ravnoteže vrijedi [HAc] = [OH-]. Kako je [Ac-] = [Na+] = cs (ispravnije [Ac-] = cs - [OH-] = cs - [HAc]) pa je Iz čega slijedi Odjel za kemiju odakle je

Primjer : Izračunati p. H vrijednost 0. 05 M otopine Na. Ac (Ka = 1. 8 x 10 -5). p. OH = -log [OH-] = 5. 28, pa je p. H = 14 – p. OH = 8. 72 Odjel za kemiju

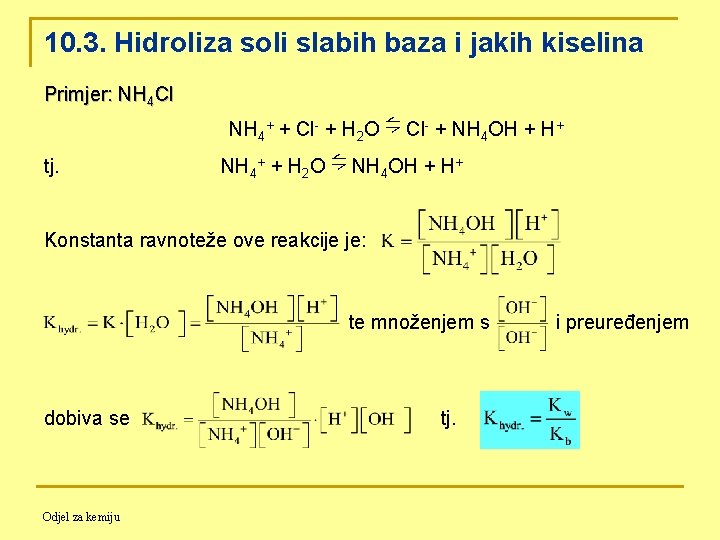
10. 3. Hidroliza soli slabih baza i jakih kiselina Primjer: NH 4 Cl NH 4+ + Cl- + H 2 O ⇋ Cl- + NH 4 OH + H+ tj. NH 4+ + H 2 O ⇋ NH 4 OH + H+ Konstanta ravnoteže ove reakcije je: te množenjem s dobiva se Odjel za kemiju tj. i preuređenjem

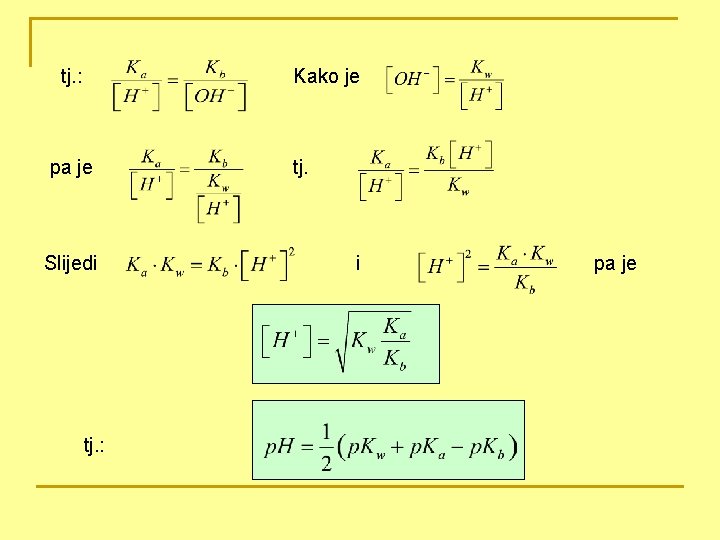
Iz NH 4+ + H 2 O ⇋ NH 4 OH + H+, u stanju ravnoteže [NH 4 OH] = [H+]. Kako je [NH 4+] = cs (ispravnije [NH 4+] = cs - [NH 4 OH] = cs - [H+]) pa je odakle je Odjel za kemiju , tj.

Primjer : Izračunati p. H vrijednost 0. 1 M otopine NH 4 Cl (Kb = 1. 75 x 10 -5). p. H = 5. 12 Odjel za kemiju

10. 4. Hidroliza soli slabih baza i slabih kiselina - vodena otopina amonijeva acetata - oba će iona reagirati s vodom, a p. H će ovisiti o konstanti ionizacije odgovarajuće kiseline i baze - u slučaju amonijeva acetata konstante ionizacije CH 3 COOH i NH 4 OH su jednake pa će p. H biti neutralan. Odjel za kemiju

- otopimo li u vodi sol nastalu neutralizacijom slabe kiseline slabom bazom, oba nastala iona bit će podložna hidrolizi - nastali ioni podliježu hidrolizi: Odjel za kemiju

- Ako pomnožimo i podijelimo ovu jednadžbu ionskim produktom vode Odjel za kemiju

p. H vrijednost soli slabe baze (MOH) i slabe kiseline (HA) Sol MA disocira: pa je tj. : pretpostavka: HA i MOH imaju sličan stupanj hidrolize, tj.

tj. : Kako je pa je Slijedi tj. : tj. i pa je

Primjer 1 Izračunaj stupanj hidrolize i p. H otopine amonij – acetata koncentracije c = 0. 1 mol/L, ako su koncentracijske konstante disocijacije Odjel za kemiju

Odjel za kemiju

Odjel za kemiju

Odjel za kemiju

10. 5. Učinak zajedničkog iona (Common ion effect) - Učinak zajedničkog iona je poseban slučaj primjene zakona kemijske ravnoteže na reakcije ionizacije. - Na primjer, u otopini slabe baze, amonijevog hidroksida, postoji ravnoteža: - Dodatak NH 4 Cl, (NH 4)2 SO 4, ili bilo koje druge topljive amonijeve soli, + povećat će koncentraciju NH 4 , i zbog toga povećati broj sudara u + sekundi između NH 4 i OH. - Ravnoteža će biti pomaknuta u lijevo, i koncentracija OH bit će + smanjena. NH 4 , budući je zajednički i amonij hidroksidu i dodanoj soli amonijaka, nazvan je „zajednički ion“. Odjel za kemiju -

- Na isti način soli koje su samo slabo topljive, mogu se učiniti čak još manje topljivim povećavajući koncentraciju zajedničkog iona. - Na primjer, ravnoteža između slabo topljivih soli gipsa, Ca. SO 4· 2 H 2 O, i njegovih iona u otopini predstavlja jednadžba: - Dodatak bilo Ca 2+ ili SO 42 - , iz bilo koje topljive soli koja sadržava jedan od ovih iona, pomaknut će ravnotežu u lijevo i smanjiti topljivost. Odjel za kemiju
 Hidroliza soli
Hidroliza soli Fruktofuranoza
Fruktofuranoza Koloid liofil contoh
Koloid liofil contoh Primarna struktura nukleinskih kiselina
Primarna struktura nukleinskih kiselina Pirogalolul
Pirogalolul Hidroliza
Hidroliza Fructopiranoza
Fructopiranoza Baze kiseline i soli
Baze kiseline i soli Pentru esterificarea acidului propanoic
Pentru esterificarea acidului propanoic Karbonilna skupina
Karbonilna skupina Koja so u vodenom rastvoru ne hidrolizuje
Koja so u vodenom rastvoru ne hidrolizuje Monosaharidi disaharidi polisaharidi
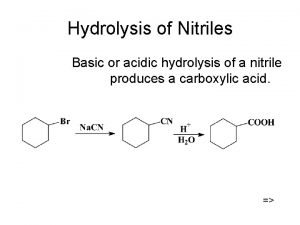
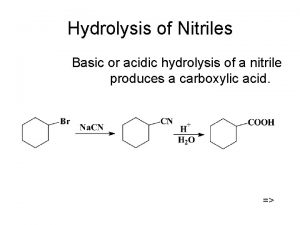
Monosaharidi disaharidi polisaharidi Hidroliza nitrila
Hidroliza nitrila Hidroliza
Hidroliza Fenoli reactii
Fenoli reactii Beta d fruktoza
Beta d fruktoza Stopnja protolize
Stopnja protolize Kemija atomi 7 razred
Kemija atomi 7 razred Termidorska reakcija
Termidorska reakcija Hidrolize reiksme
Hidrolize reiksme 2-metilpentanas
2-metilpentanas Lavoazijeov zakon
Lavoazijeov zakon