TURINYS Alkan sandara 3 Homologin eil 12 Nomenklatra



























- Slides: 53


TURINYS Alkanų sandara. . . . 3 Homologinė eilė. . . 12 Nomenklatūra. . . . 14 Izomerija. . . . 17 Gavimo būdai. . . . 22 Fizikinės savybės. . . 29 Cheminės savybės. . . 33 Atpažinimo reakcijos. . . . . 52 Šaltiniai. . . . 53 2

Alkanai – tai angliavandeniliai, prisotinti vandenilio. Iš čia ir pavadinimas: sotieji, arba prisotintieji, angliavandeniliai. Kitaip jie dar vadinami parafinais. 3

Paplitimas gamtoje • Gamtines dujos - 75%-85% metanas, 25%-2% etanas, propanas ir kiti. • Nafta ir naftos dujos – 30%-80% metanas, 4 % -20 % etanas, 5 % -20 % propanas, 5 % -20 % butanas. • Akmens anglis 4

С 18 Н 38 + Сu. О = 18 СО 2 + 19 Н 2 О + 55 Сu Ca (OH)2 + CO 2 = Ca. CO 3 ↓ + H 2 O 5

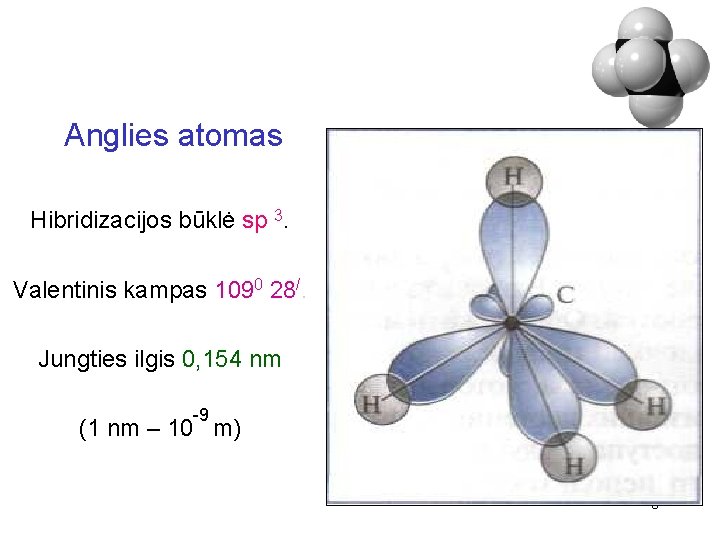
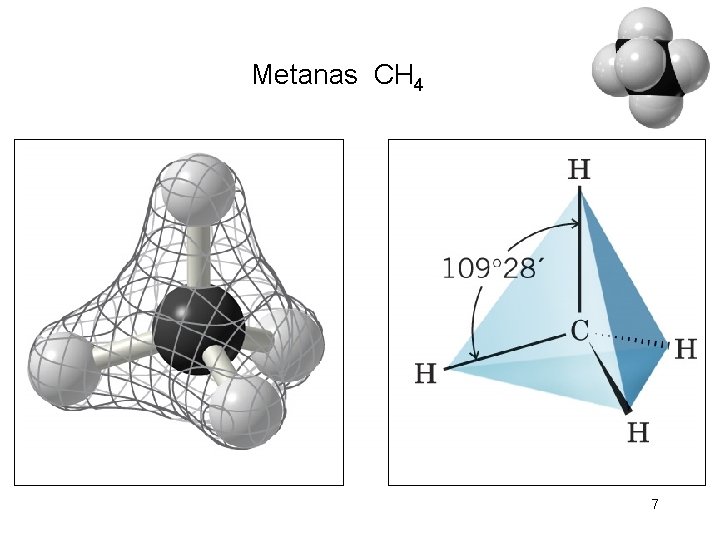
Anglies atomas Hibridizacijos būklė sp 3. Valentinis kampas 1090 28/. Jungties ilgis 0, 154 nm -9 (1 nm – 10 m) 6

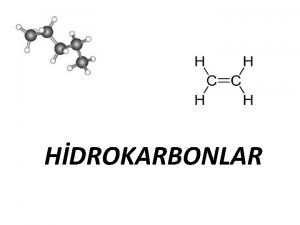
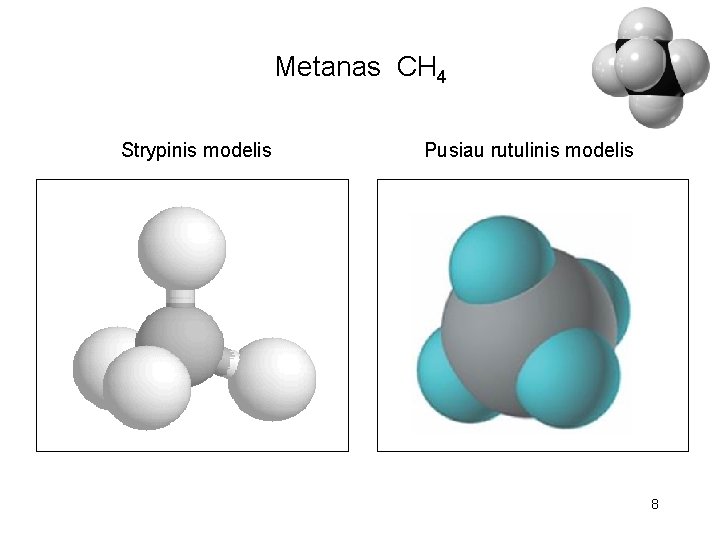
Metanas CH 4 7

Metanas CH 4 Strypinis modelis Pusiau rutulinis modelis 8

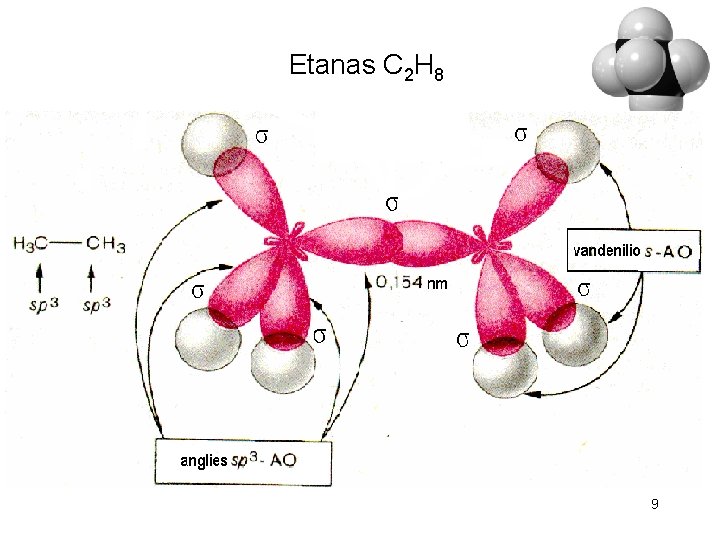
Etanas C 2 H 8 9

Etanas C 2 H 8 Strypinis modelis Pusiau rutulinis modelis 10

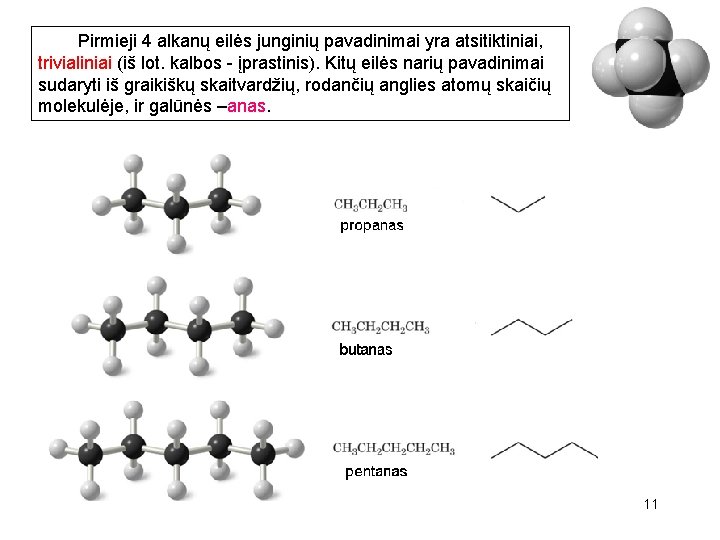
Pirmieji 4 alkanų eilės junginių pavadinimai yra atsitiktiniai, trivialiniai (iš lot. kalbos - įprastinis). Kitų eilės narių pavadinimai sudaryti iš graikiškų skaitvardžių, rodančių anglies atomų skaičių molekulėje, ir galūnės –anas. 11

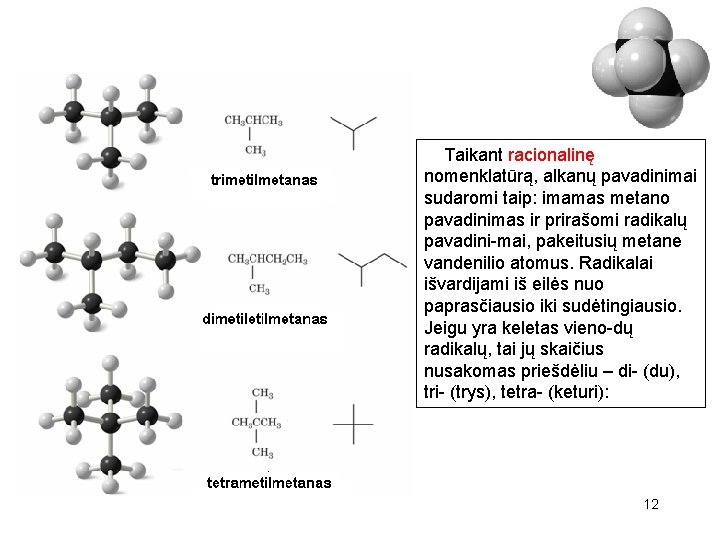
Taikant racionalinę nomenklatūrą, alkanų pavadinimai sudaromi taip: imamas metano pavadinimas ir prirašomi radikalų pavadini-mai, pakeitusių metane vandenilio atomus. Radikalai išvardijami iš eilės nuo paprasčiausio iki sudėtingiausio. Jeigu yra keletas vieno-dų radikalų, tai jų skaičius nusakomas priešdėliu – di- (du), tri- (trys), tetra- (keturi): 12

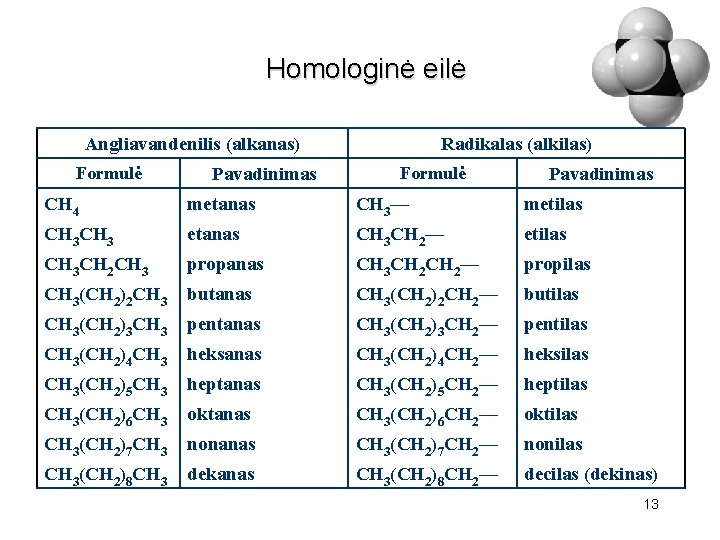
Homologinė eilė Angliavandenilis (alkanas) Formulė Pavadinimas Radikalas (alkilas) Formulė Pavadinimas CH 4 metanas CH 3— metilas CH 3 etanas CH 3 CH 2— etilas CH 3 CH 2 CH 3 propanas CH 3 CH 2— propilas CH 3(CH 2)2 CH 3 butanas CH 3(CH 2)2 CH 2— butilas CH 3(CH 2)3 CH 3 pentanas CH 3(CH 2)3 CH 2— pentilas CH 3(CH 2)4 CH 3 heksanas CH 3(CH 2)4 CH 2— heksilas CH 3(CH 2)5 CH 3 heptanas CH 3(CH 2)5 CH 2— heptilas CH 3(CH 2)6 CH 3 oktanas CH 3(CH 2)6 CH 2— oktilas CH 3(CH 2)7 CH 3 nonanas CH 3(CH 2)7 CH 2— nonilas CH 3(CH 2)8 CH 3 dekanas CH 3(CH 2)8 CH 2— decilas (dekinas) 13

Homologinė eilė 14

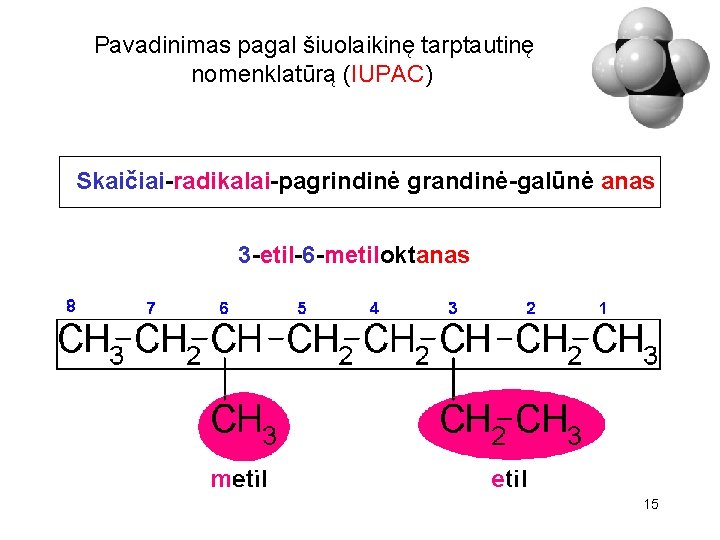
Pavadinimas pagal šiuolaikinę tarptautinę nomenklatūrą (IUPAC) Skaičiai-radikalai-pagrindinė grandinė-galūnė anas 3 -etil-6 -metiloktanas 15

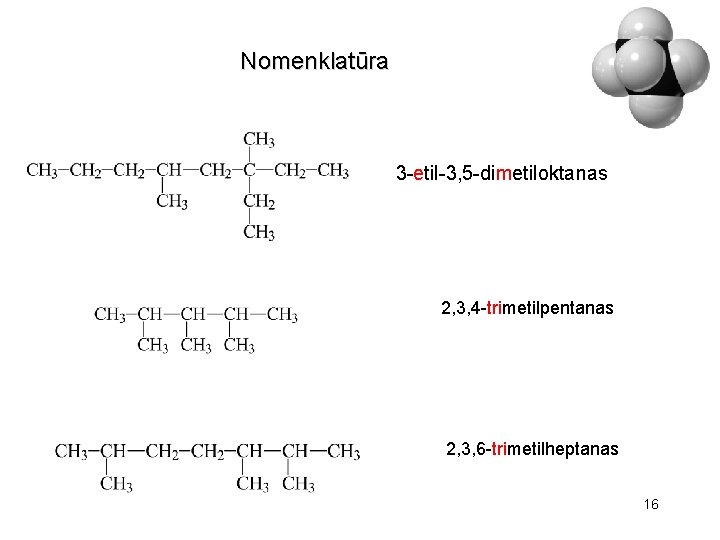
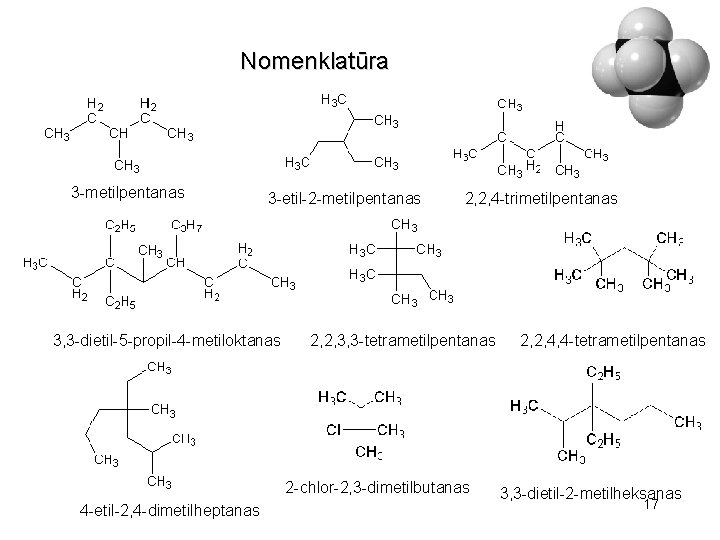
Nomenklatūra 3 -etil-3, 5 -dimetiloktanas 2, 3, 4 -trimetilpentanas 2, 3, 6 -trimetilheptanas 16

Nomenklatūra 3 -metilpentanas 3 -etil-2 -metilpentanas 3, 3 -dietil-5 -propil-4 -metiloktanas 2, 2, 4 -trimetilpentanas 2, 2, 3, 3 -tetrametilpentanas 2 -chlor-2, 3 -dimetilbutanas 4 -etil-2, 4 -dimetilheptanas 2, 2, 4, 4 -tetrametilpentanas 3, 3 -dietil-2 -metilheksanas 17

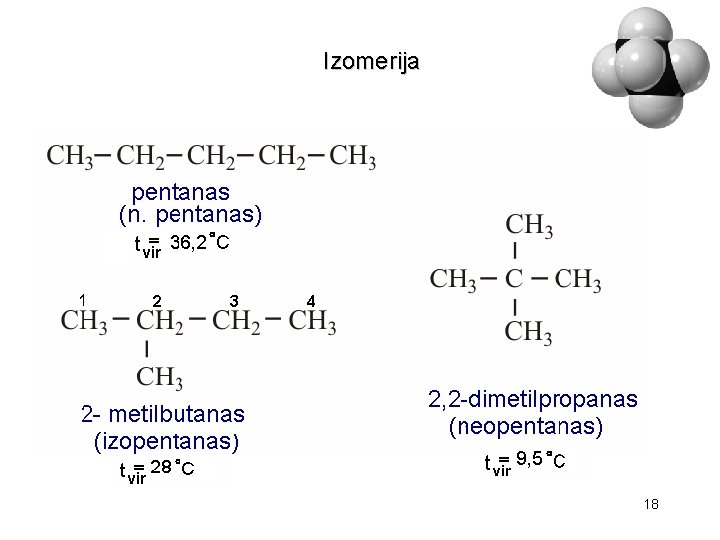
Izomerija 18

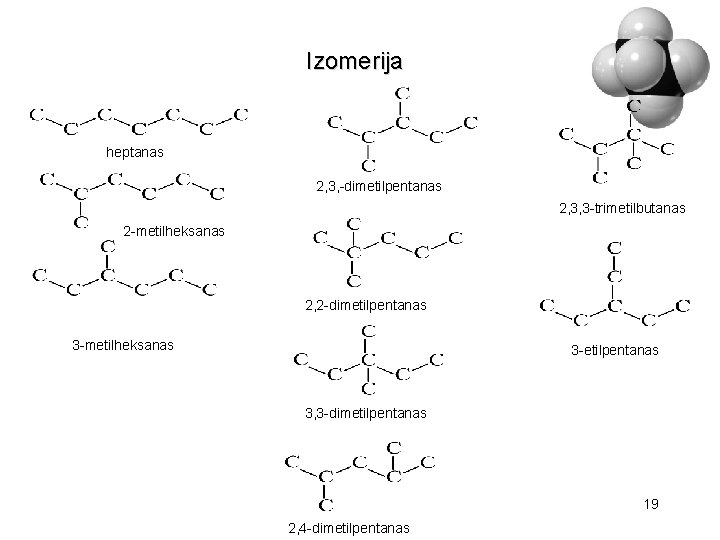
Izomerija heptanas 2, 3, -dimetilpentanas 2, 3, 3 -trimetilbutanas 2 -metilheksanas 2, 2 -dimetilpentanas 3 -metilheksanas 3 -etilpentanas 3, 3 -dimetilpentanas 19 2, 4 -dimetilpentanas

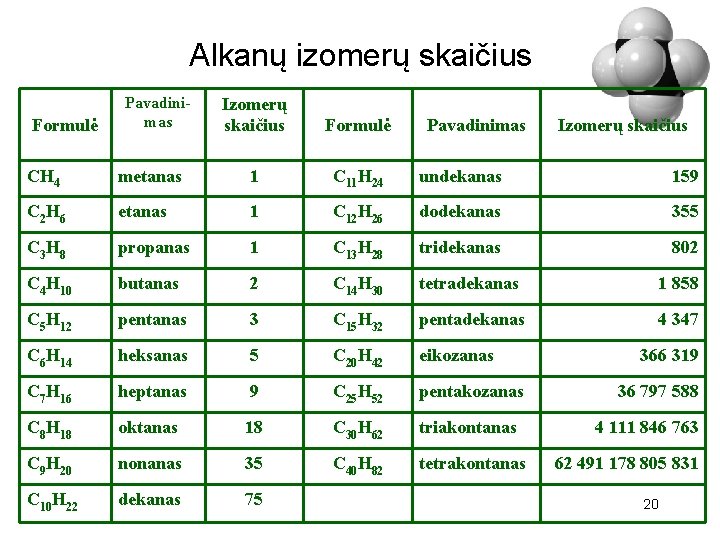
Alkanų izomerų skaičius Formulė Pavadinimas Izomerų skaičius CH 4 metanas 1 C 11 H 24 undekanas 159 C 2 H 6 etanas 1 C 12 H 26 dodekanas 355 C 3 H 8 propanas 1 C 13 H 28 tridekanas 802 C 4 H 10 butanas 2 C 14 H 30 tetradekanas 1 858 C 5 H 12 pentanas 3 C 15 H 32 pentadekanas 4 347 C 6 H 14 heksanas 5 C 20 H 42 eikozanas C 7 H 16 heptanas 9 C 25 H 52 pentakozanas C 8 H 18 oktanas 18 C 30 H 62 triakontanas C 9 H 20 nonanas 35 C 40 H 82 tetrakontanas C 10 H 22 dekanas 75 366 319 36 797 588 4 111 846 763 62 491 178 805 831 20

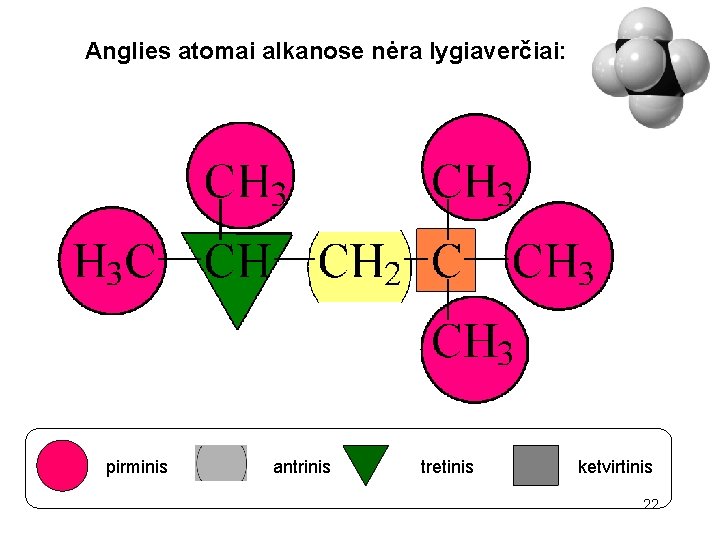
Anglies atomai angliavandeniliuose nėra lygiaverčiai: pirminis tretinis antrinis ketvirtinis 21

Anglies atomai alkanose nėra lygiaverčiai: pirminis antrinis tretinis ketvirtinis 22

Alkanų gavimo būdai Reakcijos, kurioms vykstant nesikeičia anglies atomų skaičius molekulėje: ► Nesočiųjų angliavandenilių hidrinimas Reakcijos, kurioms vykstant sumažėja anglies atomų skaičius molekulėje: ► Krekingas ► Monokarboninių rūgščių druskų lydymas su šarmais Reakcijos, kurioms vykstant pasidaro sudėtingesnis anglies skeletas: ► Viurco reakcija ► Tiesioginė sintezė iš elementų ► Katalizinis anglies monoksido hidrinimas 200 - 400°C temperatūroje 23

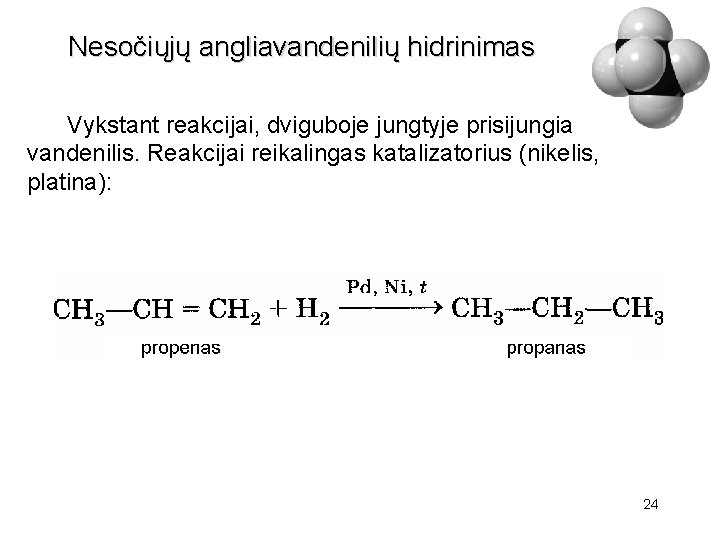
Nesočiųjų angliavandenilių hidrinimas Vykstant reakcijai, dviguboje jungtyje prisijungia vandenilis. Reakcijai reikalingas katalizatorius (nikelis, platina): 24

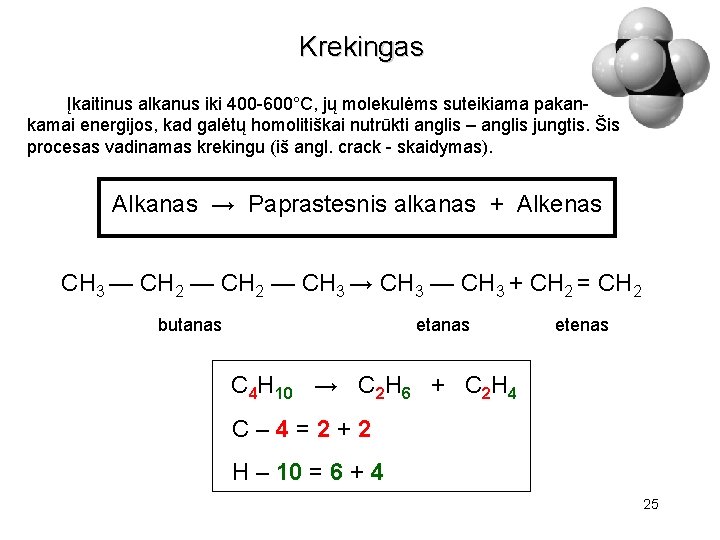
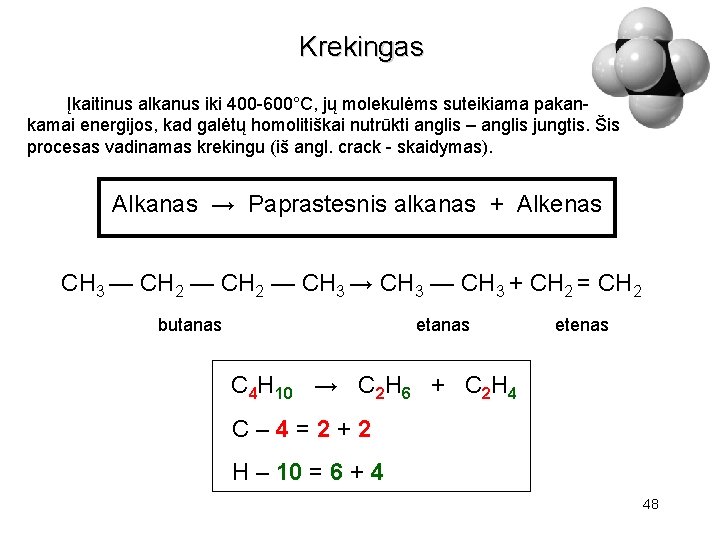
Krekingas Įkaitinus alkanus iki 400 -600°C, jų molekulėms suteikiama pakankamai energijos, kad galėtų homolitiškai nutrūkti anglis – anglis jungtis. Šis procesas vadinamas krekingu (iš angl. crack - skaidymas). Alkanas → Paprastesnis alkanas + Alkenas CH 3 — CH 2 — CH 3 → CH 3 — CH 3 + CH 2 = CH 2 butanas etenas C 4 H 10 → C 2 H 6 + C 2 H 4 C– 4=2+2 H – 10 = 6 + 4 25

Monokarboninių rūgščių druskų lydymas su šarmais CH 3 COONa + Na. OH = CH 4 + Na 2 CO 3 26

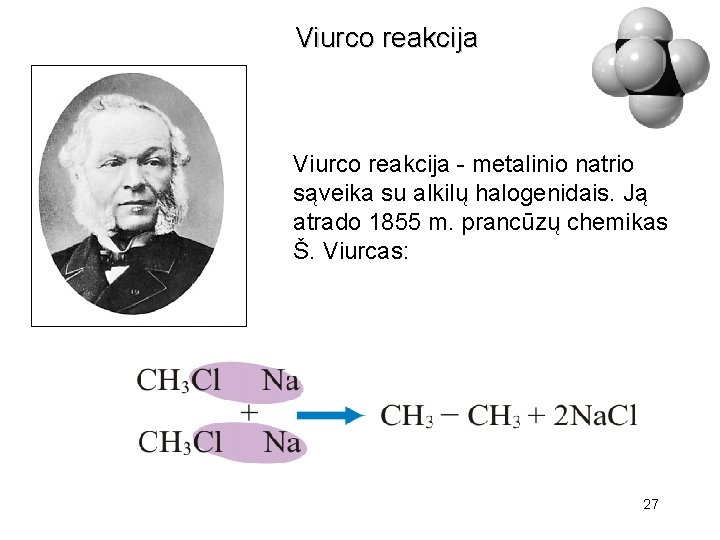
Viurco reakcija - metalinio natrio sąveika su alkilų halogenidais. Ją atrado 1855 m. prancūzų chemikas Š. Viurcas: 27

Tiesioginė sintezė iš elementų Metanas susidaro elektros lanke tarp anglies dalyvaujant vandeniliui: elektrodų, C + 2 H 2 → CH 4 Katalizinis anglies monoksido hidrinimas 200 - 400°C temperatūroje: n. CO + 2(n + 1) H 2 → Cn. H 2 n+2 + n. H 2 O 28

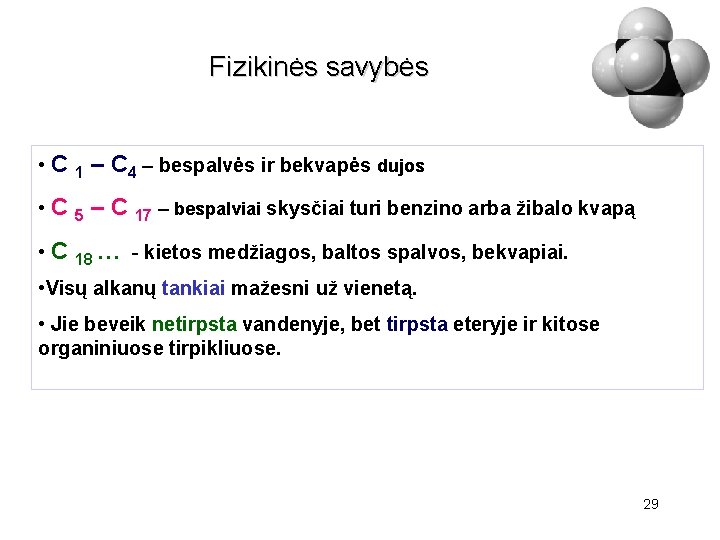
Fizikinės savybės • С 1 – С 4 – bespalvės ir bekvapės dujos • С 5 – С 17 – bespalviai skysčiai turi benzino arba žibalo kvapą • С 18 … - kietos medžiagos, baltos spalvos, bekvapiai. • Visų alkanų tankiai mažesni už vienetą. • Jie beveik netirpsta vandenyje, bet tirpsta eteryje ir kitose organiniuose tirpikliuose. 29

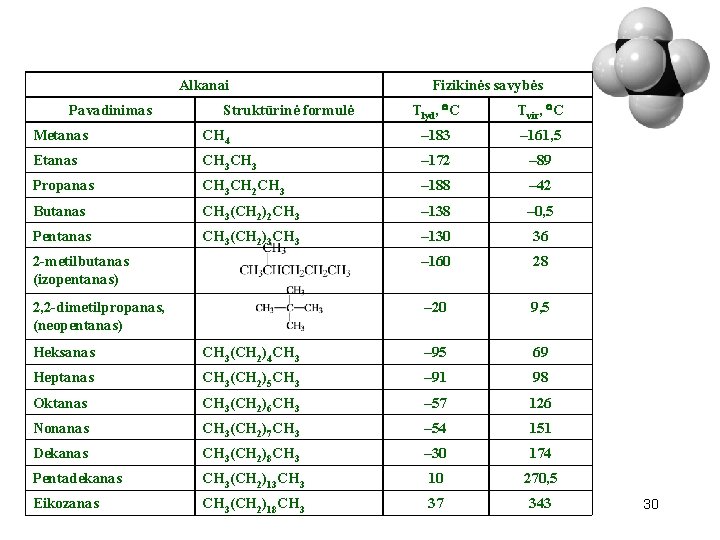
Alkanai Pavadinimas Struktūrinė formulė Fizikinės savybės Tlyd, С Tvir, С Metanas CH 4 – 183 – 161, 5 Etanas CH 3 – 172 – 89 Propanas CH 3 CH 2 CH 3 – 188 – 42 Butanas CH 3(CH 2)2 CH 3 – 138 – 0, 5 Pentanas CH 3(CH 2)3 CH 3 – 130 36 2 -metilbutanas (izopentanas) – 160 28 2, 2 -dimetilpropanas, (neopentanas) – 20 9, 5 Heksanas CH 3(CH 2)4 CH 3 – 95 69 Heptanas CH 3(CH 2)5 CH 3 – 91 98 Оktanas CH 3(CH 2)6 CH 3 – 57 126 Nonanas CH 3(CH 2)7 CH 3 – 54 151 Dekanas CH 3(CH 2)8 CH 3 – 30 174 Pentadekanas CH 3(CH 2)13 CH 3 10 270, 5 Eikozanas CH 3(CH 2)18 CH 3 37 343 30

Homologinėje eilėje laipsniškai didėja alkanų virimo, lydimosi temperatūra, taip pat tankis. 31

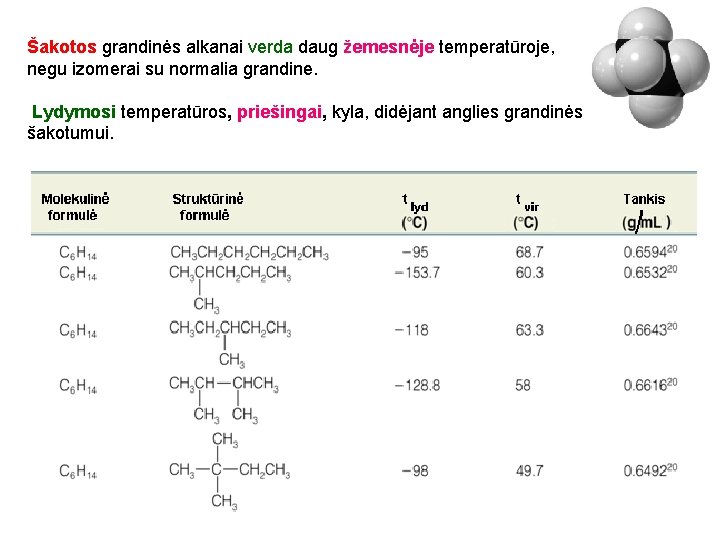
Šakotos grandinės alkanai verda daug žemesnėje temperatūroje, negu izomerai su normalia grandine. Lydymosi temperatūros, priešingai, kyla, didėjant anglies grandinės šakotumui. 32

Cheminės savybės Alkanai chemiškai mažai aktyvus, dėl to jie ir buvo pavadinti parafinais (iš lot. kalbos parum afinis – neturįs giminystės). Prijungimo reakcijose alkanai nedalyvauja. Tik ypatingomis sąlygomis galima atlikti kitas alkanų chemines reakcijas. Viena jų – radikalinė pakaitų reakcija. Jai būdingas grandininis mechanizmas. Grandininė reakcija – reakcija, kurios kiekvienoje stadijoje susidaro aktyvi dalelė – radikalas, sužadinantis sekančią reakciją. 33

Grandininis mechanizmas Reakcijos pradžia (iniciacija): 1) X—X 2 X • Grandinės augimo reakcijos: 2) X • + R—H H—X + R • 3) R • + X—X R—X + X • 2), 3), 2), 3)… Grandinės nutrūkimas (reakcijos pabaiga): 4) 2 X • X—X 5) R • + X • R—X 6) 2 R • R—R 34

Halogeninimas – labai svarbi alkanų reakcija. Halogeninimo agentu gali būti ne tik chloras, bet ir bromas. Jodas nepajėgia reakcijoje tiesiogiai pakeisti vandenilio, o fluoras reaguoja labai energingai ir, gali visiškai suardyti organines molekules. 35

Halogeninimas Reakcijos reagentai: metanas, chloras, amoniako vandeninis tirpalas 36

Halogeninimas Metanas, tekantis vamzdeliu, padegamas 37

Halogeninimas Stiklinis dangtis, uždengiantis cilindrą, pripildytą chloro, nuimamas ir į cilindro vidų įkišama metano liepsna 38

Halogeninimas Metanas reaguoja su chloru sudarydamas suodžius, vandenilio chloridą ir įvairių metano ir chloro darinių mišinį CH 4 (d. ) + Cl 2(d. ) → HCl (d. ) + C (k. ) + metano ir chloro darinių mišinys 39

Halogeninimas Norint įrodyti, kad reakcijos metu susidaro vandenilio chloridas, prie cilindro angos prikišamas kamštis nuoamoniako vandeninio tirpalo butelio. 40

Halogeninimas Susidaro baltos spalvos amonio chlorido dūmai HCl (d. ) + NH 4 OH (d. ) → NH 4 Cl (d. ) + H 2 O (d. ) 41

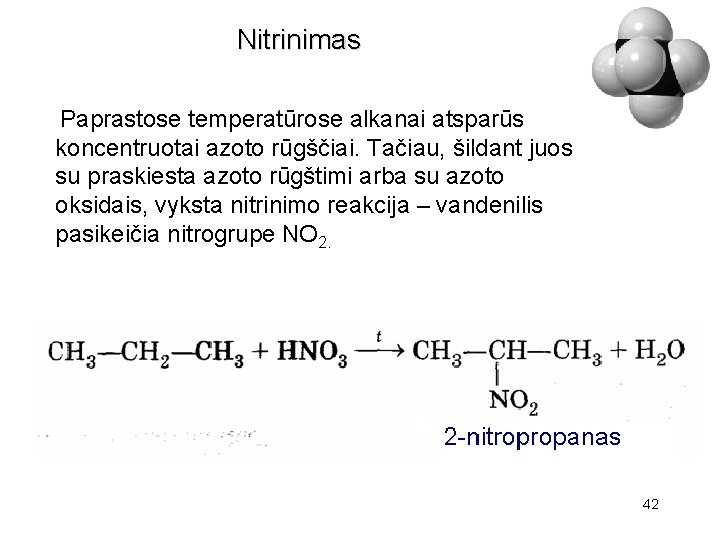
Nitrinimas Paprastose temperatūrose alkanai atsparūs koncentruotai azoto rūgščiai. Tačiau, šildant juos su praskiesta azoto rūgštimi arba su azoto oksidais, vyksta nitrinimo reakcija – vandenilis pasikeičia nitrogrupe NO 2. 42

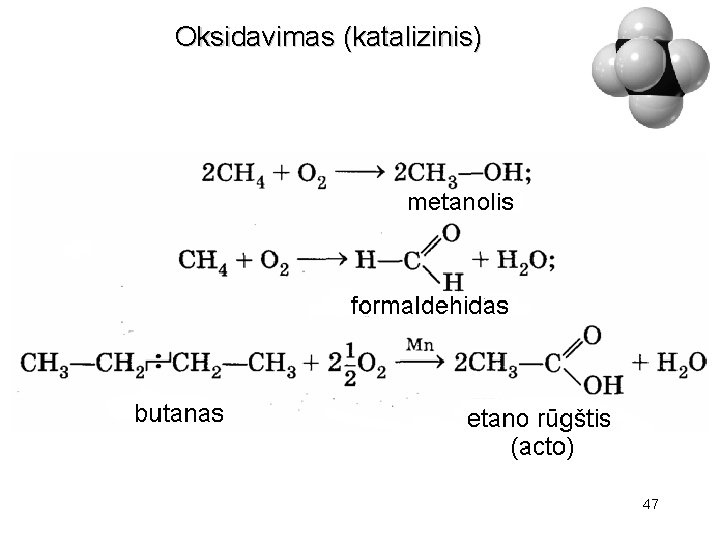
Oksidavimas Alkanų paprastoje temperatūroje neveikia oro deguonis ir paprasti oksidatoriai. Ore padegti alkanai liepsnoja ir dega: 43

Oksidavimas Metano ir deguonies mišinys yra labai sprogus 44

Oksidavimas Heksano ir žibalo (C 12 -C 18) degimas 45

Oksidavimas Parafino (C 16 -C 40) degimas 46

Oksidavimas (katalizinis) 47

Krekingas Įkaitinus alkanus iki 400 -600°C, jų molekulėms suteikiama pakankamai energijos, kad galėtų homolitiškai nutrūkti anglis – anglis jungtis. Šis procesas vadinamas krekingu (iš angl. crack - skaidymas). Alkanas → Paprastesnis alkanas + Alkenas CH 3 — CH 2 — CH 3 → CH 3 — CH 3 + CH 2 = CH 2 butanas etenas C 4 H 10 → C 2 H 6 + C 2 H 4 C– 4=2+2 H – 10 = 6 + 4 48

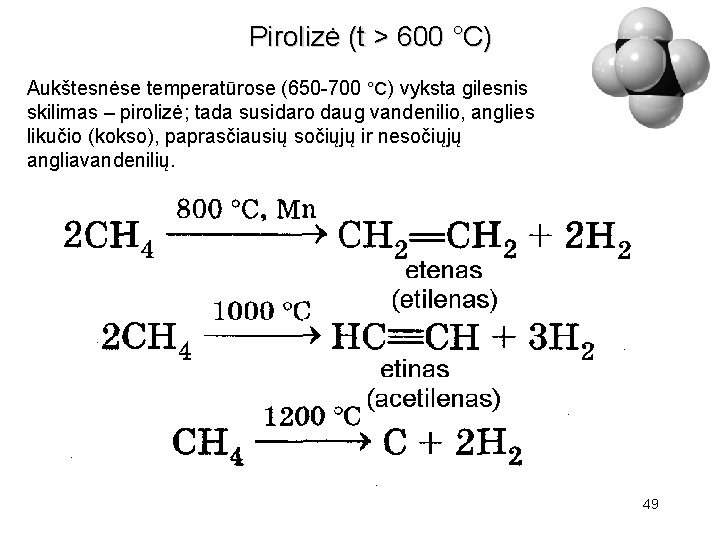
Pirolizė (t > 600 °С) Aukštesnėse temperatūrose (650 -700 °С) vyksta gilesnis skilimas – pirolizė; tada susidaro daug vandenilio, anglies likučio (kokso), paprasčiausių sočiųjų ir nesočiųjų angliavandenilių. • • 49

Dehidrinimas – vandenilio atskilimas, virstant sotiesiems angliavandeniliams nesočiais: 1500°C 2 CH 4 → C 2 H 2 + 3 H 2 Metano konversija Anglies monoksido ir vandenilio mišinys gaminamas vykdant metano konversiją vandens garais: 800°C CH 4 + H 2 O → CO + 3 H 2 50

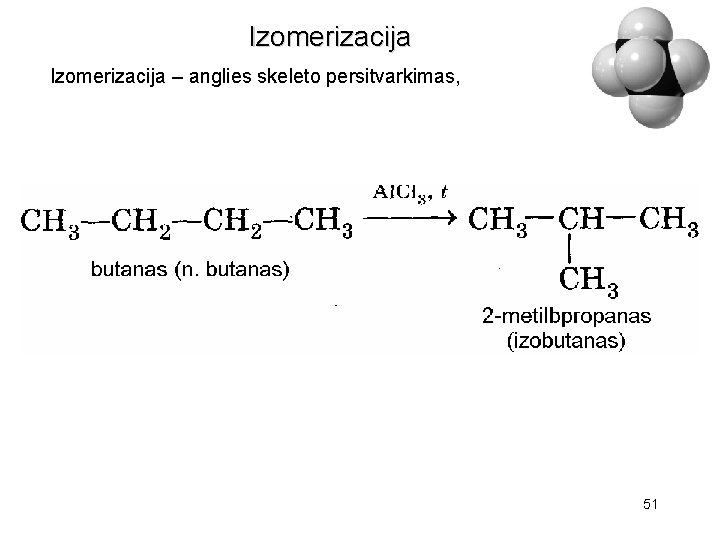
Izomerizacija – anglies skeleto persitvarkimas, 51

Atpažinimo reakcijos Neblukina bromo ir kalio permanganato tirpalus 52

Šaltiniai Literatūra: V. Potatovas, S. Tatarinčik “Organinė chemija”, Vilnius, “Mokslas”, 1977 Nuotraukų šaltinis: www. jce. divched. org Filmukų šaltinis: http: //school-collection. edu. ru/ 53
 Viurco sinteze
Viurco sinteze Homographe de vase
Homographe de vase Edms eil
Edms eil Najjednoduchsi alkan
Najjednoduchsi alkan H
H Birce alkan
Birce alkan Dr murat alkan
Dr murat alkan Yb mehmet alkan
Yb mehmet alkan Ramazan alkan
Ramazan alkan Alkan alken alkin asitlik sıralaması
Alkan alken alkin asitlik sıralaması Alkanw
Alkanw Birce alkan
Birce alkan Alkan svaly
Alkan svaly Pediatrik vücut yüzey alanı hesaplama formülü
Pediatrik vücut yüzey alanı hesaplama formülü Turinys ateminys
Turinys ateminys Tūrinys
Tūrinys Dalinys matematikoje
Dalinys matematikoje Kas yra turinys matematikoje
Kas yra turinys matematikoje Referato titulinis lapas
Referato titulinis lapas Reomiuro
Reomiuro Pastraipos sandara
Pastraipos sandara Akies optines savybes
Akies optines savybes Makšties sandara
Makšties sandara Odos funkcijos
Odos funkcijos Kompiuterio sandara
Kompiuterio sandara Samprotavimo pastraipa pavyzdys
Samprotavimo pastraipa pavyzdys Neptuno palydovas
Neptuno palydovas Sieninė geltonkerpė
Sieninė geltonkerpė žiedo sandara
žiedo sandara Ana pansevič
Ana pansevič Kotopachis
Kotopachis Akies sandara
Akies sandara Valkčiadumblis sandara
Valkčiadumblis sandara Teleskopo sandara
Teleskopo sandara Merkurijaus sandara
Merkurijaus sandara Kiaušinio sandara
Kiaušinio sandara Virpamasis epitelis
Virpamasis epitelis Ploniausios kraujagysles
Ploniausios kraujagysles Inksto sandara
Inksto sandara Triburis
Triburis Dauba vulkano virsuneje
Dauba vulkano virsuneje Galvos sandara
Galvos sandara Katekizmo sandara
Katekizmo sandara šįryt kalbos dalis
šįryt kalbos dalis Automobilio sandara
Automobilio sandara Kometa 1996
Kometa 1996 Kraujo apytakos ratai
Kraujo apytakos ratai Plazmin
Plazmin Makšties sandara
Makšties sandara Sirdies sandara
Sirdies sandara Pastraipos sandara
Pastraipos sandara Galvaninio elemento sandara
Galvaninio elemento sandara Bursa subtendinea m. subscapularis
Bursa subtendinea m. subscapularis Nekaitoma kalbos dalis
Nekaitoma kalbos dalis