RAVNOTEJA V VODNIH RAZTOPINAH PROTOLITSKE INALI IONSKE REAKCIJE





![Brønsted-Lowryeva teorija kislin in baz Al 3+(aq) je kislina [Al(H 2 O)6]3+ + H Brønsted-Lowryeva teorija kislin in baz Al 3+(aq) je kislina [Al(H 2 O)6]3+ + H](https://slidetodoc.com/presentation_image_h/8d09b1c0b932d2340513920e30f76aad/image-6.jpg)

![Lewisove kisline in baze Tvorba kompleksnih ionov; npr. [Al(H 2 O)6]3+ Al. Cl 3(s) Lewisove kisline in baze Tvorba kompleksnih ionov; npr. [Al(H 2 O)6]3+ Al. Cl 3(s)](https://slidetodoc.com/presentation_image_h/8d09b1c0b932d2340513920e30f76aad/image-9.jpg)







- Slides: 18

RAVNOTEŽJA V VODNIH RAZTOPINAH: PROTOLITSKE IN/ALI IONSKE REAKCIJE

Teorije kislin in baz Arhenius: Kisline v vodni raztopini disociirajo na "vodikove ione“ Baze v vodni raztopini disociirajo na hidroksidne ione HCl H+ + Cl Na. OH Na+ + OH Bazičnost amoniaka in organskih aminov se ni dalo razložiti V raztopini amoniaka so predpostavili, da nastanejo molekule NH 4 OH

Jandrova definicija kislin in baz Kisline so snovi, ki disociirajo enake katione kot topilo Baze so snovi, ki disociirajo enake anione kot topilo 2 H 2 O H 3 O+ + OH Definicija ni omejena na vodo kot topilo Amoniak kot topilo: 2 NH 3 NH 4+ + NH 2 – Amonieve soli so v tekočem amoniaku kisline • NH 4 Cl, NH 4 NO 3, …. – Amidi so v tekočem amoniaku baze • KNH 2

Brønsted-Lowryeva teorija kislin in baz Kisline so snovi, ki oddajo protone Baze so snovi, ki protone sprejmejo Kislina vedno odda proton bazi HA + B kislina(1) A + HB+ baza(1) baza(2) kislina(2) konjugirana baza konjugirana kislina

Brønsted-Lowryeva teorija kislin in baz NH 3(g) + HCl(g) NH 4 Cl(s) NH 4+ Cl kislina baza Protolitska reakcija Ca. O z vodo: O 2 (s) + H 2 O(l) 2 OH (aq) Ca. O(s) + H 2 O(l) Ca 2+(aq) + 2 OH (aq) kalcijevi ioni pri reakciji ne sodelujejo
![BrønstedLowryeva teorija kislin in baz Al 3aq je kislina AlH 2 O63 H Brønsted-Lowryeva teorija kislin in baz Al 3+(aq) je kislina [Al(H 2 O)6]3+ + H](https://slidetodoc.com/presentation_image_h/8d09b1c0b932d2340513920e30f76aad/image-6.jpg)
Brønsted-Lowryeva teorija kislin in baz Al 3+(aq) je kislina [Al(H 2 O)6]3+ + H 2 O(l) [Al. OH(H 2 O)5]2+ + H 3 O+(aq)

Lewisove kisline in baze Lewisova kislina je delec( atom, ion ali molekula), ki je akceptor elektronskega para Lewisova baza je delec, ki je donor elektronskega para A + B A B kislina baza adukt V aduktu je koordinativna kovalentna vez OH ion in NH 3 sta bazi po Lewisovi in po Brønsted-Lowryeva teoriji HCl ni Lewisova kislina pač pa H+ ion

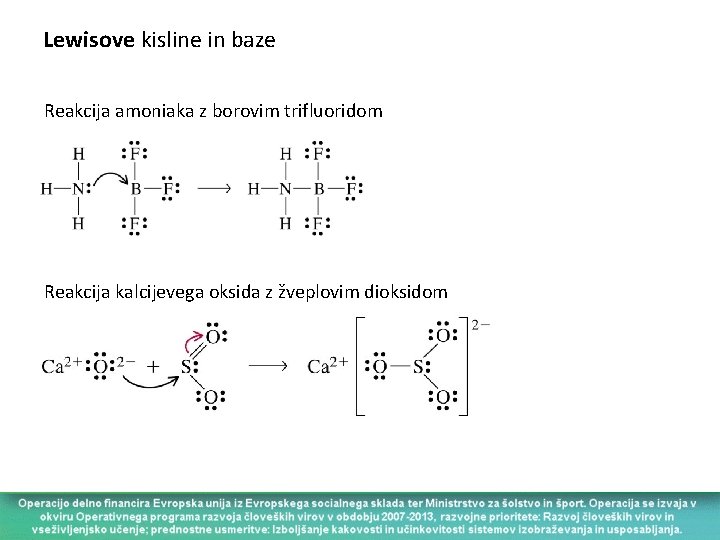
Lewisove kisline in baze Reakcija amoniaka z borovim trifluoridom Reakcija kalcijevega oksida z žveplovim dioksidom
![Lewisove kisline in baze Tvorba kompleksnih ionov npr AlH 2 O63 Al Cl 3s Lewisove kisline in baze Tvorba kompleksnih ionov; npr. [Al(H 2 O)6]3+ Al. Cl 3(s)](https://slidetodoc.com/presentation_image_h/8d09b1c0b932d2340513920e30f76aad/image-9.jpg)
Lewisove kisline in baze Tvorba kompleksnih ionov; npr. [Al(H 2 O)6]3+ Al. Cl 3(s) dodamo v vodo: Al 3+(s) je Lewisova kislina H 2 O(l) je Lewisova baza

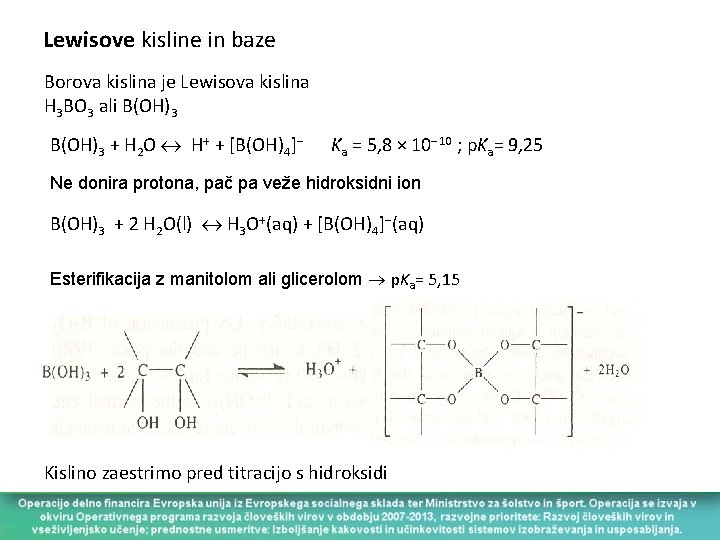
Lewisove kisline in baze Borova kislina je Lewisova kislina H 3 BO 3 ali B(OH)3 + H 2 O H+ + [B(OH)4] Ka = 5, 8 × 10 10 ; p. Ka= 9, 25 Ne donira protona, pač pa veže hidroksidni ion B(OH)3 + 2 H 2 O(l) H 3 O+(aq) + [B(OH)4] (aq) Esterifikacija z manitolom ali glicerolom p. Ka= 5, 15 Kislino zaestrimo pred titracijo s hidroksidi

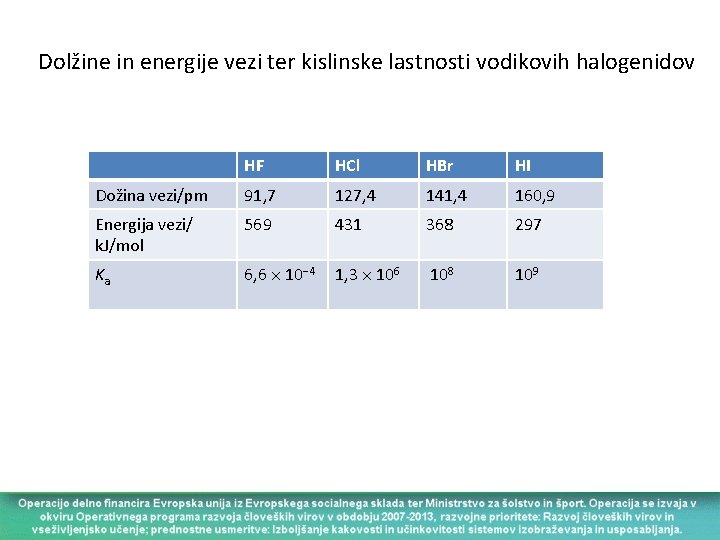
Dolžine in energije vezi ter kislinske lastnosti vodikovih halogenidov HF HCl HBr HI Dožina vezi/pm 91, 7 127, 4 141, 4 160, 9 Energija vezi/ k. J/mol 569 431 368 297 Ka 6, 6 10 4 1, 3 106 108 109

Protoliza več-protonskih kislin Prva stopnja protolize žveplove kisline: H 2 SO 4 (aq) + H 2 O(l) HSO 4 (aq) + H 3 O+(aq) Druga stopnja protolize: HSO 4 (aq) + H 2 O(l) SO 42 (aq) + H 3 O+(aq) V 0, 1 M H 2 SO 4 je samo 9% oksonijevih ionov v raztopini iz druge stopnje protolize

Koncentracija oksonijevih ionov v prvi stopnji protolize 0, 10 M žveplove kisline je: H 3 O+ = 0, 10 mol/L H 2 SO 4(aq) + H 2 O(l) HSO 4 (aq) + H 3 O+(aq) V drugi stopnji protolize: HSO 4 (aq) + H 2 O(l) SO 42 (aq) + H 3 O+(aq) (0, 10 x) mol/L x mol/L Celotna koncentracija oksonijevih ionov v raztopini je: (0, 10 + x) mol/L

x 2 + 0, 112 x 0, 0012 = 0 V 0, 1 M raztopini žveplove kisline imamo naslednje koncentracije ionov: H 3 O+ 0, 11 mol/L [HSO 4 ] 0, 09 mol/L [SO 42 ] 0, 01 mol/L

Fosforjeva kislina Prva stopnja protolize: Ka 1 = 7, 1 10 3 H 3 PO 4(aq) + H 2 O(l) H 2 PO 4 (aq) +H 3 O+(aq) Druga stopnja protolize: Ka 2 = 6, 2 10 8 H 2 PO 4 (aq)+ H 2 O(l) HPO 42 (aq) + H 3 O+(aq) Tretja stopnja protolize: Ka 3 = 1 10 12 HPO 42 (aq) +H 2 O(l) PO 43 (aq) + H 3 O+(aq)

Prva stopnja protolize: Ka 1 = 7, 1 10 3 H 3 PO 4(aq) + H 2 O(l) H 2 PO 4 (aq) + H 3 O+(aq) 7, 6 10 2 mol/L 2, 4 10 2 mol/L Druga stopnja protolize: Ka 2 = 6, 2 10 8 H 2 PO 4 (aq)+ H 2 O(l) HPO 42 (aq) + H 3 O+(aq) 2, 4 10 2 mol/L 6, 2 10 8 mol/L Tretja stopnja protolize: Ka 3 = 1 10 12 HPO 42 (aq) +H 2 O(l) PO 43 (aq) + H 3 O+(aq) 2, 6 10 18 mol/L 0, 10 M H 3 PO 4

Protolitska/ionska reakcija Napišite ionske/protolitske reakcije v vodnih raztopinah: a) Zmešamo vodni raztopini natrijevega acetata in dušikove kisline. CH 3 COO (aq) + H 3 O+(aq) CH 3 COOH(aq) + H 2 O p. Ka(CH 3 COOH) = 4, 76 b) Vodni raztopini natrijevega karbonata dodamo raztopino amonijevega klorida. CO 32 (aq) + NH 4+(aq) HCO 3 (aq) + NH 3(aq) p. Ka(HCO 3 ) = 10, 4 p. Ka(NH 4+) = 9, 25 c) Vodni raztopini natrijevega fluorida dodamo raztopino natrijevega hidrogensulfata. F (aq) + HSO 4 (aq) HF(aq) + SO 42 (aq) p. Ka(HSO 4 ) = 1, 92 p. Ka(HF) = 3, 14 d) Raztopini bakrovega(2+) sulfata dodamo vodno raztopino amoniaka v prebitku. Cu 2+(aq) + 4 NH 3(aq) [Cu(NH 3)4]2+(aq) Ks = 1, 1 1013

Reakcije v vodnih raztopinah so izbrane tako, da potečejo več kot 98 %, manj kot 2 % ali sploh ne potečejo. Napišite enačbe reakcij (ki potečejo) in označite stopnjo Zreagiranosti ( 98 %, 2 %, reakcija ne poteče). CH 3 COOH(aq) + H 2 O(l) CH 3 COO (aq) + H 3 O+(aq) CH 3 COOH(aq) + OH (aq) Na. CH 3 COO(aq) + HCl(aq) + H 2 O(l) Cl (aq) + H 3 O+(aq) Cl (aq) + H 2 O(l) NH 4+(aq) + Na. OH(aq) NH 4+(aq) + OH (aq) NH 3(aq) + H 2 O(l) NH 3(aq) + HCl(aq) NH 3(aq) + H 3 O+(aq)
 Protolitska reakcija
Protolitska reakcija Homoliticko raskidanje veza
Homoliticko raskidanje veza Heksadiin
Heksadiin Egzergone reakcije
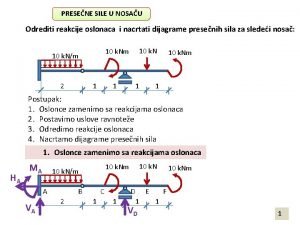
Egzergone reakcije Reakcije u osloncima
Reakcije u osloncima Brzina kemijske reakcije 8 razred
Brzina kemijske reakcije 8 razred Sila reakcije podloge
Sila reakcije podloge Modra galica zagrijavanje
Modra galica zagrijavanje Reakcije na frustracije
Reakcije na frustracije Plamenske reakcije barve
Plamenske reakcije barve Fenotip cc dd ee
Fenotip cc dd ee Entalpija hemija
Entalpija hemija Uticaj temperature na brzinu hemijske reakcije
Uticaj temperature na brzinu hemijske reakcije Reakcije u osloncima
Reakcije u osloncima Recipročna inervacija
Recipročna inervacija Acilovanje
Acilovanje Zemljo alkalijske kovine
Zemljo alkalijske kovine Aldehidi i ketoni nomenklatura
Aldehidi i ketoni nomenklatura Egzotermne i endotermne hemijske reakcije
Egzotermne i endotermne hemijske reakcije