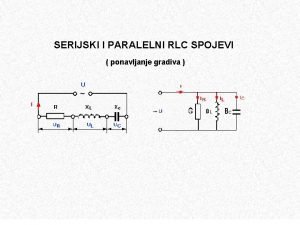
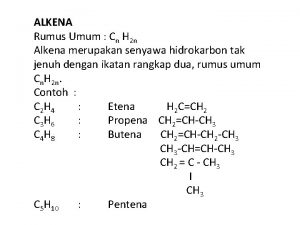
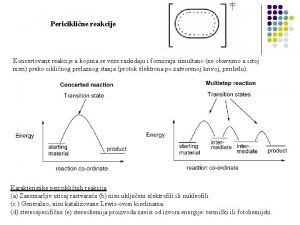
Reakcije alkena Hidrogenizacija Halogenovanje Rezonancija 1 1 Reakcije


















- Slides: 38

Reakcije alkena • Hidrogenizacija • Halogenovanje • Rezonancija 1

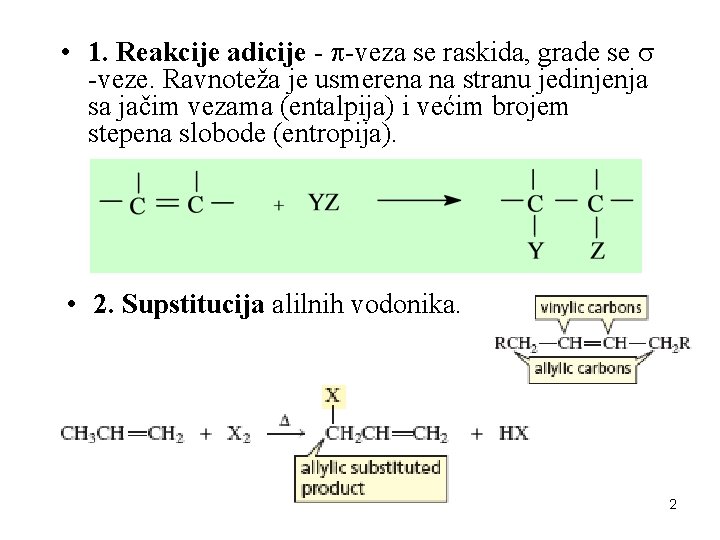
• 1. Reakcije adicije - -veza se raskida, grade se -veze. Ravnoteža je usmerena na stranu jedinjenja sa jačim vezama (entalpija) i većim brojem stepena slobode (entropija). • 2. Supstitucija alilnih vodonika. 2

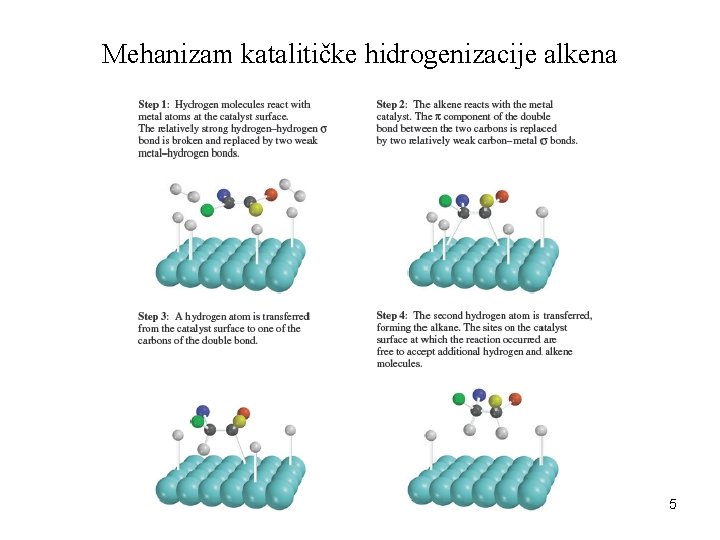
Adicija identičnih adukata Hidrogenizacija. Egzotermna reakcija, bez katalizatora vrlo spora. Toplota hidrogenizacije (toplota koja se oslobodi hidrogenizacijom jednog mola nezasićenog jedinjenja) – mera termodinamičke stabilnosti jedinjenja. 3

4

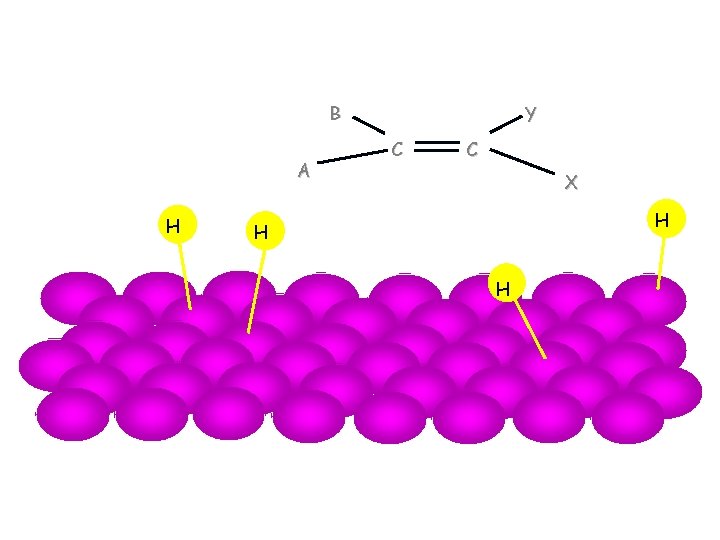
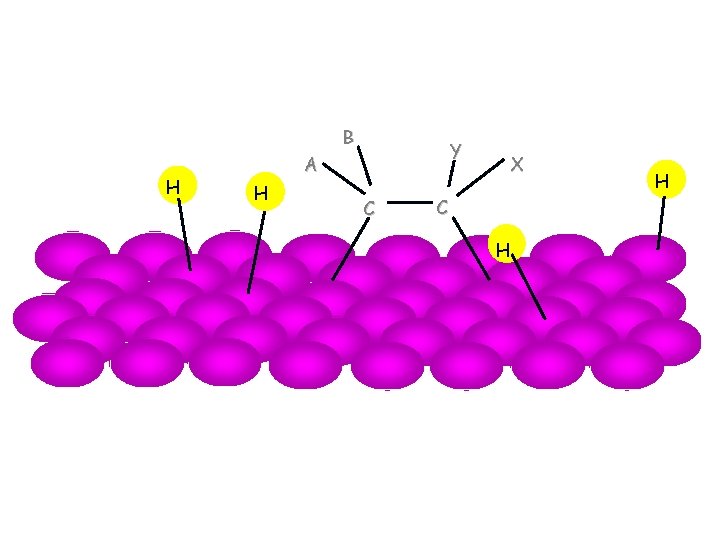
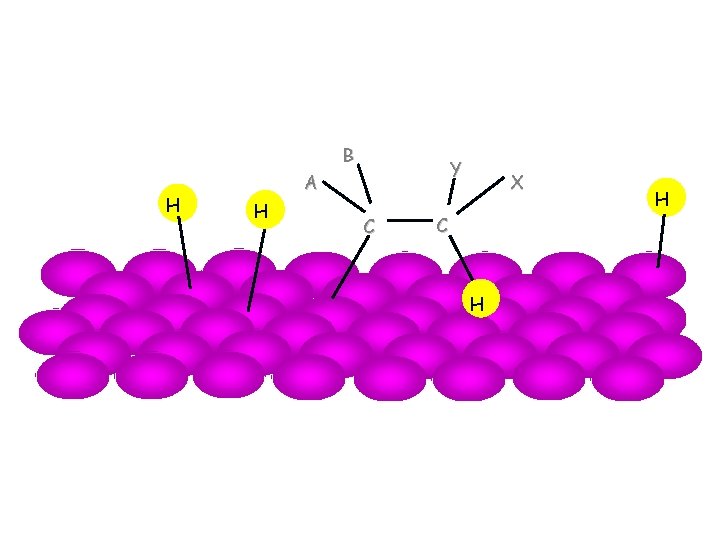
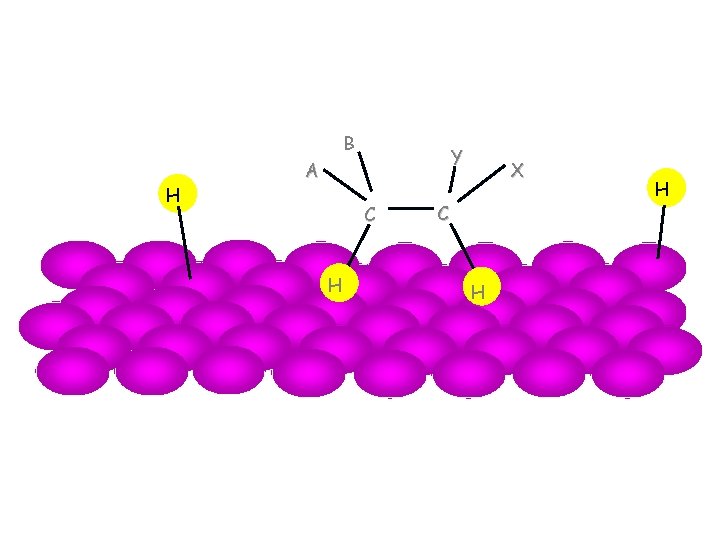
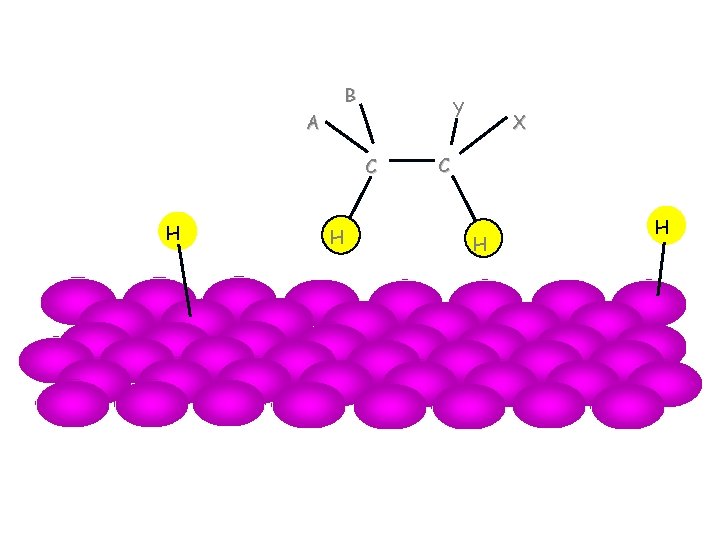
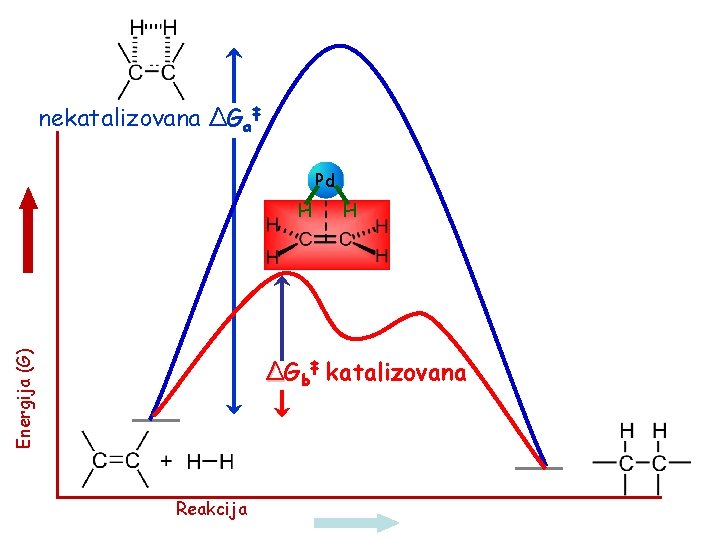
Mehanizam katalitičke hidrogenizacije alkena 5

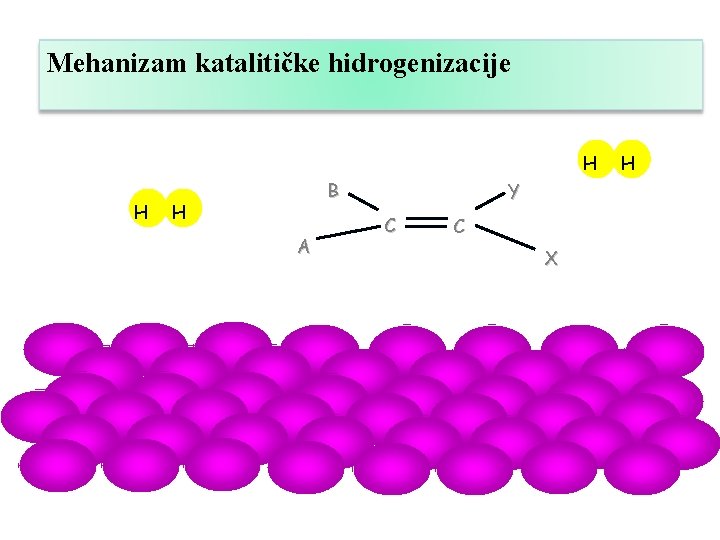
Mehanizam katalitičke hidrogenizacije H H B H A Y C C X H

B A H Y C C X H H H

B H Y A H C X C H H

B H Y A H C X C H H

B H Y A C H X C H H

B Y A C H H X C H H

nekatalizovana ΔGa‡ Pd Energija (G) H H ΔGb‡ katalizovana Reakcija

Stereohemija adicionih reakcija. Sin- (oba adukta sa iste strane dvostruke veze) i anti- adicija (jedan adukt sa jedne drugi sa druge strane dvostruke veze). Stereohemijski aspekt reakcije. Stereospecifična reakcija – reagens može prići samo na jedan način. Katalitička hidrogenizacija alkena je sterospecifična sin adicija 13

Adicija halogena • Adicija hlora ili broma - 1, 2 -dihalogenid. Vicinalni dihalogenidi. Fluor - burna reakcija, supstitucija - konkurentna reakcija. Vicinalni dijodidi - elminacija do alkena. 14

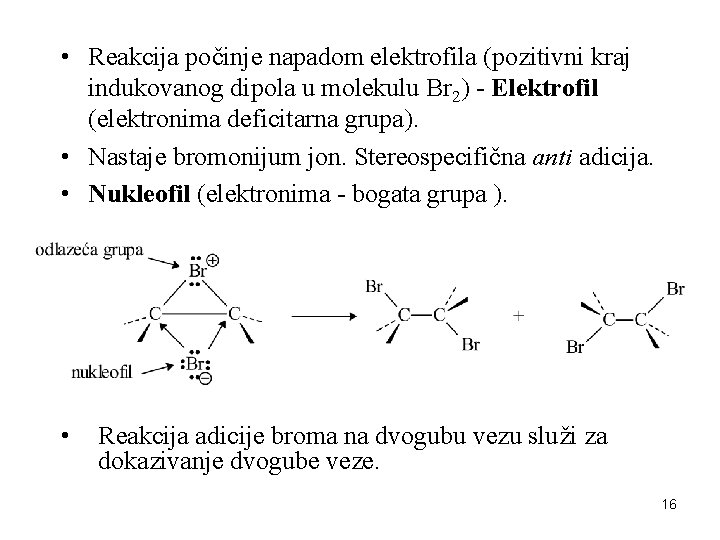
Mehanizam halogenovanja 15

• Reakcija počinje napadom elektrofila (pozitivni kraj indukovanog dipola u molekulu Br 2) - Elektrofil (elektronima deficitarna grupa). • Nastaje bromonijum jon. Stereospecifična anti adicija. • Nukleofil (elektronima - bogata grupa ). • Reakcija adicije broma na dvogubu vezu služi za dokazivanje dvogube veze. 16

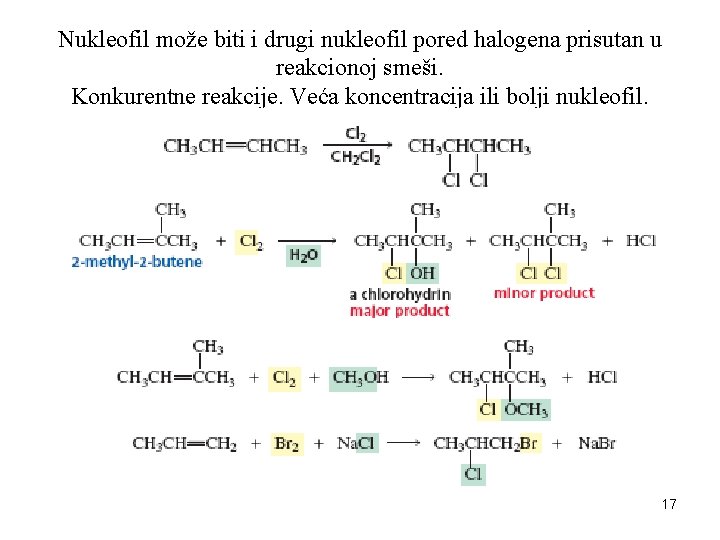
Nukleofil može biti i drugi nukleofil pored halogena prisutan u reakcionoj smeši. Konkurentne reakcije. Veća koncentracija ili bolji nukleofil. 17

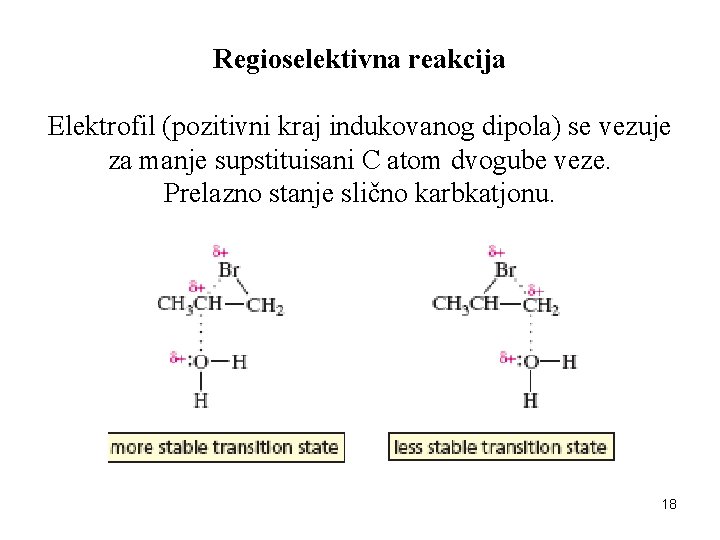
Regioselektivna reakcija Elektrofil (pozitivni kraj indukovanog dipola) se vezuje za manje supstituisani C atom dvogube veze. Prelazno stanje slično karbkatjonu. 18

Stabilnost bromonijum jona. Alkil grupe stabilizuju bromonijum jon pozitivnim induktivnim efektom i hiperkonjugacionim efektom. 19

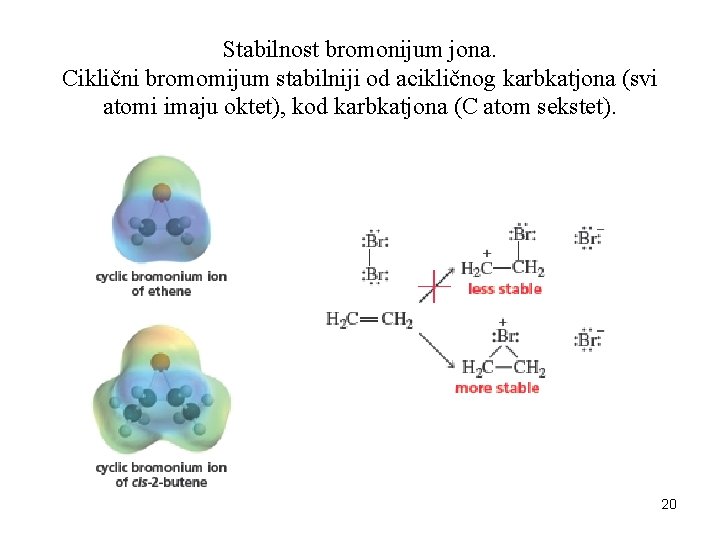
Stabilnost bromonijum jona. Ciklični bromomijum stabilniji od acikličnog karbkatjona (svi atomi imaju oktet), kod karbkatjona (C atom sekstet). 20

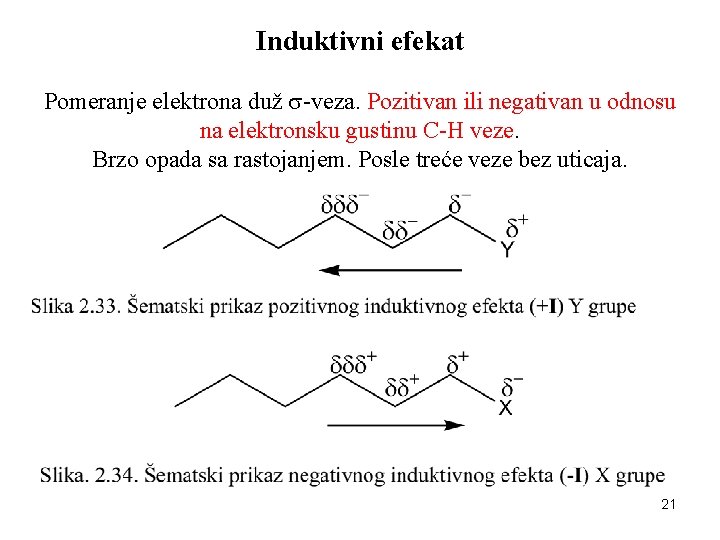
Induktivni efekat Pomeranje elektrona duž -veza. Pozitivan ili negativan u odnosu na elektronsku gustinu C-H veze. Brzo opada sa rastojanjem. Posle treće veze bez uticaja. 21

Induktivni efekat 22

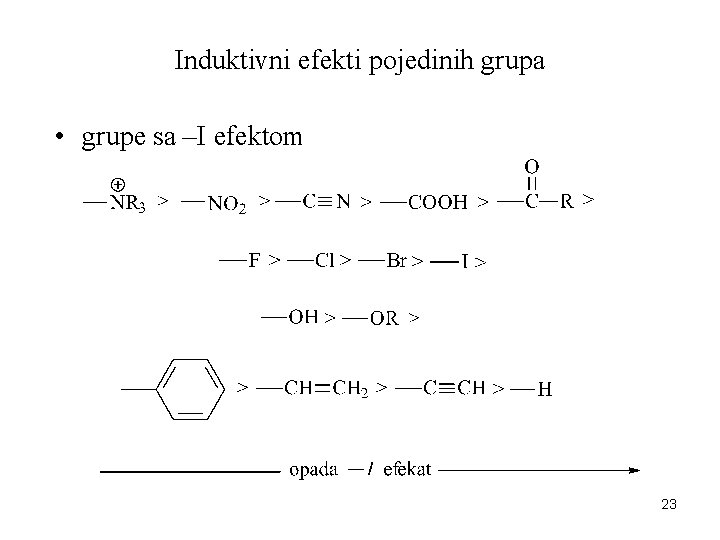
Induktivni efekti pojedinih grupa • grupe sa –I efektom 23

Induktivni efekti pojedinih grupa (nastavak) • grupe sa +I efektom 24

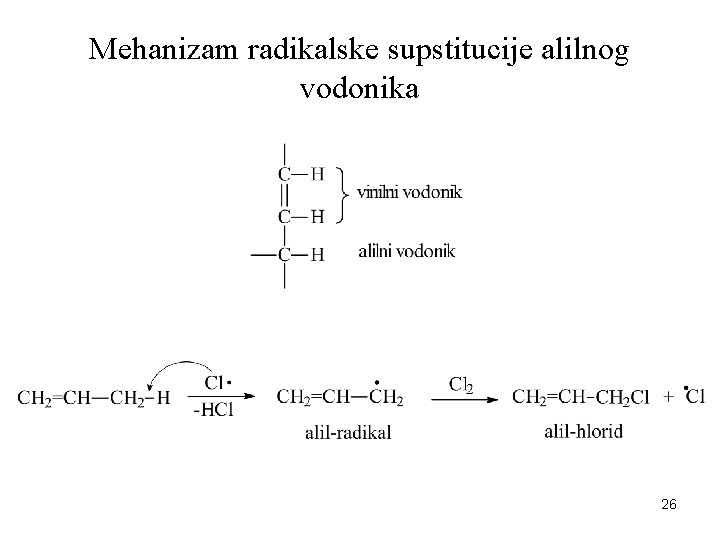
Supstitucija alilnog H atoma • Visoka temperatura ili zračenja određene talasne dužine. • Nastajanje slobodnih radikala. 25

Mehanizam radikalske supstitucije alilnog vodonika 26

Rezonancija Stabilnost alil radikala • stabilnosti radikala • alil 3 2 1 CH 3 vinil 27

Rezonancija je metod prikazivanja delokalizacije elektrona (talasnih funkcija molekula po teoriji valantne veze) pomoću Lewis-ovih formula. • Rezonanciona (kanonska) struktura – simbolički prikaz talasnih funkcija, ništa realno ne postoji sa tim strukturnim formulama. • Rezonancioni hibrid – linearna kombinacija kanonskih struktura koja odgovara realnom molekulu. • Dvostrana strelica – linearna kombinacija valentno-vezivnih talasnih funkcija, ne realni proces. Razlikovati od dvostruke strelice. • Parcijalna veza, parcijalna formalna naelektrisanja. 28

Crtanje rezonancionih struktura • Samo se elektroni pomeraju. Jezgra ostaju na svojim mestima. • A i B su formule konstitucionih izomera. Nisu rezonancione strukture. 29

• Pomeranje elektrona se predstavlja strelicom sa vrhom prema atomu ka kome se pomeraju elektroni. • Formalno naelektrisanje atoma se smanjuje ili povećava zavisno od toga da li se elektroni pomeraju od njega ili ka njemu. • Ukupno naelektrisanje molekula je isto u svim strukturama kao i broj sparenih i nesparenih elektrona. 30

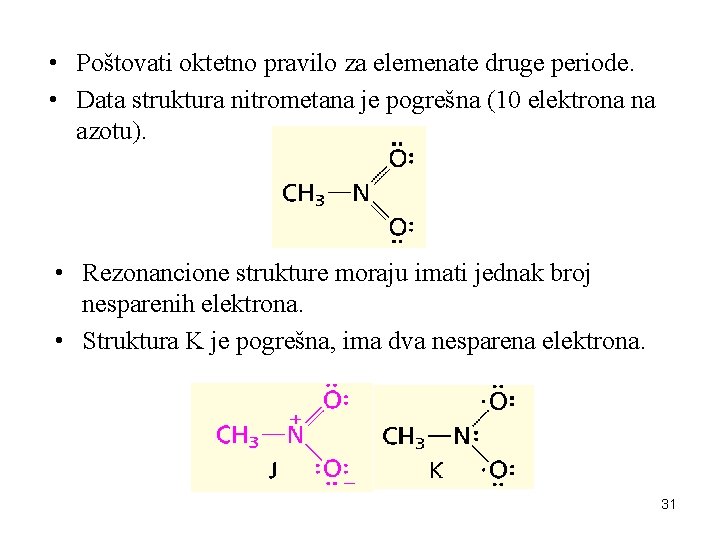
• Poštovati oktetno pravilo za elemenate druge periode. • Data struktura nitrometana je pogrešna (10 elektrona na azotu). • Rezonancione strukture moraju imati jednak broj nesparenih elektrona. • Struktura K je pogrešna, ima dva nesparena elektrona. 31

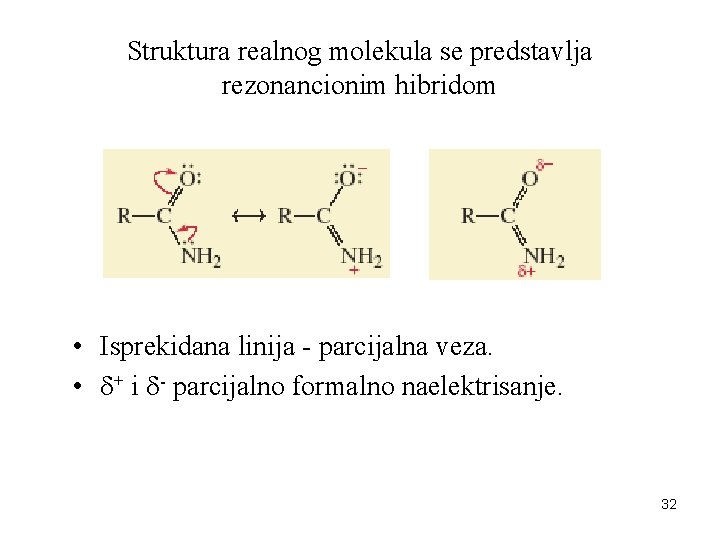
Struktura realnog molekula se predstavlja rezonancionim hibridom • Isprekidana linija - parcijalna veza. • + i - parcijalno formalno naelektrisanje. 32

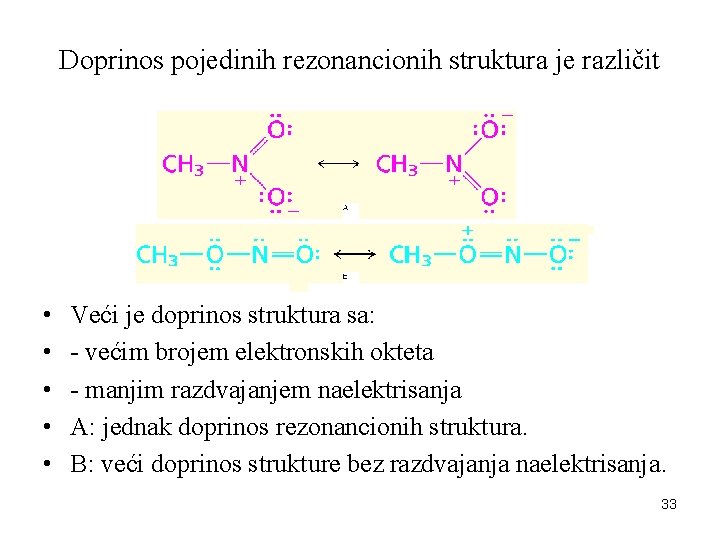
Doprinos pojedinih rezonancionih struktura je različit • • • Veći je doprinos struktura sa: - većim brojem elektronskih okteta - manjim razdvajanjem naelektrisanja A: jednak doprinos rezonancionih struktura. B: veći doprinos strukture bez razdvajanja naelektrisanja. 33

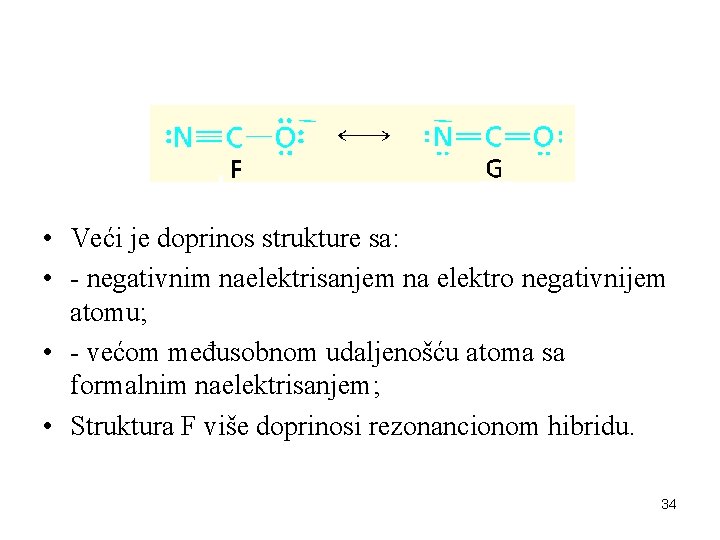
• Veći je doprinos strukture sa: • - negativnim naelektrisanjem na elektro negativnijem atomu; • - većom međusobnom udaljenošću atoma sa formalnim naelektrisanjem; • Struktura F više doprinosi rezonancionom hibridu. 34

Kako prepoznati molekul za koji je moguće napisati rezonancione strukture? 1. Rezonancija - * veza 35

2. Rezonancija nevezivni elektronski par - veza (n - *) 3. Rezonancija veza - prazna orbitala ( - p ili d) 36

4. Rezonancija nevezni elektronski par - prazna orbitala (n - p ili d) 5. Rezonancija nespareni elektron - veza (p - ) 37

38
 Alifaticni ugljovodonici
Alifaticni ugljovodonici Dehidrohalogenovanje
Dehidrohalogenovanje Strujna rezonancija
Strujna rezonancija Rezonancija zvuka
Rezonancija zvuka Hidrogenizacija
Hidrogenizacija Hlorovanje benzena
Hlorovanje benzena Karbonilna jedinjenja
Karbonilna jedinjenja 1 2 dimetilbenzen
1 2 dimetilbenzen Isomer metameri
Isomer metameri Sulfonovanje benzena
Sulfonovanje benzena 5–bromo–2–metilheks–3–ena
5–bromo–2–metilheks–3–ena Nomenklatura alkina
Nomenklatura alkina Nomenklatura alkena
Nomenklatura alkena Metilsiklopentana
Metilsiklopentana Polimerizacija alkena
Polimerizacija alkena Peta konsep alkana alkena alkuna
Peta konsep alkana alkena alkuna Halogenovanje
Halogenovanje Trans-1 2-dikloroetena
Trans-1 2-dikloroetena Alkena
Alkena Senyawa
Senyawa Izobutil benzen
Izobutil benzen Amonoliza
Amonoliza Aromatis homosiklis
Aromatis homosiklis Recipročna inervacija
Recipročna inervacija Rh fenotip ccddee
Rh fenotip ccddee Antikatalitički proces
Antikatalitički proces Termohemijske jednacine
Termohemijske jednacine Beta eliminacija
Beta eliminacija Anabolizam
Anabolizam Brzina kemijske reakcije 8 razred
Brzina kemijske reakcije 8 razred Porodica reakcije
Porodica reakcije Nomenklatura aldehida
Nomenklatura aldehida Protolitičke reakcije
Protolitičke reakcije Sila reakcije podloge formula
Sila reakcije podloge formula Piroliza modre galice
Piroliza modre galice Brzina kemijske reakcije 8 razred
Brzina kemijske reakcije 8 razred Plamenske reakcije barve
Plamenske reakcije barve Mehanika
Mehanika Zakon o dejstvu masa
Zakon o dejstvu masa