HEMIJSKE REAKCIJE I ENERGIJA TERMOHEMIJA Sve hemijske reakcije






















- Slides: 23

HEMIJSKE REAKCIJE I ENERGIJA

TERMOHEMIJA • Sve hemijske reakcije praćene su odgovarajućim energetskim promenama, koje se najčešće manifestuju u vidu oslobađanja ili vezivanja toplote. • Proučavanjem energetskih promena tokom hemijkih reakcija bave se termohemija i hemijska termodinamika.

TERMOHEMIJA • Ukupna energija molekula je zbir njegove kinetičke i potencijalne energije. • Eu = E k + Ep • Ep = E(e-j) + E(e-e) + E(j-j) • Tokom praćenja hemijskih reakcija važnije je odrediti promenu energije, nego znati apsolutnu vrednost potencijalne energije reaktanata i produkata.

TERMOHEMIJA • C(s) + O 2(g) → CO 2(g) ∆E = − 394 k. J mol− 1 • 1/2 N 2(g) +1/2 O 2(g) → NO(g)∆E = + 90 k. Jmol− 1 • Reakcije u kojima dolazi do oslobađanja energije nazivamo egzotermnim reakcijama. • Reakcije u kojima dolazi do apsorpcoije toplote nazivamo endotermnim reakcijama.

TERMOHEMIJA • Reakcije u kojima su zapremine produkata iste nazivamo reakcijama. • Reakcije u kojima su zapremine produkata različite nazivamo reakcijama. reaktanata i izohorskim reaktanata i izobarskim

TERMOHEMIJA • H 2(g) + 1/2 O 2(g) → H 2 O(g) ∆E = − 242 k. J mol− 1 • C(g) + H 2 O(g) → CO(g) + H 2(g)∆E = +131 k. J mol− 1 • Energija jednog mola vodonika i pola mola kiseonika nije veća za 242 k. J od energije jednog mola vodene pare, jer u reakciji dolazi do promene zapremine reakcione smeše. • Deo energije koju sistem apsorbuje ili oslobađa tokom reakcije troši se na promenu zapremine.

TERMOHEMIJA

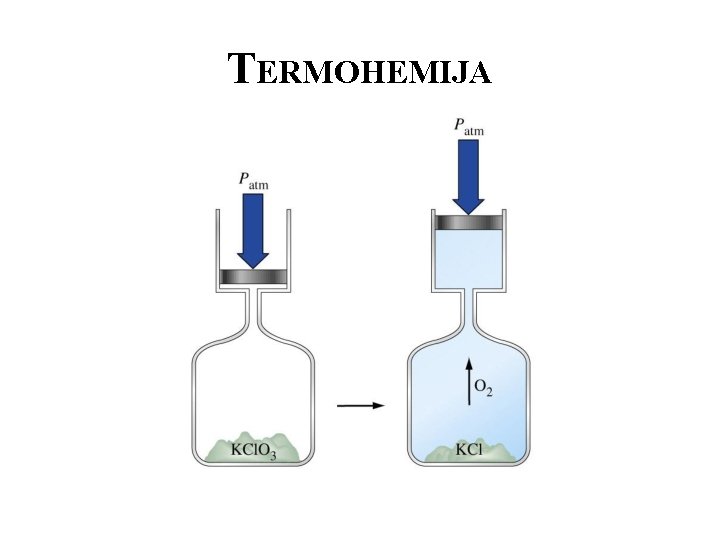
TERMOHEMIJA • 2 KCl. O 3(s) → 2 KCl(s) + 3 O 2(g) ∆E = − 89 k. J mol− 1 • Razlika u energetskom sadržaju između produkata i reaktanata manja od navedene vrednosti, jer se deo energije troši na vršenje rada (na pomeranje klipa). • Entalpija predstavlja ukupan sadržaj energije nekog sistema ili neke supstance i obeležavamo je slovom H. Promena entlpije hemijske reakcije ∆H jednaka je oslobođenoj ili vezanoj toploti reakcije na konstantnom pritisku.

TERMOHEMIJA • Reakciona entalpija ∆r. H je jednaka razlici entalpija reaktanata i entalpija produkata reakcije. • Kada je ∆r. H < 0, reakcija je egzotermna. • Kada je ∆r. H > 0, reakcija je endotermna. • Standardne reakcione entalpije ∆r. HӨ se odnosi na reakcije koje se odvijaju pod standarnim uslovima, na temperaturi od 298 K i pritisku od 101 325 Pa.

TERMOHEMIJA • Termohemijske jednačine prikazuju promenu entalpije i oznake za agregatno stanje. • H 2(g) + 1/2 O 2(g) → H 2 O(g) ∆H = − 242 k. J mol− 1 • H 2(g) + 1/2 O 2(g) → H 2 O(l) ∆H = − 286 k. J mol− 1 • H 2 O(g) → H 2(g) + 1/2 O 2(g) ∆r. H = +242 k. J mol− 1 • H 2 O(l) → H 2(g) + 1/2 O 2(g) ∆r. H = +286 k. J mol− 1

TERMOHEMIJA • Standardna entalpija stvaranja ∆f. HӨ neke supstance je entalpija reakcije u kojoj nastaje jedan mol te supstance iz odgovarajućih elementa, pod standardnim uslovima. • Entalpije stvaranja elemenata pod standardnim uslovima su jednake nuli. • Kada se element javlja u više alotropskih modifikacija, onda je samo entalpija stvaranja najstabilnijeg alotropa jednaka nuli.

TERMOHEMIJA • Kiseonik, azot, fluor, hlor i vodonik pod standardnim uslovima postoje u obliku stabilnih dvoatomskih molekula. • Zato je entalpija stvaranja ovih elemenata u obliku dvoatomskih molekula jednaka nuli. • Entalpija stvaranja jednog mola atoma kiseonika, nije jednaka nuli, jer je za raskidanje kovalentnih veza u molekulu kiseonika potrebno utrošiti određenu količinu energije.

TERMOHEMIJA • Hesov zakon • Entalpija jedne reakcije ili jednog niza reakcija jednaka je entalpiji druge reakcije ili drugog niza reakcija, pod uslovom da su u oba slučaja polazne supstance i krajnji produkti isti. • C(s) + O 2(g) → CO 2(g) ∆r. H 1 = − 394 k. J mol− 1 • C(s) + 1/2 O 2(g) → CO(g) ∆r. H 2 = − 111 k. J mol− 1 • CO(g) + 1/2 O 2(g) → CO 2(g)∆r. H 3 = − 283 k. Jmol− 1

TERMOHEMIJA • Svi sistemi u prirodi teže postizanju stanja sa minimalnim sadržajem energije – možemo očekivati da se spontano odigravaju jedino egzotermni procesi. • Rastvaranje nekih soli je endoterman proces i odvija se spontano. • Difuzija gasova koji međusobno ne reaguju je spontan proces tokom koga ne dolazi do promene entalpije sistema.

TERMOHEMIJA • Druga pokretačka sila hemijskih reakcija je povezana sa stepenom neuređenosti sistema. • Sila koja pokreće mešanje gasova ili rastvaranje soli, predstavlja njihovu težnju da pređu iz stanja manje neuređenosti u stanje veće neuređenosti. • Entropija S je proporcionalna verovatnoći postojanja sistema i izražava se u istim jedinicama kao i entalpija.

TERMOHEMIJA • Kada u sistemu ne dolazi do promene entalpije (∆H = 0), promena se spontano odvija samo u onom pravcu u kome dolazi do povećanja entropije (∆S > 0). • Da bi se odigrao suprotan proces, u kome dolazi do smanjenja entropije (∆S < 0), potrebno je utrošiti izvesnu količinu energiju.

TERMOHEMIJA • Kada u nekom procesu ne dolazi do promene entropije (∆S = 0), promena se spontano odvija samo u onom pravcu u kome dolazi do smanjenja entalpije (∆H < 0). • Da bi se odigrao suprotan proces, u kome dolazi do povećanja entalpije (∆H > 0), potrebno je dovesti izvesnu količinu energije.

TERMOHEMIJA • Kod većine procesa dolazi do istovremene promene i entalpije i entropije. • Promena entalpije odražava težnju molekula ili atoma da sjedinjavanjem grade složenije molekule, uz prelazak u stanje sa minimalnim sadržajem unutrašnje energije. • Promena entropije pokazuje težnji sistema da pređe u stanje maksimalne neuređenosti, koja je utoliko veća ukoliko je veći broj čestica.

TERMOHEMIJA • Hemijska reakcija se spontano odvija u onom smeru u kome dolazi do opadanja ukupne energije sistema, odnosno do smanjenja slobodne energije sistema. • ∆r. G = ∆r. H − T∆r. S • Hemijska reakcija se odvija spontano samo kada je ∆r. G < 0. • Procesi kod kojih dolazi do pozitivne promene slobodne energije, ∆r. G > 0, ne mogu se odigravati spontano.

TERMOHEMIJA • Kada je ∆r. H < 0 i kada je T∆r. S > 0, odnosno kada tokom egzotermne reakcije dolazi do povećanja entropije sistema, promena slobodne energije sistema je takođe manja od nule, ∆r. G < 0 i takve reakcije se uvek odvijaju spontano. • Što je veća temperatura na kojoj se odigrava reakcija, to je promena slobodne energije sistema negativnija.

TERMOHEMIJA • Egzotermne reakcije pri kojima dolazi do smanjenja entropije sistema biće spontane samo kada je proizvod T∆r. S < ∆r. H, jer je u tom slučaju promena slobodne energije reakcije i dalje negativna, ∆r. G < 0. • Ovaj uslov može biti ispunjen samo pri dovoljno niskim temperaturama: na niskim temperaturama spontano se odigravaju samo egzotermni procesi.

TERMOHEMIJA • Promena slobodne enrgije je negativna kod endotermnih reakcija tokom kojih dolazi do povećanja entropije sistema, pod uslovom da je T∆r. S > ∆r. H. • Ovaj uslov može biti ispunjen samo pri dovoljno visokim temperaturama: endotermni procesi se mogu odvijati spontano na visokim temperaturama. • Endotermni procesi se mogu spontano odvijati na niskim temperaturama samo kada tokom procesa dolazi do izuzetno velike promene entropije.

PITANJA 1. U kom odnosu stoje entalpije direktne i povratne reakcije? 2. Koji uslov mora biti ispunjen da bi se jedna reakcija odigravala spontano? 3. Entalpija neke reakcije je +90 k. J mol-1. Koliko izosi entalpija njene povratne reakcije?
 Antikatalitički
Antikatalitički Zakon o dejstvu masa
Zakon o dejstvu masa Brzina hemijske reakcije
Brzina hemijske reakcije Energetika hemija
Energetika hemija Fizicke i hemijske osobine vode
Fizicke i hemijske osobine vode Hemijske osobine metala
Hemijske osobine metala Hemijske osobine vode
Hemijske osobine vode Hemijske osobine metala
Hemijske osobine metala Primeri polarne kovalentne veze
Primeri polarne kovalentne veze Dehidratacija alkohola
Dehidratacija alkohola Halogenovanje
Halogenovanje Djevojka nadmudrila marka analiza
Djevojka nadmudrila marka analiza Misljenje alekseja karenjina o polozaju zena
Misljenje alekseja karenjina o polozaju zena Glasovne promjene
Glasovne promjene Cvonjak
Cvonjak Posvojne zamjenice primjeri
Posvojne zamjenice primjeri Kako je koren kovač sve vragove zastrašio
Kako je koren kovač sve vragove zastrašio Voda uvjet života
Voda uvjet života Google znalc
Google znalc Slušao sam jedno jutro ptičicu
Slušao sam jedno jutro ptičicu Vrste brodova
Vrste brodova Sta se sve moze adresirati na internetu
Sta se sve moze adresirati na internetu O glembajevima
O glembajevima Svo ili sve
Svo ili sve