Procesi gaenja 2 Deo Procesi nekontrolisanog sagorevanja i





















































































- Slides: 89

Procesi gašenja 2. Deo

Procesi nekontrolisanog sagorevanja i gašenja u termodinamičkom sistemu • Požar je svaki proces nekontrolisanog sagorevanja, koji se dešava mimo volje i želje ljudi. Požari dovode do ogromnih materijalnih šteta i čestih gubitaka ljudskih života. Pored toga oni ugožavaju i životnu sredinu. • Nastanak, razvoj i prekid procesa nekontrolisanog sagorevanja u realnim uslovima je izuzetno složen i praćen je čitavim nizom fizičko-hemijskih procesa istovremeno ili sukcesivno.

Samo mesto požara u termodinamičkom smislu može se posmatrati kao termodinamički sistem. • Termodinamički sistem je deo prostora koji je izdvojen pri posmatranju tako da sve što nije njim obuhvaćeno predstavlja okolinu. Posmatranjem interakcije između termodinamičkog sistema i okoline u smislu razmene energije i mase, termodinamički sistem može da bude: – otvoren, pri čemu razmenjuje i energiju i masu sa okolinom, – zatvoren, razmenjuje samo energiju dok masa u sistemu ostaje ista i – izolovan kada nema razmene ni energije ni mase sa okolinom.

Jasno je da se mesto požara svrstava u otvoren termodinamički sistem i nikakvim pojednostavljenjima ne može se svrstati u druga dva sistema, što njegovo proučavanje čini veoma složenim.

Kada je reč o razmeni energije, treba se podsetiti na prostu definiciju energije, koja kaže da je energija sposobnost tela da vrši rad. Pri tom se ne sme zaboraviti da je energija svojstvo materije i da se ispoljava u različitim i neprekidnim makroskopskim i mikroskopskim promenama stanja tela, odnosno njegovih sićušnih čestica.

Neke promene su vidljive, neke se mogu konstatovati samo preciznim merenjima i komplikovanim teorijskim analizama, a mnoge se mogu samo pretpostaviti, jer ljudsko saznanje još nije stiglo do nivoa da sve prirodne pojave praktično prikaže i teorijski objasni. U svakodnevnom životu najuočljivija je mehanička energija. Nju vidimo posmatrajući: kamen kad pada, automobile koji se kreću, vratilo koje se obrće. . .

Pored kretanja spoljašnjih vidljivih tela, prema molekularno – kinetičkoj teoriji poznata su i kretanja unutar tela, koje vrše molekuli i atomi, kao i sile koje deluju između molekula. Spoljašnji odraz kretanja molekula i atoma je prema molekularno – kinetičkoj teoriji, temperatura tela. Ukoliko je to unutrašnje kretanje življe i temperatura je viša. Zapravo to unutrašnje kretanje ispoljava se u obliku toplotne energije.

Oba navedena oblika energije, mehanička i toplotna, odraz su kretanja, prvi spoljašnjeg, vidljivog kretanja i drugi unutrašnjeg, nevidljivog kratanja. I drugi oblici energije: električna, hemijska, nuklearna. . . jesu odraz odgovarajuće vrste kretanja. Sve oblike energije globalno možemo da podelimo na potencijalnu i kinetičku energiju. Potencijalna energija ispoljava se u mogućnosti da se tela kreću: voda sakupljena u jezeru na nekoj visini, hemijska energija gorivih materijala, vodena para pod pritiskom u cilindru itd.

Kinetička energija ispoljava se u samom kretanju: voda kad teče, molekuli kad se kreću. . . Potencijalna energija je mogućnost kretanja, a kinetička samo kretanje (mogućnost kretanja pretvara se u samo kretanje). Osobinu pretvaranja jednog oblika energije u drugi imaju svi oblici energije: električna energija može da se u sijalici pretvori u svetlosnu ili npr. u grejalici u toplotnu, hemijska energija gorivih materijala može da se pretvori u toplotnu i mehaničku energiju gasovitih produkata sagorevanja. . .

Na osnovu ovog utvrđeno je da se energija ne može ni proizvesti niti uništiti, već da samo može da prelazi iz jednog oblika u drugi. Svako radno telo, telo koje posmatramo u termodinamičkom i fizičko – hemijskom smislu ima svoju unutrašnju energiju. Ta unutrašnja energija se kod većine tela manifestuje kao toplotna energija nastala usled kretanja molekula i atoma unutar tela. Kod nekih radnih tela kao što su goriva i gorivi materijali unutrašnja energija može da se manifestuje kao hemijska reakcija, a kod radioaktivnih kao nuklearna reakcija.


Od pojma unutrašnja energija treba razlikovati pojam količina toplote. Unutrašnja energija je veličina stanja tela, dok se količina toplote odnosi na promenu kojoj se radno telo ili sistem izlaže pri prelazu iz jednog unutrašnjeg energetskog stanja u drugo. Količina toplote kao termodinamička veličina zavisi od mnogih činilaca kao što su pritisak, temperatura i specifična zapremina, ali i od načina odvijanja procesa, pa ona nije veličina stanja.

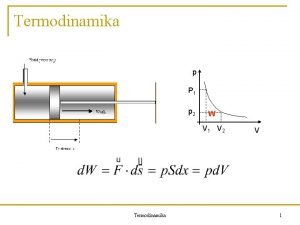
U termodinamici, sva stanja radnih tela ili sistema definisana su pomoću jednačina stanja koje se odnose na ravnotežna stanja. Na primer, ako je radno telo neki gas, ravnotežno stanje je takvo stanje u kom gas po čitavoj zapremini ima jednak pritisak i temperaturu. Neravnotežno stanje je stanje u kom gas po čitavoj zapremini nema jednak pritisak i temperaturu. Na neravnotežna stanja, a takva su stanja pri procesima nekontrolisanog sagorevanja i gašenja, ne mogu se primeniti jednačine klasične termodinamike.

• Pri nekontrolisanom sagorevanju, požaru, toplota se prenosi sa višeg izvora toplote, gorive materijena na niži izvor toplote, okolinu, atmosferski vazduh, vodu. . . • Požar je pravi nepovratni proces otvorenog termodinamičkog sistma i nikakvim aproksimacijama nemože se povezati sa povratnim.

• Pri pretvaranju jednog oblika energije u dugi oblik, deo energije koji pređe iz jednog oblika u drugi nazivamo eksergijom, a deo koji se nepovratno gubi tj. predaje okolini naziva se anergijom. Eksergija je korisan oblik energije, anergija nekorisan oblik energije. • energija eksergija + anergija

• U termodinamičkom smislu toplotna energija koja se iskoristi naziva se eksergija, a deo koji se ne iskoristi anergija. • Pri požaru hemijski vezana energija u gorivoj materiji prelazi u toplotnu, koja jednim delom vrši nekorisan rad, a drugim delom se predaje okolini pa se može smatrati da celokupna hemijski vezana energija u gorivoj materiji prelazi u anergiju. • Požar je pravi nepovratni i nestacionarni proces otvorenog termodinamičkog sistema pri kom se sva dobijena energija pretvara u anergiju.

3. 2. Vrste požara • Izbor sredstava za gašenje požara, odnosno mehanizma gašenja zavisi od vrste požara. • U zavisnosti od niza uticajnih faktora požare možemo podeliti prema: – – vrsti gorive materije, mestu nastanka, veličini i obimu i fazi razvoja.

Podela prema vrsti gorive materije • Prema vrsti gorive materije, kao što je već rečeno u prethodnom poglavlju, požare možemo razvrstati na požare klase A, B, C, D i F (požare čvrstih, tečnih, gasovitih materija, požare metala i ulja i masti u kuhinjama). • Sam proces sagorevanja: čvrstih, tečnih i gasovitih materijala se razlikuje, pa će se samim tim razlikovati i proces gašenja.

Sagorevanje čvrstih gorivih materijala Proces sagorevanja čvrstih gorivih materijala odvija se kroz sledeće faze: – fazu zagrevanja, – fazu sušenja (isparavanja vlage prisutne u materijalu), – fazu obrazovanja i sagorevanja volatila i – sagorevanje koksnog ostatka.

Bez obzira da li se oni odvijaju sukcesivno ili istovremeno, vreme trajanja ovih procesa je kratko i u znatnoj meri zavisi od temperature. Viša temperatura uslovljava kraće vreme sušenja i devolatizacije. Tokom procesa devolatizacije dolazi do isparavanja gorivih, isparljivih jedinjenjka i do njihove termičke destrukcije. Proces sagorevanja volatila odvija se u fazi: gas (volatili) – gas (vazduh), pa ovaj proces pripada homogenim reakcijama sagorevanja. Sagorevanje koksnog ostatka odvija se u dvofaznom sistemu: čvrsta faza (koksni ostatak) – gas (vazduh), pa pripada heterogenom sagorevanju (sagorevanje sa žarom).

Sagorevanje tečnih gorivih materijala, najčešće se odvija kao homogena hemijska reakcija sagorevanja jer gorivi materijal najpre ispari i onda u smeši sa vazduhom sagoreva. U retkim slučajevima sagorevaju kapi tečnog goriva u smeči sa vazduhom pa je onda upitanju heterogena hemijska reakcija sagorevanja.

Sagorevanje gorivih gasova Gasovita goriva sagorevaju samo pri homogenim hemijskim reakcijama.

Bezobzira na vrstu sagorljive materije, sagorevanje počinje u gasnoj fazi, odvija se kroz niz međuprocesa hemijskih reakcija i završava kada nema više komponenata sposobnih za dalju transformaciju. Sagorevanjem se sva, ili veći deo hemijski vezane energije gorive materije transformiše u toplotnu energiju.

Podela prema mestu nastanka Prema mestu nastanka, požari mogu da budu na otvorenom i zatvorenom prostoru. U požare na otvorenom prostoru svrstavaju se požari šuma, poljski požari, požari otvorenih skladišta itd. Pod požarima u zatvorenom prostoru smatraju se najčešće požari u zgradama, proizvodnim halama, u jednoj ili više prostorija ili u šupljinama konstrukcije zgrada. Požari u rudnicima, tunelima i drugim oknima su požari zatvorenih prostora, ali pod određenim uslovima usled ekspolozije i rušenja, mogu da postanu požari otvorenih prostora. Razvoj požara otvorenih i zatvorenih prostora je potpuno različit, pa će i mehanizmi gašenja biti različiti.

Podela prema veličini požara • Prema veličini požari mogu da budu mali, srednji, veliki, blokovski i požarne oluje.

Mali požari Malim požarima smatraju se požari u slučajevima kada je vatrom zahvaćena manja količina gorive materije, odnosno pojedini predmeti ili manje površine. Ukoliko se odmah pristupi gašenju ovakvih požara ručnim aparatima za gašenje požara, vodom, peskom, zemljom ili nekim prekrivačem oni se mogu brzo lokalizovati i eliminisati.

Srednj požari Srednjim požarom smatraju se oni požari kod kojih je vatrom zahvaćena jedna ili više prostorija sa većim požarnim opterećenjem. Ovde spadaju i požari na otvorenom koji su ograničeni na manji prostorni obim. Požarno opterećenje je definisano standardom. Ovim standardom određuju se tri grupe specifičnih požarnih opterećenja: – nisko požarno opterećenje do 1 GJ/m 2, – srednje požarno opterećenje do 2 GJ/m 2 i – visoko požarno opterećenje preko 2 GJ/m 2.

Veliki požari Velikim požarom smatraju se požari kod kojih je vatrom zahvaćena goriva materija na čitavom spratu, krovu zgrade, većem delu podrumskog prostora ili čitavom objektu. Na otvorenom to su požari koji zahvataju veće površine i veće količine gorivog materijala. Kod ove vrste požara ugrožena je i bliža okolina.

Blokovski požari Blokovskim požarima smatraju se požari koji zahvataju čitave blokove zgrada, delove naselja ili velike komplekse otvorenih skladišta gorivih materijala. Ovde se svrstavaju i veliki šumski požari, poljski požari u rafinerijama, ma da nemaju karakteristike blokovskih požara.

Požarna oluja je fenomen koji može da se javi prilikom prenošenja velikih blokovskih požara, odnosno kada je požarom zahvaćeno više od 70% objekata u gusto naseljenom naselju i kada su vremenski uslovi pogodni za razvoj požara, bez vetra i kiše. U centru takvog požara temperature dostižu preko 1000 0 C, usled čega dolazi do brzog strujanja produkata sagorevanja i vazduha naviše. Usled strujanja i intezivnog trošenja kiseonika u centru požara stvara se potpritisak. Usled stvorenog podpritiska spoljašnji vazduh se usisava i naglo prodire ka centru požara. Brzina strujanja ovog vazduha može da bude i 200 km/h. U situacijama pojave ovog fenomena intervencije gašenja se obustavljaju dok se požar ne stiša.

Faze razvoja požara Posmatrajući fazu razvoja požara, požari mogu da se izdiferenciraju u tri faze: – fazu razvoja, – razbuktavanja i – dogorevanja.

Faza razvoja Za prvu fazu, fazu razvoja, karakterističan je mali intenzitet, relativno niska temperatura i mali prostor zahvaćen požarom. U ovoj početnoj fazi, sagorevanje je nepotpuno sa većom količinom dima, čađi i toksičnim, nepotpunim gasovitim produktima sagorevanja.

Faza razbuktavanja Sledeću, razbuktalu fazu karakteriše sagorevanje 80% i više gorivog materijala, postizanje maksimalnih temperatura sagorevanja i mogućnost širenja požara na okolne objekte i površine.

Dogorevanje Treća faza dogorevanja nastupa posle sagorevanja većeg dela gorivog materijala, karakteriše je opadanje temperature i postepeno gašenje požara. Za ovu fazu su opasna mesta sagorevanja bez plamena, sa žarom, jer usled akumulacije toplote na tim mestima postoji mogućnost ponovnog rasplamsavanja požara ako u okolini ima još gorivog materijala.

Izbor procesa, odnosno mehanizma gašenja požara i izbor sredstava za gašenje zavise od: – vrste gorive materije, – mesta nastanka požara, – veličine i njegovog obima, kao i – faze razvoja.

3. 3. Procesi gašenja Postupci gašenja, koje prate fizički, hemijski, termički i strujni procesi, su u odnosu na proces sagorevanja još složeniji. Zbog toga je preporučljivo da se proces gašenja raščlani na pojedinačne efekte i podefekte gašenja. Raščlanjivanjem procesa gašenja postiže se diferencija kompleksnog procesa gašenja, a sa druge strane omogućuje se funkcionalna podela sredstava za gašenje. Pri tome mora se imati u vidu da nijedno sredstvo za gašenje nema samo jedan efekt gašenja, pogotovu ne samo jedan podefekt.

Procesi gašenja Ovde će mo procese gašenja podeliti na proces gašenja: – hlađenjem, – ugušivanjem i – inhibicijom (antikatalizom). Svaki od ovih procesa ima svoje podefekte.

Gašenje hlađenjem možemo da raščlanimo na podefekte: – isparavanja, – sublimacije, – razlaganja i – izjednačavanja.

Gašenje ugušivanjem na podefekte: – odvajanja, – razredenja (inertizacije) i – emulzije.

Gašenje inhibicijom A gašenje inhibicijom na procese: – homogene i – heterogene inhibicije (antikatalize).

3. 3. 1. Gašenje hlađenjem Po osnovu načina prostiranja toplote pri nekontrolisanim procesima sagorevanja, toplota se prostire na okolinu i okolna tela: – provođenjem ili kondukcijom, – strujanjem ili konvekcijom i – zračenjem ili radijacijom, – dok jedan manji deo toplote ostaje u zgarištu kao toplotni sadržaj zgarišta.

Najveći deo razvijene toplote se kod požara sa plamenom prostire radijacijom, manji konvekcijom dok je kondukcija skoro zanemarljiva. Znači toplota se od mesta požara najvećim delom odvodi zračenjem i konvekcijom, dok se jedan manji deo toplote od 15 do 20 %, u zavisnosti od vrste gorive materije, troši na njeno zagrevanje odnosno na dalje odvijanje procesa sagorevanja.

• Kolličina toplote koju treba oduzeti od požara, da bi se proces sagorevanja zaustavio, je maksimalno 1/5 od ukupno sagorevanjem razvijene količine toplote. • Razlika Q-Q 1 predstavlja količinu toplote koja se izrači tokom požara ili odvede gasovitim produktima sagorevanja. • Sredstvo za gašenje požara efektom hlađenja treba da za svoje zagrevanje i isparavanje utroši količinu toplote Q 1, kako bi se požar eliminisao.

Gašenje hlađenjem vrši se neposrednim dejstvom sredstava za gašenje na samo žarište požara. Hlađenjem, odnosno odvođenjem toplote iz zone sagorevanja smanjuje se temperatura, a time i brzina sagorevanja. Uticaj temperature na brzinu sagorevanja je veliki. Smanjenjem temperature za 10 0 C brzina sagorevanja se smanji od dva do tri puta. Smanjenjm temperature za 100 0 C brzina se smanji 1000 puta. Smanjenjm temperature ispod temperature paljenja sagorevanje se prekida.

Gašenje hlađenjem Od svih sredstava za gašenje voda ima najveću sposobnost hlađenja. Druga sredstva za gašenje kao CO 2 i prah imaju efekat hlađenja kao sporedni evekat. Proces hlađenja se sastoji od nekoliko podprocesa (podefekata) gašenja: – – isparavanje, sublimacija, razlaganje i izjednašavanje.

Agregatna stanja Agregatno stanje, ili faza, je stanje materije opisano svojstvima koja zavise od temperature i pritiska. Klasična fizika poznaje tri agregatna stanja: – čvrsto, – tečno i – gasovito agregatno stanje,

• Prelaz iz jednog u drugo agregatno stanje, iz jedne u drugu fazu, naziva se fazni prelaz. Fazni prelaz je isključivo fizički proces bez hemijskih reakcija. Većina supstanci zagrevanjem prelazi iz čvrstog u tečno agregatno stanje. Temperatura prelaska iz čvrstog u tečno agregatno stanje naziva se temperatura topljenja. Daljim zagrevanjem tečnosti doći će do prelaska u gasovito stanje, a odgovarajuću temperaturu nazivamo temperaturom isparavanja. • Neke supstance direktno iz čvrste prelaze u gasovitu fazu, tj. nepostoje u tečnom stanju, procesom sublimacije.

Tela u čvrstom stanju mogu da budu kristalna i amorfna. U kristalnim telima atomi su pravilno raspoređeni u prostoru i osciluju oko svog ravnotežnog položaja. U amorfnim telima čestice isto osciluju oko ravnotežnog položaja ali je njihov prostorni raspored neuređen. U tečnom stanju je raspored čestica kao kod amorfnih, one osciluju s tim što se i translatorno kreću. Pri tom čestice tečnosti razmenjuju položaje, ali su privlačne sile dovoljno velike u odnosu na njihovu toplotnu energiju da ih drže na bliskom rastojanju. Otuda tečnosti imaju konstantnu zapreminu, ali ne i oblik.

Osim ovih agregatnih stanja koje susrećemo u svekodnevnom životu i čija svojstva su nam dobro poznata, danas savremena fizika definiše još tri agregatna stanja: – plazma, – tečni krustali i – superfluid (supertečnost).

Na ekstremno visokim temperaturama sve materije prelaze u jonozujuće stanje, plazma stanje. Tečni kristali su oni kako im ime kaže: tečnosti sa kristalnom rešetkom. Kod tečne faze molekuli se kreću u prostoru i međusobno menjaju svoja usmerenja, jedan u odnosu na drugi. Tečni kristali se u prostoru kreću kao tečnosti, ali mećusobno molekuli zadržavaju svoja usmerenja. Ovakve supstance lako reaguju na toplotu, zagrevanjem postaju obične tečnosti. Tečni kristali na specifičan način reaguju na električnu struju i svetlost, propučtaju ih u pravcu u kom stepen zakrenutosti tečnog kristala to dopušta. Danas, tečni kristali imaju široku primenu u savremenoj hemijskoj industriji, zahvaljujući njima postoje mobilni telefoni i LCD monitori.

• Superfluid je agregatno stanje koje se javlja kod nekih hemijskih elemenata i jedinjenja kada se oni rashlade ne temperaturu od 2 do 5 K. Za njih je karakteristično da su u tom stanju sa ekstremno niskim viskozitetom i velikim koeficijentom provođenja toplote (λ ). • Primer superfluida je izotop helijuma He-3. Naime helijum ima dva izotopa He-3 i He-4. Kad se rashlade na oko 4 K, kod He-3 gubi se unutrašnji otpor između atoma i He-3 postaje superprfluid sa magnetnim osobinama. Hemijski elementi i jedinjenja sa ovom osobinom koriste se u savremenoj medicini kod magnetne rezonance, u nuklearnoj fizici u akceleratorima čestica i specijalnim električnim generatorima umesto bakarne žice.

Isparavanje Proces isparavanja javlja se pri prelasku tečnosti u parno stanje, tj. pri promeni agregatnog stanja. Sredstvo za gašenje uzima potrebnu kolišinu toplote za isparavanje od materijala koji gori. Najefikasnije sredstvo za gašenje efektom hlđenja, podefektom isparavanja, je voda. Oduzimanjem toplote smanjuje se temperatura, brzina sagorevanja i dolazi do prekida procesa sagorevanja. Da bi se 1 kg vode zagrejao za 1 0 C potrbna je količina toplote od 4, 186 k. J, a da bi 1 kg vode prešao iz tečne u parnu fazu potrebna je količina toplote od 2247, 39 k. J. Pri prelasku iz tečnog u parno stanje od 1 kg vode dobija se 1 700 dm 3 vodene pare. Za promenu zapremine vode utroši se 7, 5%, a za promenu unutrašnje energije 92, 5 % od 2247, 39 k. J latentne toplote isparavanja vode ili entalpije isparavanja.

Sublimacija je prelazak supstance iz čvrstog u gasovito agregatno stanje bez tečnog međustanja. Sublimacija je (u fizici) jedan od faznih prelaza. Pri normalnom pritisku, supstance se, na različitim temperaturama, nalaze u jednom od tri stanja. Pritom, prelazak iz čvrstog u gasovito stanje zahteva tečno međustanje. Kod sublimacije se ono ne javlja. Supstance koje lako sublimuju po pravilu imaju visok napon pare i pri normalnim uslovima.

Sublimacija Neke supstance sublimuju pri normalnim uslovima. Primeri za to su jod i ugljendioksid (suvi led - CO 2 u čvrstom stanju - prelazi u gas bez topljenja). Voda sublimuje tj. iz čvrstog agregatnog stanja, iz faze leda, prelazi u gasovito agregatno stanje, u fazu vodene pare, bez otapanja u vodu, samo u određenim klimatskim zonama koje karakterišu niske temperature, jaki vetrovi, intenzivna Sunčeva svetlost i veoma nizak vazdušni pritisak (npr. južna strana Mt. Everesta). Za sublimaciju, kao i za isparavanje potrebna je toplotna energija, koju meterija koja sublimuje uzima od okoline. Najbolji način za vizualizaciju sublimacije je zamrznuti CO 2, kao što se može videti na slici:

Sublimacija Pri gašenju požara upotrebom CO 2, kao sredstva za gašenje požara, prisutan je proces sublimacije kao jedan od podefekata gašenja, pri čemu CO 2 u fazi leda (snega) za prelazak u gasovitu fazu potrebnu količinu toplote uzima od zapaljene materije.

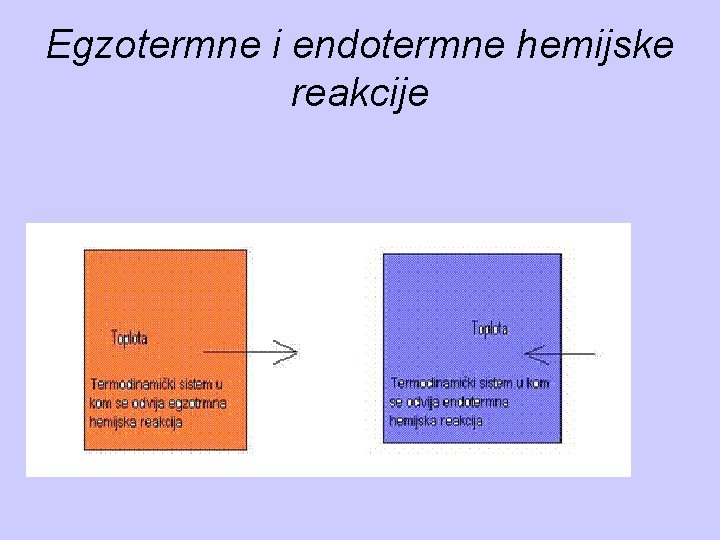
Razlaganje Neke hemijske reakcije odigravaju se sa promenom hemijskog sastava i sa određenim toplotnim efektom, pri čemu može da se energija otpušta ili vezuje. Ukoliko se prilikom reakcije troši ili oslobađa toplota onda se govori o termohemijskim reakcijama. Količina toplote koja se u toku hemijske reakcije oslobađa ili vezuje naziva se toplota reakcije. • Hemijske reakcije koje se odigravaju oslobađanjem toplote nazivaju se egzotermne reakcije. • Hemijske reakcije koje se odigravaju sa vezivanjem toplote nazivaju se endotermne reakcije.

Proces razlaganja javlja se na visokim temperaturama kad sredstvo za gašenje pretrpi neke endotemne hemijske reakcije, pri čemu za odvijanje procesa koristi toplotu koju oduzme od materije koja gori, što za posledicu ima snižavanje temperature u zoni sagorevanja.

Egzotermne i endotermne hemijske reakcije

Izjednačavanje Proces izjednačavanja moguć je samo pri gašenju požara tečnih zapaljivih materija. Pri sagorevanju npr. ulja na površini su visoke temperature. Od gornje površine ka dnu temperatura naglo opada. Efekat izjednašavanja postiže se procesom intenzivnog mešanja tečnosti pri čemu se temeratura gornjeg sloja smanjuje ispod temperature paljenja. Ovaj efekat gašenja moguće je postići samo kod tečnosti sa visokom temperaturom paljenja.

3. 3. 2. Gašenje zagušivanjem Proces sagorevanja uslovljen je tačnim količinskim odnosom zapaljive materije i kiseonika. Na pr:

Proces zagušivanja zasniva se na smanjenju odnosa zapaljiva materija i kiseonik, a sastoji se od sledećih podefekata: – odvajanja, – razredenja i – emulzije.

Gašenje zagušivanjem Proces gašenja zagušivanjem povezan je sa kontaktom gorivi materijal i oksidans, pri čemu je oksidans najčešće kiseonik prisutan u vazduhu. Razdvajanjem ova dva reaktanta, gorivog materijala i vazduha, ili smanjenjem procenta kiseonika u zoni sagorevanja ispod minimalne količine potrebne za sagorevanje proces gorenja se prekida. Koji od podefekata će biti primenjen zavisi od vrste gorivog materijala, odnosno od klase požara.

Podefekt odvajanja Efekt ugušivanja, podefekt odvajanja ili prekrivanja sastoji se od odvajanja parne od tečne faze neke materije u procesu gorenja. Primenjuje se uglavnom pri gašenju požara zapaljivih tečnosti i čvrstih materija koje sublimiraju, odnosno čijim zagrevanjem se formiraju volatili. Izolacija tih dveju faza (tečne ili čvrste od parne) sprovodi se pomoću sredstva za gašenje kao što su vazdušna i hemijska pena. U početnoj fazi nastanka požara kao sredstva za gašenje često mogu da posluže i razna ćebad, pesak, zemlja i slično.

Osim što deluje rashlađujuće na površinu zapaljive tečnosti ili neke druge čvrste materije, pena ima sposobnost rasprostiranja po površini i pokrivanja tih površina, a na taj način gorivi materijal odvaja od parne faze koja ustvari i gori. Kada u požaru izgori parna faza, požar se prekida (ugasi) jer izolujući sloj sredstava za gašenje svojom kompaktnošću, čvrstoćom i otporom sprečava nastajanje i ulazak novih volatila u zonu požara. Ova metoda gašenja požara ima široku primenu na požarima klase ײ B ײ , a može se primeniti i na manjim požarima klase ײ A ײ. Primenom ove metode gašenja troše se znatne količine sredstava za gašenje, ali se istovremeno veoma uspešno sprečava “obnavljanje i povratak“ požara.

Podefekt razređivanja (inertizacije) Efekat ugušivanja, podefekt razređivanja, sastoji se u smanjenju koncentracije kiseonika u vazduhu koji ulazi u zonu reakcije (žarište). Posmatrajući sastav vazduha u kom dominira azot (N 2) sa 78%, te kiseonik (O 2) sa 21% dok 1% pripada ostalim gasovima. Uvođenjem u zonu reakcije na primer azota ili ugnjendioksida (CO 2) smanjuje se koncentracija kiseonika na 15 %, što izaziva prekid gorenja za većinu zapaljivih materija i zuzev materija koje u svom sastavu imaju kiseonik za održavanje gorenja.

Kada se u praksi gašenje sprovodi azotom, ugljen-dioksidom, vodenom parom ili nekim drugim inertnim gasom, ovaj efekat se naziva i inertizacija. Treba napomenuti da se ovaj postupak prekidanja gorenja koristi uglavnom u zatvorenim prostorima, ali i tada treba voditi računa da se posle faze razvijenog požara preostala goriva materija može nalaziti u stanju visoke zagrijanosti i da se, posle dosta dugog perioda, kada dođe do priliva svežeg vazduha može obnoviti plameno gorenje iz žara ili vrelih para zapaljivih tečnosti.

Takođe ovaj postupak prekidanja gorenja koristi se za gašenje početnih požara svih klasa, veoma uspešno, posebno iz razloga što goriva materija i okolina nije dovoljno zagrejana i ne preti opasnost od obnovljenog gorenja. Kako se ubacivanje inertnih materija vrši obično u velikoj količini postiže se brzo smanjenje koncentracije kiseonika, ali i snižavanje temperature žarišta jer je sredstvo za gašenje na znatno nižem temperaturnom nivou od zapaljenog gorivog materijala, pa usled razmene toplote dolazi do snižavanja temperature, što zajedno dovodi do relativno brzog gašenja.

Efekat emulzije Emulzija je smeša dve tečnosti koje se ne rastvaraju jedna u drugoj, pri čemu je jedna od ove dve tečnosti raspoređena u obliku kapi u drugoj. Tečnost koja je prisutna u obliku kapi naziva se disperzna faza, dok se tečnost u kojoj su kapi raspoređene naziva kontinualna faza. Emulzija se zato definiše kao dvokomponentni sistem. Emulzije mogu da se podele u dve grupe: – emulzije tipa ulje u vodi i – emulzije tipa voda u ulju.

Emulzija Primeri emulzija u svakodnevnom životu su mnogi prehrambeni proizvodi (majonez, maslac, mleko, margarin, čokolada), razne vrste kozmetičkih preparata, neke vakcine i medicinski preparati, boje i lakovi, nafta, itd. Proces dobijanja emulzija naziva se emulgovanje. Sredstva za emulgovanje olakšavaju dobijanje emulzija i povećavaju njihovu stabilnost. Najčešće korišćena sredstva za emulgovanje su emulgatori i stabilizatori.

Efekat emulzije javlja se pri gašenju zapaljenih ulja prahom. Na visokim temperaturama dolazi do razlaganja praha pri čemu se dobija H 2 O, CO 2 i Na. CO 3. H 2 O i Na. CO 3 sa uljima stvaraju emulziju čije dejstvo se svodi na proces odvajanja gasne od tečne faze. Gašenje požara efektom emulzije javlja se kao sporedni efekat nenamerno izazvan. Pokušaj gašenja požara zapaljivih tečnost ovim efektom, ubacivanjem vode pod pritiskom može da bude veoma opasan jer nekad se kap emulzije stvori sa opnom od vode (tip A), kada se postiže efekat gašenja, a nekad je opna zapaljiva tečnost (tip B), čime se nepostiže odvajanja gorive materije i kiseonika.

Emulzija: A - ulje u vodi i B voda u ulju Nafta i njeni derivati mogu da formiraju emulzije mešanjem sa vodom. Proces emulgovanja zavisi pre svega od vrste prisutnih ugljovodonika i organskih kiselina. Proces emulgovanja zapaljivih tečnosti pri gašenju požara ne može da se primeni zbog mogućnosti stvaranja emulzije voda u ulju.

3. 2. 3 Efekat inhibicije (antikatalitički efekat) Gašenje požara efektom homogene ili heterogene inhibicije skopčano je sa hemijskom kinetikom, odnosno sa faktorima uticaja na brzinu odvijanja hemijske reakcije sagorevanja i uspostavljanja hemijske ravnoteže.

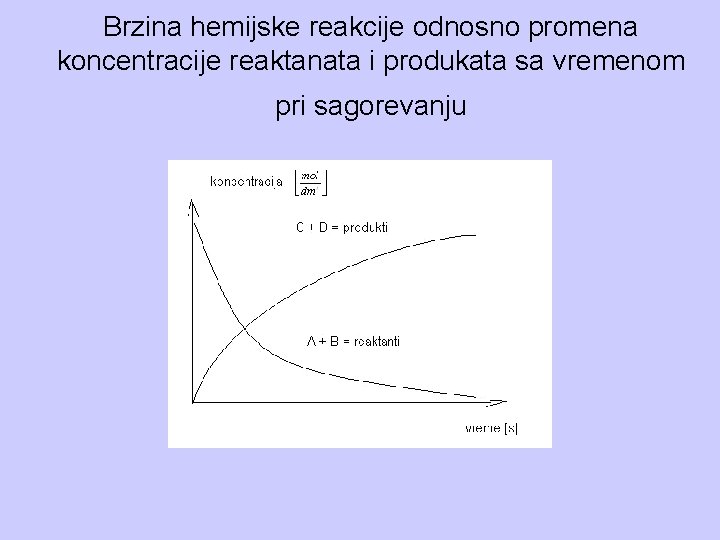
Brzina hemijske reakcije je promena koncentracije reaktanata ili proizvoda reakcije u jedinici vremena. Kod procesa sagorevanja označimo reaktante, gorivu materiju i kiseonik sa A i B, a proizvod reakcije, produkte sagorevanja sa C i D, onda sagorevanje kao hemijski proces možemo da predstavimo jednačinom:


Brzina hemijske reakcije odnosno promena koncentracije reaktanata i produkata sa vremenom pri sagorevanju

Brzina hemijske reakcije sagorevanja Na brzinu hemijske reakcije sagorevanja utiču: – priroda reaktanata i produkata, – temperatura (sa porastom temperature brzina hemijske reakcije se povećava), – koncentracija reaktanata, – dodirna površina između reaktanata i – prisustvo katalizatora.

• Brzina hemijske reakcije sagorevanja često se iskazuje preko konstante brzine hemijske reakcije k, koja zavisi od temperature, pritiska i fizičko – hemijskih svojstava reaktanata. • Konstanta brzine hemijske reakcije • predstavlja učestalost sudara molekula reaktanata.

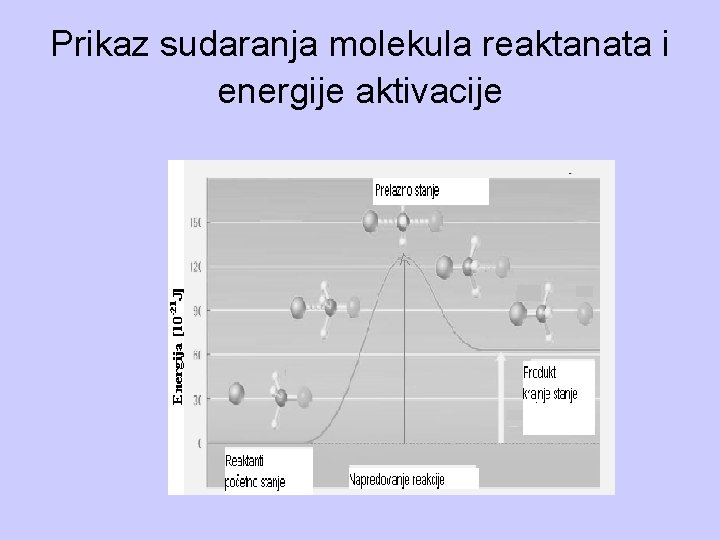
Molekuli, koji su u gasnoj fazi nalaze se međusobno na bliskom rastojanju, usled njihovog neprekidnog kretanja dolazi do međusobnog sudara molekula. Vreme između dva sudara je kratko i iznosi oko 10 -9 s. Da bi došlo do hemijske reakcije sagorevanja potrebno je da dođe do sudara molekula reaktanata i da energija sudara bude dovoljno velika kako bi se raskidale postojeće veze i nagradile nove. Ta energija naziva se energijom aktivacije.

Znači da bi došlo do hemijske reakcije sagorevanja, tj. do nastanka produkata sagorevanja potrebno je da: – se čestice reaktanata sudaraju sa pogodnom orjentacijom i – da prilikom sudara imaju dovoljnu energiju aktivacije. Energija aktivacije, Ea, je minimalna energija koja je potrebna za početak bilo koje hemijske reakcije, pa i reakcije sagorevanja.

Prikaz sudaranja molekula reaktanata i energije aktivacije

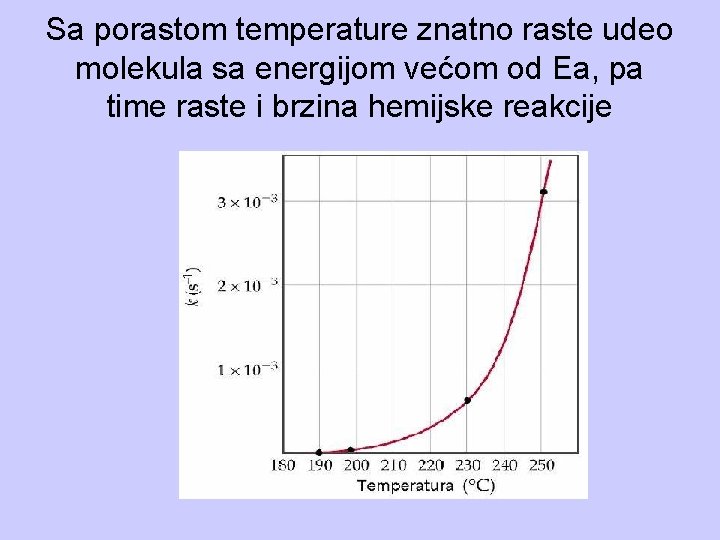
Sa porastom temperature znatno raste udeo molekula sa energijom većom od Ea, pa time raste i brzina hemijske reakcije

• Uticaj površine na procese sagorevanja i gašenja ima značaja samo kod heterogenih procesa, dok je kod homogenih ona zanemarljiva. Veća površina, znači intezivniji prenos mase i toplote, efikasnije sagorevanje, kada je upitanju površina reaktanata i efikasnije gašenje, kada je upitanju dodirna površina između zapaljivog materijala i sredstva za gašenje požara.

Povećanjem koncentracije reaktanata povećava se broj efikasnih sudara, pa je i brzina hemijske reakcije veća. Brzina hemijske reakcije povećava se srazmerno povećanju koncentracije reaktanata, za razliku od uticaja temperature gde je ova zavisnost eksponencijalna. U suprotnom usled smanjenja koncentracije reaktanata u toku odvijanja hemijskog proces, zbog nastajanja produkata, brzina hemijske reakcije opada sa vremenom. Hemijska reakcija koja se zaustavi u trenutku postizanja hemijske ravnoteže zove se povratna hemijska reakcija i u stanju ravnoteže prisutni su i reaktanti i produkti hemijske reakcije. Hemijske reakcije koje idu do kraja zovu se nepovratne hemijske reakcije, kakav je proces sagorevanja i kod njih na kraju imamo samo produkte.

Katalizatori su supstance čije prisustvo u reakcijama povećava brzinu reakcije, a antikatalizatori usporavaju brzinu reakcije. I jedni i drugi deluju u maloj količini, ne učestvuju u hemijskoj reakciji. Proces u kome katalizatori deluju na brzinu hemijske reakcije naziva se kataliza. Postoji homogena kataliza kada su reaktanti i katalizatori u istoj fazi, istom agregatnom stanju i heterogena kataliza kada su u različitim fazama.

Retardanti Brzina rekcije sagorevanja, odnosno gašenja zavisi i od prisutnosti supstanci koje usporavaju rekciju, a označavaju se kao inhibitori ili retardanti ili negativni katalizatori (antikatalizatori). Dovođenjem supstanci sa antikatalitičkim dejstvom u zonu sagorevanja doći će do smanjenja brzine reakcije sagorevanja, a samim tim i do gašenja. Kod datog načina prekida procesa sagorevanja treba razlikovati efekat homogene antikatalize i efekat heterogene antikatalize.

Efekat homogene antikatalize Homogena antikataliza je reakcija pri kojoj supstance koje reaguju i sam antikatalizator imaju isto agregatno stanje i obrazuju jednorodan gasovit sistem. Sam antikatalizator ne učestvuje u procesu sagorevanja, ali njegovo prisustvo usporava hemijsku reakciju do njenog zaustavljanja.

• Tokom procesa sagorevanja u stupnjevitoj, lančanoj reakciji obrazuju se slobodni radikali, nosioci hemijske reakcije sagorevanja, njihovim eliminisanjem ili usporavanjem brzine i smanjenjem broja njihovih sudara usporava se proces sagorevanja. • Slobodni radikali su atomske strukture koje sadrže jedan elektron bez svog komplementarnog elektrona, naime tokom lančane reakcije sagorevanja nastaju slobodni radikali: H, OH, CH 3, C 2 H 5. . . , koji lakše i brže reaguju sa kiseonikom. S druge strane uvođenjem sredstava za gašenje požara kao što su haloni, nova hemijska sredstva za gašenje požara i aerosolnih generatora dolazi do njihove toplotne destrukcije i stvaranja njihovih slobodnih radikala kao što su: CH 2 Cl, CF 3, CCl 2, CHCl. . . , koji ustvari imaju antikatalitičko, tj. inhibitorsko, usporavajuće dejstvo. . Na ovom se efektu uglavnom zasniva delovanje halogenih ugljovodonika koji, s obzirom na svoju građu, u požaru stvaraju radikale koji dovode do prekida lanca procesa gorenja.

Efekat heterogene antikatalize Heterogena antikataliza se objašnjava time što se slobodnim radikalima, koji održavaju lančani razvoj reakcije sagorevanja, u kontaktu sa česticom, na primer praha, tj. pri sudaru sa njom, oduzima energija aktivacije, odnosno ona se predaje antikatalizatoru. Ukoliko je neka materija više usitnjena, utoliko je veća njena ukupna površina u odnosu na masu. Tako, na primer, 1 kilogram praha za gašenje požara, srednje veličine čestice od 0, 02 do 0, 03 mm ima korisnu površinu od nekoliko stotina kvadratnih metara. Ova neubičajeno velika kontaktna površina objašnjava veliki broj sudara sa nosiocima lančane reakcije sagorevanja i veliki efekat gašenja prahom.

Suština antikatalitičkog efekta sredstava za gašenje leži u njegovoj spospbnosti da svojim molekulima „koče“ slobodne radikale – nosioce lanaca do prekida lanaca reakcije. Osim ove dve pretpostavke, o homogenoj antikatalizi i heterogenoj, postoji i pretpostavka da treća komponenta vrši dezaktiviranje slobodnih radikala tako što se sa njima rekombinuje i „lepi“ ih za sebe, čime stupaju u reakciju, pa onda više nije reč o katalizatoru, odnosno antikatalizatoru, već o inhibitoru. Sam antikatalitički mehanizam delovanja sredstva za gašenje još uvek je u domenu pretpostavki i dovoljno naučno nepotvrđenih hipoteza, pa je iz tih razloga sigurnije koristiti izraz inhibicija, nego antikataliza.
 Entalpija reakcije
Entalpija reakcije Ille mi par esse deo videtur traduzione e analisi
Ille mi par esse deo videtur traduzione e analisi позитивна наследничка изјава
позитивна наследничка изјава Il taso
Il taso Isključenje nužnih nasljednika
Isključenje nužnih nasljednika Omov zakon za deo strujnog kola
Omov zakon za deo strujnog kola Deo florida
Deo florida Bilabijalni glasovi
Bilabijalni glasovi Deo cecytem
Deo cecytem Reganove vezbe za lumbalni deo kicme
Reganove vezbe za lumbalni deo kicme Nui deo
Nui deo Amritdhara pharmacy v. satyadeo gupta
Amritdhara pharmacy v. satyadeo gupta Rekrutim kuptimi
Rekrutim kuptimi Psihicke funkcije podela
Psihicke funkcije podela Procesi
Procesi Dolinski ledenjaci
Dolinski ledenjaci Plan financiar
Plan financiar Puženje
Puženje Vanjske sile
Vanjske sile Kognitivne nauke
Kognitivne nauke Fizikālie procesi
Fizikālie procesi Unutrasnja energija
Unutrasnja energija Egzogeni procesi kviz
Egzogeni procesi kviz Plan projekti
Plan projekti Adijabatski procesi
Adijabatski procesi Reakcije oksido redukcije
Reakcije oksido redukcije Qarkullimi i ujit ne natyre vizatim
Qarkullimi i ujit ne natyre vizatim Pravoditelj
Pravoditelj Notat ne muzik
Notat ne muzik Procesi socijalizacije
Procesi socijalizacije 2 zakon termodinamike
2 zakon termodinamike Saznajni procesi
Saznajni procesi Marinski reljefni oblici
Marinski reljefni oblici Procesi i vendimarrjes
Procesi i vendimarrjes Osnovi metabolizma hemija
Osnovi metabolizma hemija Membranski procesi
Membranski procesi