VIRUS FITOPATGENOS FITOPATG ENOS Raquel Fernndez Ana Gmez










![3. Multiplicación Traducción temprana ARN cs+ [= ARNm] Proteínas tempranas (Reguladoras) Citoplasma Replicación (Síntesis 3. Multiplicación Traducción temprana ARN cs+ [= ARNm] Proteínas tempranas (Reguladoras) Citoplasma Replicación (Síntesis](https://slidetodoc.com/presentation_image_h/b9ce9fe7484fdb8fcce5b543cc42fec7/image-17.jpg)



































- Slides: 56

VIRUS FITOPATÓGENOS FITOPATÓG ENOS Raquel Fernández Ana Gómez Rosa Mª.

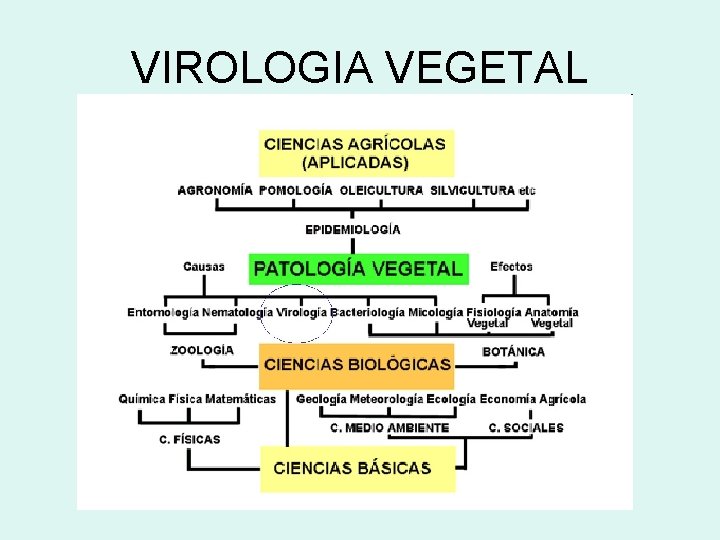
VIROLOGIA VEGETAL

¿QUÉ ES UN VIRUS?

VIRUS VEGETALES EN LA HISTORIA: Entre 1600 -1660 en Europa occidental: TULIPOMANÍA Virus del mosaico del Tulipán: produce Variegación.

VIRUS VEGETALES EN LA HISTORIA Beijerinck Descubrió agentes filtrantes más pequeños que las bacterias.

VIRUS VEGETALES EN LA HISTORIA: • 1922. Kunkel: estudió la transmisión de virus por insectos. • Entre 1930 -1950 la virología se centró en el estudio del TMV.

VIRUS VEGETALES EN LA HISTORIA: • En los 80 se descubrieron nuevas técnicas de diagnóstico. • En la actualidad: se busca el beneficio comercial.

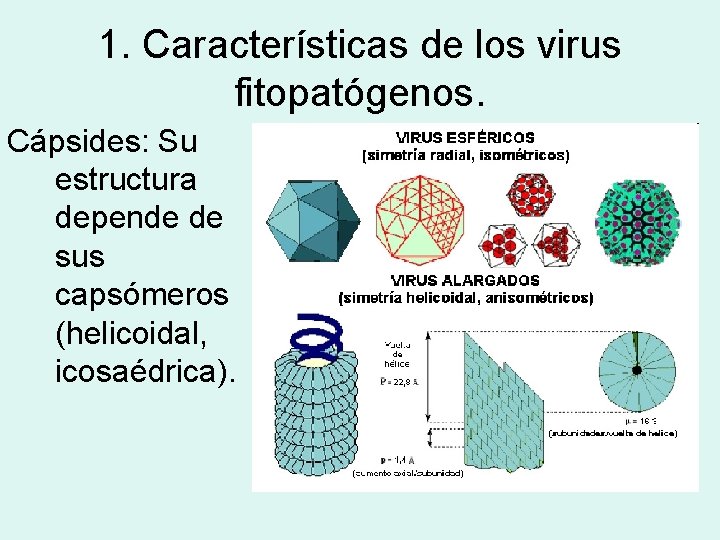
1. Características de los virus fitopatógenos. Cápsides: Su estructura depende de sus capsómeros (helicoidal, icosaédrica).

1. Características de los virus fitopatógenos. Presentan un único tipo de capsómero, no tienen proteínas de unión específicas.

1. Características de los virus fitopatógenos. La mayoría no presentan envuelta, son virus vegetales desnudos. Genoma: la mayora presentan ARN de cadena sencilla, polaridad positiva. Pueden presentar el genoma segmentado.

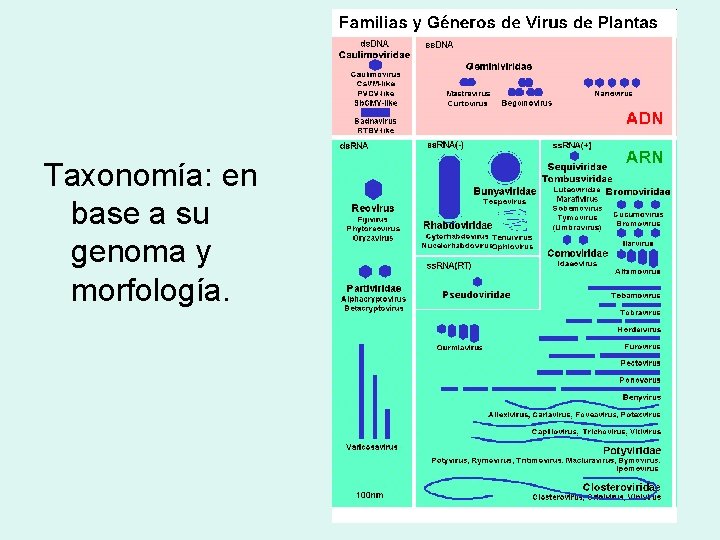
Taxonomía: en base a su genoma y morfología.

2. Infección y transmisión. Solo infectan a la planta a través de un vector o por una herida mecánica. NO TIENEN RECEPTOR ESPECIFICO.

2. Infección y transmisión. Mecanismos de transmisión: A través de la semilla. Propagación vegetativa (injerto) Transmisión mecánica (daño humano y ambiental).

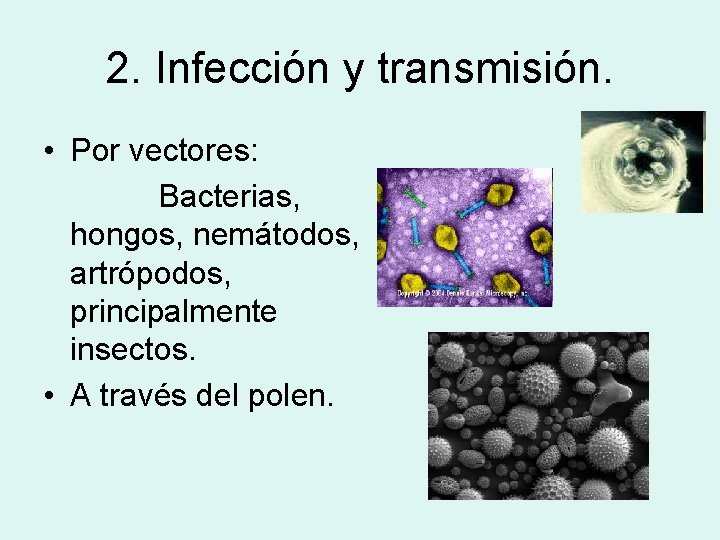
2. Infección y transmisión. • Por vectores: Bacterias, hongos, nemátodos, artrópodos, principalmente insectos. • A través del polen.

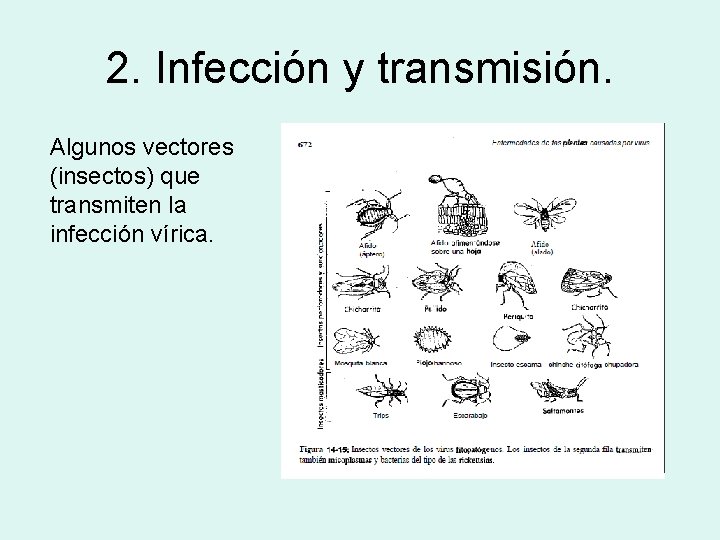
2. Infección y transmisión. Algunos vectores (insectos) que transmiten la infección vírica.

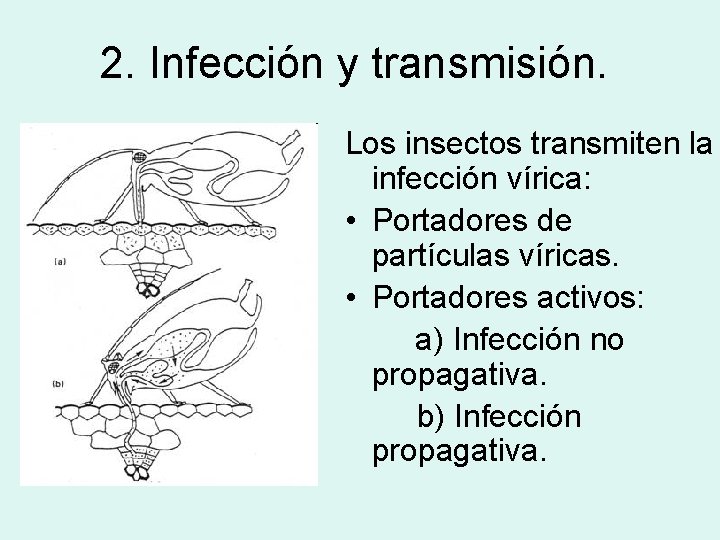
2. Infección y transmisión. Los insectos transmiten la infección vírica: • Portadores de partículas víricas. • Portadores activos: a) Infección no propagativa. b) Infección propagativa.
![3 Multiplicación Traducción temprana ARN cs ARNm Proteínas tempranas Reguladoras Citoplasma Replicación Síntesis 3. Multiplicación Traducción temprana ARN cs+ [= ARNm] Proteínas tempranas (Reguladoras) Citoplasma Replicación (Síntesis](https://slidetodoc.com/presentation_image_h/b9ce9fe7484fdb8fcce5b543cc42fec7/image-17.jpg)
3. Multiplicación Traducción temprana ARN cs+ [= ARNm] Proteínas tempranas (Reguladoras) Citoplasma Replicación (Síntesis Replicasa virus ARN cs-) ARN cs+ ARN cs- ARN cd ARNm Tra du Cit ↑↑ S ínte sis ARN cs + Progenie virus (Proteínas + ARNcs+) op cc las ión tar día ma Proteínas tardías (Estructurales) INCLUSIONES CRISTALINAS INFECCIÓN A CÉLULAS ADYACENTES Virus del Mosaico del tabaco: simetría helicoidal, RNA cadena simple, polaridad positiva.

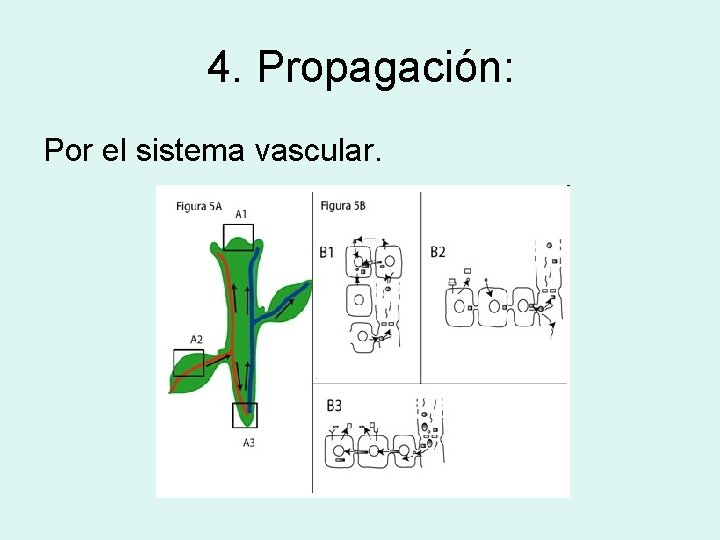
4. Propagación: Por el sistema vascular.

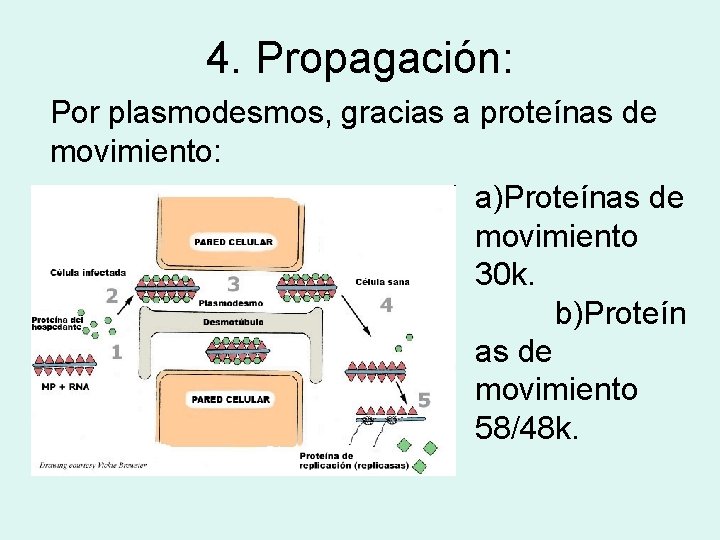
4. Propagación: Por plasmodesmos, gracias a proteínas de movimiento: a)Proteínas de movimiento 30 k. b)Proteín as de movimiento 58/48 k.

5. Virus multiparticulados: Son virus con genoma fraccionado, y cada uno de los fragmentos están encapsidados en una partícula independiente. • Begomovirus. • Comovirus. • Bromoviridae. • Ventaja y desventaja.

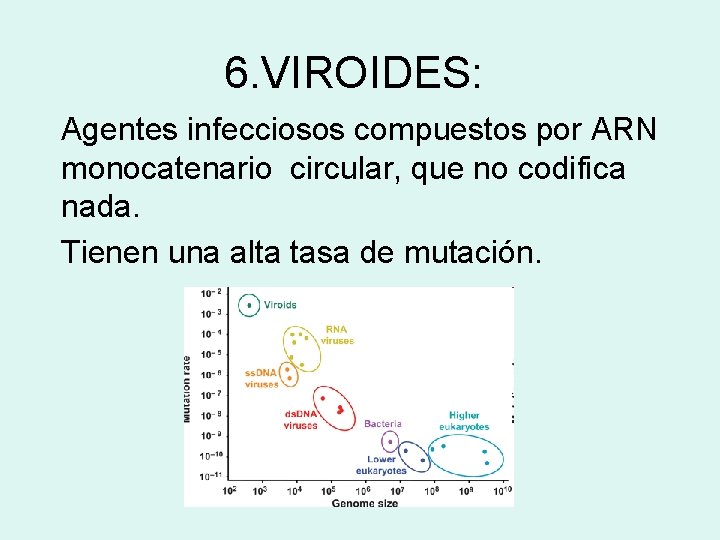
6. VIROIDES: Agentes infecciosos compuestos por ARN monocatenario circular, que no codifica nada. Tienen una alta tasa de mutación.

• INFECTAN FUNDAMENTALMENTE A PLANTAS. • Transmisión: mecánica, polen…. • Patogénesis vegetal: tubérculo filiforme de la patata, cadang-cadang del cacahuete, enanismo del crisantemo… Hoja de olivo con clorosis y deformaciones causadas por viroides.

7. Satélites: Agentes infecciosos que no pueden replicarse por sí mismo y necesita la coinfección de otro virus vegetal. Dos tipos: • Virus satélites. • Ácidos nucleicos satélite. Patógenos: VTMo. V, LTSV, SCMo. V

9. Respuestas de la planta a la infección: • Síntesis de proteínas PR (proteínas respuesta). • Incremento en la producción de compuestos fenólicos en la pared celular. • Liberación de especies activas del oxígeno. • Producción de fitoalexinas. • Acumulación de ácido salicílico.

10. Síntomas de la planta infectada • Mosaico • Tumores o agallas Virus del mosaico del tabaco. • Enanismo o achaparramiento Achaparramiento en maíz Enanismo en planta de patata. Compárese con la planta normal de la izquierda.

• Marchitez manchada del tomate • Clorosis Amarillamiento de la remolacha por BYV

• Anillos cloróticos • Fasciación Anillos cloróticos en hojas de Morrón. Fasciación en sarmiento de Vid • Necrosis de las nervaduras. • Ramas planas

• Sarna del peral • Perforaciones Corteza corchosa de la vid • Manchas anulares en las hojas

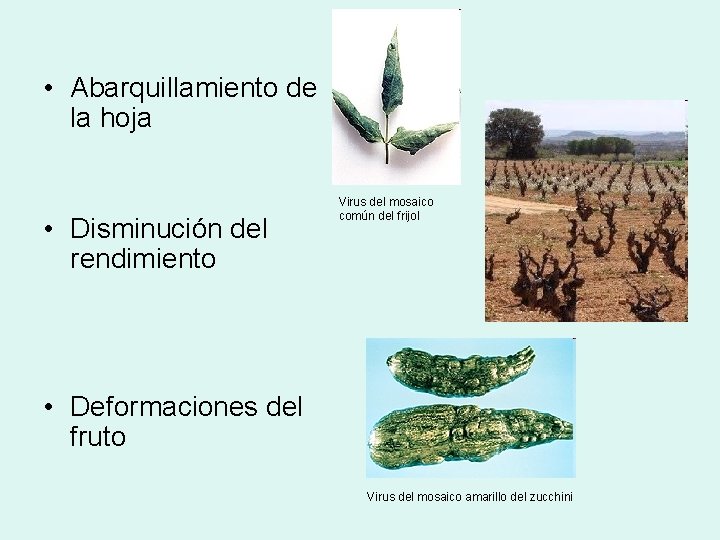
• Abarquillamiento de la hoja • Disminución del rendimiento Virus del mosaico común del frijol • Deformaciones del fruto Virus del mosaico amarillo del zucchini

• Variegación Virus del quebrado de color del tulipán • Exfoliación de la corteza

EN RESUMEN: Las infecciones virales: • Rara vez matan a la planta. • Dan síntomas localizados. • Para producir infección sistémica deben atravesar barreras tisulares. • La infección es de por vida.

PREVENCIÓN Y CONTROL: • Control de los vectores de transmisión. • Eliminación de los huéspedes alternativos. • Técnicas de higiene. • Desarrollo de variedades resistentes de cultivo. • Uso de semillas o portainjertos certificados libres de virus.

Virus del mosaico del tabaco (TMV) • Es el virus de las plantas más estudiado. • Sirvió como sistema modelo para la virología y biología molecular. • A. Martinus Beijerinck se le reconoce por el virus TMV y por acuñar el término “virus”. • Participante en la historia del TMV: Rosalind Franklin formuló hipótesis de que la partícula de TMV era hueca, y genoma RNAcs.

Estructura • Helicoidales. • Es uno de los más estables. • Resistente a agentes químicos y físicos que inactivan a otros virus. • Proteína de cubierta resistente a proteasas. • RNA cs + • Proporción ARN/PROTEÍNA: 5/95%

Rango de huéspedes y transmisión • • Rango amplio: > 500 sp. de plantas en floración. De importancia comercial: tomate, tabaco, pimientos y patatas. Transmisión mecánica, entre plantas, por raíces y suelo; por inoculación mecánica; operarios con manipulación de tabaco infectado, fácil transmisión a otras plantas contribuyendo a su diseminación. Desconocida la transmisión por vectores artrópodos. Estabilidad del TMV: - Su infectibilidad persiste ~2 años en suelos sin exposición a heladas o sequías. - También en los restos de las plantas en el suelo. - En los abonos orgánicos de las plantas de los tomates.

Signos y diagnósticos • Comparando con otros virus, sus signos infecciosos no son tan definidos. • Variación de signos dependen: cepa viral, edad de la planta, condiciones de cultivo. • Sintomatología: áreas en mosaico de color verde oscuro y claro; reducción del desarrollo. En invierno pueden aparecer plantas enanizadas con las hojas en forma de “hoja de helecho”. • Generalmente, no mata a la planta, afectando a la calidad y cantidad de cultivo. • Efectos por herbicidas, deficiencias minerales y otras enfermedades se pueden confundir con los de TMV.

Control • Por su estabilidad es casi imposibles prevenir la infección por TMV en la naturaleza. • TMV se encuentra donde sea que el tabaco se desarrolle. • Reduce el rendimiento del cultivo en un 30%, disminuyendo el valor comercial. • Puede permanecer años en cigarrillos realizados con hojas infectadas. • Medidas para prevenir diseminación: – Usar suelos no contaminados. – Prohibir fumar durante el trabajo. – Lavarse las manos. – Eliminar plantas infectadas. – Realizar transplantes en campos libres de tabaco, tomate y pimiento. – Plantar variedades resistentes a TMV.

VIRUS DEL ENANISMO DEL TRIGO • Descripción: formados por dos partículas isométricas unidas El genoma consiste en una molécula circular de ADN monocatenario. • Citopatología: los viriones se encuentran en el núcleo de células de hojas y raíces. No inducen la formación de inclusiones. • Huéspedes: Los hospedantes naturales son avena, cebada y trigo. Experimentalmente se ha determinado la susceptibilidad de varias especies de gramíneas. • Sintomatología: enanismo severo acompañado de estrías y amarilleos en las hojas. • Transmisión: por Psammotettix alienus. No inoculación mecánica, semilla. • Distribución geográfica: norte, este y oeste de Europa. Otros países como Francia y, mas recientemente, en España se han observado brotes epidémicos de este virus.

Cultivo de trigo Vector Psammotettix alienus

VIRUS DE LAS MANCHAS CLORÓTICAS DEL MANZANO • Descripción: filamentos flexuosos helicoidales. Contienen una sola molécula de RNA de cadena sencilla y sentido positivo • Huéspedes: Albaricoquero, almendro, cerezo, ciruelo, melocotonero y otros ornamentales; manzano, membrillero, peral y algunas rosáceas ornamentales y frambueso.

• Sintomatología: afectan poco a la mayoría de las especies y cultivares: – Albaricoquero: viruela en frutos y retraso en el crecimiento, algunas cepas puede provocar la formación de rosetas con entrenudos muy cortos. – Cerezo: necrosis en frutos – Injertos Prunus: Provoca mal prendimiento del injerto cuando se injerta en patrones infectados. – Melocotonero: causa líneas y puntos que forman un jaspeado verde, mas oscuro que el color normal en hojas jóvenes – Ciruelo: Causa ramas aplanadas y corteza agrietada – Membrillero: Causa crecimiento débil en primavera, manchas cloróticas, deformaciones en hojas y frutos pequeños y poco numerosos • Transmisión: Por injerto y otras multiplicaciones vegetativas y experimentalmente por inoculación mecánica. • Distribución geográfica: Mundial.

VIRUS DEL ENRROLLADO DE LA HOJA DE LA JUDÍA • Descripción: Partícula isométrica. Compuesto de una molécula de RNA de • • • cadena sencilla y sentido positivo. Citopatología: Virus encontrados en el floema de la plantas infectadas, donde ocasionan necrosis y colapso del floema. Huéspedes: Guisante, judía, haba, lenteja, garbanzo, alfalfa, trébol. Sintomatología: amarilleo internervial de las hojas viejas, enrollado y disminución de vainas en haba. En guisante, judía, garbanzo y lenteja causa clorosis y enanismo. En alfalfa es asintomático. Transmisión: Se transmite por pulgones de forma persistente. Acyrthosiphonpisum es el vector más eficiente. Distribución geográfica: Oriente próximo, Norteamérica, Europa; en España se ha citado en Andalucía, Murcia, Castilla y León, Cataluña, Baleares y Extremadura.

VIRUS DEL MARCHITAMIENTO DEL HABA Descripción: Partículas isométricas. • • Citopatología: inclusiones amorfas y cristalinas en células epidérmicas. Inclusiones en forma de tubo compuestos por partículas virales. • Huéspedes: guisante, haba, espinaca, pimiento, zanahoria, perejil.

• Sintomatología: Produce marchitamiento en haba y espinaca; la infección es temprana produce una necrosis sistémica de las hojas del brote. En guisante causa estrías. En pimiento, mosaico de fuerte a suave en brotes, en forma de manchas de color verde oscuro. En frutos síntomas variables, desde áreas necróticas, manchas necróticas, dibujos irregulares y anillos cloróticos. Reducción del desarrollo. • Transmisión: Transmitido por M. persicae de forma no persistente. M. persicae se considera como el mas eficiente vector de esta virosis. • Distribución geográfica: Australia, USA, Japón, Europa, España.

VIRUS DEL BRONCEADO DEL TOMATE • Estructura: partícula isométrica esférica. Tiene 3 cadenas de ARN monocatenario negativo. Envuelta licoprotéica que presenta la superficie cubierta de proyecciones. • Citopatología: Incluido en el retículo endoplasmático, formando paquetes, en el citoplasma de las células infectadas. • Huéspedes: son muy variados desde solanáceas hasta leguminosas así hasta llegar a 500 especies. • Sintomatología: tonalidad bronceada sobre las hojas jóvenes, parada de crecimiento incluso la muerte, necrosis y amarilleos con manchas anilladas • Transmisión mediante tisanópteros.

CONCAVIDADES GOMOSAS DE LOS CíTRICOS • Citopatología: Acumulación de goma en los vasos del xilema de • • algunos anillos de crecimiento. Huéspedes: Naranjo, mandarino y pomelo. Sintomatología: concavidades alargadas en el tronco, anchas y de fondo plano o estrechas y profundas. En las secciones transversales de las zonas afectadas se observa acumulación de goma en forma de anillos concéntricos. en los bordes de las concavidades se producen grietas en la corteza, por las que rezuma la goma acumulada en el xilema. En las hojas jóvenes se observa al trasluz la aparición de flecos cloróticos y manchas de bordes ondulados en torno al nervio principal, que se asemejan a la forma de una hoja de roble. Transmisión: El agente se transmite por injerto. Distribución geográfica: Zonas templadas.

VIRUS DE LA TRISTEZA DE LOS CITRICOS • Descripción: Partícula filamentosa flexuosa, ARN monocatenario de sentido positivo y dos proteínas helicoidales alrededor del ARN genómico. • Citopatología: Limitado a floema. En especies sensibles se observa inactivación de la actividad meristemática del cambium, entre la corteza y la madera, da lugar a un crecimiento radial irregular con formación de acanaladuras en la madera donde esta inactivacion tiene lugar. sobre naranjo, induce formación de cantidad excesiva de floema, y en la zona próxima a la línea de injerto. Los tubos criboso y células acompañantes del floema funcional aparecen obliterados y finalmente se necrotizan, que induce la formación de nuevo floema, que sufre el mismo proceso de decaimiento. Los radios medulares del naranjo situados bajo la línea de injerto frecuentemente sufren hiperplasia y se lignifican, quedando adheridos a la madera cuando se separa la corteza.

• Huéspedes: la mayoria de las especies y variedades de los generos Citrus y Fortunella, Algunas especies, como las limas acidas, son más sensibles, los pomelos y naranjos dulces, son tolerantes y solo dan sintomas con los aislados mas virulentos; los mandarinos, son tolerantes a casi todos los aislados. El naranjo trifoliado (Poncirus trifoliata) posee genes de resistencia que impiden el movimiento y acumulacion del virus, y el kumquat y pomelo tienen genes de resistencia frente a algunas cepas del virus.

• Sintomatología: 3 síndromes diferentes: - Decaimiento y muerte de plantas propagadas sobre naranjo amargo o limonero. - Amarilleo de plantas de semilla - Acanaladuras en la madera, enanismo y fruta pequeña. *Primer síndrome: enfermedad de la tristeza, CTV causa la muerte del floema por debajo de la línea de injerto, da lugar a la desnutrición y muerte progresiva del sistema radicular, provoca brotaciones escasas y cortas, produce frutos pequeños y amarillentos, defoliación y muerte progresiva de la copa que suele acabar con la vida del árbol. Los árboles afectados presentan pequeñas proyecciones en la cara cambial de la madera, que se corresponden con orificios en la corteza. * Segundo síndrome: consiste en un amarilleo intenso de las hojas y detención del crecimiento de plantitas de semilla de pomelo, limonero o naranjo amargo. * Tercer síndrome resulta de la inactivación de algunas zonas del cambium, da lugar a enanismo, frutos de tamaño reducido y mermas en la producción y calidad de la fruta. La incidencia de estos síndromes varia con los aislados y especies afectadas.

• Transmisión: La vía fundamental de es mediante propagación vegetativa de yemas infectadas, y por pulgones de forma semipersistente. El vector mas eficiente es Toxoptera citricida, seguido por Aphis gossypii, el principal propagador en el Mediterráneo. Otras especies menos importantes parecen transmitir solo algunos aislados del virus. • Distribución geográfica: Mundial. CTV esta presente en casi todas las zonas de cultivo de cítricos, si bien su incidencia y la intensidad de los daños varían mucho de unas zonas a otras.

VIRUS DEL ENTRENUDO CORTO INFECCIOSO DE LA VID de silueta angular, con RNA • Descripción: Partículas isométricas monocatenario de sentido positivo. • Citopatología: Partículas virales en células del parénquima de las raíces de plantas de vid y en el citoplasma de células del mesófila de Chenopodium sp. • Huéspedes: Presencia en el genero Vitis sp. , y en diferentes plantas herbáceas y hortícolas, como: Nicotiana tabacum, Chenopodium sp. , Phaseolus vulgaris, Cucumis sativus, etc. • Sintomatología: En hoja son senos peciolares abiertos, nervios principales con tendencia a juntarse, dentición acusada y mosaicos. -Los pámpanos muestran ramificación anormal, nudos dobles, entrenudos cortos, fasciaciones y bifurcaciones, madera aplastada y crecimiento en zig–zag. -Los racimos presentan corrimiento de bayas. Tanto las raíces principales y secundarias aparecen en menor numero, con mas grosor y menor longitud que las de plantas sanas. Agostamiento irregular.

• Transmisión: Propagación vegetativa, teniendo como vector transmisor el nematodo ectoparasito Xiphinema index. También por inoculación mecánica artificial a determinadas plantas herbáceas. • Distribución geográfica: Muy extendido por todas las zonas vitícolas, siendo mayor su presencia en suelos con X. index.

VIRUS DEL ENROLLADO DE LA HOJA DE LA PATATA • Descripción: Partícula isométrica. Con RNA de cadena simple y polaridad positiva. Proteína de la capside con una región necesaria para la transmisión por el pulgón. • Citopatología: Restringido al floema, causa necrosis aparentes. • Huéspedes: La patata y también infecta a especies de Solanáceas, y en otras familias como Amaranthus sp. En tomate se le conoce como “Tomato yellow top”, aunque no ha sido descrito en España hasta este momento.

• Sintomatología: La infección por pulgón (síntoma primario), produce una clorosis intervenal y enrollamiento hacia arriba de las hojas apicales. En variedades norteamericanas, la necrosis del floema se aprecia a simple vista al cortar el ombligo del tubérculo. La planta nacida de tubérculo el año siguiente de la infección por pulgón (síntoma secundario) presenta los síntomas foliares desde las primeras hojas con el típico enrollamiento, se vuelven coriáceas y producen un chasquido característico al ser dobladas. Se reduce el tamaño de los tubérculos y el rendimiento puede bajar hasta un 50%. • Transmisión: Mediante propagación vegetativa de material infectado, y transmisión mecánica con las herramientas de poda. Es poco probable que se transmita por semilla. • Distribución geográfica: en Europa (Francia, España, Italia, Bosnia–Herzegovina y Grecia), África (Túnez) y Australia y Estados Unidos.

VIROIDE DE LOS CHANCROS PUSTULOSOS DEL PERAL • Descripción: RNA monocatenario circular con estructura secundaria en forma de cuasi–varilla con regiones de doble hélice • Citopatología: Ninguna descrita. • Huéspedes: Los únicos hospedantes naturales son el peral y el membrillero. Transmitido experimentalmente a especies del genero Pyrus, Malus, Chaenomeles, Cydonia y Sorbus, aunque en todos los casos sin síntomas. Se ha transmitido al pepino, que reacciona con una ligera rugosidad de las hojas o asintomáticamente. • Sintomatología: la mayoría de los cultivares de peral son tolerantes. Los síntomas en condiciones de campo solo se expresan en corteza dos años después de la inoculación y consisten en pústulas superficiales en la epidermis que, evolucionan a chancros, escamas y hendiduras profundas, que causan la muerte en 5– 8 años. Los síntomas en invernadero, consisten en necrosis en la base de los pecíolos que luego se extiende a las hojas y a la corteza, aparecen a los 3– 5 meses después de la inoculación.

GRACIAS Y MUCHA SUERTE
 Leyes de las reacciones químicas
Leyes de las reacciones químicas Selena gmez
Selena gmez Jeremy enos
Jeremy enos Heavenly father prayer
Heavenly father prayer Alejandro fernndez
Alejandro fernndez Alejandro fernndez
Alejandro fernndez Raquel villaamil
Raquel villaamil Santiago mazarrasa
Santiago mazarrasa Raquel tena
Raquel tena Neutropenia febril
Neutropenia febril Raquel anido
Raquel anido Raquel trillo
Raquel trillo Halimbawa ng akdang patula
Halimbawa ng akdang patula El lider y su familia jonas y raquel arrais pdf
El lider y su familia jonas y raquel arrais pdf Raquel sanchez
Raquel sanchez Raquel anido
Raquel anido Raquel otero
Raquel otero Aaup porta
Aaup porta Raquel rose
Raquel rose Raquel ramati
Raquel ramati Raquel montllor linares
Raquel montllor linares Raquel anido
Raquel anido Raquel miralles
Raquel miralles Raquel bono
Raquel bono Raquel oliveira prates
Raquel oliveira prates Raquel oreiro
Raquel oreiro Raquel anido
Raquel anido Raquel huidobro
Raquel huidobro Raquel olmos
Raquel olmos Raquel julia rita carolina fernando paulo
Raquel julia rita carolina fernando paulo Jonas arrais
Jonas arrais Nols dhet
Nols dhet Raquel en hebreo
Raquel en hebreo Collectively exhaustive
Collectively exhaustive Alkabani
Alkabani Veonika raquel
Veonika raquel Raquel sedano
Raquel sedano Credtic
Credtic Raquel duarte-davidson
Raquel duarte-davidson Raquel vila
Raquel vila Raquel glazman y maría de ibarrola
Raquel glazman y maría de ibarrola Raquel tena barreda
Raquel tena barreda 2bach
2bach Raquel mendoza age
Raquel mendoza age Raquel puertas
Raquel puertas Rabies incubation period
Rabies incubation period Vírus de macro
Vírus de macro Rna virus
Rna virus Virus
Virus Como se transimite el sida
Como se transimite el sida Virus coxsackie
Virus coxsackie Clasificación de la familia
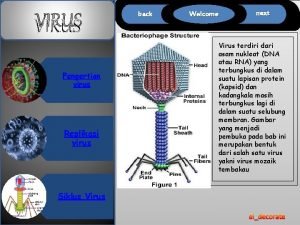
Clasificación de la familia Bacteriófago
Bacteriófago Hoax virus informatico
Hoax virus informatico Aciclovir varicela copii
Aciclovir varicela copii Paravo virus
Paravo virus Virus name
Virus name