Inoculacin de fitopatgenos Curso Diagnstico de enfermedades vegetales

























- Slides: 27

Inoculación de fitopatógenos Curso: Diagnóstico de enfermedades vegetales. Ing. Agr. Vivienne Gepp, MSc. 6 de mayo de 2011

Objetivos • Conocer las principales técnicas que se usan para inocular hongos, bacterias, virus y nematodos fitopatógenos.

Esquema de la clase PARTE TEÓRICA • Inóculo, calidad y cuantificación. • Métodos de inoculación de hongos, bacterias, virus y nematodos en hojas, raíces, tallo, frutos. PARTE PRÁCTICA • Inoculación LUEGO DE LA CLASE • Observación, análisis e informe de resultados

Inóculo • Hongos: – trozos de micelio – esporas – esclerotos • Bacterias: – unidades formadoras de colonias (UFC) • Virus: – partículas en macerado, buffer, etc. • Nematodo s: – larvas, huevos, quistes

Calidad del inóculo • Viable – en activo crecimiento (micelio, bacterias), esporas capaces de germinar • Homogéneo: – siembra de hongo en centro de placa vs. suspensión de esporas • “Acostumbramiento a crecer en medio de cultivo” – pérdida de patogenicidad (Ralstonia) o de producción de esporas (Septoria, Cercospora)

Cuantificación del inóculo • Hematocitómetro • Turbidez • Unidades formadoras de colonias

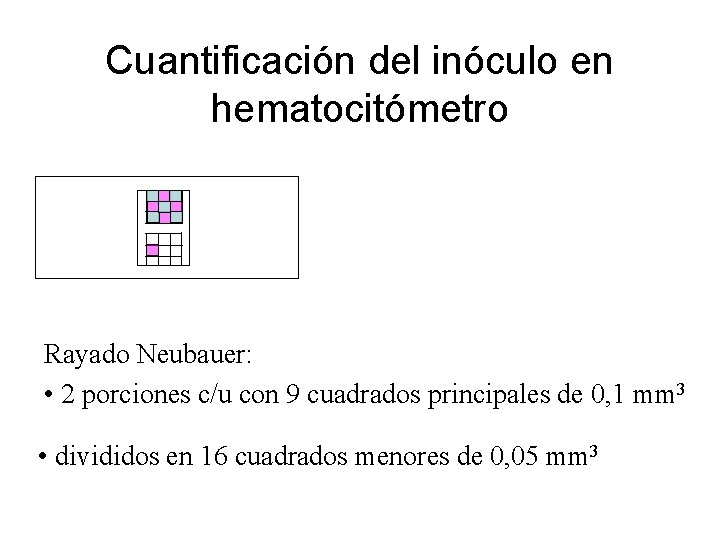
Cuantificación del inóculo en hematocitómetro Rayado Neubauer: • 2 porciones c/u con 9 cuadrados principales de 0, 1 mm 3 • divididos en 16 cuadrados menores de 0, 05 mm 3

Cuantificación de inóculo • Turbidez - bacterias – Escala de Mc. Farland: Ba. Cl 2 + H 2 SO 4 – Densidad óptica: colorímetro o espectrofotómetro a 450 – 650 mµ

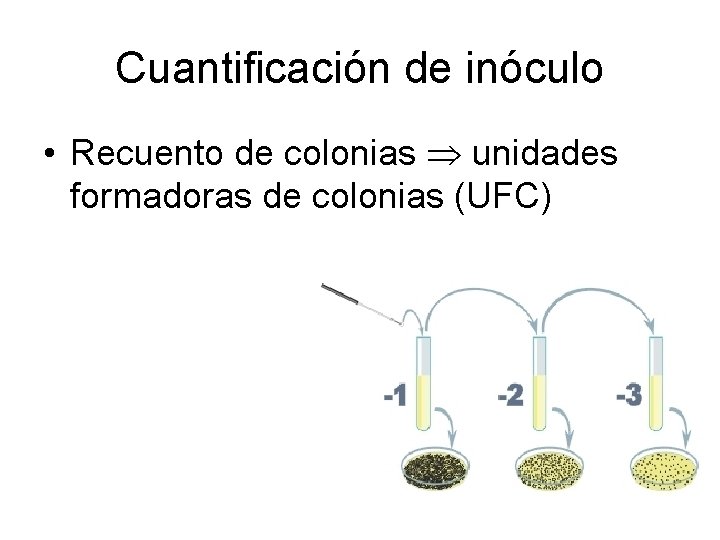
Cuantificación de inóculo • Recuento de colonias unidades formadoras de colonias (UFC)

Inoculación al follaje • Penetración por estomas o epidermis - mayoría penetra en 24 hs. en condiciones adecuadas de humedad y 20 -24ºC • Métodos: 1. pulverización: • • 0, 5% Tween o 0, 1% jabón cereales: 1º frotar hoja con dedos mojados para que se mojen mejor 0, 5% gelatina o 0, 1 -0, 2% agar – adhiere esporas y mantiene humedad aceite dispersa esporas, mantiene humedad. Oidios pierden infectividad.

Métodos de inoculación al follaje 1. pulverización: • 0, 5% Tween o 0, 1% jabón • cereales: 1º frotar hoja con dedos mojados para que se mojen mejor • 0, 5% gelatina o 0, 1 -0, 2% agar – adhiere esporas y mantiene humedad • aceite dispersa esporas, mantiene humedad. Oidios pierden infectividad.

Métodos de inoculación al follaje 2. espolvoreo con talco • royas: humedecer hojas 1º (aspersión) • oidios – seco 3. rozar o colocar hojas esporuladas sobre sanas (previamente rociadas) 4. inmersión en suspensión de

Métodos de inoculación al follaje 4. infiltración 5. colocar trozo de micelio

Métodos de inoculación al follaje

Inoculación de virus

Plantas indicadoras • Tabaco, pepino, Chenopodium quinoa, etc. – Sin síntomas – Lesiones locales – Síntomas sistémicos

Plantas indicadoras

Transmisión mecánica 1. Macerado de planta enferma 2. Abrasivo (carborundum) 3. Planta sana = Transmisión “por jugos”

Transmisión por pulgones

Transmisión por propagación vegetativa • tubérculos, bulbos, estacas, etc. • injerto l An overview of the paintings of Christina Brodie http: //www. microscopyuk. org. uk/mag/indexmag. html? http: //www. microscopyuk. org. uk/mag/artnov 05/cbpaint. html

Inoculación al suelo o raíces • efecto del suelo: microflora conducente o supresivo reducir variación sin suelo • humedad muy alta para Pitáceas, • + síntomas a > temp. hasta 28ºC en gral. • Métodos: – infestación de suelo – hidroponia – “cut and dip”

Inoculación al tallo o rama • Generalmente con heridas • Corte longitudinal – inocular inmediatamente – cubrir para evitar deshidratación. (gel, algodón mojado) • Patógenos vasculares

Inoculación al tallo o rama • Patógenos vasculares: – axila - pinchar a través de gota o con aguja o escarbadiente contaminado. – inyección al tallo – evita stress de transplante

Inoculación en órganos carnosos • Pinchazo • Sacabocado • Corte

Condiciones ambientales Antes de inocular: • Patógenos que penetran por estomas • Patógenos que penetran por heridas • Virus

Condiciones ambientales Post-inoculación: • Humedad para bacterias y hongos – factor más importante • Virus

BIBLIOGRAFÍA • DHINGRA, O. D. ; SINCLAIR, J. B. 1985. Basic plant pathology methods. • FRENCH, E. R. y HERBERT, T. 1980. Métodos de investigación fitopatológica. • KIRÁLY, Z. 1970. Methods in plants pathology with special reference to breeding for disease resistance. • LELLIOTT, R. A. ; STEAD, D. E. 1987. Methods for the diagnosis of bacterial diseases of plants. • THE COMMONWEALTH MYCOLOGICAL INSTITUTE. 1968. Plant pathologist's pocketbook.
 Nicotiana benthamiana
Nicotiana benthamiana Perosisomas
Perosisomas Vegetales españoles
Vegetales españoles Carbones vegetales crucigrama
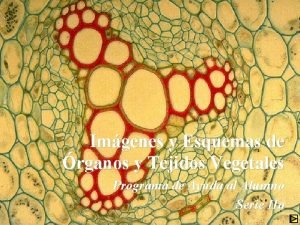
Carbones vegetales crucigrama Imagenes de tejidos animales y vegetales
Imagenes de tejidos animales y vegetales Colenquima
Colenquima Conductores vegetales
Conductores vegetales Colorantes vegetales
Colorantes vegetales Gomas vegetales ejemplos
Gomas vegetales ejemplos Analisis marginal
Analisis marginal Partes de la célula animal
Partes de la célula animal Celula vegetal microscopio
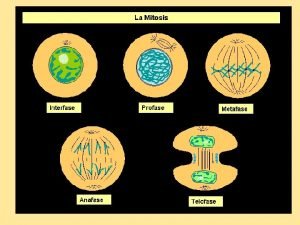
Celula vegetal microscopio Anafse
Anafse Reino metafitas
Reino metafitas Paisajes vegetales
Paisajes vegetales Enfermedades ligadas al sexo
Enfermedades ligadas al sexo Enfermedades transmitidas por alimentos
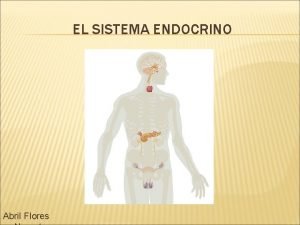
Enfermedades transmitidas por alimentos Enfermedades del sistema endocrino
Enfermedades del sistema endocrino Patron obstructivo biliar
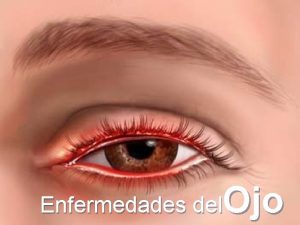
Patron obstructivo biliar Enfermedades del sentido de la vista
Enfermedades del sentido de la vista Materiales de fabricación del serrucho
Materiales de fabricación del serrucho Enfermedades restrictivas
Enfermedades restrictivas Tipos de enfermedades
Tipos de enfermedades Enfermedades del cacao
Enfermedades del cacao Enfermedades del chopo
Enfermedades del chopo Enfermedades del roble
Enfermedades del roble Tabla de enfermedades laborales del magisterio
Tabla de enfermedades laborales del magisterio Edgar lopategui corsino
Edgar lopategui corsino