Valitutti Falasca Amadio La chimica della Natura Zanichelli





































- Slides: 42

Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 1

Valitutti, Falasca, Amadio La chimica della Natura Seconda edizione

Capitolo 2 Le trasformazioni fisiche della materia 1. I sistemi materiali 2. I miscugli omogenei o soluzioni 3. Gli stati fisici e i passaggi di stato 4. Le tecniche di separazione dei miscugli Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 3

1. I sistemi materiali Un sistema è una porzione delimitata di materia. Un bicchiere di acqua è un esempio di sistema. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 4

1. I sistemi materiali La materia può esistere in tre stati fisici, detti stati di aggregazione della materia: • stato solido; • stato liquido; • stato aeriforme. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 5

1. I sistemi materiali Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 6

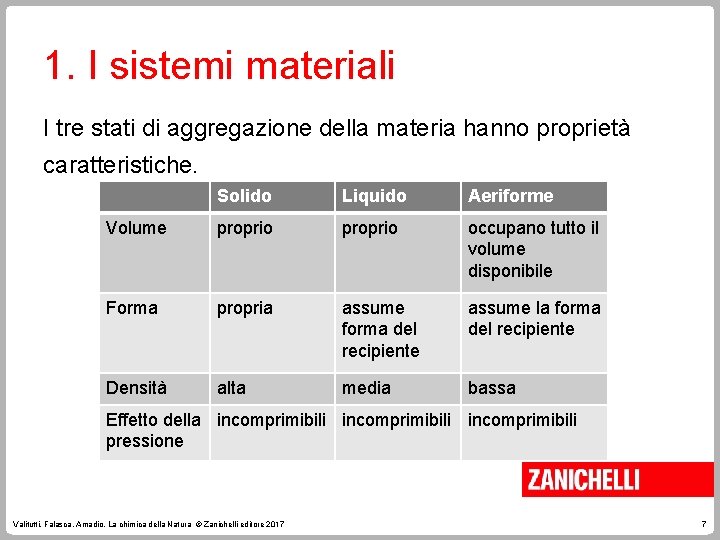
1. I sistemi materiali I tre stati di aggregazione della materia hanno proprietà caratteristiche. Solido Liquido Aeriforme Volume proprio occupano tutto il volume disponibile Forma propria assume forma del recipiente assume la forma del recipiente Densità alta media bassa Effetto della incomprimibili pressione Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 7

1. I sistemi materiali Si dice fase una porzione di materia fisicamente distinguibile e delimitata che ha proprietà intensive uniformi. Un sistema costituito da una sola fase è detto omogeneo. Un sistema costituito da due o più fasi è detto eterogeneo. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 8

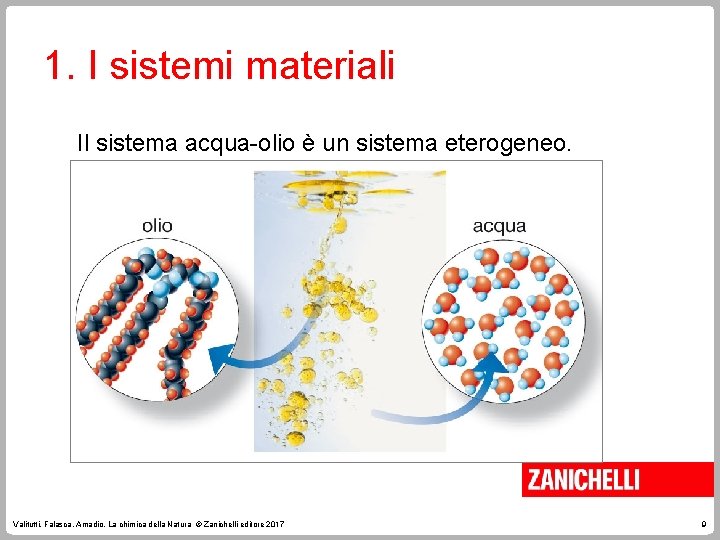
1. I sistemi materiali Il sistema acqua-olio è un sistema eterogeneo. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 9

1. I sistemi materiali La materia può essere suddivisa in sostanze pure e miscugli. Un sistema è puro solo se è formato da una singola sostanza. Le sostanze pure hanno caratteristiche e composizione costanti. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 10

1. I sistemi materiali Un sistema formato da due o più sostanze è un miscuglio. Anche i miscugli possono essere omogenei o eterogenei. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 11

1. I sistemi materiali Un miscuglio omogeneo di due o più sostanze è chiamato soluzione. Il componente più abbondante del miscuglio è il solvente, mentre i componenti meno abbondanti si chiamano soluti. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 12

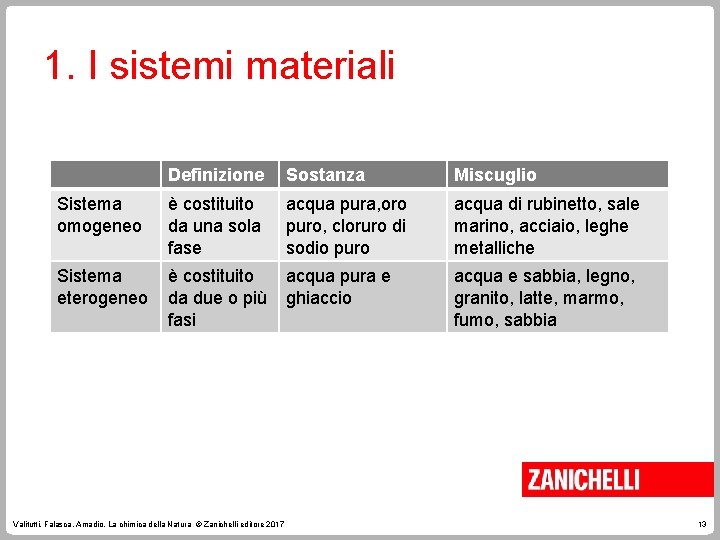
1. I sistemi materiali Definizione Sostanza Miscuglio Sistema omogeneo è costituito da una sola fase acqua pura, oro puro, cloruro di sodio puro acqua di rubinetto, sale marino, acciaio, leghe metalliche Sistema eterogeneo è costituito da due o più fasi acqua pura e ghiaccio acqua e sabbia, legno, granito, latte, marmo, fumo, sabbia Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 13

1. I sistemi materiali Un miscuglio eterogeneo è costituito da componenti chimicamente definiti e da fasi fisicamente distinguibili. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 14

1. I sistemi materiali I miscugli eterogenei possono presentare aspetti anche molto diversi al variare dello stato di aggregazione delle fasi che li costituiscono. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 15

1. I sistemi materiali La schiuma è un tipico esempio di miscuglio costituito dalla dispersione di gas in un liquido. La nebbia è un miscuglio acqua-aria. Il fumo è un miscuglio eterogeneo di un solido in un gas. L’emulsione è un miscuglio tra due o più liquidi immiscibili. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 16

1. I sistemi materiali I colloidi costituiscono una classe di materiali che ha caratteristiche intermedie tra quelle dei miscugli omogenei e quelle dei miscugli eterogenei. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 17

1. I sistemi materiali I colloidi sono: • sol, se la fase disperdente, liquida o gassosa, prevale su quella solida; • gel, se prevale la fase solida sulla fase disperdente. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 18

2. I miscugli omogenei o soluzioni Una soluzione è satura quando ha un corpo di fondo che non si può ulteriormente sciogliere. La solubilità è la quantità massima di soluto che si può sciogliere in una determinata quantità di solvente a una certa temperatura. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 19

2. I miscugli omogenei o soluzioni Le soluzioni con molto solvente rispetto al soluto sono diluite. Le soluzioni con poco solvente rispetto al soluto sono concentrate. La concentrazione di una soluzione è il rapporto tra la quantità di soluto e la quantità di soluzione o di solvente in cui il soluto è disciolto. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 20

2. I miscugli omogenei o soluzioni La concentrazione si esprime in diversi modi: • concentrazione percentuale in massa (% m/m) • concentrazione percentuale massa su volume (% m/V) • concentrazione percentuale in volume (% V/V) Se si conosce la densità di una soluzione si può usare per la conversione % m/V = % m/m × d Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 21

3. Gli stati fisici e i passaggi di stato I passaggi di stato sono trasformazioni fisiche avvengono per variazioni di temperatura o pressione. I passaggi di stato portano a cambiamenti di densità. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 22

3. Gli stati fisici e i passaggi di stato Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 23

3. Gli stati fisici e i passaggi di stato La fusione è il passaggio dallo stato solido allo stato liquido. L’evaporazione è il passaggio dallo stato liquido allo stato di vapore. La sublimazione è il passaggio diretto dallo stato solido allo stato di vapore. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 24

3. Gli stati fisici e i passaggi di stato La condensazione è il passaggio dallo stato di vapore allo stato liquido. La solidificazione è il passaggio dallo stato liquido allo stato solido. Il brinamento è il passaggio diretto dallo stato di vapore allo stato solido. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 25

3. Gli stati fisici e i passaggi di stato A parità di massa, nel passaggio di un materiale dallo stato liquido allo stato aeriforme, il volume aumenta e la densità diminuisce. Nel passaggio allo stato solido la densità, di solito, aumenta. Il ghiaccio è un’eccezione perché è meno denso dell’acqua. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 26

3. Gli stati fisici e i passaggi di stato Le curve di riscaldamento e raffreddamento si possono usare per distinguere le sostanze pure dai miscugli. Ogni sostanza pura ha una curva di riscaldamento e temperature di fusione e di ebollizione caratteristiche in funzione della pressione a cui avviene il passaggio di stato. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 27

3. Gli stati fisici e i passaggi di stato Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 28

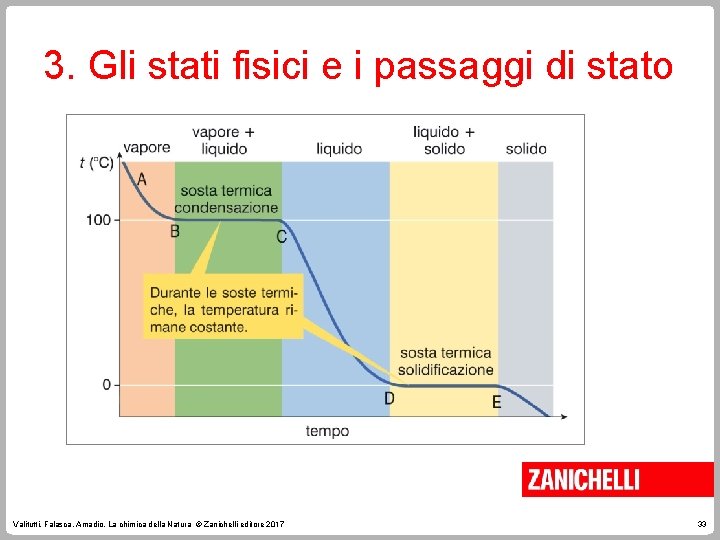
3. Gli stati fisici e i passaggi di stato La curva di riscaldamento si ottiene fornendo calore nel tempo e misurando la temperatura. La curva di riscaldamento ha due soste termiche. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 29

3. Gli stati fisici e i passaggi di stato La temperatura alla quale coesistono acqua e ghiaccio è denominata temperatura di fusione. È una proprietà intensiva dell’acqua distillata e delle sostanze pure. Terminata la fusione si ha la sosta termica. Se il vapore esercita una pressione uguale alla pressione atmosferica si ha la tensione di vapore. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 30

3. Gli stati fisici e i passaggi di stato La temperatura alla quale la tensione di vapore eguaglia la pressione esterna è detta temperatura di ebollizione. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 31

3. Gli stati fisici e i passaggi di stato La curva di raffreddamento si ottiene raffreddando il sistema nel tempo. La curva di raffreddamento ha due soste termiche. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 32

3. Gli stati fisici e i passaggi di stato Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 33

3. Gli stati fisici e i passaggi di stato Ogni sostanza pura ha una curva di raffreddamento attraverso la quale si distinguono: • temperatura di condensazione • temperatura di solidificazione Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 34

3. Gli stati fisici e i passaggi di stato Se i due passaggi di stato (condensazione ed ebollizione) avvengono alle stesse condizioni di pressione, la temperatura di condensazione è uguale alla temperatura di ebollizione. Se i due passaggi di stato (solidificazione e fusione) avvengono alle stesse condizioni di pressione, la temperatura di solidificazione è uguale alla temperatura di fusione. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 35

3. Gli stati fisici e i passaggi di stato I passaggi di stato delle soluzioni e dei miscugli, in generale, non avvengono a temperature costanti. In un miscuglio, la curva di riscaldamento e quella di raffreddamento non hanno soste termiche ben definite. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 36

4. Le tecniche di separazione dei miscugli La filtrazione è il metodo per separare, per mezzo di filtri, i materiali solidi da un miscuglio liquido o gassoso. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 37

4. Le tecniche di separazione dei miscugli La centrifugazione è il metodo per separare miscugli eterogenei di liquidi e/o solidi aventi densità diversa. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 38

4. Le tecniche di separazione dei miscugli L’estrazione è il metodo per separare i componenti di un miscuglio per mezzo di un solvente. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 39

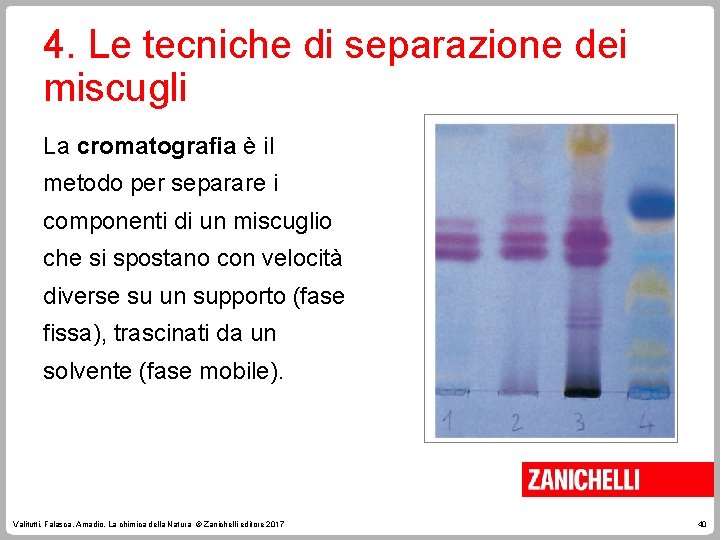
4. Le tecniche di separazione dei miscugli La cromatografia è il metodo per separare i componenti di un miscuglio che si spostano con velocità diverse su un supporto (fase fissa), trascinati da un solvente (fase mobile). Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 40

4. Le tecniche di separazione dei miscugli La distillazione si basa sulla diversa volatilità dei componenti di miscele liquide. Minore è la temperatura di evaporazione, maggiore è la volatilità. Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 41

4. Le tecniche di separazione dei miscugli La distillazione • semplice permette di separare un liquido da soluti non volatili • frazionata permette di separare liquidi a punto di ebollizione molto vicino tra loro Valitutti, Falasca, Amadio, La chimica della Natura © Zanichelli editore 2017 42
 La doppia natura della luce zanichelli
La doppia natura della luce zanichelli Principio di le chatelier
Principio di le chatelier Soluzioni il racconto delle scienze naturali
Soluzioni il racconto delle scienze naturali Soluzioni il racconto della chimica e della terra
Soluzioni il racconto della chimica e della terra Soluzioni il racconto della chimica e della terra
Soluzioni il racconto della chimica e della terra Soluzioni il racconto della chimica e della terra
Soluzioni il racconto della chimica e della terra Soluzioni il racconto delle scienze naturali
Soluzioni il racconto delle scienze naturali Moti millenari zanichelli
Moti millenari zanichelli Il racconto della chimica soluzioni
Il racconto della chimica soluzioni Il racconto della chimica e della terra
Il racconto della chimica e della terra Paolo falasca
Paolo falasca Marco falasca
Marco falasca Prove sulla sfericità della terra
Prove sulla sfericità della terra Giuseppe valitutti
Giuseppe valitutti Patrizia amadio
Patrizia amadio Patrizia amadio
Patrizia amadio Dr peter amadio
Dr peter amadio Cinque regni
Cinque regni Natura particellare della luce
Natura particellare della luce Viviamo porfirio mio
Viviamo porfirio mio Pila daniell zanichelli
Pila daniell zanichelli Cinetica ordine zero
Cinetica ordine zero Chimica piu capitolo 8 soluzioni
Chimica piu capitolo 8 soluzioni Carico glicemico
Carico glicemico Capitolo 18 la velocità di reazione
Capitolo 18 la velocità di reazione Scopriamo la biologia zanichelli
Scopriamo la biologia zanichelli Valitutti soluzioni capitolo 11
Valitutti soluzioni capitolo 11 Vito posca
Vito posca Verifica sistema endocrino zanichelli
Verifica sistema endocrino zanichelli Valitutti esploriamo soluzioni
Valitutti esploriamo soluzioni Soluzioni chimica piu capitolo 14
Soluzioni chimica piu capitolo 14 Le reazioni chimiche zanichelli capitolo 14
Le reazioni chimiche zanichelli capitolo 14 La nuova chimica di rippa soluzioni
La nuova chimica di rippa soluzioni Capitolo 8 soluzioni
Capitolo 8 soluzioni Capitolo 10 chimica zanichelli
Capitolo 10 chimica zanichelli Soluzioni capitolo 16 zanichelli chimica più
Soluzioni capitolo 16 zanichelli chimica più Barriere postzigotiche
Barriere postzigotiche Zanichelli soluzioni chimica capitolo 16
Zanichelli soluzioni chimica capitolo 16 Capitolo 13 chimica zanichelli
Capitolo 13 chimica zanichelli Soluzioni capitolo 6 zanichelli chimica più
Soluzioni capitolo 6 zanichelli chimica più Soluzione chimica più
Soluzione chimica più L'equilibrio chimico zanichelli capitolo 19
L'equilibrio chimico zanichelli capitolo 19 Soluzioni chimica zanichelli capitolo 6
Soluzioni chimica zanichelli capitolo 6






























































