TRANSFERENCIA DE MATERIAL GENTICO II AISLAMIENTO DE PLSMIDOS



















- Slides: 39

TRANSFERENCIA DE MATERIAL GENÉTICO II: AISLAMIENTO DE PLÁSMIDOS LISIS ALCALINA ENSAYOS DE RESTRICCIÓN

ESQUEMA GENERAL SESIÓN I: TRANSFORMAR cepas de E. coli con un plásmido para que adquieran resistencia a un antibiótico SESIÓN 2: AISLAR el plásmido mediante la técnica de Lisis alcalina SESIÓN 3: FUNCIÓN DE LAS ENZIMAS DE RESTRICCIÓN Cortar el plásmido aislado con enzimas de restricción y visualizarlo en un gel de agarosa teñido con bromuro de etidio

En la práctica: Aislamiento de plásmido mediante Kit de Purificación Mini Prep Objetivos: • Conocer los fundamentos para la purificación del DNA plasmídico y su separación del DNA genómico. • Realizar el aislamiento del DNA plasmídico.

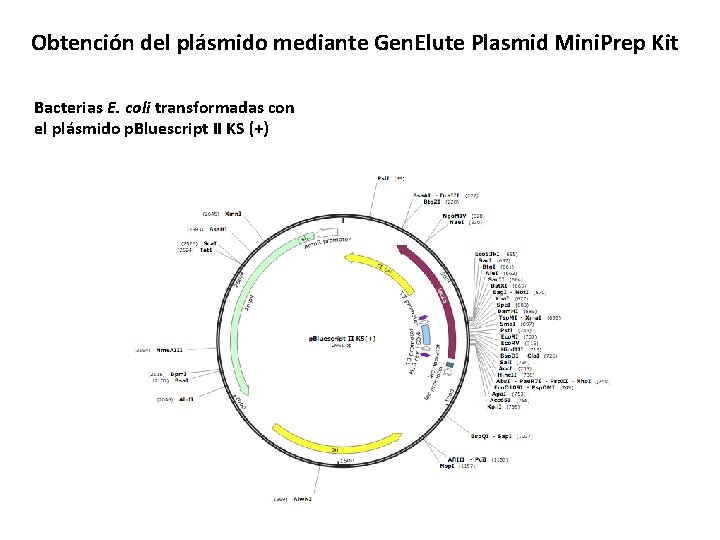
Obtención del plásmido mediante Gen. Elute Plasmid Mini. Prep Kit Bacterias E. coli transformadas con el plásmido p. Bluescript II KS (+)

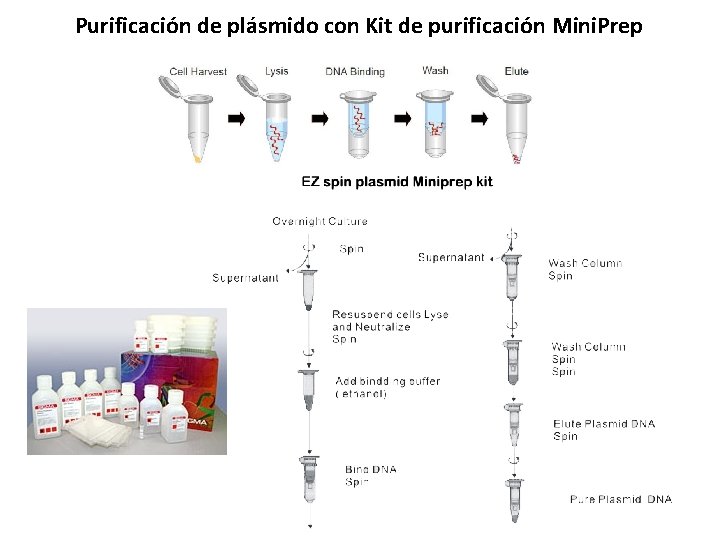
Protocolo Gen. Elute Plasmid Mini. Prep Kit

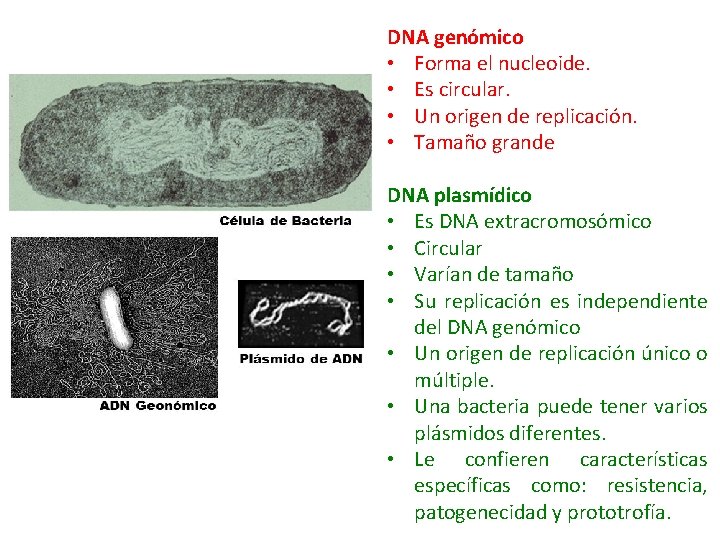
DNA genómico • Forma el nucleoide. • Es circular. • Un origen de replicación. • Tamaño grande DNA plasmídico • Es DNA extracromosómico • Circular • Varían de tamaño • Su replicación es independiente del DNA genómico • Un origen de replicación único o múltiple. • Una bacteria puede tener varios plásmidos diferentes. • Le confieren características específicas como: resistencia, patogenecidad y prototrofía.

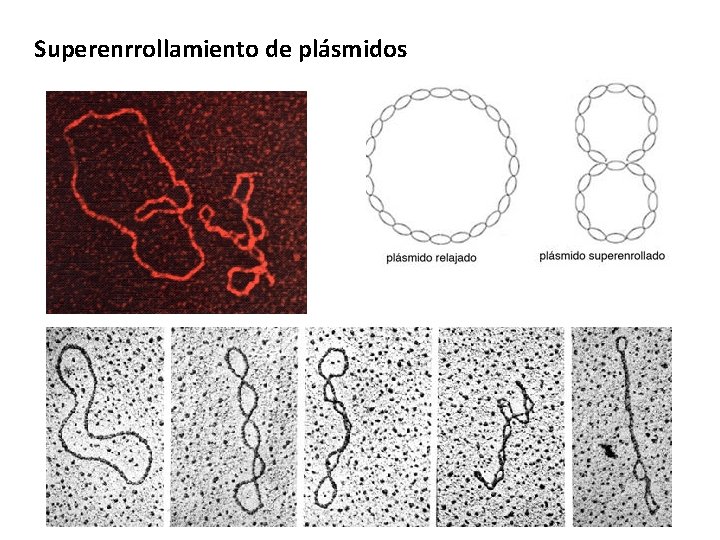
Superenrrollamiento de plásmidos

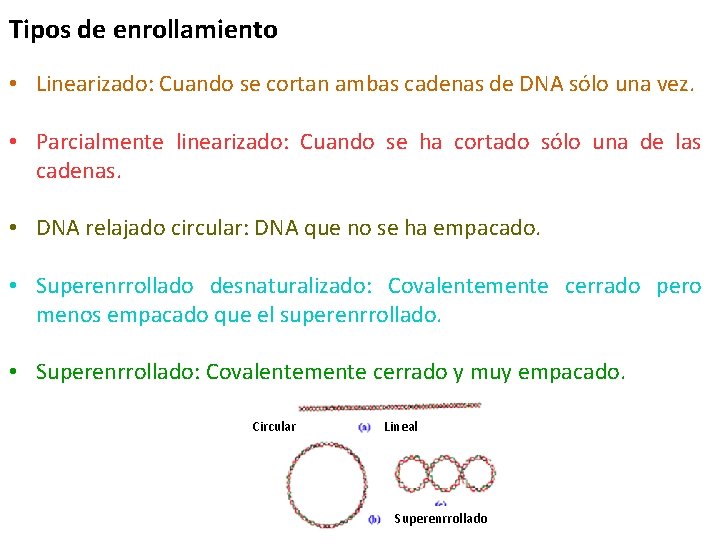
Tipos de enrollamiento • Linearizado: Cuando se cortan ambas cadenas de DNA sólo una vez. • Parcialmente linearizado: Cuando se ha cortado sólo una de las cadenas. • DNA relajado circular: DNA que no se ha empacado. • Superenrrollado desnaturalizado: Covalentemente cerrado pero menos empacado que el superenrrollado. • Superenrrollado: Covalentemente cerrado y muy empacado. Circular Lineal Superenrrollado

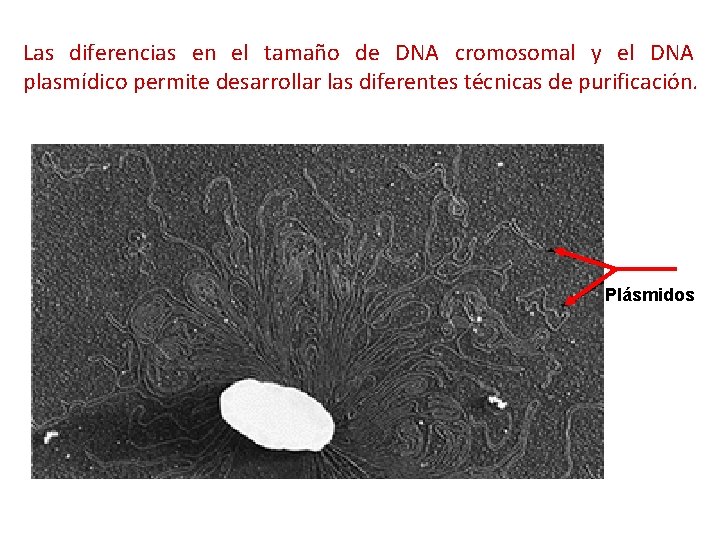
Las diferencias en el tamaño de DNA cromosomal y el DNA plasmídico permite desarrollar las diferentes técnicas de purificación. Plásmidos

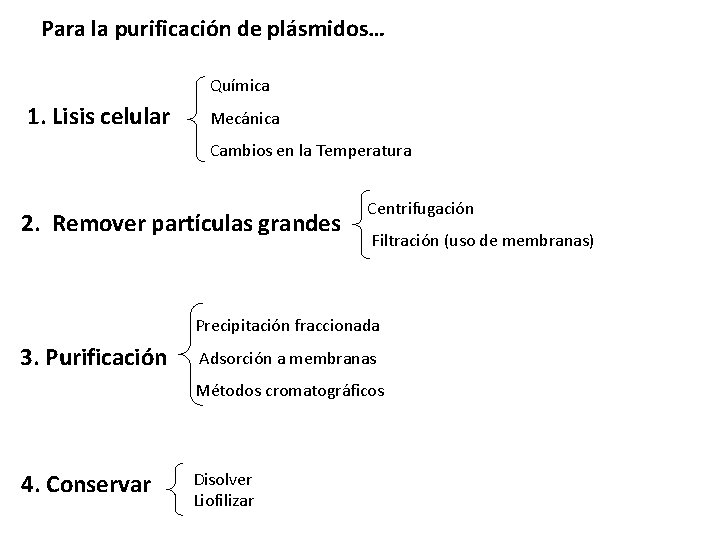
Para la purificación de plásmidos… Química 1. Lisis celular Mecánica Cambios en la Temperatura 2. Remover partículas grandes Centrifugación Filtración (uso de membranas) Precipitación fraccionada 3. Purificación Adsorción a membranas Métodos cromatográficos 4. Conservar Disolver Liofilizar

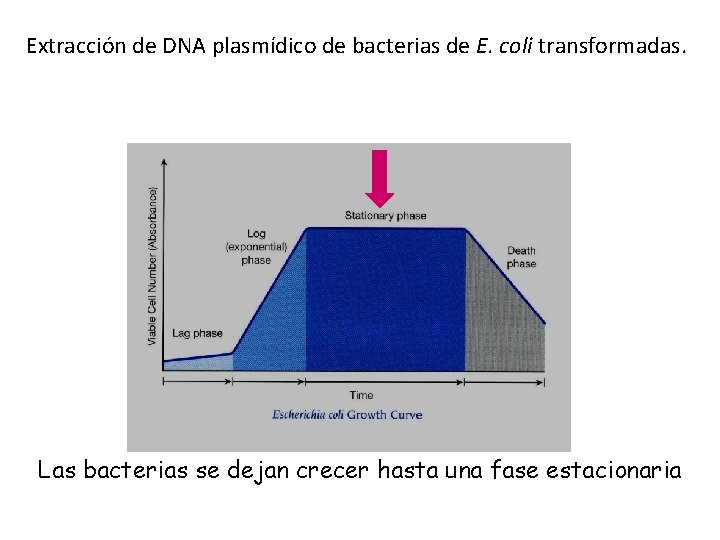
Extracción de DNA plasmídico de bacterias de E. coli transformadas. Las bacterias se dejan crecer hasta una fase estacionaria

Existen varios métodos de purificación de plásmidos, pero todos se rigen por lo siguientes pasos: 1. Remover las células del caldo de cultivo (mediante centrifugación). 2. Descartar el sobrenadante para reducir la contaminación por fragmentos de la pared celular. 3. Resuspender las células en un amortiguador que contenga Tris, EDTA y glucosa. 4. Lisar las células con Na. OH y SDS. 5. Unión de las hebras de DNA y remoción de contaminantes mediante acetato de potasio. 6. Precipitación del DNA plasmídico mediante un alcohol, puede ser etanol o isopropanol (se puede mezclar con una sal como acetato de amonio, cloruro de litio, cloruro de sodio, etc. , para mejorar la precipitación). 7. Lavar el material genético purificado con Et. OH al 70%. 8. Resuspender el material genético.

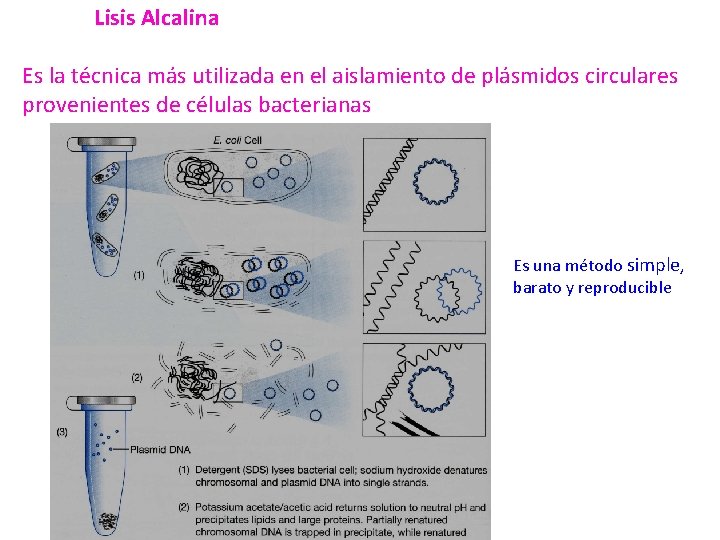
Las técnicas de extracción de plásmido se basan en: Es una técnica que explota las diferencia en las propiedades de desnaturalización y renaturalización del DNA plasmídico (círculos cerrados covalentemente) y el DNA cromosómico (fragmentado). La alcalinización con Na. OH en presencia de un detergente aniónico fuerte (SDS), que provoca la lisis celular, desnaturalización del DNA cromosómico y de las proteínas y la liberación del DNA plasmídico. Los plásmidos se ven poco afectados por su estructura circular y superenrrollada. La presencia de alta sal (acetato de potasio), permite la neutralización del medio y la precipitación de las proteínas y del DNA cromosómico. El DNA cromosómico y los agregados de proteínas insolubles se separan de el DNA plasmídico por centrifugación. El DNA plasmídico queda en el sobrenadante, conservando mayoritariamente su estructura nativa.

Métodos de extracción de plásmido: Mini. Prep • A la técnica de aislamiento de plásmido se le conoce como Mini. Preps o mini preparaciones de plásmidos. • Es el mayormente utilizado para obtención de plásmido circular. • El material genético debe de provenir de células bacterianas. • Con este protocolo se obtiene DNA plasmídico a partir de cultivos bacterianos a pequeña escala (1. 4 m. L). • La pequeña escala permite el análisis de colonias recombinantes. Para obtener el plásmido se debe tomar en cuenta lo siguiente: u u u El cultivo bacteriano debe provenir de una sola colonia. Se debe cultivar en 5 m. L de medio de cultivo líquido, el cuál contenga antibiótico. El cultivo debe ser incubado toda la noche con agitación constante (150 RPM) a 37ºC

Purificación de plásmido con Kit de purificación Mini. Prep

Lisis Alcalina Es la técnica más utilizada en el aislamiento de plásmidos circulares provenientes de células bacterianas Es una método simple, barato y reproducible

Lisis Alcalina 1. - Agregar cultivo de bacterias. 2. - Resuspender el pellet en solución GTE: (50 m. M Glucosa, 25 m. M Tris-HCl p. H 8. 0 y EDTA 10 m. M): La glucosa funciona como osmolito. EDTA debilita la membrana, uniéndose a cationes divalentes como Ca 2* y Mg 2*. 3. - Adicionar solución de lisis (Na. OH 0. 2 N y SDS 1%): Ayuda a disolver los fosfolípidos de las membranas y los componentes proteicos. El Na. OH desnaturaliza el DNA cromosomal y plasmídico. 4. - Adicionar solución de Acetato de potasio 3 M preenfriado: PRECIPITA EL SDS JUNTO CON PROTEÍNAS Y LÍPIDOS El DNA cromosomal neutralizado, se precipita junto con el SDS, las proteínas y los lípidos. El DNA plasmídico y el RNA no se precipitan, por lo que SE MANTIENEN EN EL SOBRENADANTE. 5. - adicionar Isopropanol: El isopropanol nos permite precipitar en DNA plasmídico. 6. - Adicionar etanol 70%: ESTE PASO INTERMEDIO NOS PERMITE ELIMINAR LAS SALES SDS Y EL ISOPROPANOL (LA MEZCLA ISOPROPANOL-ETANOL SE EVAPORA CON MAYOR RAPIDEZ) 7. - Secar la muestra de DNA

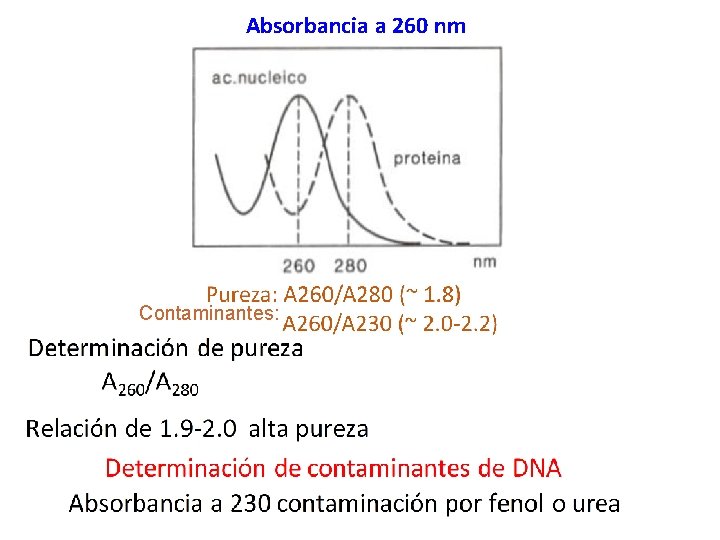
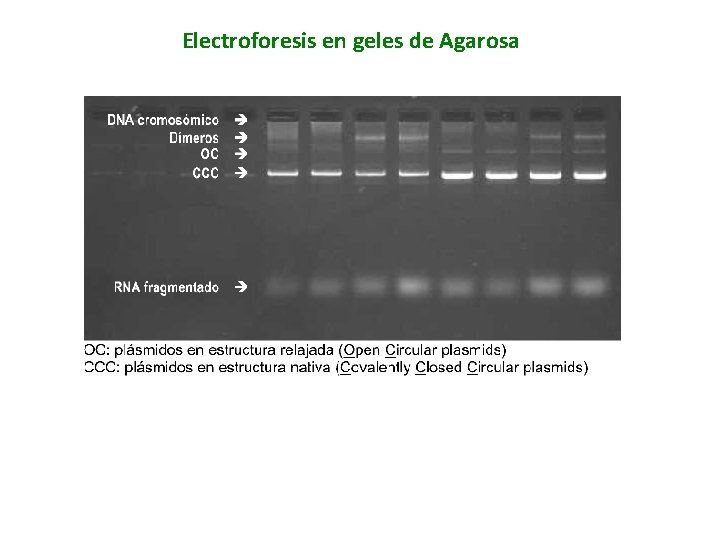
Verificación de la purificación Para monitorear el progreso de la purificación del plásmido, y verificar la correcta purificación, se llevan a cabo dos técnicas principalmente: 1. - Absorbancia a 260 nm 2. - Electroforesis en geles de Agarosa

Absorbancia a 260 nm Contaminantes:

Electroforesis en geles de Agarosa

ESQUEMA GENERAL SESIÓN I: TRANSFORMAR cepas de E. coli con un plásmido para que adquieran resistencia a un antibiótico SESIÓN 2: AISLAR el plásmido mediante la técnica de Lisis alcalina SESIÓN 3: FUNCIóN DE LAS ENZIMAS DE RESTRICCIÓN Cortar el plásmido aislado con enzimas de restricción y visualizarlo en un gel de agarosa teñido con bromuro de etidio

En la práctica: Ensayos de restricción de plásmido Objetivos: • Conocer el principio de separación y detección de ácidos nucleicos en geles de agarosa. • Emplear electroforesis en geles de agarosa para visualizar ácidos nucleicos. • Determinar el tamaño de fragmentos de ácidos nucleicos separados en geles de agarosa. • Conocer la utilidad de las enzimas de restricción en la transformación genética y la biotecnología.

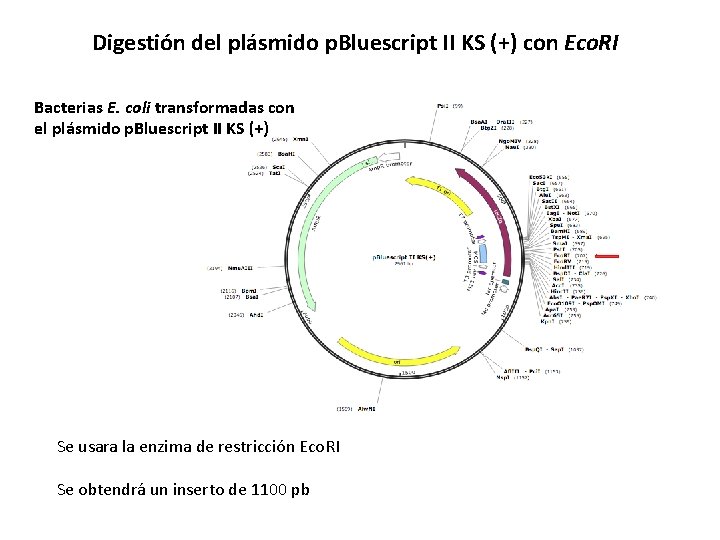
Digestión del plásmido p. Bluescript II KS (+) con Eco. RI Bacterias E. coli transformadas con el plásmido p. Bluescript II KS (+) Se usara la enzima de restricción Eco. RI Se obtendrá un inserto de 1100 pb

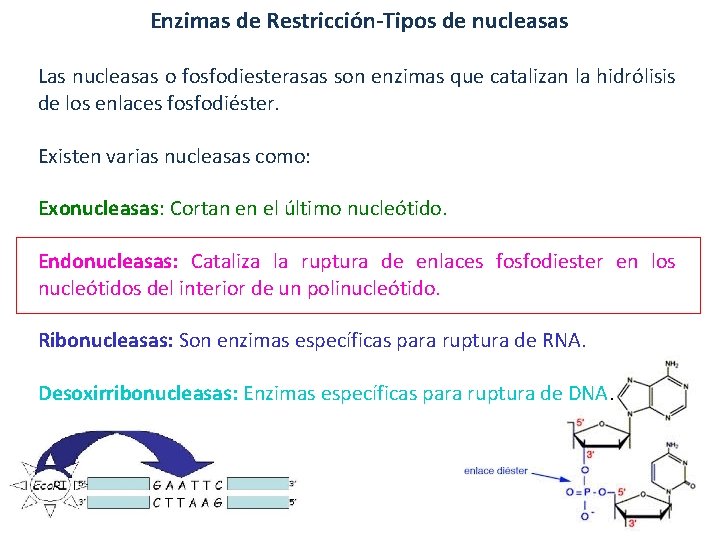
Enzimas de Restricción-Tipos de nucleasas Las nucleasas o fosfodiesterasas son enzimas que catalizan la hidrólisis de los enlaces fosfodiéster. Existen varias nucleasas como: Exonucleasas: Cortan en el último nucleótido. Endonucleasas: Cataliza la ruptura de enlaces fosfodiester en los nucleótidos del interior de un polinucleótido. Ribonucleasas: Son enzimas específicas para ruptura de RNA. Desoxirribonucleasas: Enzimas específicas para ruptura de DNA.

Funciones Biológicas de las Enzimas de Restricción en BACTERIAS En bacterias, las enzimas de restricción tienen la función de endonucleasas. Utilizan estas enzimas para cortar DNA viral en fragmentos pequeños, convirtiéndolos en no funcionales, evitando la invasión del bacteriófago (como mecanismos de defensa). Para evitar cortar el propio DNA de la bacteria, se llevan a cabo modificaciones en su DNA, como metilaciones. Se les denomina enzimas de restricción, porque restringen la invasión del bacteriófago.

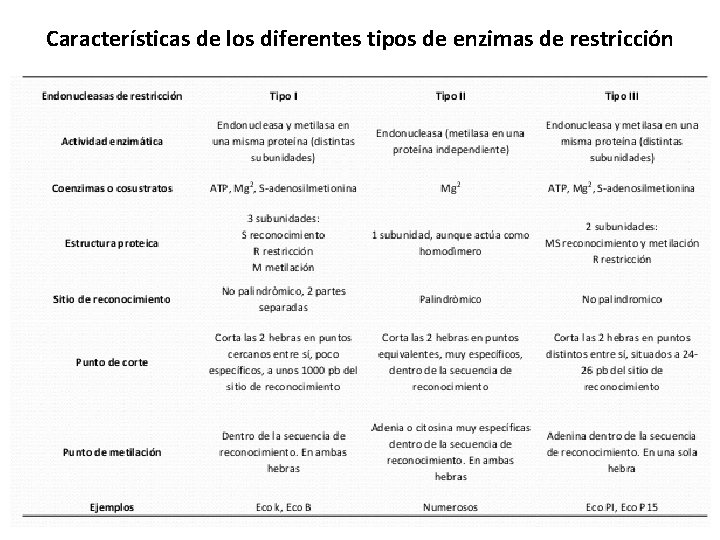
Características de los diferentes tipos de enzimas de restricción

Tipos de enzimas de restricción con funciones biológicas Existen varios tipos de enzimas de restricción. Los tipos I y III : Tienen capacidad de restricción y de metilación. Reconocen regiones grandes y asimétricas. Cortan en un sitio diferente al de reconocimiento: Tipo I: Cortan a una distancia grande de la secuencia de reconocimiento, en sitios al azar, ya sea río arriba o río abajo. La enzima que reconoce el sitio de restricción posee 3 subunidades. Tipo III: Cortan en 5 a 8 pares después del sitio de reconocimiento.

Enzimas de restricción tipo II: Este tipo de enzimas de restricción que únicamente cortan, no metilan. Son endonucleasas (no todas son enzimas de restricción). La restricción ocurre en el sitio de reconocimiento. Cortan enlaces fosfodiéster en sitios de secuencias específicas de 4 a 8 nucleótidos que reconocen y que se denominan sitios de restricción o secuencias de reconocimiento. Reconocen secuencias en el DNA palindrómicas (que se leen igual de ambas direcciones) Amad a la dama Adán no calla con nada Amor a Roma Ana lava lana Son usadas en Biología molecular, porque permiten romper en sitios específicos.

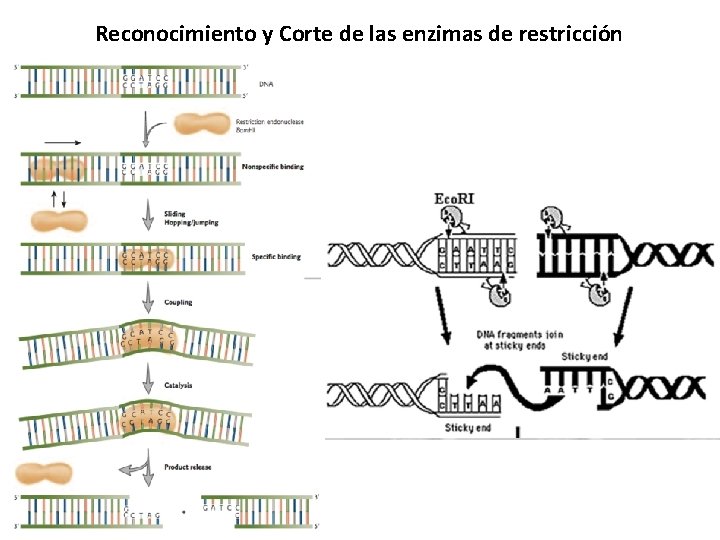
Reconocimiento y Corte de las enzimas de restricción

Los cortes de las enzimas de restricción se dividen en dos tipos de acuerdo a su sitio de corte en la doble cadena de DNA: • Extremos cohesivos • Extremos romos

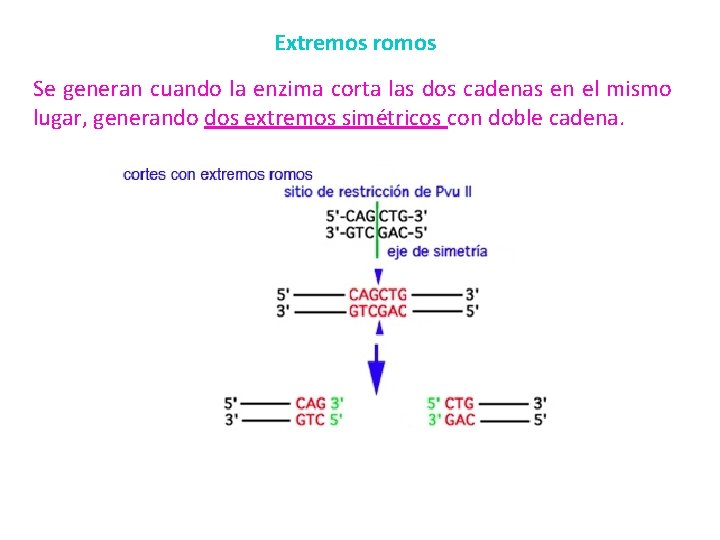
Extremos romos Se generan cuando la enzima corta las dos cadenas en el mismo lugar, generando dos extremos simétricos con doble cadena.

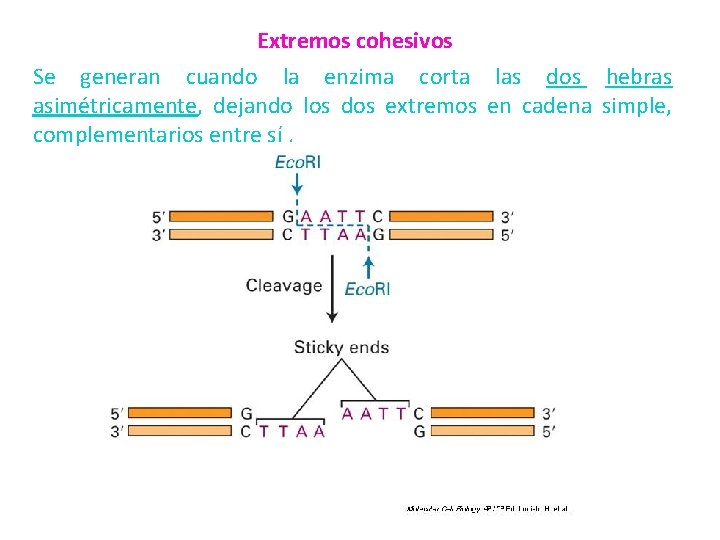
Extremos cohesivos Se generan cuando la enzima corta las dos hebras asimétricamente, dejando los dos extremos en cadena simple, complementarios entre sí.

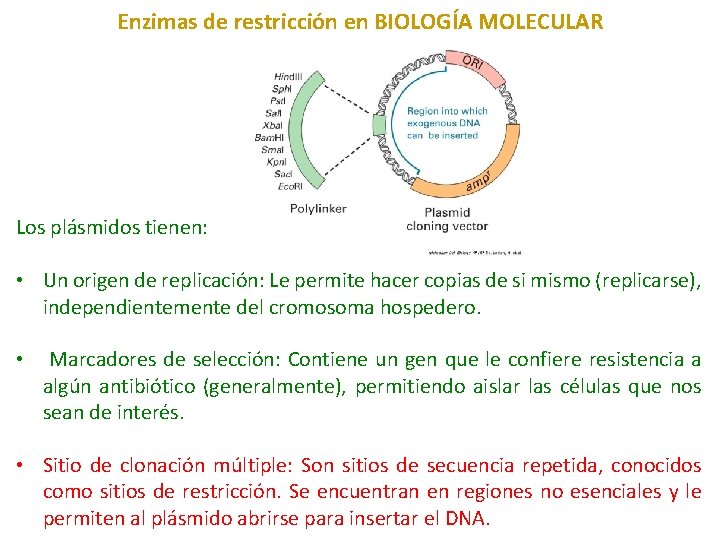
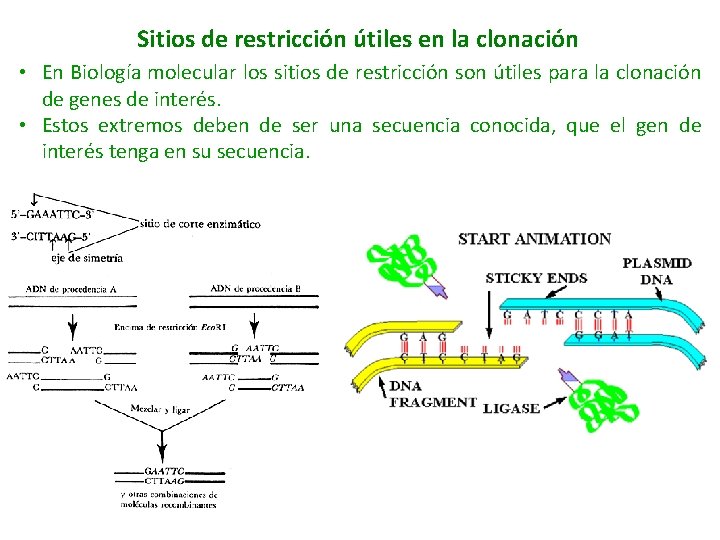
Enzimas de restricción en BIOLOGÍA MOLECULAR Los plásmidos tienen: • Un origen de replicación: Le permite hacer copias de si mismo (replicarse), independientemente del cromosoma hospedero. • Marcadores de selección: Contiene un gen que le confiere resistencia a algún antibiótico (generalmente), permitiendo aislar las células que nos sean de interés. • Sitio de clonación múltiple: Son sitios de secuencia repetida, conocidos como sitios de restricción. Se encuentran en regiones no esenciales y le permiten al plásmido abrirse para insertar el DNA.

Sitios de restricción útiles en la clonación • En Biología molecular los sitios de restricción son útiles para la clonación de genes de interés. • Estos extremos deben de ser una secuencia conocida, que el gen de interés tenga en su secuencia.

Algunas de las Enzimas de restricción usadas en Biología Molecular

Nomenclatura de las enzimas de restricción Las enzimas de restricción se nombran de acuerdo al organismo del cuál provienen y sus características. Nombre: Eco RI E co R I Escherichia coli RY 13 Corresponde a la primera enzima identificada Género Especie Cepa bacteriana Número de identificación

NOTA: Una unidad de enzima es la cantidad de enzima que corta 1μg de DNA en una hora

Como nota cultural… Existe una gran cantidad de endonucleasas de restriccio n que reconocen y digieren el ADN en secuencias concretas de tetra, penta, hexa o hepta nucleo tidos, llamadas “secuencias palindro micas” Frecuencias de reconocimiento de las enzimas de restricción: Las enzimas que cortan 4 pares de bases (pb) cortan con más frecuencia que las que cortan 6 pb y que las que cortan 8 pb. La probabilidad de que una secuencia de 4 pb ocurra en el genoma es cada 256 pb (44=256). La probabilidad de que una secuencia de 6 pb ocurra en el genoma es cada 4096 pb (46=4096). La probabilidad de que una secuencia de 8 pb ocurra en el genoma es cada 65000 pb (48≈65000).

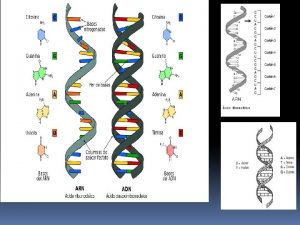
 Codigo gentico
Codigo gentico Plasmidios
Plasmidios Extremos romos y cohesivos
Extremos romos y cohesivos Plsmidos
Plsmidos Imagenes de aislamiento geografico
Imagenes de aislamiento geografico Aislamiento aereo hospitalario
Aislamiento aereo hospitalario Herramientas y equipos que infrinjan los requisitos de osha
Herramientas y equipos que infrinjan los requisitos de osha Curso aislamiento hospitalario
Curso aislamiento hospitalario Flujo de genes
Flujo de genes Grapa 212
Grapa 212 Transformador de aislamiento
Transformador de aislamiento Aislamiento respiratorio
Aislamiento respiratorio Aislamiento etológico ejemplos
Aislamiento etológico ejemplos Galapdos
Galapdos Geometric tolerance symbols
Geometric tolerance symbols Rsq in standard costing
Rsq in standard costing Useful and harmful material at home
Useful and harmful material at home What is cultural divergence
What is cultural divergence The knowledge language values customs and material objects
The knowledge language values customs and material objects Example of material culture
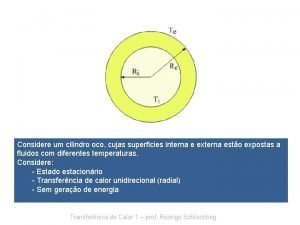
Example of material culture Transferência de calor
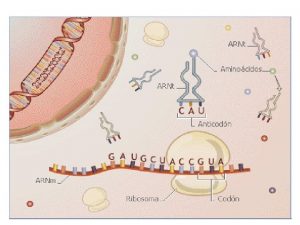
Transferência de calor Traducción de la información genética
Traducción de la información genética Transferência de calor
Transferência de calor Transferencia de calor concepto
Transferencia de calor concepto Radiaçao termica
Radiaçao termica Metodo koseling
Metodo koseling Objetivos de transferencia de calor
Objetivos de transferencia de calor Graficar funciones de transferencia en matlab
Graficar funciones de transferencia en matlab Se puede quedar embarazada con inyección mensual
Se puede quedar embarazada con inyección mensual Paredes compuestas
Paredes compuestas Transferencia de calor
Transferencia de calor ¿qué se define como transferencia documental?
¿qué se define como transferencia documental? Sistemas de control
Sistemas de control Ciclo de refrigeração
Ciclo de refrigeração Transferencia tecnologica
Transferencia tecnologica Tabela de bessel
Tabela de bessel Transferencia de cationes
Transferencia de cationes Transferencia de registros
Transferencia de registros Mecanismo de transferencia
Mecanismo de transferencia Condução de calor
Condução de calor