TEORI KINETIK GAS Dr Kuwat Triyana Jurusan Fisika







![Persamaan Keadaan Gas Ideal P = Tekanan gas [N. m-2] V = Volume gas Persamaan Keadaan Gas Ideal P = Tekanan gas [N. m-2] V = Volume gas](https://slidetodoc.com/presentation_image/3315f24f1c058b1b2aa4f79f05936daf/image-9.jpg)















- Slides: 39

TEORI KINETIK GAS Dr. Kuwat Triyana Jurusan Fisika FMIPA UGM Email: triyana@ugm. ac. id http: //triyana. staff. ugm. ac. id

Aplikasi teori kinetik (molekul) gas Pembuatan bandeng/ayam presto (tulang lunak) Mesin uap (kereta uap/PLTU) Terbentuknya angin dan perubahan cuaca Memanaskan makanan/minuman dengan microwave oven Mengapa pesawat terbang termasuk helikopter dapat terbang? Bagaimana mengukur ketinggiannya?

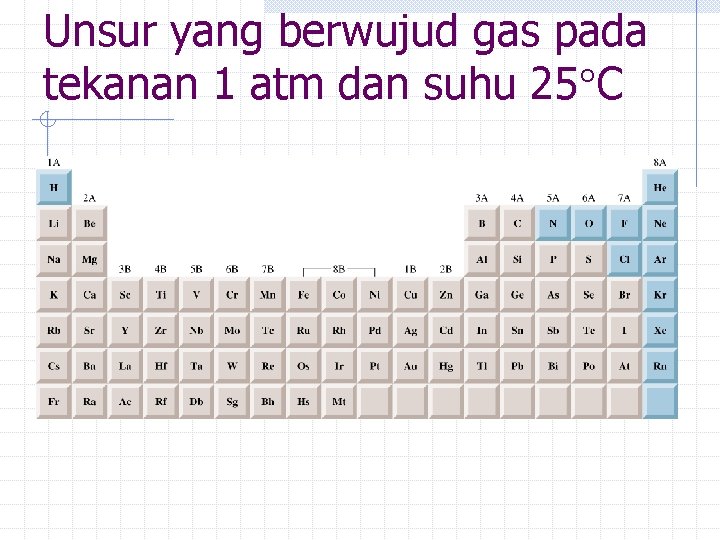
Unsur yang berwujud gas pada tekanan 1 atm dan suhu 25 C

Kompoisis udara yang kita hirup Komposisi atmosfer bumi Senyawa Nitrogen Oxygen Argon Carbon dioxide Methane Hydrogen %(Volume) 78. 08 20. 95 0. 934 0. 033 2 x 10 -4 5 x 10 -5 Fraksi mola 0. 7808 0. 2095 0. 00934 0. 00033 2 x 10 -6 5 x 10 -7 a. Fraksi mol = kompoen mol /total mol dalam campuran.

Teori Kinetik Gas Teori Kinetik (atau teori kinetik pada gas) menjelaskan sifat-sifat makroscopik gas (tekanan, suhu, atau volume) dengan memperhatikan komposisi molekular mereka dan gerakannya. n n Tekanan gas tidaklah disebabkan oleh denyut-denyut statis di antara molekul-molekul, seperti yang diduga Isaac Newton, melainkan disebabkan oleh tumbukan antarmolekul yang bergerak pada kecepatan yang berbeda-beda. Dikenal pula sebagai Teori Kinetik-Molekular atau Teori Tumbukan atau Teori Kinetik pada Gas.


Model Gas Ideal 1. 2. 3. 4. 5. 6. 7. 8. 9. Terdiri atas partikel (atom atau molekul) yang jumlahnya besar Partikel-partikel tersebut tersebar merata dalam seluruh ruang Partikel-partikel tersebut bergerak acak ke segala arah Jarak antar partikel jauh lebih besar dari ukuran partikel Tidak ada gaya interaksi (atraktif/repulsif) antar partikel kecuali bila bertumbukan Semua tumbukan (antar partikel atau dengan dinding) bersifat lenting sempurna dan terjadi dalam waktu yang sangat singkat Mempunyai volume yang sangat kecil dibanding volume wadahnya. Mempunyai energi kinetik yang bertambah dengan kenaikan suhu. Hukum Newton tentang gerak berlaku

Model Gas Ideal 1. 2. 3. 4. 5. 6. 7. Terdiri atas partikel (atom atau molekul) yang jumlahnya besar Partikel-partikel tersebut tersebar merata dalam seluruh ruang Partikel-partikel tersebut bergerak acak ke segala arah Jarak antar partikel jauh lebih besar dari ukuran partikel Tidak ada gaya interaksi antar partikel kecuali bila bertumbukan Semua tumbukan (antar partikel atau dengan dinding) bersifat lenting sempurna dan terjadi dalam waktu yang sangat singkat Hukum Newton tentang gerak berlaku
![Persamaan Keadaan Gas Ideal P Tekanan gas N m2 V Volume gas Persamaan Keadaan Gas Ideal P = Tekanan gas [N. m-2] V = Volume gas](https://slidetodoc.com/presentation_image/3315f24f1c058b1b2aa4f79f05936daf/image-9.jpg)
Persamaan Keadaan Gas Ideal P = Tekanan gas [N. m-2] V = Volume gas [m 3] n = Jumlah mol gas [mol] N = Jumlah partikel gas NA = Bilangan Avogadro = R = Konstanta umum gas = 8, 314 J. mol-1 K-1 k. B = Konstanta Boltzmann = 1, 38 x 10 -23 J. K-1 T = Temperatur mutlak gas [K]

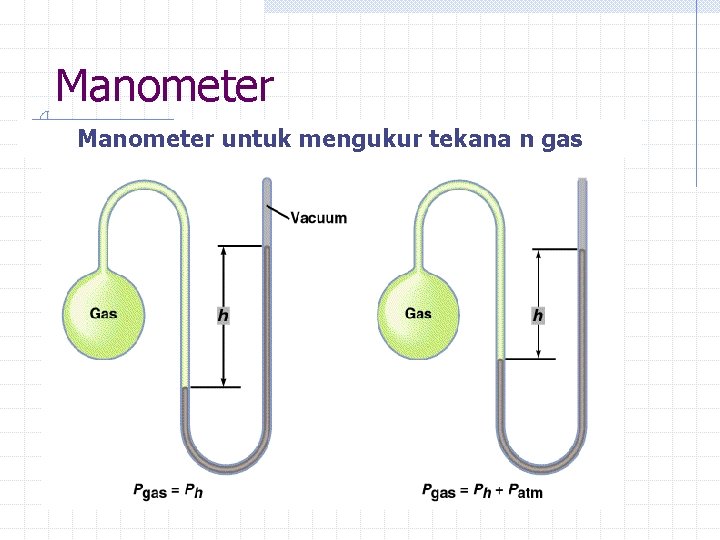
Tekanan Gas Tekanan gas Didefinisikan sebagai gaya yang bekerja pada suatu luasan. Satuan tekanan adalah: atm, mm Hg, torr, lb/in. 2 dan kilopascal (k. Pa). 1 atm = = 760 mm Hg (eksak) 760 torr 1 atm = 14. 7 lb/in. 2 1 atm = 101. 325 k. Pa Gaya Luasan

Tekanan Gas dan Efeknya Kaleng berisi air sebagian saat dipanaskan akan terbentuk uap di dalamnya Ketika kaleng kemudian didinginkan, ternyata kaleng menjadi penyok, tahukan anda apa penyebabnya? Tangki yang siang harinya masih utuh, pada pagi hari juga penyok, tahukan anda apa penyebabnya?

Manometer untuk mengukur tekana n gas

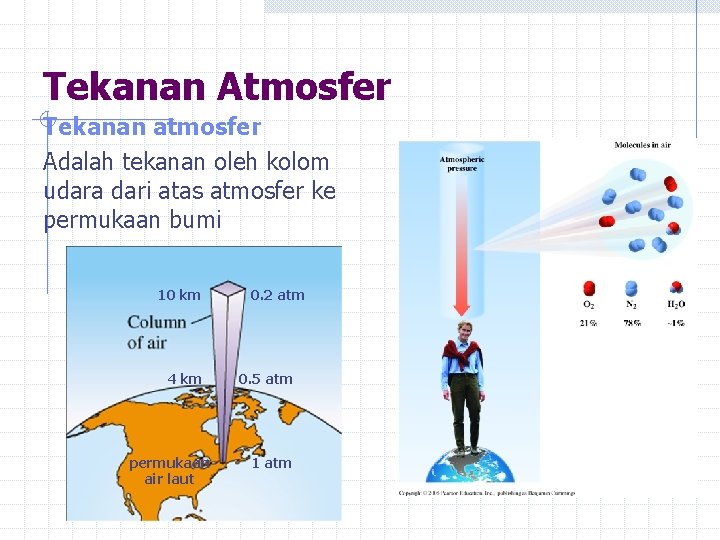
Tekanan Atmosfer Tekanan atmosfer Adalah tekanan oleh kolom udara dari atas atmosfer ke permukaan bumi 10 km 4 km permukaan air laut 0. 2 atm 0. 5 atm 1 atm

Ketinggian dan tekanan atmosfer Tekanan atmosfer Sekitar 1 atmosfer di atas permukaan air laut. Bergantung pada ketinggian dan cuaca. Semakin tinggi lokasi, semakin rendah. Lebih tinggi saat hujan dibanding saat cerah/tidak hujan.

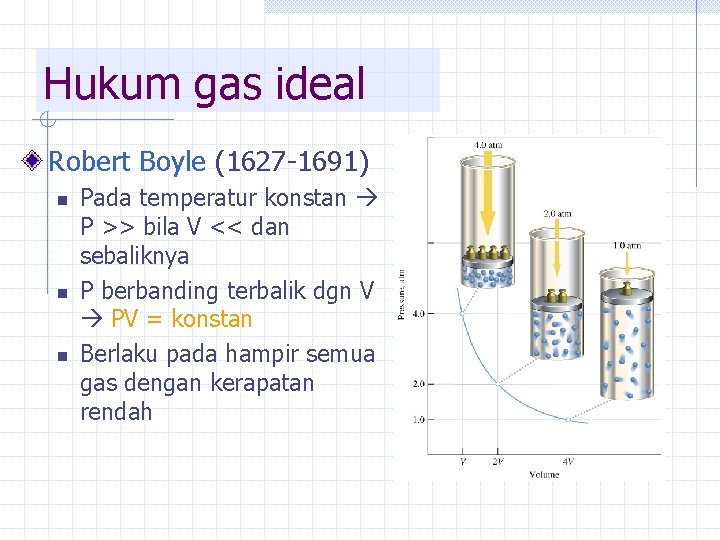
Hukum gas ideal Robert Boyle (1627 -1691) n n n Pada temperatur konstan P >> bila V << dan sebaliknya P berbanding terbalik dgn V PV = konstan Berlaku pada hampir semua gas dengan kerapatan rendah

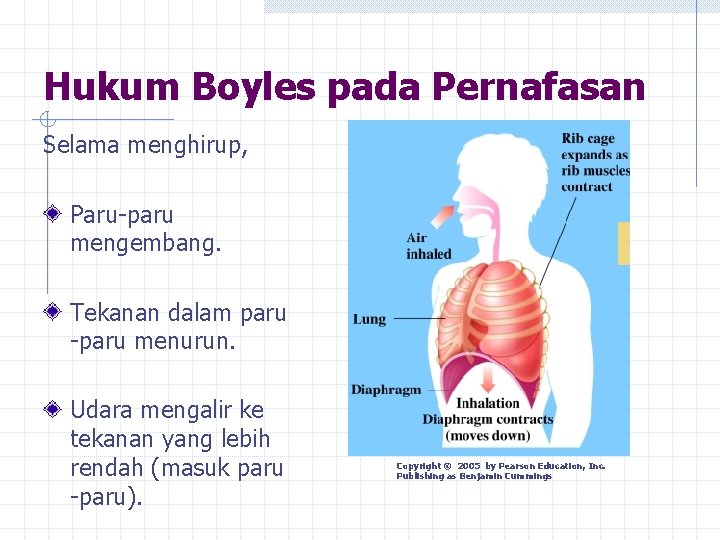
Hukum Boyles pada Pernafasan Selama menghirup, Paru-paru mengembang. Tekanan dalam paru -paru menurun. Udara mengalir ke tekanan yang lebih rendah (masuk paru -paru). Copyright © 2005 by Pearson Education, Inc. Publishing as Benjamin Cummings

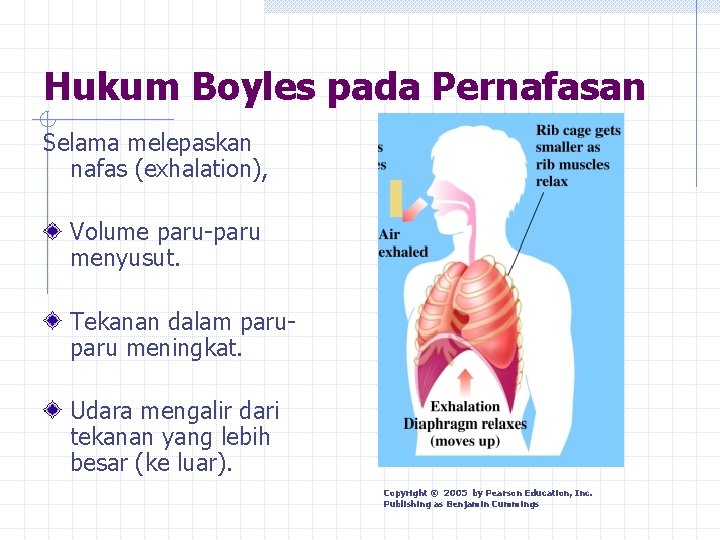
Hukum Boyles pada Pernafasan Selama melepaskan nafas (exhalation), Volume paru-paru menyusut. Tekanan dalam paru meningkat. Udara mengalir dari tekanan yang lebih besar (ke luar). Copyright © 2005 by Pearson Education, Inc. Publishing as Benjamin Cummings

Jacques Charles (1746 -1823) Gay Lussac (1778 -1850) n Pada kerapatan rendah, untuk gas w Temperatur absolut sebanding dengan tekanan pada volume konstan w Temperatur absolut sebanding dengan volume pada tekanan konstan PV = CT n C sebanding dengan jumlah gas sehingga PV = Nk. T w N = jumlah molekul gas w k = konstanta Boltzman 1, 381 x 10 -23 J/K

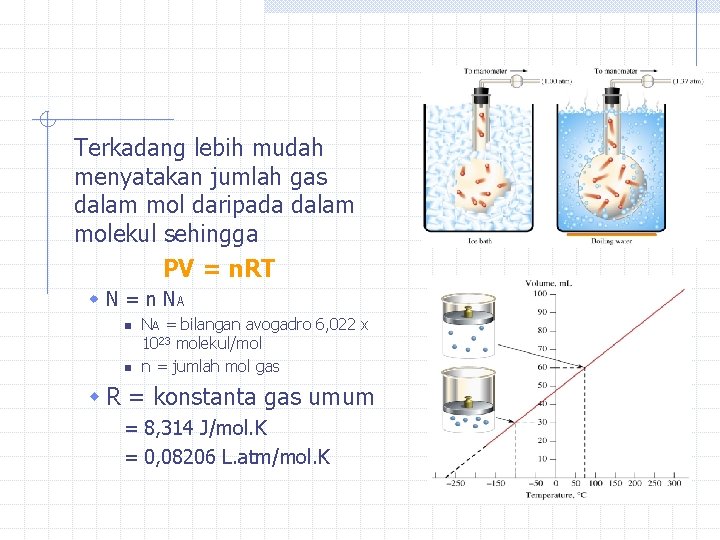
Terkadang lebih mudah menyatakan jumlah gas dalam mol daripada dalam molekul sehingga PV = n. RT w N = n NA n n NA = bilangan avogadro 6, 022 x 1023 molekul/mol n = jumlah mol gas w R = konstanta gas umum = 8, 314 J/mol. K = 0, 08206 L. atm/mol. K

Gas ideal didefinisikan sebagai gas dimana PV/n. T konstan untuk seluruh tekanan. Persamaan keadaan gas ideal PV = n. RT Massa molar M, massa 1 mol unsur/senyawa n Massa molar 12 C = 12 g/mol Massa n mol gas m = n. M Kerapatan gas ideal Pada temperatur tertentu, kerapatan gas ideal sebanding dengan tekanan n Perilaku gas ideal perilaku gas nyata pada kerapatan dan tekanan rendah Untuk sejumlah gas tertentu PV/T = konstan, sehingga dapat ditulis

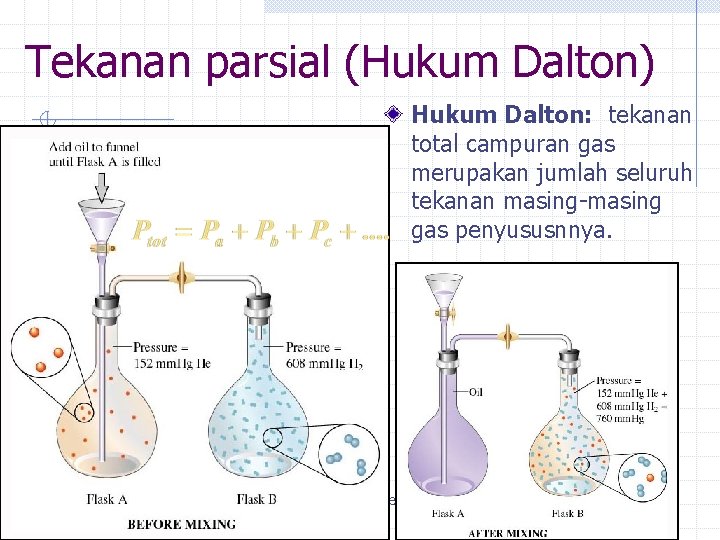
Tekanan parsial (Hukum Dalton) Hukum Dalton: tekanan total campuran gas merupakan jumlah seluruh tekanan masing-masing gas penyususnnya. Copyright © Houghton Mifflin Company. All rights reserved. Presentation of Lecture Outlines, 5 – 21

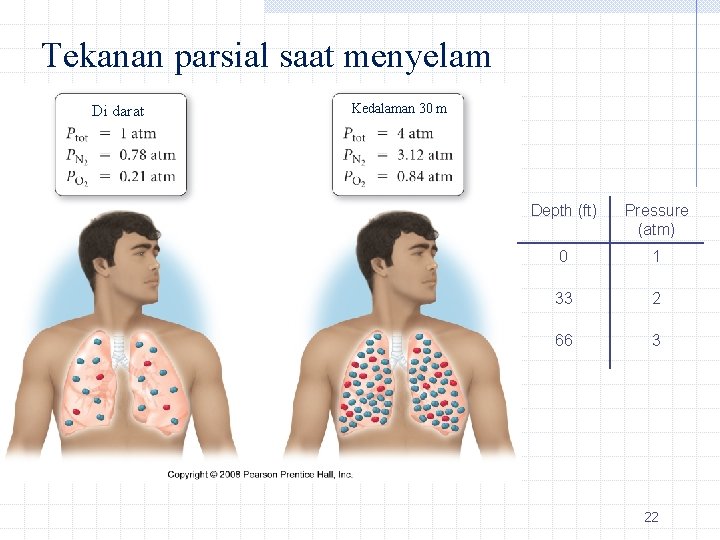
Tekanan parsial saat menyelam Di darat Kedalaman 30 m Depth (ft) Pressure (atm) 0 1 33 2 66 3 22

Scuba Diving and the Gas Laws P Depth (ft) Pressure (atm) 0 1 33 2 66 3 V 5. 6

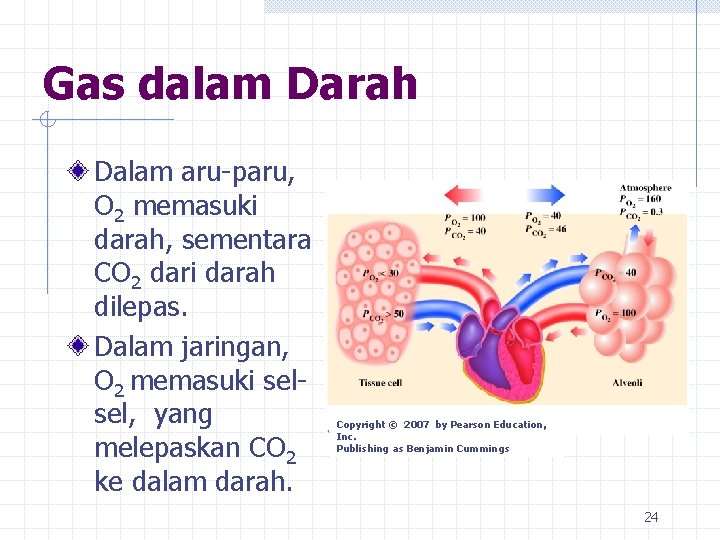
Gas dalam Darah Dalam aru-paru, O 2 memasuki darah, sementara CO 2 dari darah dilepas. Dalam jaringan, O 2 memasuki selsel, yang melepaskan CO 2 ke dalam darah. Copyright © 2007 by Pearson Education, Inc. Publishing as Benjamin Cummings 24

Gas dalam Darah Dalam tubuh, O 2 mengalir ke dalam jaringan (tissue) karena tekanan parsial O 2 lebih tinggi di dalam darah, dan lebih rendah di dalam jaringan. CO 2 mengalir keluar jaringan karena tekanan parsial CO 2 lebih tinggi di dalam jaringan, dan lebih rendah di dalam darah. Tekanan parsial dalam darah dan jaringan Gas Oxygenated Blood Deoxygenated Blood Tissues O 2 100 40 30 or less 46 50 or greater CO 2 40 25

Gas Exchange During Breathing Copyright © 2007 by Pearson Education, Inc. Publishing as Benjamin Cummings 26

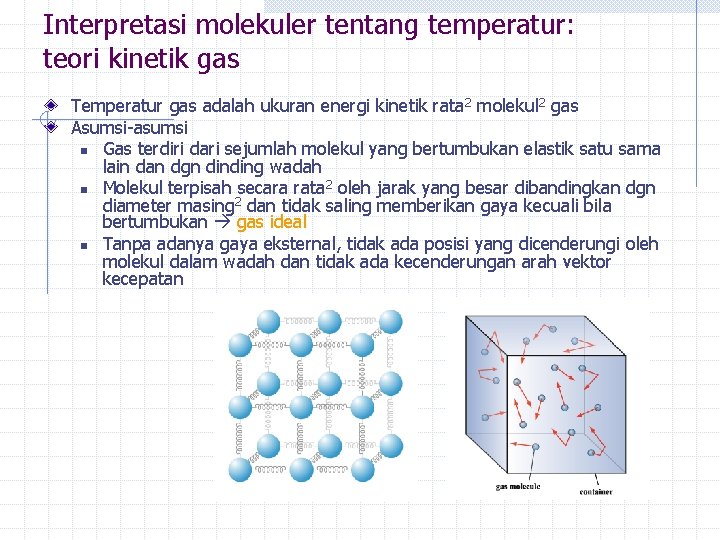
Interpretasi molekuler tentang temperatur: teori kinetik gas Temperatur gas adalah ukuran energi kinetik rata 2 molekul 2 gas Asumsi-asumsi n Gas terdiri dari sejumlah molekul yang bertumbukan elastik satu sama lain dan dgn dinding wadah n Molekul terpisah secara rata 2 oleh jarak yang besar dibandingkan dgn diameter masing 2 dan tidak saling memberikan gaya kecuali bila bertumbukan gas ideal n Tanpa adanya gaya eksternal, tidak ada posisi yang dicenderungi oleh molekul dalam wadah dan tidak ada kecenderungan arah vektor kecepatan

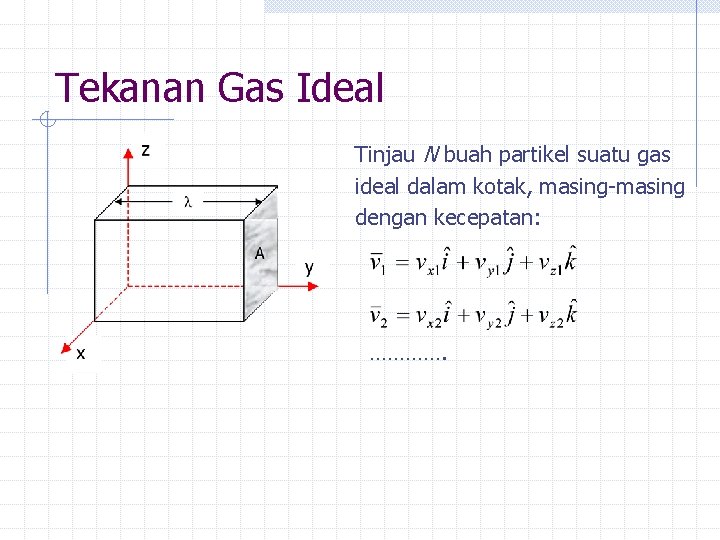
Tekanan Gas Ideal Tinjau N buah partikel suatu gas ideal dalam kotak, masing-masing dengan kecepatan: ………….

Tinjau 1 partikel. . . Kecepatan partikel mula 2: Kecepatan partikel setelah menumbuk dinding kanan (asumsi: tidak ada tumbukan antar partikel): Perubahan momentum partikel: Selang waktu partikel tsb dua kali menumbuk dinding kanan: Besarnya momentum yg diberikan partikel pada dinding kanan tiap satuan waktu:

Bagaimana dengan N partikel ? Besarnya momentum total yg diberikan N buah partikel pada dinding kanan tiap satuan waktu: Tekanan gas pada dinding kanan: Tetapi sehingga dan

Temperatur Gas Ideal Dari persamaan dan persamaan gas ideal dapat diperoleh hubungan atau sehingga Energi kinetik translasi partikel gas

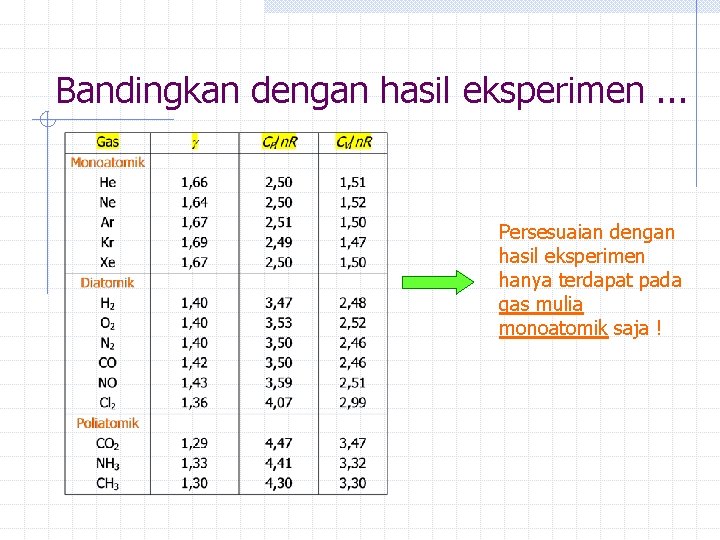
Energi Dalam Gas Ideal Dari hubungan terakhir di atas dapat dituliskan yaitu energi kinetik gas, yg juga merupakan energi total dan energi dalam gas Perbandingan dengan eksperimen ? Kapasitas kalor pada volume tetap: atau kapasitas kalor pd tekanan tetap: Perbandingan CP dan CV adalah suatu konstanta:

Bandingkan dengan hasil eksperimen. . . Persesuaian dengan hasil eksperimen hanya terdapat pada gas mulia monoatomik saja !

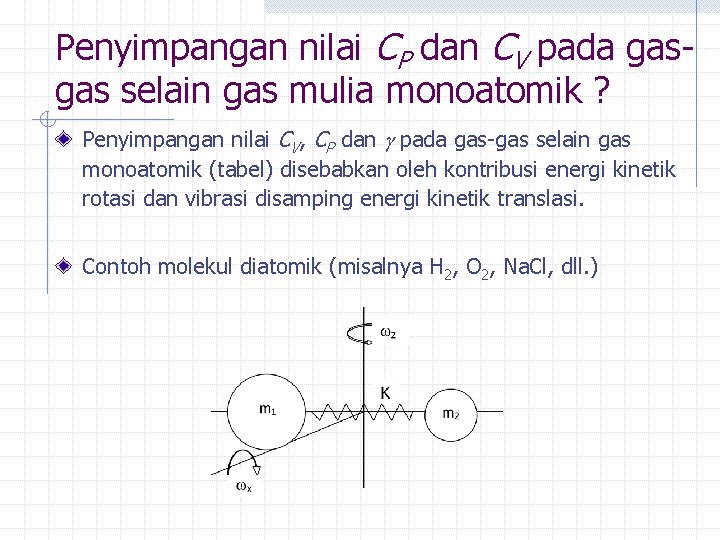
Penyimpangan nilai CP dan CV pada gasgas selain gas mulia monoatomik ? Penyimpangan nilai CV, CP dan pada gas-gas selain gas monoatomik (tabel) disebabkan oleh kontribusi energi kinetik rotasi dan vibrasi disamping energi kinetik translasi. Contoh molekul diatomik (misalnya H 2, O 2, Na. Cl, dll. )

Kontribusi tambahan pada energi kinetik translasi (thd subx, y dan z) diasosiasikan dengan energi kinetik rotasi (thd sb-x dan z) dan energi kinetik vibrasi (thd sb-y): Ix = Iz : momen inersia thd sb x & z K : Konstanta “pegas” M : Massa tereduksi m 1 dan m 2 Energi (kinetik) total gas diatomik:

Asas Ekipartisi Energi: untuk tiap derajat kebebasan yang energinya berbanding dengan kuadrat variabel bebasnya, energi rata-ratanya adalah 1/2 k. BT Jadi untuk molekul gas diatomik: ; ; Dari tabel, hasil eksperimen utk gas diatomik, 1, 40 !

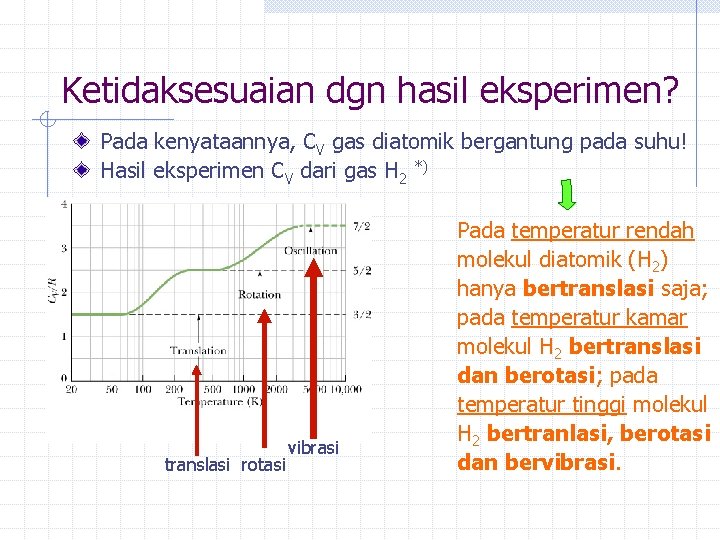
Ketidaksesuaian dgn hasil eksperimen? Pada kenyataannya, CV gas diatomik bergantung pada suhu! Hasil eksperimen CV dari gas H 2 *) translasi rotasi vibrasi Pada temperatur rendah molekul diatomik (H 2) hanya bertranslasi saja; pada temperatur kamar molekul H 2 bertranslasi dan berotasi; pada temperatur tinggi molekul H 2 bertranlasi, berotasi dan bervibrasi.

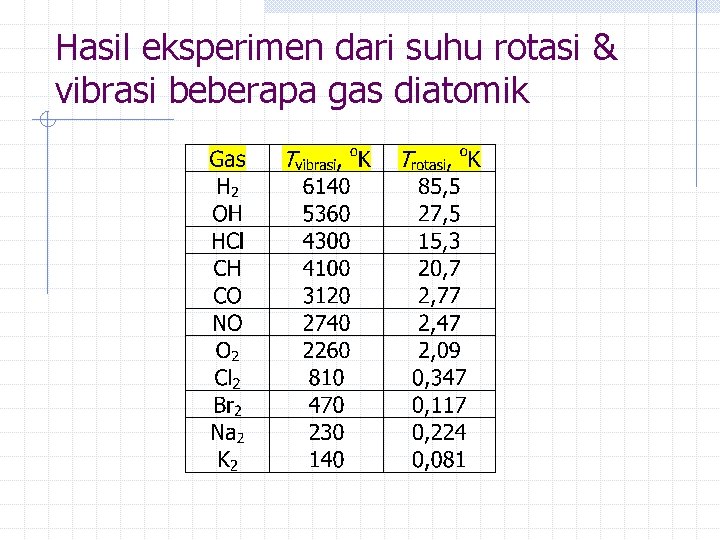
Hasil eksperimen dari suhu rotasi & vibrasi beberapa gas diatomik

Persamaan Van der Waals dan gas tak ideal • • } } Koreksi tekanan Koreksi volume P = tekanan gas V = volume total (wadah gas) a = ukuran atraktif antar partikel b = volume tanpa partikel n = jumlah mol R = konstanta gas universal T = temperatur absolut
 Pengertian kurva kepuasan sama
Pengertian kurva kepuasan sama Teori kinetik gas
Teori kinetik gas Faalih imaduddin salma
Faalih imaduddin salma Teori kinetik gas adalah
Teori kinetik gas adalah Contoh soal teori kinetik gas
Contoh soal teori kinetik gas Teori kinetik gas
Teori kinetik gas Peta konsep teori kinetik gas
Peta konsep teori kinetik gas Soal dan pembahasan teori kinetik gas
Soal dan pembahasan teori kinetik gas Dua zarah subatom dalam nukleus
Dua zarah subatom dalam nukleus Laporan praktikum dasar pengukuran dan ketidakpastian
Laporan praktikum dasar pengukuran dan ketidakpastian Senyawa halogen adalah
Senyawa halogen adalah Energi kinetik
Energi kinetik Sistem partikel
Sistem partikel Li3po4 bileşiğinin adı
Li3po4 bileşiğinin adı Elektron enerjisi formülü
Elektron enerjisi formülü Kecepatan relativitas
Kecepatan relativitas Tabel besaran turunan
Tabel besaran turunan Kapalı kinetik zincir egzersizleri
Kapalı kinetik zincir egzersizleri Regulation von enzymen
Regulation von enzymen Tünel restorasyonlar
Tünel restorasyonlar Esnek olmayan çarpışmalar
Esnek olmayan çarpışmalar Gaya konstan
Gaya konstan Enerji potensial və kinetik enerji
Enerji potensial və kinetik enerji Paralel levha kinetik enerji
Paralel levha kinetik enerji Rumus energi
Rumus energi R sabiti
R sabiti Yay potansiyel enerjisi formülü
Yay potansiyel enerjisi formülü .compexels
.compexels Enerji potensial və kinetik enerji
Enerji potensial və kinetik enerji Paralel levha kinetik enerji
Paralel levha kinetik enerji Tabel kapasitas panas (cp)
Tabel kapasitas panas (cp) Tenaga kinetik zarah
Tenaga kinetik zarah Jurusan smkn 1 bangkalan
Jurusan smkn 1 bangkalan Login lms unisnu
Login lms unisnu Jurusan penelitian dan evaluasi pendidikan
Jurusan penelitian dan evaluasi pendidikan Jurusan psikologi di medan
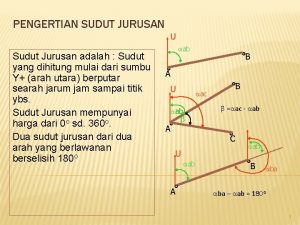
Jurusan psikologi di medan Sudut jurusan adalah
Sudut jurusan adalah Contoh struktur organisasi kelompok perikanan
Contoh struktur organisasi kelompok perikanan Amikom jogja jurusan
Amikom jogja jurusan Jurusan akamigas balongan
Jurusan akamigas balongan