TEORI KINETIK GAS HUKUM I TERMODINAMIKA Model Gas


![Persamaan Keadaan Gas Ideal P = Tekanan gas [N. m-2] V = Volume gas Persamaan Keadaan Gas Ideal P = Tekanan gas [N. m-2] V = Volume gas](https://slidetodoc.com/presentation_image/1e953cc9d988f513b5eed2b950ac35ad/image-3.jpg)











- Slides: 22

TEORI KINETIK GAS & HUKUM I TERMODINAMIKA

Model Gas Ideal 1. 2. 3. 4. 5. 6. 7. Terdiri atas partikel (atom atau molekul) yang jumlahnya besar Partikel-partikel tersebut tersebar merata dalam seluruh ruang Partikel-partikel tersebut bergerak acak ke segala arah Jarak antar partikel jauh lebih besar dari ukuran partikel Tidak ada gaya interaksi antar partikel kecuali bila bertumbukan Semua tumbukan (antar partikel atau dengan dinding) bersifat lenting sempurna dan terjadi dalam waktu yang sangat singkat Hukum Newton tentang gerak berlaku
![Persamaan Keadaan Gas Ideal P Tekanan gas N m2 V Volume gas Persamaan Keadaan Gas Ideal P = Tekanan gas [N. m-2] V = Volume gas](https://slidetodoc.com/presentation_image/1e953cc9d988f513b5eed2b950ac35ad/image-3.jpg)
Persamaan Keadaan Gas Ideal P = Tekanan gas [N. m-2] V = Volume gas [m 3] n = Jumlah mol gas [mol] N = Jumlah partikel gas NA = Bilangan Avogadro = 6, 02 x 1023 R = Konstanta umum gas = 8, 314 J. mol-1 K-1 k. B = Konstanta Boltzmann = 1, 38 x 10 -23 J. K-1 T = Temperatur mutlak gas [K]

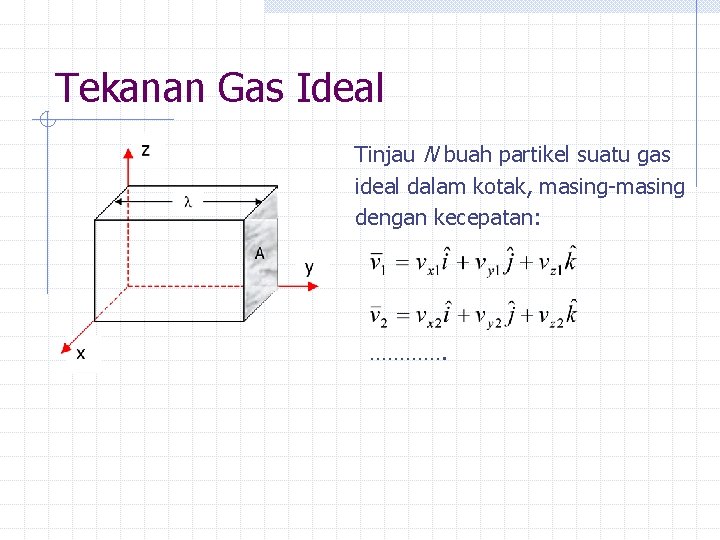
Tekanan Gas Ideal Tinjau N buah partikel suatu gas ideal dalam kotak, masing-masing dengan kecepatan: ………….

Tinjau 1 partikel. . . Kecepatan partikel mula 2: Kecepatan partikel setelah menumbuk dinding kanan (asumsi: tidak ada tumbukan antar partikel): Perubahan momentum partikel: Selang waktu partikel tsb dua kali menumbuk dinding kanan: Besarnya momentum yg diberikan partikel pada dinding kanan tiap satuan waktu:

Bagaimana dengan N partikel ? Besarnya momentum total yg diberikan N buah partikel pada dinding kanan tiap satuan waktu: Tekanan gas pada dinding kanan: Tetapi sehingga dan

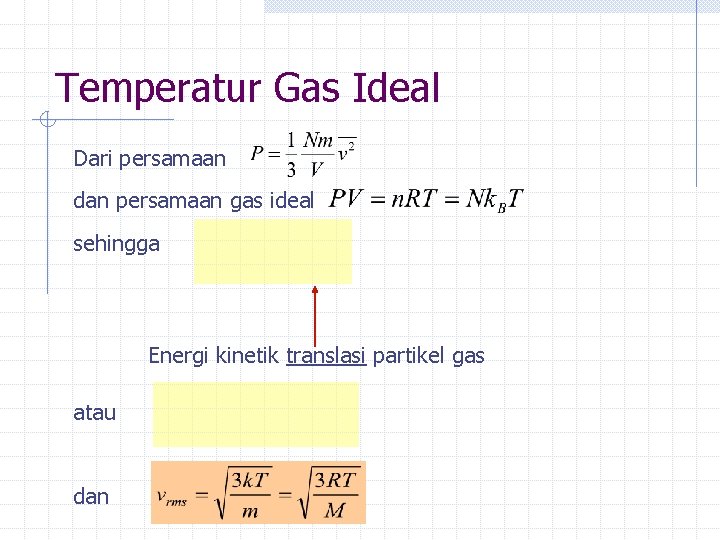
Temperatur Gas Ideal Dari persamaan dan persamaan gas ideal sehingga Energi kinetik translasi partikel gas atau dan

Energi Dalam Gas Ideal Dari hubungan terakhir di atas dapat dituliskan yaitu energi kinetik gas, yg juga merupakan energi total dan energi dalam gas kapasitas Panas Kapasitas kalor pada volume tetap: atau kapasitas kalor pd tekanan tetap: Perbandingan CP dan CV adalah suatu konstanta:

Bandingkan dengan hasil eksperimen. . . Persesuaian dengan hasil eksperimen hanya terdapat pada gas mulia monoatomik saja ! Dilakukan sekitar suhu 300 -600 K

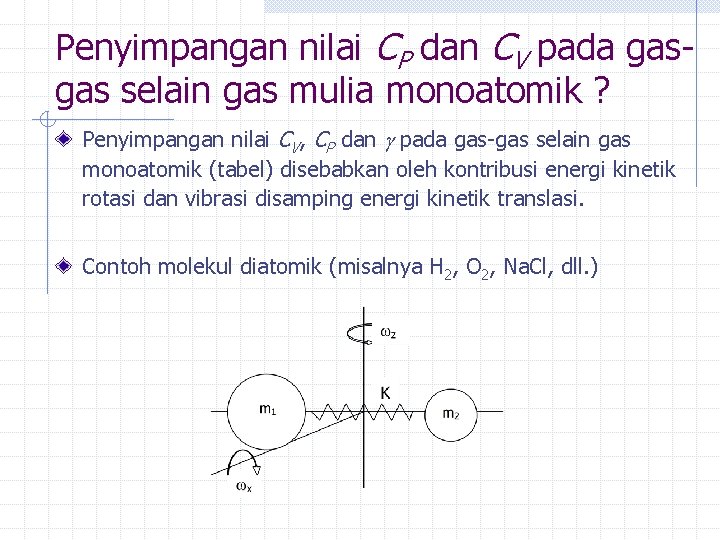
Penyimpangan nilai CP dan CV pada gasgas selain gas mulia monoatomik ? Penyimpangan nilai CV, CP dan pada gas-gas selain gas monoatomik (tabel) disebabkan oleh kontribusi energi kinetik rotasi dan vibrasi disamping energi kinetik translasi. Contoh molekul diatomik (misalnya H 2, O 2, Na. Cl, dll. )

Kontribusi tambahan pada energi kinetik translasi (thd subx, y dan z) diasosiasikan dengan energi kinetik rotasi (thd sb-x dan z) dan energi kinetik vibrasi (thd sb-y): Ix = Iz : momen inersia thd sb x & z K : Konstanta “pegas” M : Massa tereduksi m 1 dan m 2 Energi (kinetik) total gas diatomik:

Asas Ekipartisi Energi: untuk tiap derajat kebebasan yang energinya berbanding dengan kuadrat variabel bebasnya, energi rata-ratanya adalah 1/2 k. BT Jadi untuk molekul gas diatomik: ; ; Dari tabel, hasil eksperimen utk gas diatomik, 1, 40 !

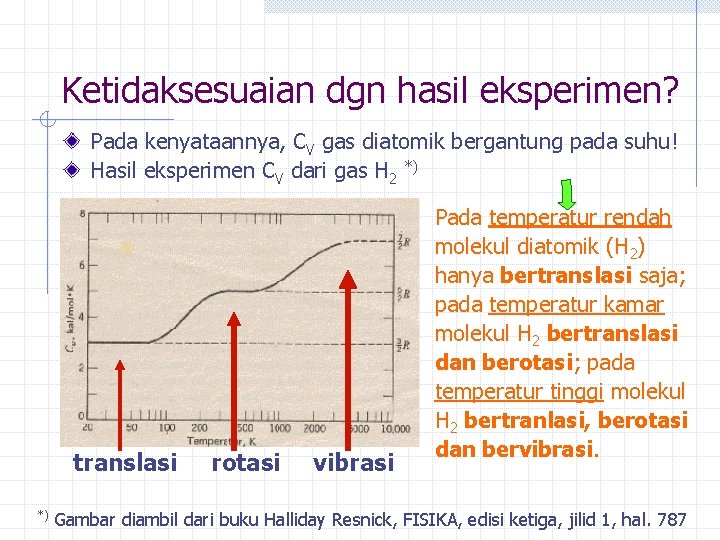
Ketidaksesuaian dgn hasil eksperimen? Pada kenyataannya, CV gas diatomik bergantung pada suhu! Hasil eksperimen CV dari gas H 2 *) translasi *) rotasi vibrasi Pada temperatur rendah molekul diatomik (H 2) hanya bertranslasi saja; pada temperatur kamar molekul H 2 bertranslasi dan berotasi; pada temperatur tinggi molekul H 2 bertranlasi, berotasi dan bervibrasi. Gambar diambil dari buku Halliday Resnick, FISIKA, edisi ketiga, jilid 1, hal. 787

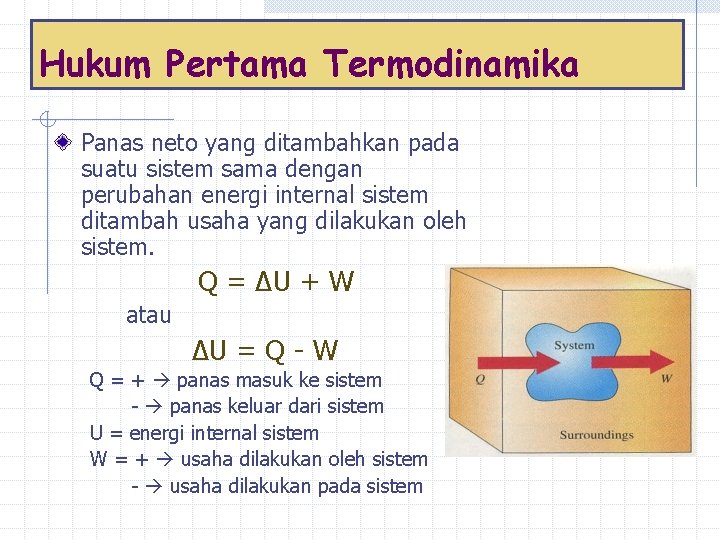
Hukum Pertama Termodinamika Panas neto yang ditambahkan pada suatu sistem sama dengan perubahan energi internal sistem ditambah usaha yang dilakukan oleh sistem. Q = ΔU + W atau ΔU = Q - W Q = + panas masuk ke sistem - panas keluar dari sistem U = energi internal sistem W = + usaha dilakukan oleh sistem - usaha dilakukan pada sistem

contoh Sebuah pemanas air menggunakan listrik sebagai sumbernya digunakan untuk memanaskan 3 kg air pada 80 o. C. Usaha yang diberikan filamen pemanas 25 k. J sementara panas yang terbuang karena konduksi sebesar 15 kkal. Berapa perubahan energi internal sistem? Panas terbuang 15 kkal = 62, 7 k. J ΔU = Q - W ΔU = -62, 7 k. J – (-25 k. J) ΔU = -37, 7 k. J

Usaha dan diagram PV untuk gas Usaha = luas daerah di bawah kurva

Contoh Sejumlah gas ideal dipanaskan pada tekanan tetap 2. 104 N/m 2. Sehingga volumenya berubah dari 20 m 3 menjadi 30 m 3, usaha luar yang dilakukan gas selama ekspansi adalah….

Proses Isotermal Selama proses temperatur sistem tetap konstan A B Hk. Termodinamika ke-1: U = Q – W = 0 W=Q

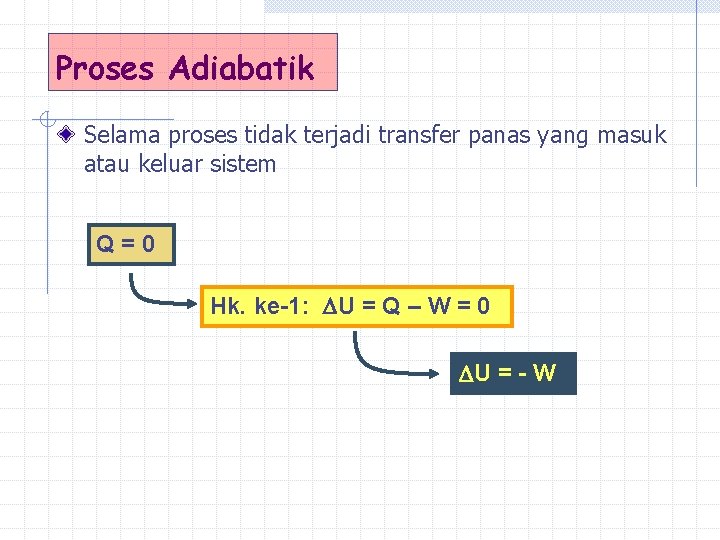
Proses Adiabatik Selama proses tidak terjadi transfer panas yang masuk atau keluar sistem Q=0 Hk. ke-1: U = Q – W = 0 U = - W

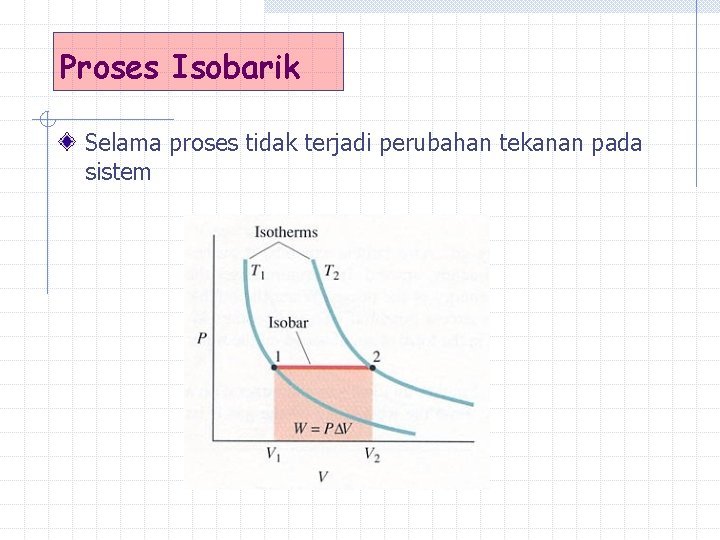
Proses Isobarik Selama proses tidak terjadi perubahan tekanan pada sistem

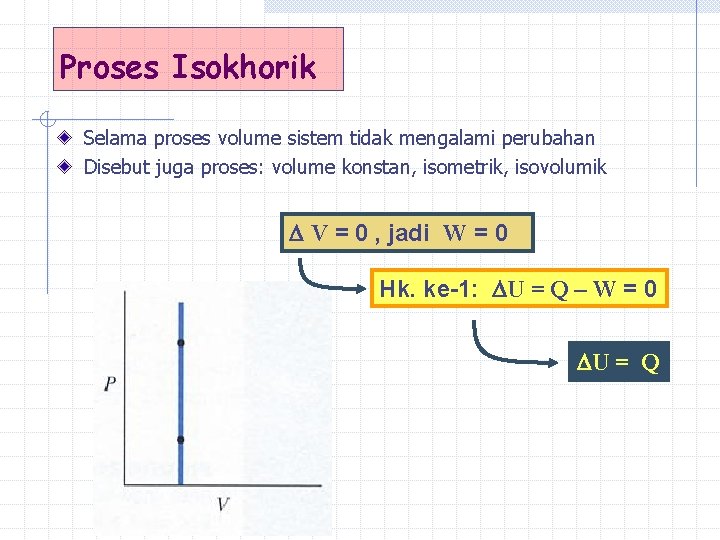
Proses Isokhorik Selama proses volume sistem tidak mengalami perubahan Disebut juga proses: volume konstan, isometrik, isovolumik V = 0 , jadi W = 0 Hk. ke-1: U = Q – W = 0 U = Q

Contoh Terdapat 1 mol gas ideal mula-mula tekanannya 3 atm, volumenya 1 L dan energi dalamnya 456 J. Gas kemudian berekspansi pada tekanan tetap sampai volumenya 3 L, kemudian didinginkan pada volume konstan sampai tekanannya menjadi 2 atm. (a) Tunjukkan proses yang dialami gas dalam diagram p –V, (b) hitunglah usaha yang dilakukan gas, (c) hitunglah kalor yang ditambahkan pada gas selama proses tersebut.
 Lapisan dalam ilmu hukum
Lapisan dalam ilmu hukum Soal teori kinetik gas kelas 11
Soal teori kinetik gas kelas 11 Teorema ekipartisi energi
Teorema ekipartisi energi 8 314 konstanta
8 314 konstanta Ekipartisi energi
Ekipartisi energi Teori kinetik gas
Teori kinetik gas Soal dan pembahasan teori kinetik gas
Soal dan pembahasan teori kinetik gas Tekanan sebuah gas dalam bejana
Tekanan sebuah gas dalam bejana Proses termodinamika adalah
Proses termodinamika adalah Hukum kedua termodinamika
Hukum kedua termodinamika Pengertian hukum ke nol termodinamika
Pengertian hukum ke nol termodinamika Prinsip carnot
Prinsip carnot Hukum pertama termodinamika
Hukum pertama termodinamika Hukum termodinamika disebut juga sebagai
Hukum termodinamika disebut juga sebagai Termodinamika 2
Termodinamika 2 Aplikasi hukum termodinamika 2
Aplikasi hukum termodinamika 2 Hukum termodinamika
Hukum termodinamika Gas ideal
Gas ideal Hukum termodinamika
Hukum termodinamika Hukum termodinamika 2
Hukum termodinamika 2 Dua zarah subatom dalam nukleus
Dua zarah subatom dalam nukleus Fungsi hukum taklif
Fungsi hukum taklif Hukum-hukum perkembangan peserta didik
Hukum-hukum perkembangan peserta didik