TEORI KINETIK GAS OLEH Fallima Nur M 1307230

















- Slides: 25

TEORI KINETIK GAS OLEH: Fallima Nur M 1307230 M. Himni Muhaemin 1301596

Persemaan Gas Ideal dan Hukum Peta Konsep Materi inti Tekanan dan Energi kinetik gas Fenomena sehari-hari Materi esensila Teorema Ekipartisi Teori Kinetik Gas Tujuan Pembelajaran Materi Pokok Kompeten si Dasar Indikator

Materi Pokok KI 1: KI 2: Title Menghayati dan mengamalkan ajaran agama yang dianutnya. Menghayati dan mengamalkan perilaku jujur, disiplin, tanggung jawab, peduli (gotong royong, kerja sama, toleran, damai), santun, responsif dan pro-aktif, dan menunjukkan sikap sebagai bagian dari solusi atas berbagai permasalahan dalam berinteraksi • Text secara efektif dengan lingkungan sosial dan alam serta dalam menempatkan diri sebagai cerminan bangsa dalam pergaulan dunia. KI 3: Memahami, menerapkan, menganalisis pengetahuan faktual, konseptual, prosedural berdasarkan rasa ingin tahunya tentang ilmu pengetahuan, teknologi, seni, budaya, dan humaniora dengan wawasan kemanusiaan, kebangsaan, kenegaraan, dan peradaban terkait penyebab fenomena dan kejadian, serta menerapkan pengetahuan prosedural pada bidang kajian yang spesifik sesuai dengan bakat dan minatnya untuk memecahkan masalah. KI 4: Mengolah, menalar, dan menyaji dalam ranah konkret dan ranah abstrak terkait dengan pengembangan dari yang dipelajarinya di sekolah secara mandiri, dan mampu menggunakan metoda sesuai kaidah keilmuan.

Kompetensi Dasar 3. 8 : Memahami teori kinetik gas dalam menjelaskan karakteristik gas pada ruang tertutup.

Indikator 3. 8. 1 Mendeskripsikan sifat-sifat gas ideal; 3. 8. 2 Menjelaskan hubungan antara suhu, volume, dan tekanan; 3. 8. 3 Memformulasikan hukum Boyle, Gay Lusac dan Charles; 3. 8. 4 Memformulasikan persamaan keadaan gas ideal; 3. 8. 5 Menerapkan persamaan keadaan gas ideal dalam kehidupan; 3. 8. 6 Memformulasikan tekanan gas dari sifat mikroskopis gas; 3. 8. 7 Memformulasikan energi kinetik dan kecepatan rata-rata partikel gas; 3. 8. 8 Memformulasikan teorema ekuipartisi energi.

Tujuan Pembelajaran 1. Peserta didik dapat mendeskripsikan sifat-sifat gas Title ideal. 2. Setelah melakukan kajian tentang sifat-sifat gas ideal • pada Textkehidupan, peserta didik dapat memahami hukum boyle, gay lussac, Charles dan persamaan keadaan gas Ideal. 3. Setelah menganalisis suatu gas dalam keadaan tertutup peserta didik dapat membedakan gas ideal secara makroskopis dan mikroskopis. 4. Setelah melakukan kajian tentang hukum-hukum gas ideal, peserta didik dapat mengetahui hubungan gas ideal dan energi kinetik. 5. Peserta didik dapat mengidentifikasi energi pada gas ideal dan kecepatan partikel gas ideal.

Materi Inti § § § § § Mol dan Massa molekul Hubungan Massa mol an mol Persamaan Keadaan Gas Ideal Hukum Boyle, Gay Lussac dan Charles Persamaan Keadaan Gas ideal pada Penapasan Tekanan dan Energi kinetik Teori kinetik gas Tekanan gas dalam wadah tertutup Kelajuan efektif gas Teorema ekipartisi energi

Materi Esensial 1. Gas ideal 2. Tekanan 3. Suhu 4. Volume 5. Isotermik 6. Isobar 7. Isokhorik 8. Hukum Boyle 9. Hukum Gay-Lussac 10. Hukum Charles 11. Persamaan keadaan gas ideal 12. Energi kinetik 13. Momentum 14. Kecepatan molar 15. Gas monoatomik 16. Gas diatomik

Peta Konsep

PERNAHKAH ANDA MELIHAT FENOMENA SEPERTI DIBAWAH INI? AGAR DAPAT DIMENGERTI MARI KITA BELAJAR BERSAMA

Teori Kinetik Gas Dapat ditinjau secara MAKROSKOPIS MIKROSKOPIS

Sifat-sifat Gas Ideal • Terdiri dari banyak partikel, tetapi tidak ada gaya tarikmenarik (interaksi) antarpartikel. • Senantiasa bergerak dengan arah sembarangan dan tersebar merata dalam ruang. • Jarak partikel lebih besar daripada ukuran partikelnya • Setiap tumbukan yang terjadi antarpartikel gas dan antara partikel gas dan dinding bersifat lenting sepurna. • Dinding tempat gas licin sempurna. • Berlaku hukum Newton tentang gerak.

Persamaan Gas Ideal ROBERT BOYLE (1627 -1690) JACQUES CHARLES (1746 -1820) GAY LUSSAC (1778 -1850)

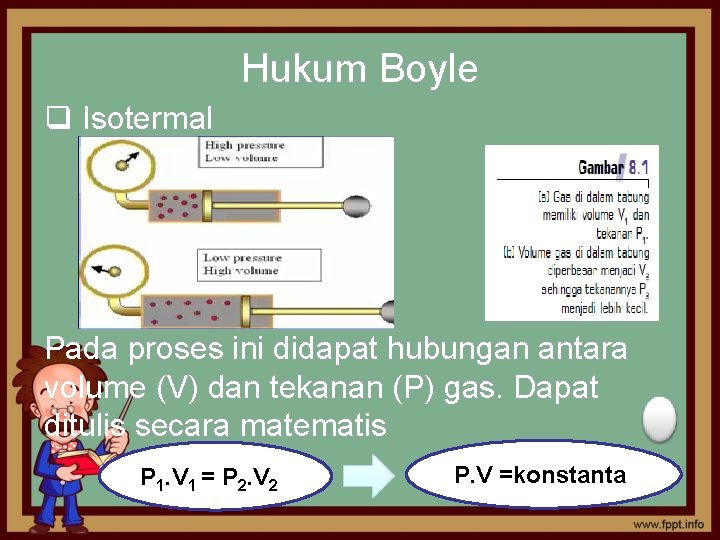
Hukum Boyle q Isotermal Pada proses ini didapat hubungan antara volume (V) dan tekanan (P) gas. Dapat ditulis secara matematis P 1. V 1 = P 2. V 2 P. V =konstanta


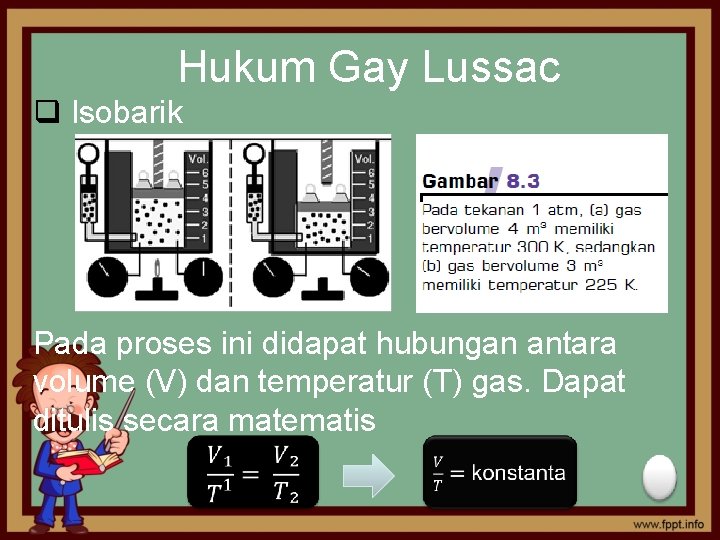
Hukum Gay Lussac q Isobarik Pada proses ini didapat hubungan antara volume (V) dan temperatur (T) gas. Dapat ditulis secara matematis


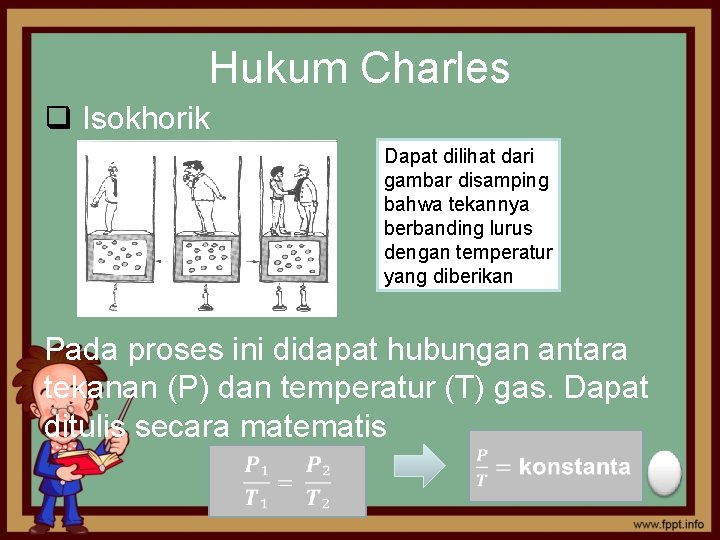
Hukum Charles q Isokhorik Dapat dilihat dari gambar disamping bahwa tekannya berbanding lurus dengan temperatur yang diberikan Pada proses ini didapat hubungan antara tekanan (P) dan temperatur (T) gas. Dapat ditulis secara matematis

Persamaan Keadaan Gas Ideal q Apabila dalam suatu percobaan variabel gas tidak ada yang dibuat konstan (tetap) Maka dapat dituliskan secara matematis

Persamaan Keadaan Gas Ideal • (8, 31 J/mol. K)

Sekarang sudah mengerti yaaa

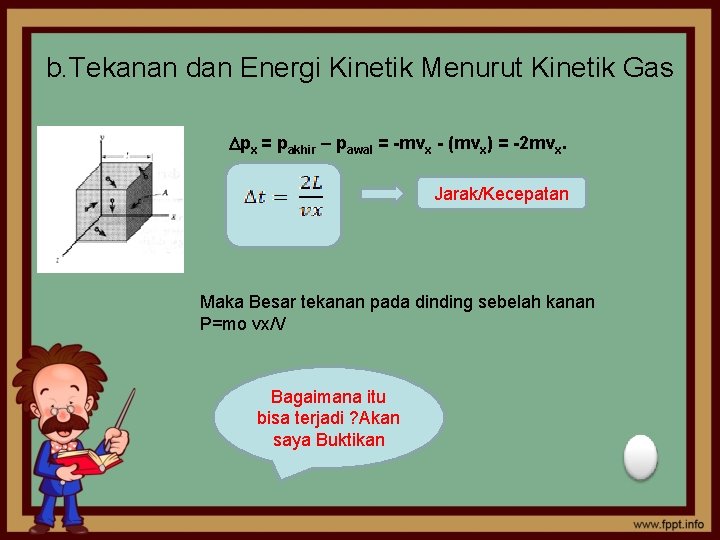
b. Tekanan dan Energi Kinetik Menurut Kinetik Gas px = pakhir – pawal = -mvx - (mvx) = -2 mvx. Jarak/Kecepatan Maka Besar tekanan pada dinding sebelah kanan P=mo vx/V Bagaimana itu bisa terjadi ? Akan saya Buktikan

Dari formulasi gas dalam wadah tertutup kita dapatkan Tekanan dinding sebelah kanan Tekanan total pada dinding gas Kecepatan rata-rata kuadrat partikel

Teorema Ekipartisi, Energi Kinetik dan tekanan Energi kinetik rata-rata molekul suatu zat pada suhu mutlak 3 Atau Faktor pengali ekipalensi dari rata-rata kuadrat komponen-komponen kecepatan masing-masing sumbu. Faktanya ekipalensi kelakuan ini menunjukan tidak bergantung pada pemilihan orientasi arah sumbu x, y, z sehingga Karena bergerak 3 komponen maka dapat dikatakan 3 derajat kebebasan

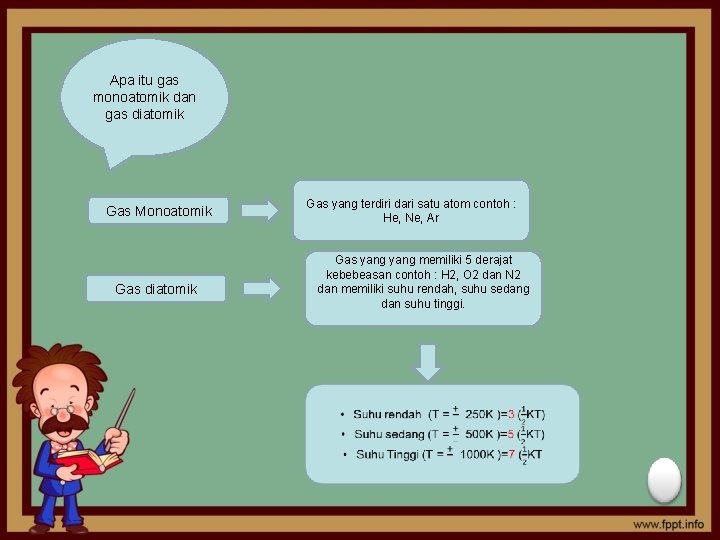
Apa itu gas monoatomik dan gas diatomik Gas Monoatomik Gas diatomik Gas yang terdiri dari satu atom contoh : He, Ne, Ar Gas yang memiliki 5 derajat kebebeasan contoh : H 2, O 2 dan N 2 dan memiliki suhu rendah, suhu sedang dan suhu tinggi.
 Soal kinetik gas
Soal kinetik gas Teorema ekipartisi energi
Teorema ekipartisi energi 8 314 konstanta
8 314 konstanta Teori kinetik gas adalah
Teori kinetik gas adalah Teori kinetik gas
Teori kinetik gas Soal dan pembahasan teori kinetik gas
Soal dan pembahasan teori kinetik gas Dalam suatu ruangan yang bervolume 1 5 liter terdapat gas
Dalam suatu ruangan yang bervolume 1 5 liter terdapat gas 3 zarah subatom
3 zarah subatom Izotonik egzersiz örnekleri
Izotonik egzersiz örnekleri Paralel levha kinetik enerji
Paralel levha kinetik enerji Paralel levha kinetik enerji
Paralel levha kinetik enerji Bohr açısal momentum formülü
Bohr açısal momentum formülü Li3po4 bileşiğinin adı
Li3po4 bileşiğinin adı Air abrazyon tekniği
Air abrazyon tekniği Derişim cinsinden denge sabiti
Derişim cinsinden denge sabiti Tenaga kinetik zarah
Tenaga kinetik zarah Rumus besaran pokok dan besaran turunan
Rumus besaran pokok dan besaran turunan Enerji potensial və kinetik enerji
Enerji potensial və kinetik enerji Materiyanın növləri
Materiyanın növləri Sistem partikel adalah
Sistem partikel adalah Regulation von enzymen
Regulation von enzymen Fisika
Fisika Tabel kapasitas panas (cp)
Tabel kapasitas panas (cp) Dilatasi waktu
Dilatasi waktu çizgisel momentum
çizgisel momentum Yay potansiyel enerjisi
Yay potansiyel enerjisi