FI1101 Kuliah 13 TEORI KINETIK GAS Teori Kinetik






















- Slides: 25

FI-1101: Kuliah 13 TEORI KINETIK GAS Teori Kinetik Gas Suhu Mutlak Hukum Boyle-Gay Lussac Gas Ideal Teori Kinetik & Interpretasi molekular dari Suhu FI-1101: Teori Kinetik Gas, Hal 1

FISIKA TERMAL Cabang Fisika yang mempelajari perubahan sifat zat karena pengaruh temperatur atau kalor yang diterimanya Fisika termal dibagi menjadi: - Termodinamika klasik: mempelajari sifat makroskopik (sifat yang dapat diukur langsung) dari suatu zat. - Termodinamika statistik: mempelajari sifat mikroskopik dari suatu zat. Termodinamika statistik dibagi menjadi: - Teori kinetik: mempelajari mulai dari sifat partikel sebagai individu, misalnya kecepatannya, momentumnya, dsb. - Mekanika statistik: meninjau sekelompok partikel dengan menggunakan konsep statistik. FI-1101: Teori Kinetik Gas, Hal 2

Ekspansi Termal l Secara umum suatu bahan akan memuai jika dipanaskan dan menyusut jika didinginkan. Akan tetapi pemuaian & penyusutan ini bergantung pada masing-masing bahan. Sifat ini dinyatakan dengan koefisien muai panjang/linier, a, dari bahan tersebut. L 0 T 0 DL T L Jika pada T 0 panjang bahan adalah L 0, maka pada suhu T panjang bahan L dapat dinyatakan sebagai berikut: L = L 0 {1+ a (T-T 0)} FI-1101: Teori Kinetik Gas, Hal 3

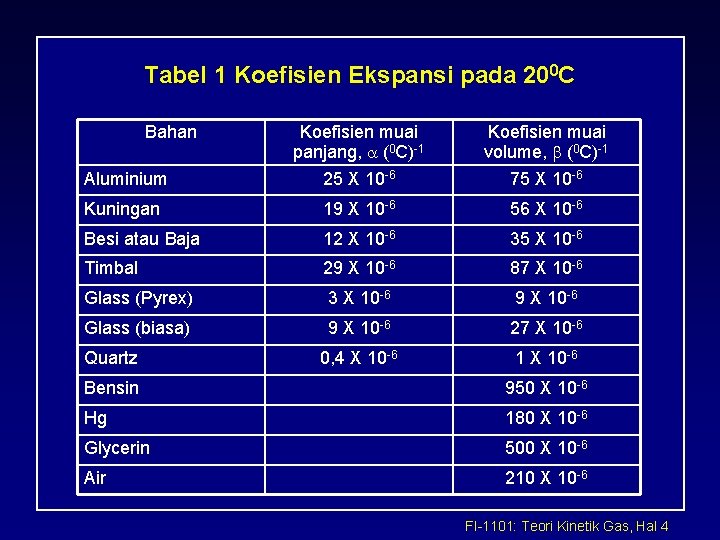
Tabel 1 Koefisien Ekspansi pada 200 C Bahan Aluminium Koefisien muai panjang, a (0 C)-1 25 X 10 -6 Koefisien muai volume, b (0 C)-1 75 X 10 -6 Kuningan 19 X 10 -6 56 X 10 -6 Besi atau Baja 12 X 10 -6 35 X 10 -6 Timbal 29 X 10 -6 87 X 10 -6 Glass (Pyrex) 3 X 10 -6 9 X 10 -6 Glass (biasa) 9 X 10 -6 27 X 10 -6 0, 4 X 10 -6 1 X 10 -6 Quartz Bensin 950 X 10 -6 Hg 180 X 10 -6 Glycerin 500 X 10 -6 Air 210 X 10 -6 FI-1101: Teori Kinetik Gas, Hal 4

Sifat anomali air di bawah 40 C l Secara umum suatu bahan akan memuai jika dipanaskan (selama tidak ada perubahan fase). Akan tetapi air tidak mengikuti pola yang umum. Jika air pada 0 0 C dipanaskan, volumenya akan menyusut sampai mencapai suhu 40 C. Di atas 40 C air akan berperilaku normal, volumenya memuai jika temperaturnya naik. Karenanya air memiliki rapat massa yang paling tinggi pada 40 C. l Sifat air ini sangat penting bagi ketahanan kehidupan air (aquatic life) selama musim dingin. FI-1101: Teori Kinetik Gas, Hal 5

Suhu Mutlak & Hukum-Hukum Mengenai Gas l Volume gas sangat bergantung pada tekanan dan temperatur => penting sekali untuk menentukan hubungan antara volume, tekanan, temperatur, dan massa gas. Hubungan ini biasa disebut sebagai persamaan keadaan (equation of state). l Dalam kajian ini kita hanya akan meninjau keadaan kesetimbangan (equilibrium state) saja, dimana variabel persamaan keadaan sama untuk keseluruhan sistem. Jika keadaan sistem berubah, kita harus menunggu sampai nilainya merata untuk keseluruhan sistem. l Dalam tinjauan ini juga, tekanan gas tidak terlalu tinggi dan temperaturnya jauh dari titik didih. FI-1101: Teori Kinetik Gas, Hal 6

Suhu Mutlak & Hukum-Hukum Mengenai Gas… l Hukum Boyle (Robert Boyle, 1627 - 1691): Volume dari suatu gas adalah berbanding terbalik dengan tekanan yang diberikan jika suhunya dipertahankan tetap. Tekanan disini adalah tekanan mutlak. V ~ 1/P atau PV = konstan (jika T konstan) P V FI-1101: Teori Kinetik Gas, Hal 7

Suhu Mutlak & Hukum-Hukum Mengenai Gas… l Hukum Charles (The Frenchman Jacques Charles, 17461823): Volume dari sejumlah gas berbanding lurus dengan suhu mutlak jika tekanan dipertahankan konstan. V~T (jika P konstan) Suhu mutlak : T (K) = T (0 C) + 273. 15 V V -273. 15 C 0 Suhu (C) 0 K 173 K Suhu (K) FI-1101: Teori Kinetik Gas, Hal 8

Suhu Mutlak & Hukum-Hukum Mengenai Gas… l Hukum Guy-Lussac (Joseph Guy-Lussac 1778 -1850): Pada volume tetap, tekanan gas berbanding lurus dengan suhu mutlak. P~T (jika V konstan) Suhu mutlak : T (K) = T (0 C) + 273. 15 P 0 K 173 K Suhu (K) FI-1101: Teori Kinetik Gas, Hal 9

Gas Ideal l Hukum Boyle, Charles, dan Guy-Lussac mengisyaratkan suatu hubungan umum antara P, V, dan T dari suatu kuantitas gas tertentu: PV ~ T l Selanjutnya kita harus memasukkan pengaruh jumlah gas PV ~ m. T l Kuantitas gas ini dapat dituliskan sebagai mol zat berikut: n (mol) = massa (gram) / massa molekular (gram/mol) l Sehingga persamaan gas di atas dapat ditulis sbb: PV = n. RT FI-1101: Teori Kinetik Gas, Hal 10

Gas Ideal… l Persamaan: PV = n. RT dikenal sebagai persamaan gas ideal, dimana R adalah Konstanta gas umum. R = 8, 315 J / (mol. K) = 0. 0821 (L. atm) / (mol. K) = 1. 99 calories / (mol. K) FI-1101: Teori Kinetik Gas, Hal 11

Gas Ideal… l Hipotesa Avogadro (Amedeo Avogadro, 1776 -1856) mengatakan bahwa gas dengan volume yang sama pada tekanan dan temperatur yang sama mengandung jumlah molekul yang sama. NA = 6. 02 X 1023 NA dikenal sebagai bilangan Avogadro. PV = n. RT = (N/NA) RT PV = Nk. T k = R/ NA = 8. 315 J/(mol. K) / (6. 02 X 1023 /mol) = 1. 38 X 10 -23 J/K k dikenal sebagai Konstanta Boltzmann FI-1101: Teori Kinetik Gas, Hal 12

Teori Kinetik & Interpretasi molekular dari Suhu l 1. 2. 3. 4. 5. 6. 7. Sebagai anggapan dasar bagi pembahasan teori kinetik gas dibuatlah model tentang gas ideal sebagai berikut: Gas ideal terdiri atas partikel yang amat banyak jumlahnya. Partikel-partikel itu tersebar merata dalam seluruh ruang. Partikel-partikel itu senantiasa bergerak secara acak. Jarak antara partikel itu jauh lebih besar dibandingkan ukuran partikel. Tidak ada gaya interaksi antar partikel, kecuali bila partikel bertumbukan. Semua tumbukan bersifat lenting sempurna dan terjadi dalam waktu yang amat singkat. Hukum-hukum Newton tentang gerak tetap berlaku. FI-1101: Teori Kinetik Gas, Hal 13

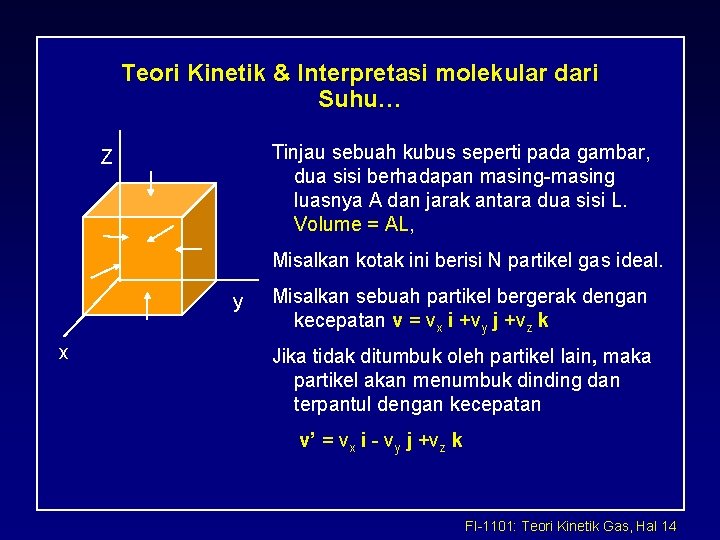
Teori Kinetik & Interpretasi molekular dari Suhu… Tinjau sebuah kubus seperti pada gambar, dua sisi berhadapan masing-masing luasnya A dan jarak antara dua sisi L. Volume = AL, Z Misalkan kotak ini berisi N partikel gas ideal. y x Misalkan sebuah partikel bergerak dengan kecepatan v = vx i +vy j +vz k Jika tidak ditumbuk oleh partikel lain, maka partikel akan menumbuk dinding dan terpantul dengan kecepatan v’ = vx i - vy j +vz k FI-1101: Teori Kinetik Gas, Hal 14

Teori Kinetik & Interpretasi molekular dari Suhu… Perubahan momentum partikel adalah: Dp = mv’ - mv = m ( vx i - vy j + vz k ) – m ( vx i + vy j + vz k ) Dp = - 2 mvy j , dengan m adalah massa partikel Selang waktu antara 2 kali menumbuk dinding adalah Dt = 2 L / vy , Tiap satuan waktu partikel ini memberikan momentum pada dinding kanan sebesar: Dp/Dt = 2 mv 2 y j / 2 L = mv 2 y j / L Karena ada N partikel, masing-masing dengan kecepatan v 1 = vx 1 i +vy 1 j +vz 1 k …… v. N = vx. N i +vy. N j +vz. N k FI-1101: Teori Kinetik Gas, Hal 15

Teori Kinetik & Interpretasi molekular dari Suhu… Maka dalam satuan waktu partikel-partikel itu memberikan perubahan momentum pada dinding kanan sebesar: F = Dp/Dt = (m / L) {v 2 y 1 + v 2 y 2 +… +v 2 y. N } j Tekanan gas pada dinding kanan menjadi: P = Dp/ADt = (m / AL) {v 2 y 1 + v 2 y 2 +… +v 2 y. N } Nilai rata-rata dapat v 2 y dituliskan: <v 2 y > = {v 2 y 1 + v 2 y 2 +… +v 2 y. N } / N Volume = V = AL , sehingga P = m. N <v 2 y > / V FI-1101: Teori Kinetik Gas, Hal 16

Teori Kinetik & Interpretasi molekular dari Suhu… Karena v 2 = v 2 x + v 2 y +v 2 z diperoleh: <v 2 > = <v 2 x > + <v 2 y > + <v 2 z > dan <v 2 x > = <v 2 y > = <v 2 z > sehingga <v 2 > = 3<v 2 y > atau <v 2 y > = 1/3 <v 2 > Dengan demikian tekanan gas ideal menjadi P = (1/3) m. N <v 2 > / V FI-1101: Teori Kinetik Gas, Hal 17

Teori Kinetik & Interpretasi molekular dari Suhu… Tekana gas ideal : P = (1/3) m. N <v 2 > / V dan PV = (1/3) m. N <v 2 > PV = Nk. T Maka temperatur dapat dinyatakan sebagai: T = (1/3) m <v 2 > / k atau T = (2/3 k) {(1/2) (m <v 2 >)} merupakan energi kinetik (translasi) rata-rata gas FI-1101: Teori Kinetik Gas, Hal 18

Energi Dalam Telah ditunjukkan bahwa: T = (2/3 k) {(1/2) (m <v 2 >)} merupakan energi kinetik (translasi) rata-rata gas. Dapat dituliskan bahwa: EK = (3/2) k. T Energi kinetik (EK) translasi rata-rata berbanding langsung dengan temperatur mutlak. Energi total secara keseluruhan dapat dituliskan menjadi N {(1/2) (m <v 2 >)} = (3/2) Nk. T Secara keseluruhan gas tidak bergerak, energi total merupakan energi dalam gas, U. U = (3/2) Nk. T = (3/2) n. RT FI-1101: Teori Kinetik Gas, Hal 19

Energi Dalam… l Besaran U tidak dapat diukur secara langsung dalam eksperimen, yang dapat diukur adalah turunannya, yakni kapasitas panas pada volume tetap, CV, walaupun sukar. Yang biasa diukur adalah , Cp adalah kapasitas l panas/kalor pada tekanan tetap. l Dalam termodinamika klasik, untuk gas ideal Cp – Cv = n. R Sehingga diperoleh l FI-1101: Teori Kinetik Gas, Hal 20

Energi Dalam… l Atau Cp = Cv + n. R =(5/2) n. R Sehingga diperoleh: Apakah hasil ini cocok dengan eksperimen? FI-1101: Teori Kinetik Gas, Hal 21

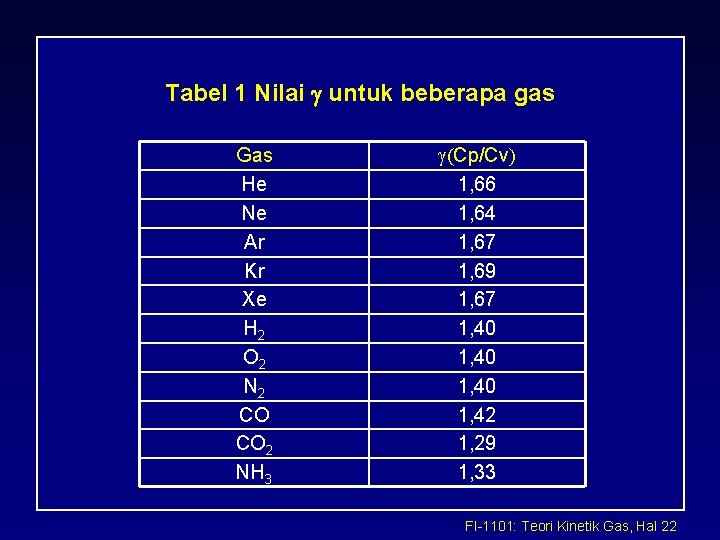
Tabel 1 Nilai g untuk beberapa gas Gas He Ne Ar Kr Xe H 2 O 2 N 2 CO CO 2 NH 3 g(Cp/Cv) 1, 66 1, 64 1, 67 1, 69 1, 67 1, 40 1, 42 1, 29 1, 33 FI-1101: Teori Kinetik Gas, Hal 22

Prinsip Ekipartisi Energi l l l Telah kita lihat ketidaksesuaian antara teori & hasil eksperimen untuk kapasitas kalor pada gas yang bukan beratom tunggal. Pada gas beratom banyak pengaruh energi rotasi dan energi vibrasi harus diperhitungkan. Dengan menggunakan distribusi Maxwell-Boltzmann diperoleh energi rata-rata molekul sebagai berikut: E = Et + Er + Ev = (3/2)k. T + (2/2)k. T = (7/2) k. T Energi rata-rata translasi (3/2)k. T karena ada 3 derajat kebebasan (x, y, z), energi rata-rata rotasi (2/2)k. T karena ada 2 derajat kebebasan, energi rata-rata vibrasi (2/2)k. T karena ada 2 derajat kebebasan Secara umum setiap derajat kebebasan menghasilkan energi rata-rata (1/2)k. T. Prinsip ini dikenal sebagai prinsip ekipartisi energi (asas pembagian merata energi). FI-1101: Teori Kinetik Gas, Hal 23

Prinsip Ekipartisi Energi…. . l Dari hasil di atas diperoleh U = (7/2) Nk. T = (7/2) n. RT l Atau Cv = (7/2) n. R Cp = Cv + n. R =(9/2) n. R Sehingga diperoleh: g = (9/7) = 1, 29 Ternyata masih tidak cocok dengan eksperimen? Teori klasik tidak bisa menjawabnya. FI-1101: Teori Kinetik Gas, Hal 24

Review : Teori Kinetik Gas & Interpretasi molekular dari Suhu Tekanan gas ideal : P = (1/3) m. N <v 2 > / V dan PV = (1/3) m. N <v 2 > PV = Nk. T Maka temperatur dapat dinyatakan sebagai: T = (1/3) m <v 2 > / k atau T = (2/3 k) {(1/2) (m <v 2 >)} merupakan energi kinetik (translasi) rata-rata gas FI-1101: Teori Kinetik Gas, Hal 25
 Fi1101
Fi1101 Soal dan pembahasan teori kinetik gas
Soal dan pembahasan teori kinetik gas Teori kinetik gas
Teori kinetik gas Contoh soal pilihan ganda dan jawaban teori kinetik gas
Contoh soal pilihan ganda dan jawaban teori kinetik gas Teori kinetik gas adalah
Teori kinetik gas adalah Soal teori kinetik gas
Soal teori kinetik gas Teori kinetik gas
Teori kinetik gas Peta konsep teori kinetik gas
Peta konsep teori kinetik gas Struktur zarah subatom
Struktur zarah subatom Contoh kontrak kuliah teori ekonomi mikro
Contoh kontrak kuliah teori ekonomi mikro Ideal gas vs perfect gas
Ideal gas vs perfect gas Poisonous gas leaked in bhopal gas tragedy
Poisonous gas leaked in bhopal gas tragedy Ideal gas vs perfect gas
Ideal gas vs perfect gas Gas leaked in bhopal gas tragedy
Gas leaked in bhopal gas tragedy Bhopal gas tragedy causes
Bhopal gas tragedy causes Difference between ideal gas and real gas
Difference between ideal gas and real gas Imaginary gas
Imaginary gas Volume molare
Volume molare Contoh soal kinetika kimia orde 1
Contoh soal kinetika kimia orde 1 Differences between ideal gas and real gas
Differences between ideal gas and real gas Flue gas desulfurisation gas filter
Flue gas desulfurisation gas filter Gas exchange key events in gas exchange
Gas exchange key events in gas exchange Energi kinetik
Energi kinetik Usaha dan energi fisika
Usaha dan energi fisika Sonucu
Sonucu Kinetik enerji formülü
Kinetik enerji formülü