KOMPETENSI KIMIA KELAS XII 1 2 3 4










- Slides: 14

KOMPETENSI KIMIA KELAS XII 1. 2. 3. 4. Mengidentifikasi faktor-faktor yang memengaruhi laju reaksi Menjelaskan sistem klasifikasi dan kegunaan polimer Memahami koloid, suspensi, dan larutan sejati Melakukan pemisahan dan analisis

Standar Kompetensi : Mengidentifikasi faktor-faktor yang memengaruhi laju reaksi Kompetensi Dasar : 1. Menentukan laju reaksi dan orde reaksi 2. Menjelaskan faktor-faktor yang memengaruhi laju reaksi

LAJU REAKSI Bab ini akan membahas kinetika reaksi dan faktor-faktor yang memengaruhinya. Adapun tujuan mempelajari bab ini siswa dapat; Menjelaskan pengertian laju reaksi. Menerangkan faktor-faktor yang memengaruhi laju reaksi. Menjelaskan terjadinya laju reaksi berdasarkan teori tumbukan. Menjelaskan persamaan

KONSEP LAJU REAKSI Kamu pasti masih ingat, reaksi kimia merupakan proses perubahan zat pereaksi (reaktan) menjadi hasil reaksi (produk). Seperti kebakaran hutan. Prosesnya melibatkan tumbuhan dan oksigen (reaktan)menjadi abu dan asap (produk). Semakin berkurang reaktan maka produknya semakin banyak. Pengurangan konsentrasi pereaksi atau pertambahan zat produk persatuan waktu disebut laju reaksi

FAKTOR –FAKTOR YANG MEMPENGARUHI LAJU REAKSI KEMBALI

TEORI TUMBUKAN Terjadinya tumbukan efektif ditentukan oleh 2 faktor, yaitu energi kinetik partikel dan arah atau orientasi partikel yang saling bertumbukan.

Arah Partikel yang Bertumbukan Tumbukan efektif akan terjadi jika partikel zat pereaksi atau reaktan saling bertumbukan dengan arah yang tepat. Misalnya dalam industri, kokas (C) direaksikan dengan uap air (H 2 O) untuk memproduksi gas CO. C(kokas) + H 2 O (g) CO (g) + H 2 (g) a H O C C H O HH b C C H H O O H H Arah Tumbukan Partikel (a) arah tumbukan antar partikel pereaksinya tepat, sehingga menghasilkan tumbukan efektif dan terjadi produk reaksi CO dan H 2, (b) arah tumbukan antar partikel zat pereaksinya tidak tepat sehingga tidak menghasilkan tumbukan efektif.

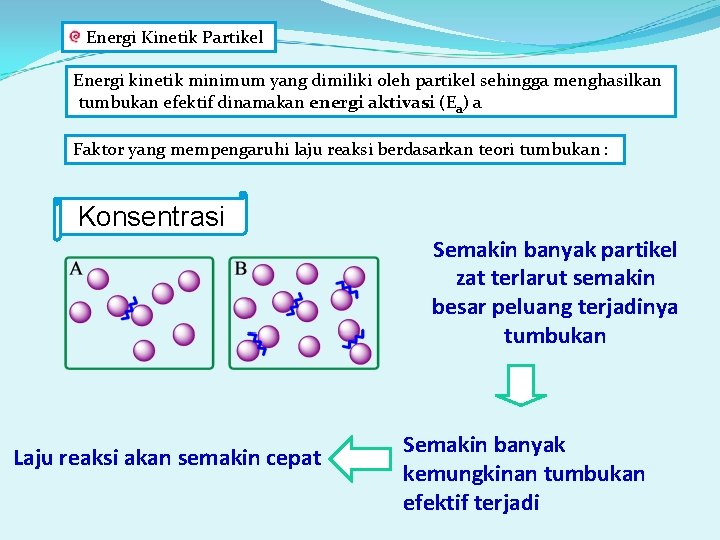
Energi Kinetik Partikel Energi kinetik minimum yang dimiliki oleh partikel sehingga menghasilkan tumbukan efektif dinamakan energi aktivasi (Ea) a Faktor yang mempengaruhi laju reaksi berdasarkan teori tumbukan : Konsentrasi Semakin banyak partikel zat terlarut semakin besar peluang terjadinya tumbukan Laju reaksi akan semakin cepat Semakin banyak kemungkinan tumbukan efektif terjadi

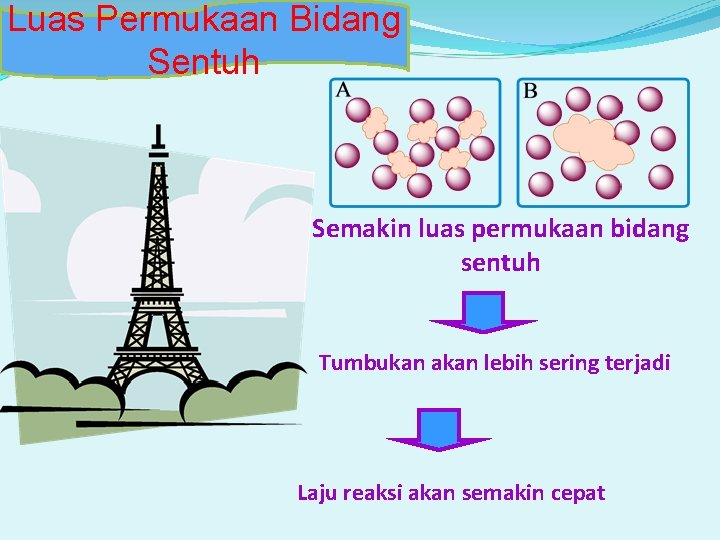
Luas Permukaan Bidang Sentuh Semakin luas permukaan bidang sentuh Tumbukan akan lebih sering terjadi Laju reaksi akan semakin cepat

Suhu Semakin tinggi suhu reaksinya Semakin cepat gerak molekulnya Semakin besar energi kinetik yg dimiliki molekul Laju reaksinya semakin cepat

Katalis hanya mampu mempercepat reaksi dan bereaksi spesifik Zat yang dapat mempercepat reaksi, tapi ia tidak ikut bereaksi, sehingga akan diperoleh kembali pada akhir reaksi. Katalis hanya mampu mempercepat reaksi , hanya bereaksi untuk satu reaksi saja.

PERSAMAAN LAJU REAKSI DAN ORDE REAKSI reaksi : m. A + n. B p. C + q. D maka bentuk persamaan laju reaksinya pada suhu (T) tetap dapat ditulis sebagai : v = k [A]x [B]y dimana : v = laju reaksi k = tetapan laju reaksi x = orde reaksi terhadap pereaksi A y = orde reaksi terhadap pereaksi B

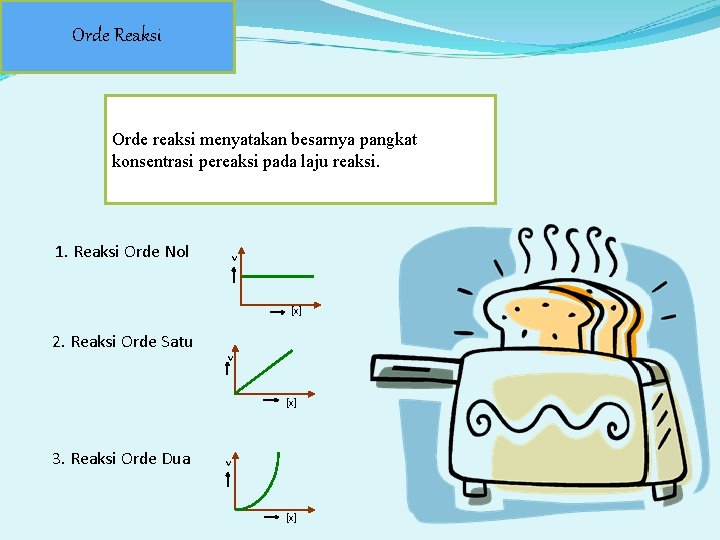
Orde Reaksi Orde reaksi menyatakan besarnya pangkat konsentrasi pereaksi pada laju reaksi. 1. Reaksi Orde Nol v [x] 2. Reaksi Orde Satu v [x] 3. Reaksi Orde Dua v [x]

SEKIAN dan TERIMA KASIH KELOMPOK KIMIA SMK Koordinator : Drs. Maman Tasman Anggota 1. Asma Farida 2. Majangkumalo 3. Hermawan
 Integral substitusi
Integral substitusi Materi kelas 12 semester 1
Materi kelas 12 semester 1 Materi kelas xii semester 1
Materi kelas xii semester 1 Modul agama katolik kelas 12
Modul agama katolik kelas 12 Kompetensi inti dan kompetensi dasar
Kompetensi inti dan kompetensi dasar Pertanyaan tentang kompetensi inti dan kompetensi dasar
Pertanyaan tentang kompetensi inti dan kompetensi dasar Jenis kompetensi berdasarkan strata kompetensi
Jenis kompetensi berdasarkan strata kompetensi Kompetensi dasar ips
Kompetensi dasar ips Hubungan kompetensi inti kompetensi dasar dan indikator
Hubungan kompetensi inti kompetensi dasar dan indikator Materi penyepuhan logam
Materi penyepuhan logam Peta konsep hukum dasar kimia kelas 10
Peta konsep hukum dasar kimia kelas 10 Flamabel
Flamabel Turunan alkana kelas 12
Turunan alkana kelas 12 Materi kimia kelas 12 semester 1 sifat koligatif larutan
Materi kimia kelas 12 semester 1 sifat koligatif larutan Kompetensi dasar fisika kelas 11
Kompetensi dasar fisika kelas 11



























