TECNICHE OTTICHE o SPETTROSCOPICHE Il passaggio della luce





























- Slides: 58

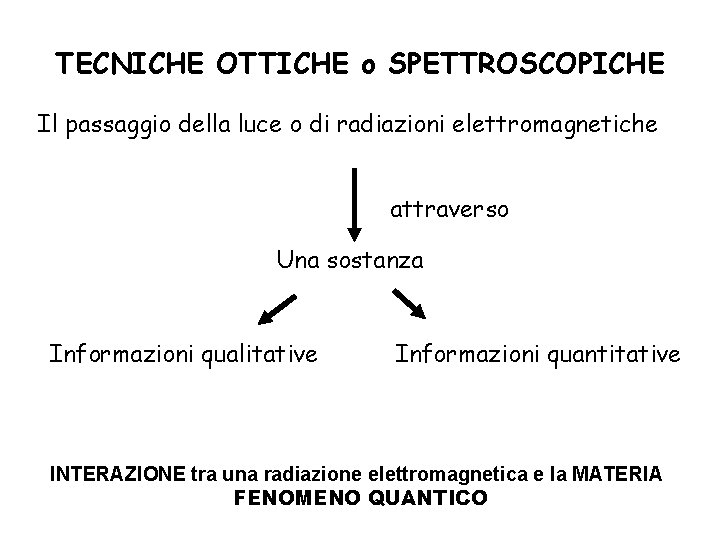
TECNICHE OTTICHE o SPETTROSCOPICHE Il passaggio della luce o di radiazioni elettromagnetiche attraverso Una sostanza Informazioni qualitative Informazioni quantitative INTERAZIONE tra una radiazione elettromagnetica e la MATERIA FENOMENO QUANTICO

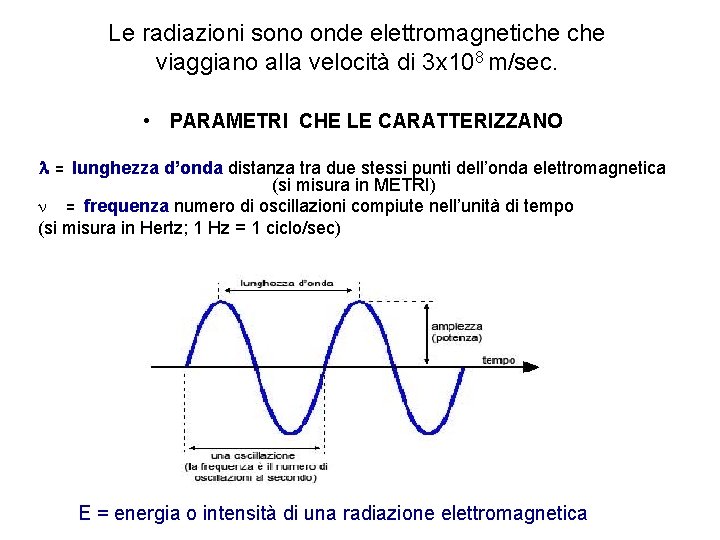
Le radiazioni sono onde elettromagnetiche viaggiano alla velocità di 3 x 108 m/sec. • PARAMETRI CHE LE CARATTERIZZANO l = lunghezza d’onda distanza tra due stessi punti dell’onda elettromagnetica (si misura in METRI) n = frequenza numero di oscillazioni compiute nell’unità di tempo (si misura in Hertz; 1 Hz = 1 ciclo/sec) E = energia o intensità di una radiazione elettromagnetica

• La lunghezza d’onda ( l ) e la sua frequenza ( n ) sono grandezze tra loro inversamente proporzionali: ln=C C = la velocità di propagazione dipende dal mezzo ed è massima nel vuoto Il suo valore è di circa 3 x 108 m/sec Per una qualsiasi radiazione è necessario conoscere solo uno dei due parametri per poter ricavare anche l’altro. E=n l elevata energia Elevata lunghezza d’onda ed bassa frequenza: bassa energia Radiazioni a bassa lunghezza d’onda e ad elevata frequenza:

Lunghezza d’onda SPETTRO DELLE RADIAZIONI ELETTROMAGNETICHE Nella regione del VISIBILE: radiazioni che possono essere percepite dall’occhio umano Radiazioni a bassa lunghezza d’onda e ad elevata frequenza: elevata energia Elevata lunghezza d’onda ed a bassa frequenza: bassa energia

λ> Bassa Energia Le radiazioni elettromagnetiche riusciamo a "vedere" sono solo una piccolissima parte dello spettro elettromagnetico

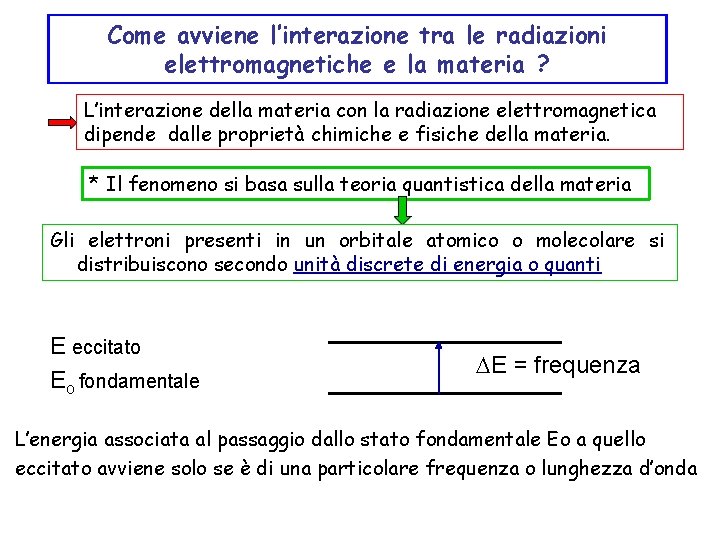
Come avviene l’interazione tra le radiazioni elettromagnetiche e la materia ? L’interazione della materia con la radiazione elettromagnetica dipende dalle proprietà chimiche e fisiche della materia. * Il fenomeno si basa sulla teoria quantistica della materia Gli elettroni presenti in un orbitale atomico o molecolare si distribuiscono secondo unità discrete di energia o quanti E eccitato Eo fondamentale DE = frequenza L’energia associata al passaggio dallo stato fondamentale Eo a quello eccitato avviene solo se è di una particolare frequenza o lunghezza d’onda

Interazioni tra una radiazione elettromagnetica e la materia SI VERIFICANO TRANSIZIONI ELETTRONICHE associabili ALLE DIVERSE RADIAZIONI ELETTROMAGNETICHE La radiazione incidente provoca transizioni elettroniche con assorbimento della radiazione: questo tipo di interazione è utilizzata dalle tecniche spettroscopiche La radiazione incidente è associata ad un processo interno che causa emissione di radiazione: questo tipo di interazione è utilizzata nella spettroscopia di luminescenza

La spettroscopia atomica o molecolare in seguito a transizioni che si verificano a livello atomico e molecolare • Considera l’energia delle radiazioni elettromagnetiche viene assorbita: SPETTROSCOPIA DI ASSORBIMENTO • Oppure quella parte dell’energia delle radiazioni elettromagnetiche viene emessa: SPETTROSCOPIA DI EMISSIONE

Sulla base delle diverse radiazioni elettromagnetiche avremo: • spettroscopia rotazionale (onde radio) • spettroscopia vibrazionale (infrarosso) • spettroscopia molecolare (visibile e ultravioletto) • spettroscopia atomica (raggi X)

LA TECNICA SPETTROSCOPICA CONSENTE AI CHIMICI DI OTTENERE INFORMAZIONI QUALI-QUANTITATIVE Le tecniche spettroscopiche sono basate sullo scambio di energia che si verifica fra l’energia radiante e la materia SPETTROFOTOMETRIA DI ASSORBIMENTO assorbimento delle radiazioni luminose della regione dello spettro elettromagnetico appartenenti al campo del visibile (350 – 750 nm) e del vicino ultravioletto (200– 350 nm)

SPETTROSCOPIA DI ASSORBIMENTO Quando una radiazione elettromagnetica attraversa una sostanza, provocherà una transizione elettronica e la radiazione emergente dalla sostanza avrà una intensità più bassa I 0 = Intensità radiazione incidente • IR = “ “ riflessa • IA = “ “ assorbita • IT = “ “ trasmessa I 0 = IR + IA + IT Nelle soluzioni: I 0 = IA + IT IL SOLUTO è responsabile dell’assorbimento

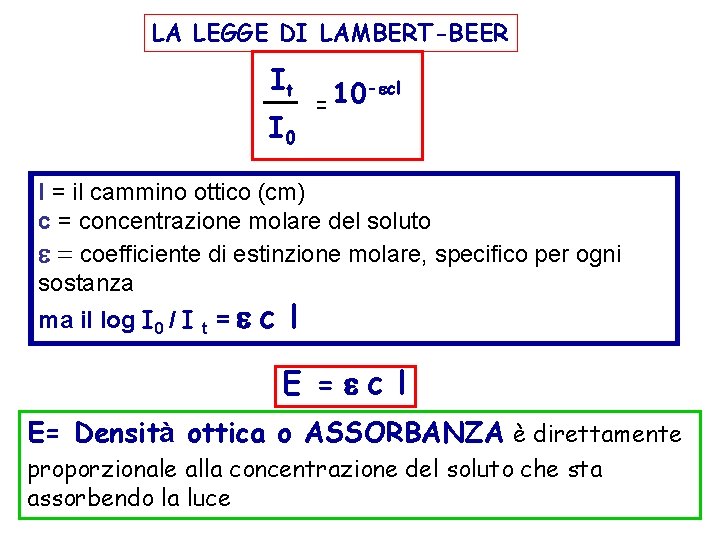
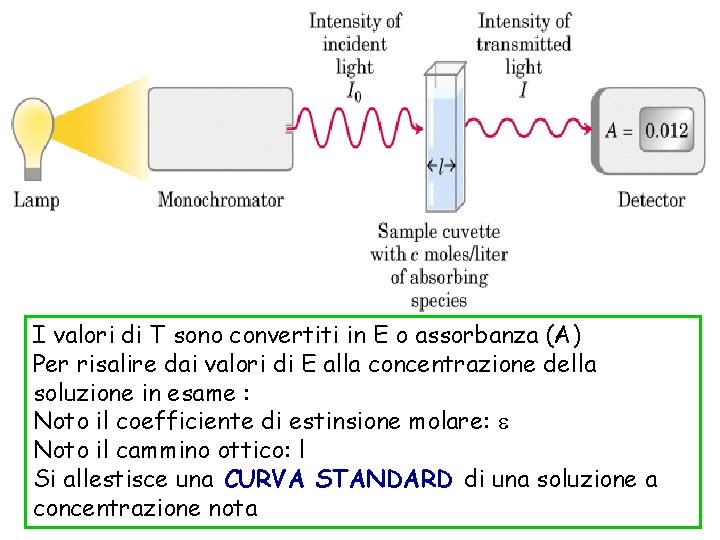
LA LEGGE DI LAMBERT-BEER It I 0 -ecl 10 = l = il cammino ottico (cm) c = concentrazione molare del soluto e = coefficiente di estinzione molare, specifico per ogni sostanza ma il log I 0 / I t = e c l E =ec l E= Densità ottica o ASSORBANZA è direttamente proporzionale alla concentrazione del soluto che sta assorbendo la luce

• e= coefficiente di estinsione molare Rappresenta quella densità ottica di una soluzione in cui la concentrazione = 1 (c = 1) ed il cammino ottico è unitario (l = 1) It I 0 -ecl 10 = E = εc l La legge di Lambert-Beer consente di calcolare facilmente la concentrazione di una soluzione dalla misura dell’intensità della radiazione trasmessa It quando è nota: l’intensità della luce incidente I 0 , e ed il cammino ottico (l)

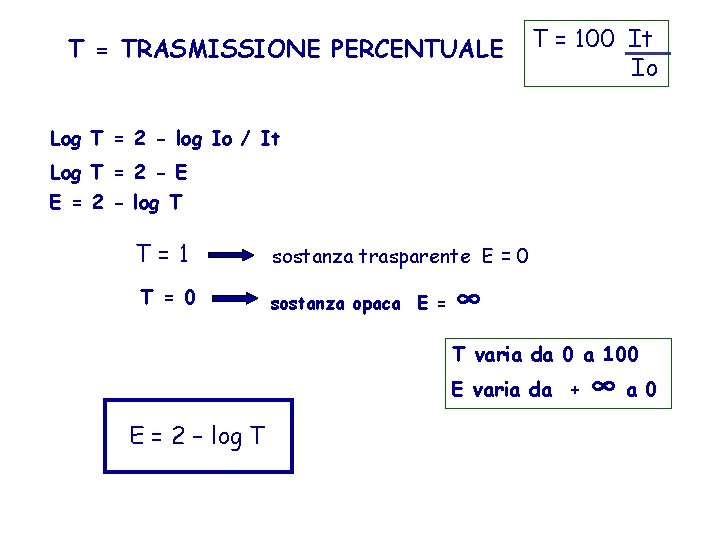
T = TRASMISSIONE PERCENTUALE T = 100 It Io Log T = 2 - log Io / It Log T = 2 - E E = 2 - log T T=1 T = 0 sostanza trasparente E = 0 sostanza opaca E = ∞ T varia da 0 a 100 E varia da + E = 2 – log T ∞a 0

Spettrofotometri UV-VISIBILE, i tipi più comuni sono il “monoraggio” e il “doppio raggio”: 1) SORGENTE DI RADIAZIONE 2) SELEZIONATORE DI LUNGHEZZE D’ONDA: MONOCROMATORE 3) CELLA o Cuvetta (contenitore campione) 4) RIVELATORE 5) LETTORE


Sorgenti di radiazioni per spettroscopia nel visibile ed ultravioletto Ad incandescenza (compresa tra 350 -750 nm) adatta solo per il visibile Ad idrogeno (compresa tra 200 -400 nm) adatta solo per ultravioletto

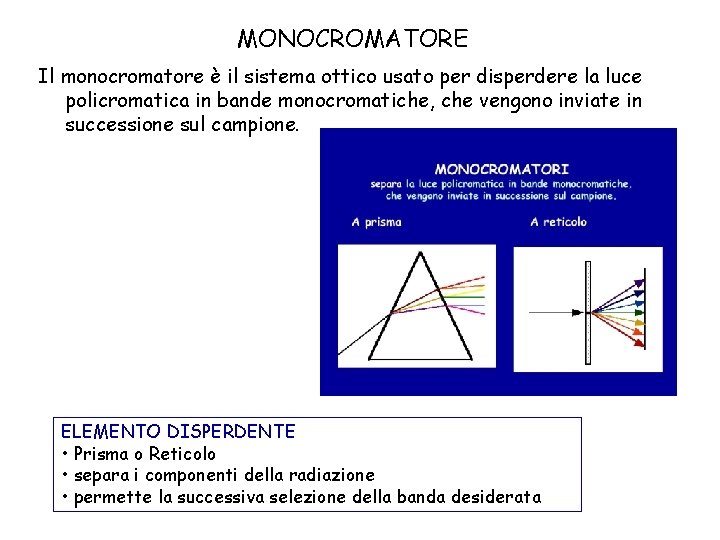
MONOCROMATORE Il monocromatore è il sistema ottico usato per disperdere la luce policromatica in bande monocromatiche, che vengono inviate in successione sul campione. ELEMENTO DISPERDENTE • Prisma o Reticolo • separa i componenti della radiazione • permette la successiva selezione della banda desiderata

CUVETTE Sono i contenitori dei campioni da analizzare Ø Cammino ottico calibrato (1 cm) Ø Volume diverso Ø Materiale diverso: ü Quarzo per UV e visibile ü Vetro o plastica solo per il visibile

PORTACUVETTE dove inserire il campione

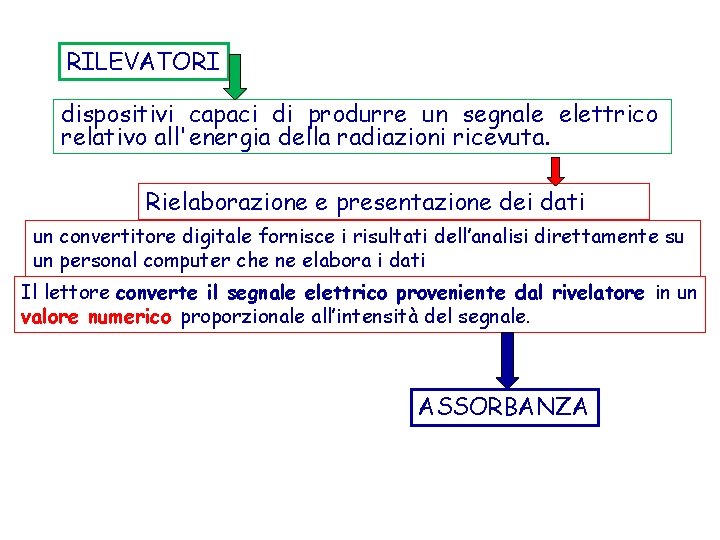
RILEVATORI dispositivi capaci di produrre un segnale elettrico relativo all'energia della radiazioni ricevuta. Rielaborazione e presentazione dei dati un convertitore digitale fornisce i risultati dell’analisi direttamente su un personal computer che ne elabora i dati Il lettore converte il segnale elettrico proveniente dal rivelatore in un valore numerico proporzionale all’intensità del segnale. ASSORBANZA

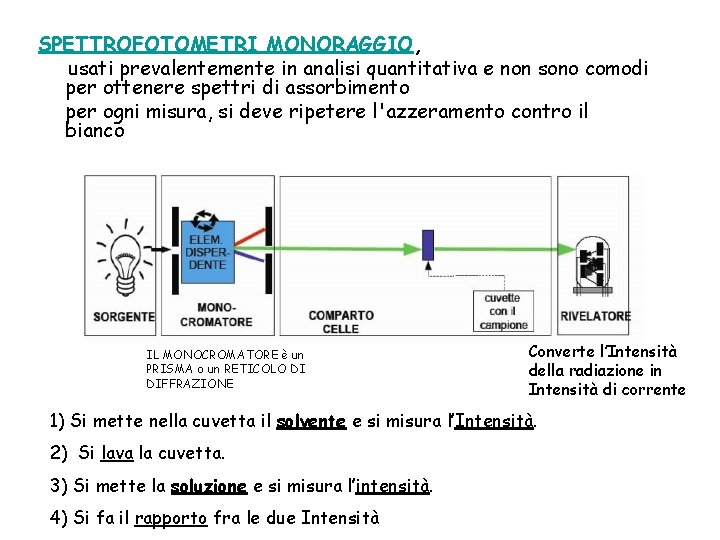
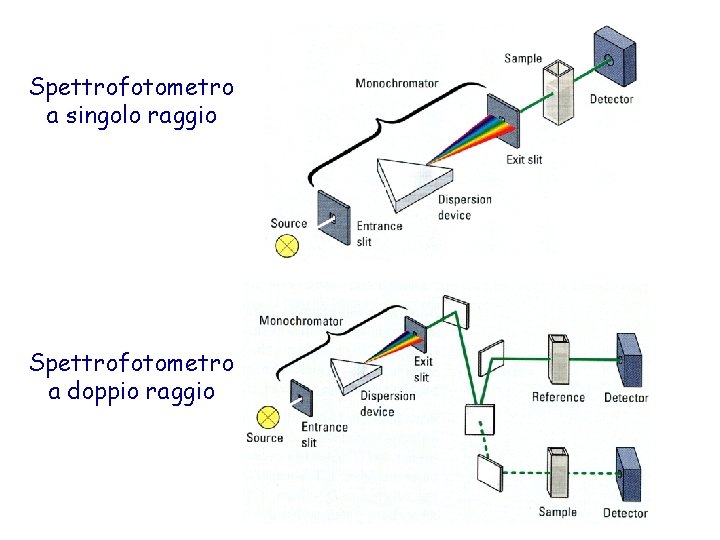
SPETTROFOTOMETRI MONORAGGIO, usati prevalentemente in analisi quantitativa e non sono comodi per ottenere spettri di assorbimento per ogni misura, si deve ripetere l'azzeramento contro il bianco IL MONOCROMATORE è un PRISMA o un RETICOLO DI DIFFRAZIONE Converte l’Intensità della radiazione in Intensità di corrente 1) Si mette nella cuvetta il solvente e si misura l’Intensità. 2) Si lava la cuvetta. 3) Si mette la soluzione e si misura l’intensità. 4) Si fa il rapporto fra le due Intensità

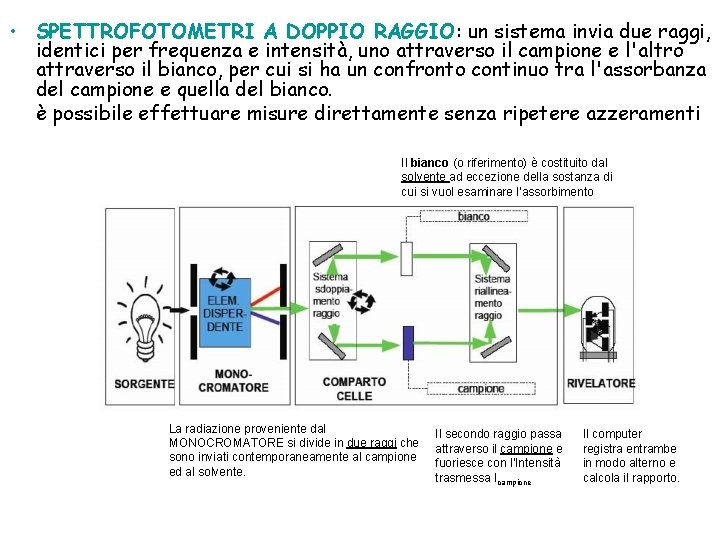
• SPETTROFOTOMETRI A DOPPIO RAGGIO: un sistema invia due raggi, identici per frequenza e intensità, uno attraverso il campione e l'altro attraverso il bianco, per cui si ha un confronto continuo tra l'assorbanza del campione e quella del bianco. è possibile effettuare misure direttamente senza ripetere azzeramenti Il bianco (o riferimento) è costituito dal solvente ad eccezione della sostanza di cui si vuol esaminare l’assorbimento La radiazione proveniente dal MONOCROMATORE si divide in due raggi che sono inviati contemporaneamente al campione ed al solvente. Il secondo raggio passa attraverso il campione e fuoriesce con l’Intensità trasmessa Icampione Il computer registra entrambe in modo alterno e calcola il rapporto.

Spettrofotometro a singolo raggio Spettrofotometro a doppio raggio

ASSORBANZA L’assorbanza è il logaritmo negativo della trasmittanza E = 2 -log (T) E = e cl Secondo la legge di Lambert–Beer l’assorbanza E è proporzionale alla concentrazione del soluto, per cui più elevata è la concentrazione delle molecole che passano dallo stato fondamentale a quello eccitato, maggiore sarà l’assorbanza

FOTOMETRIA I valori di T sono convertiti in E o assorbanza (A) Per risalire dai valori di E alla concentrazione della soluzione in esame : Noto il coefficiente di estinsione molare: e Noto il cammino ottico: l Si allestisce una CURVA STANDARD di una soluzione a concentrazione nota

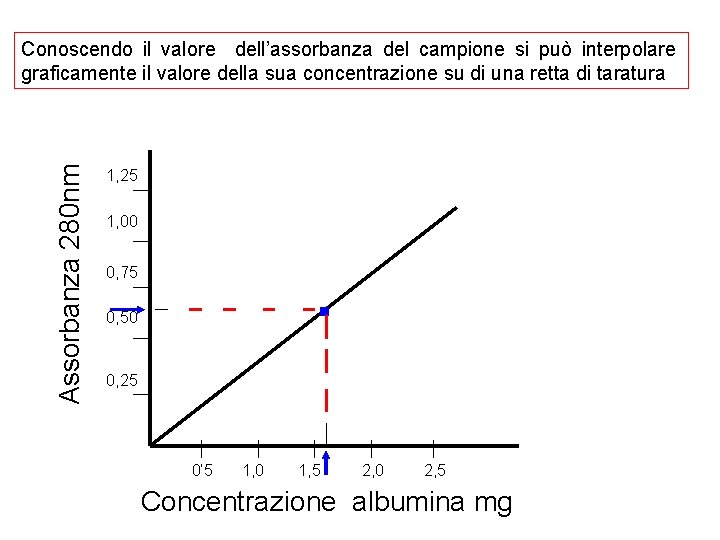
Assorbanza 280 nm Conoscendo il valore dell’assorbanza del campione si può interpolare graficamente il valore della sua concentrazione su di una retta di taratura 1, 25 1, 00 . 0, 75 0, 50 0, 25 0’ 5 1, 0 1, 5 2, 0 2, 5 Concentrazione albumina mg

METODI COLORIMETRICI PER IL DOSAGGIO DELLE PROTEINE METODO DI LOWRY: Il metodo si basa sulla REAZIONE DEL BIURETO : - i legami peptidici reagiscono con gli ioni Cu 2+ del reagente di Folin-Ciocalteau, si sviluppa un colore BLU-PORPORA proporzionale alla concentrazione delle proteine, si misura l’assorbanza a 660 nm METODO DI BRADFORD Il colorante Coomasie Blue forma composti colorati in "blu" con le proteine, tramite legami elettrostatici proteinagruppi sulfonici del colorante in soluzione acida. Quando è legato alla proteina ha un massimo a 595 nm. Stabile da 5’ ad 1 hr

Il massimo dell’assorbimento dipende dai gruppi funzionali presenti nelle molecole ed identifica LO SPETTRO DI ASSORBIMENTO Lo studio delle radiazioni assorbite da una sostanza (SPETTRO DI ASSORBIMENTO) può essere utilizzato A SCOPO ANALITICO

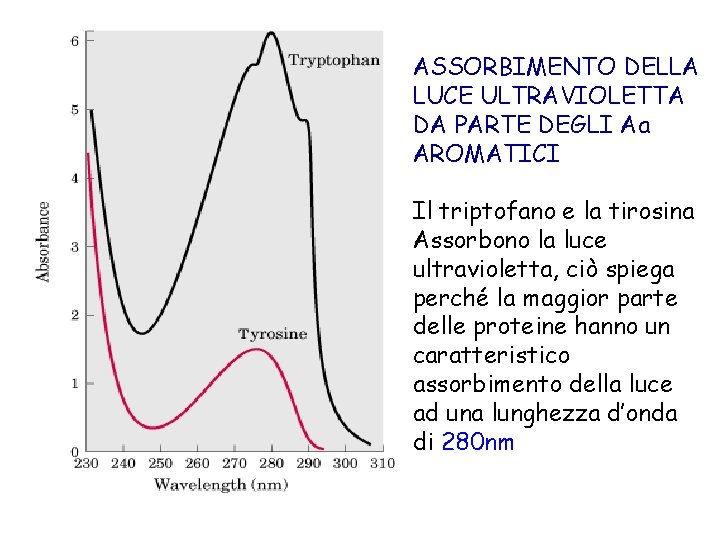
ASSORBIMENTO DELLA LUCE ULTRAVIOLETTA DA PARTE DEGLI Aa AROMATICI Il triptofano e la tirosina Assorbono la luce ultravioletta, ciò spiega perché la maggior parte delle proteine hanno un caratteristico assorbimento della luce ad una lunghezza d’onda di 280 nm

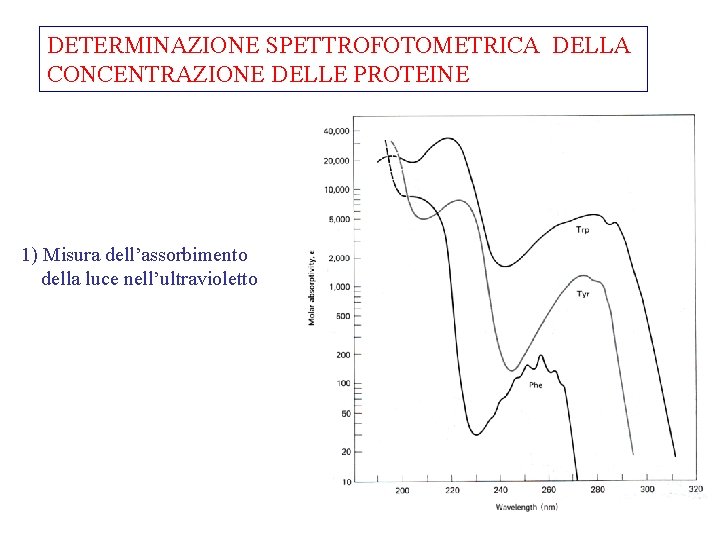
DETERMINAZIONE SPETTROFOTOMETRICA DELLA CONCENTRAZIONE DELLE PROTEINE 1) Misura dell’assorbimento della luce nell’ultravioletto

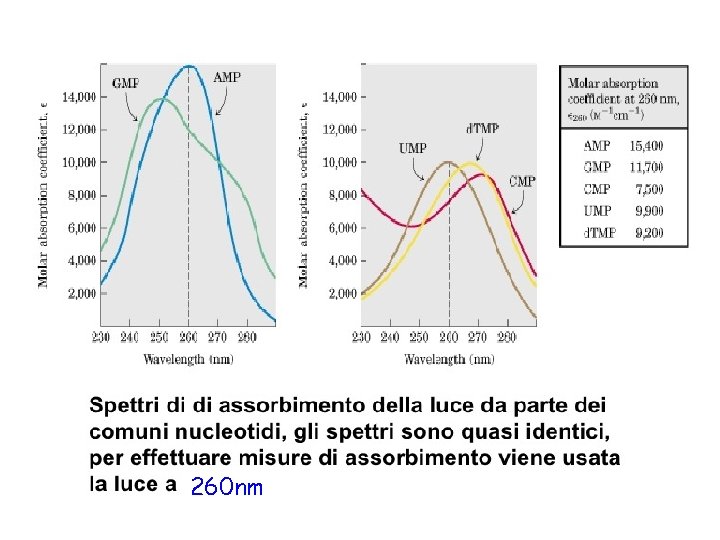
260 nm

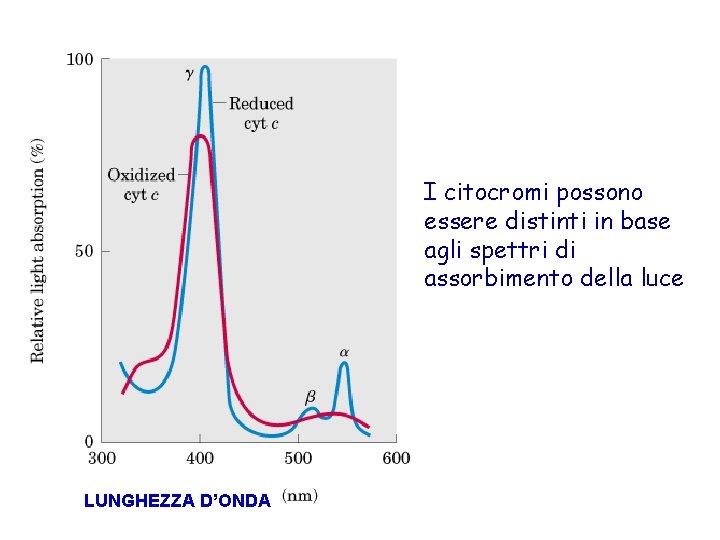
I citocromi possono essere distinti in base agli spettri di assorbimento della luce LUNGHEZZA D’ONDA

Dosaggio degli acidi nucleici 1) Metodo spettrofotometrico (spettroscopia nell’ultravioletto) 2) Metodo fluorimetrico 3) Metodo colorimetrico (spettroscopia nel visibile)

SPETTROFOTOMETRIA DI ASSORBIMENTO assorbimento delle radiazioni luminose della regione dello spettro elettromagnetico appartenenti al campo del visibile (350 – 700 nm) e del vicino ultravioletto (200– 350 nm) • METODI DIRETTI • Sfruttano le proprietà ottiche delle molecole analizzate PROTEINE = 280 nm ACIDI NUCLEICI = 260 nm • METODI INDIRETTI

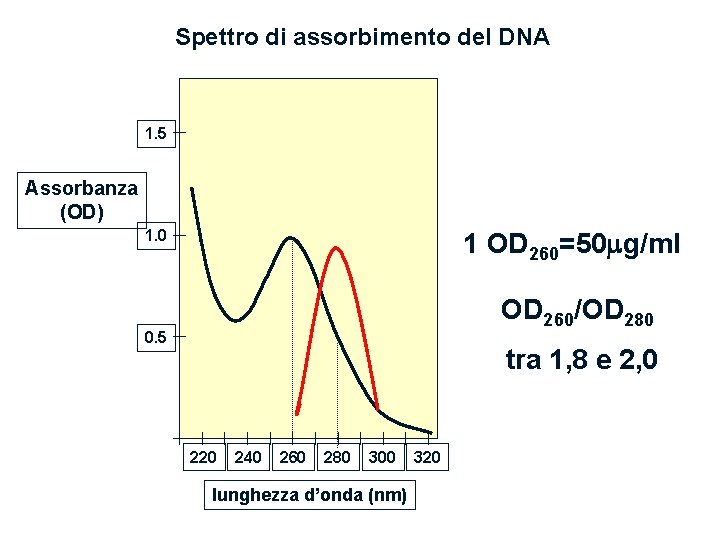
COME DETERMINARE LA PUREZZA E LA CONCENTRAZIONE DI UN ACIDO NUCLEICO • • lettura spettrofotometrica a 260 nm 1 OD = 50 mg/ml di DNA 1 OD = 40 mg/ml di RNA Il rapporto tra le OD misurate a 260 nm e 280 nm fornisce una indicazione della purezza dell’acido nucleico esaminato Una soluzione di DNA o RNA puro dovrebbe avere un rapporto A 260/A 280 di 1, 8 - 2, 0 NOTA. Un picco di assorbimento a 270 nm indica presenza di fenolo, eliminabile con un lavaggio con etere etilico

Spettro di assorbimento del DNA 1. 5 Assorbanza (OD) 1. 0 1 OD 260=50 g/ml OD 260/OD 280 0. 5 tra 1, 8 e 2, 0 220 240 260 280 300 lunghezza d’onda (nm) 320

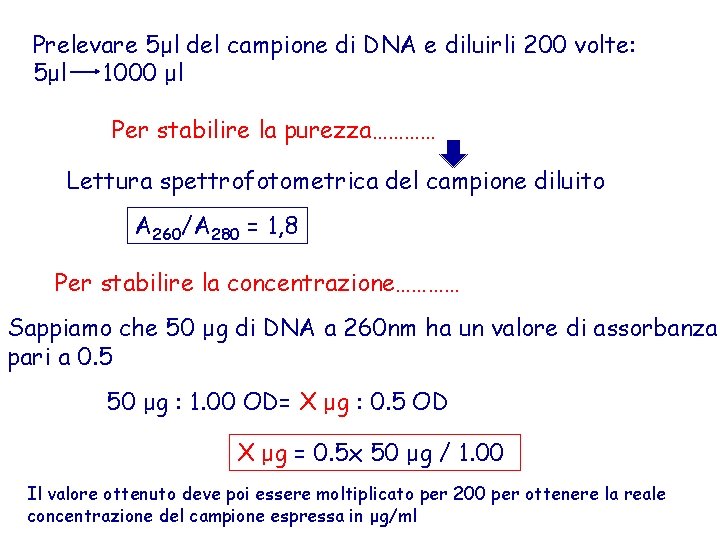
Prelevare 5μl del campione di DNA e diluirli 200 volte: 5μl 1000 μl Per stabilire la purezza………… Lettura spettrofotometrica del campione diluito A 260/A 280 = 1, 8 Per stabilire la concentrazione………… Sappiamo che 50 μg di DNA a 260 nm ha un valore di assorbanza pari a 0. 5 50 μg : 1. 00 OD= X μg : 0. 5 OD X μg = 0. 5 x 50 μg / 1. 00 Il valore ottenuto deve poi essere moltiplicato per 200 per ottenere la reale concentrazione del campione espressa in μg/ml

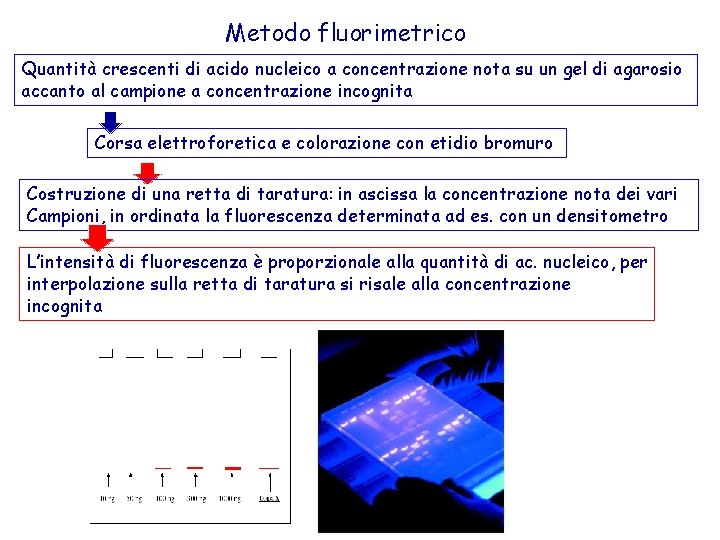
Metodo fluorimetrico Quantità crescenti di acido nucleico a concentrazione nota su un gel di agarosio accanto al campione a concentrazione incognita Corsa elettroforetica e colorazione con etidio bromuro Costruzione di una retta di taratura: in ascissa la concentrazione nota dei vari Campioni, in ordinata la fluorescenza determinata ad es. con un densitometro L’intensità di fluorescenza è proporzionale alla quantità di ac. nucleico, per interpolazione sulla retta di taratura si risale alla concentrazione incognita

Metodo colorimetrico Difenilammina (DFA) per il DNA - reazione specifica Forma un complesso di colore celeste in ambiente acido Lettura delle OD allo spettrofotometro ad una lunghezza d’onda di 595 nm Saggio con l'orcinolo per il dosaggio dell'RNA Forma un complesso verde-azzurro Lettura delle OD allo spettrofotometro ad una lunghezza d’onda di 660 nm


APPLICAZIONI DELLA SPETTROFOTOMETRIA • Analisi quantitatitiva: Ø Misura della concentrazione di molecole che assorbono la luce come le proteine e gli acidi nucleici Ø Studio delle interazioni delle macromolecole (DNA o proteine) con ligandi o altre macromolecole Ø Studio delle cinetiche di reazione (cinetica enzimatica) • Analisi qualitativa: identificazione di classi di composti, sia in forma pura che in preparati biologici. • Identificazione di intermedi di reazione.

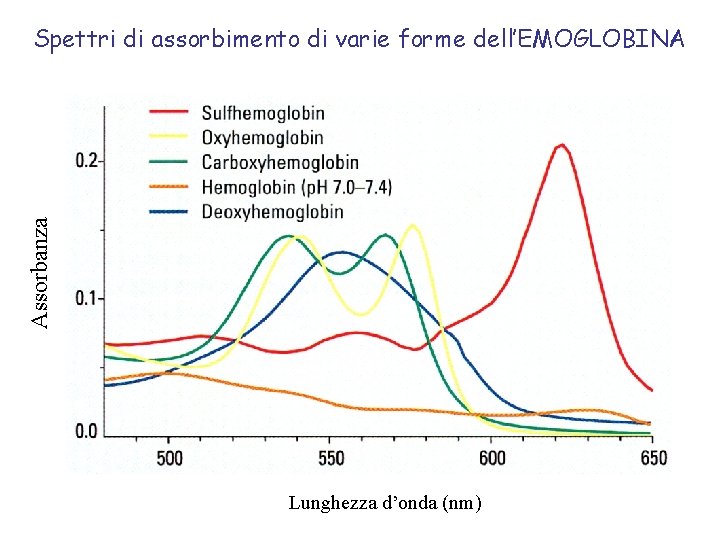
Assorbanza Spettri di assorbimento di varie forme dell’EMOGLOBINA Lunghezza d’onda (nm)

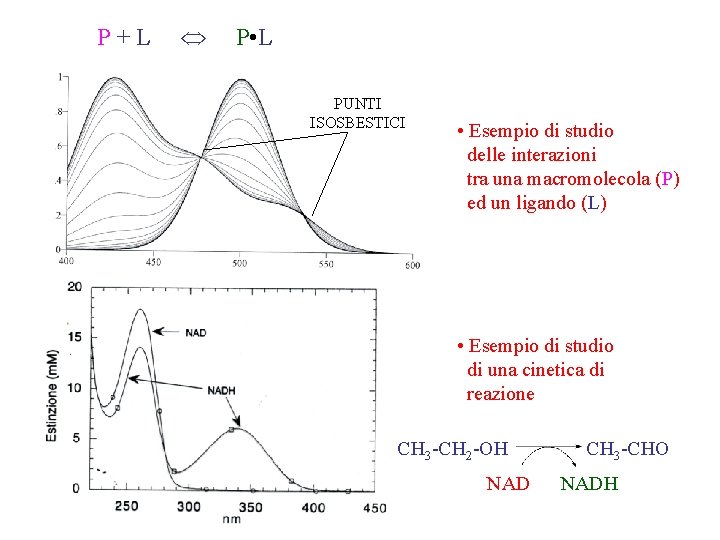
P+L P • L PUNTI ISOSBESTICI • Esempio di studio delle interazioni tra una macromolecola (P) ed un ligando (L) • Esempio di studio di una cinetica di reazione CH 3 -CH 2 -OH NAD CH 3 -CHO NADH

Applicazioni METODI DIRETTI • METODI INDIRETTI • • Amminoacidi = ninidrina (570 nm) Proteine = biureto (540) Zuccheri = proprietà riducenti Enzimi = substrati o prodotti

METODI DI DOSAGGIO DEL GLUCOSIO Metodi enzimatici indiretti Reazioni enzimatiche accoppiate in cui il prodotto viene utilizzato come substrato in un’altra reazione nella quale è coinvolta una sostanza cromofora Glucosio ossidasi Glucosio + O 2 + H 2 O → Ac. Gluconico + H 2 O 2 Perossidasi H 2 O 2 + cromogeno ridotto → cromogeno ossidato + H 2 O esochinasi Glucosio + ATP → Glucosio-6 P + ADP Glucosio-6 P + NADP → 6 P-gluconato + NADPH

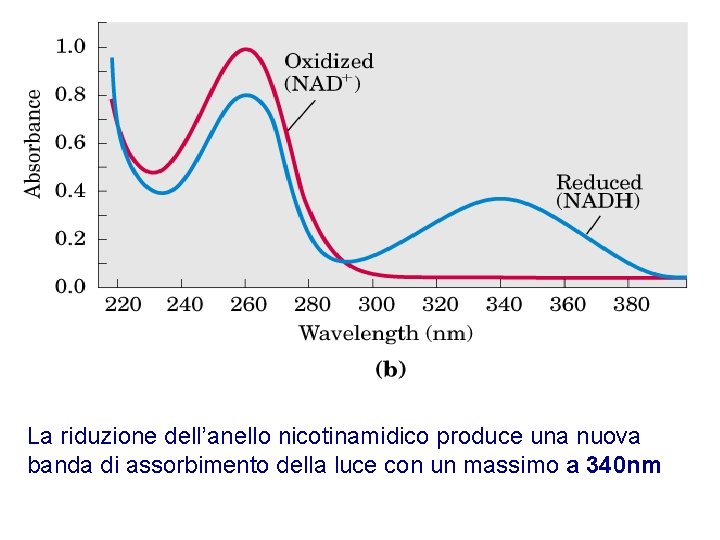
La riduzione dell’anello nicotinamidico produce una nuova banda di assorbimento della luce con un massimo a 340 nm

SPETTROFLUORIMETRIA • Tecnica ottica quali-quantitativa • Una molecola assorbe radiazioni nell’ultravioletto e le emette nel visibile • La molecola passa dal livello energetico fondamentale ad uno stato eccitato instabile • Si verifica una transizione elettronica da uno stato energetico superiore ad uno inferiore EMETTE ENERGIA INFERIORE A QUELLA ASSORBITA L’energia della radiazione emessa: avrà una frequenza inferiore e una lunghezza d’onda superiore a quella di eccitazione: “legge di Stokes” Le radiazioni emesse appaiono come spettri a banda

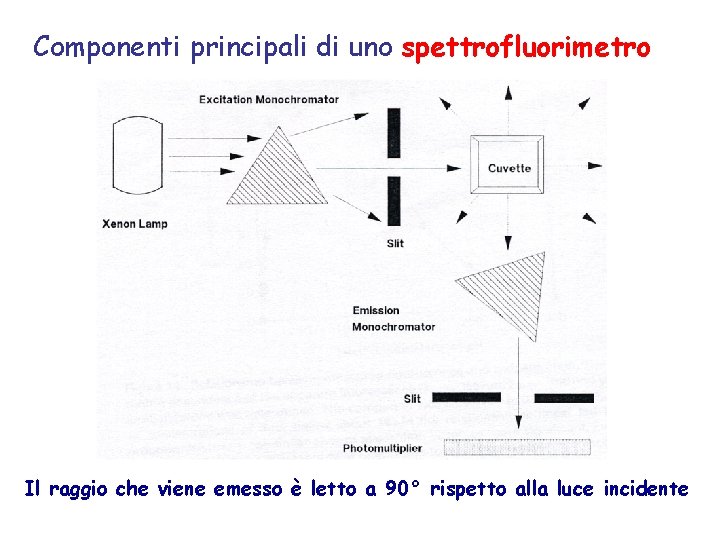
Componenti principali di uno spettrofluorimetro Il raggio che viene emesso è letto a 90° rispetto alla luce incidente

La lunghezza d'onda della radiazione emessa da una lampada allo Xenon (l 1) viene selezionata attraverso l'utilizzo di un monocromatore (M 1) e viene usata per eccitare il campione posto in una cuvette. La radiazione di fluorescenza emessa dalla specie in esame (l 2) viene inviata ad un fotomoltiplicatore che la amplifica e la invia all'analizzatore, il quale come output produce lo spettro.

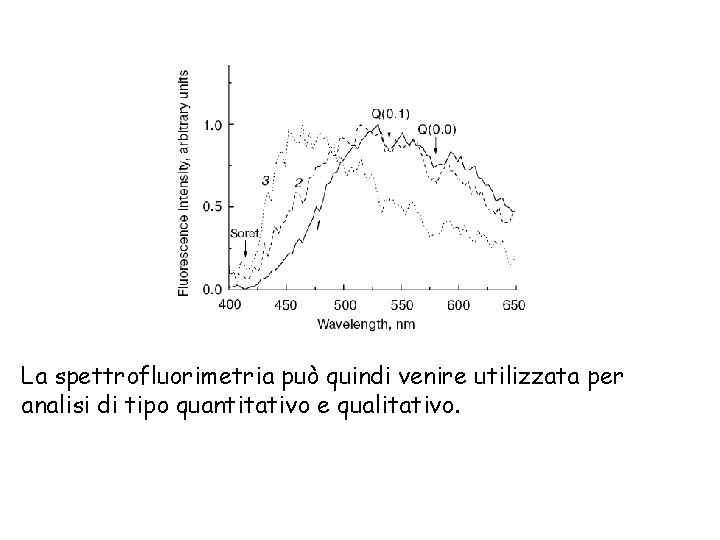
La spettrofluorimetria può quindi venire utilizzata per analisi di tipo quantitativo e qualitativo.

L’intensità della radiazione emessa in seguito al fenomeno della fluorescenza può essere utilizzata a scopi quantitativi Poiché esiste la relazione • A basse concentrazioni della sostanza fluorescente (fluoroforo), l’intensità della fluorescenza (If) è proporzionale alla concentrazione C è la concentrazione del fluoroforo d è il cammino ottico della luce nella soluzione fluorescente el è il coefficiente di estinzione molare del fluoroforo I 0 è l’intensità della radiazione incidente Q è la RESA QUANTICA (rapporto tra energia emessa e quella assorbita)

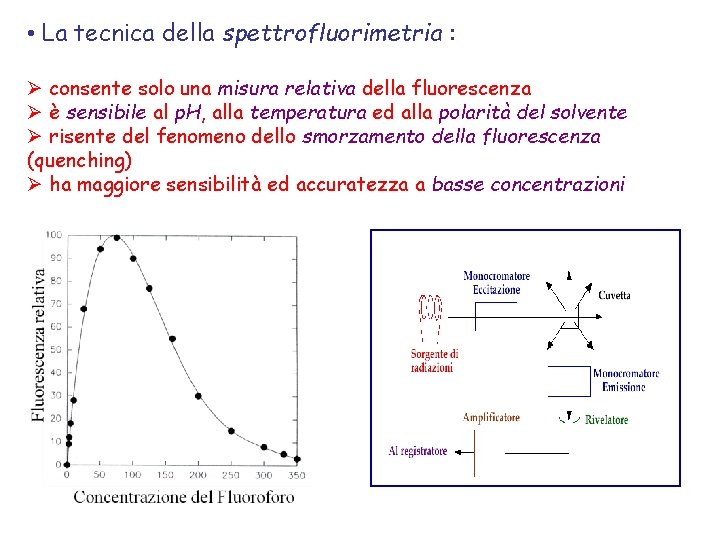
• La tecnica della spettrofluorimetria : Ø consente solo una misura relativa della fluorescenza Ø è sensibile al p. H, alla temperatura ed alla polarità del solvente Ø risente del fenomeno dello smorzamento della fluorescenza (quenching) Ø ha maggiore sensibilità ed accuratezza a basse concentrazioni

APPLICAZIONI DELLA SPETTROFLUORIMETRIA • Analisi qualitativa: Ø Identificazione della struttura di una sostanza (confronto tra spettro di assorbimento e spettro di emissione; Ø Analisi della struttura delle proteine (fluorescenza dei residui aromatici) Ø Separazione di cellule tramite marcatura con anticorpi fluorescenti Ø Dosaggi enzimatici e misure di cinetica enzimatica


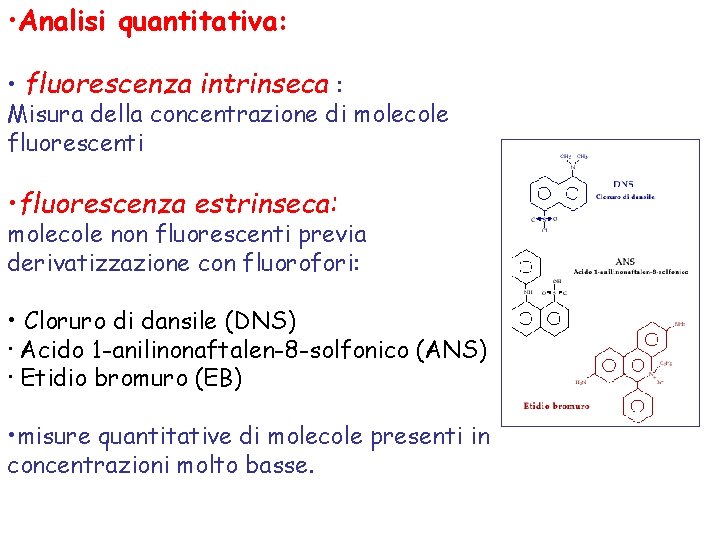
• Analisi quantitativa: • fluorescenza intrinseca : Misura della concentrazione di molecole fluorescenti • fluorescenza estrinseca: molecole non fluorescenti previa derivatizzazione con fluorofori: • Cloruro di dansile (DNS) · Acido 1 -anilinonaftalen-8 -solfonico (ANS) · Etidio bromuro (EB) • misure quantitative di molecole presenti in concentrazioni molto basse.

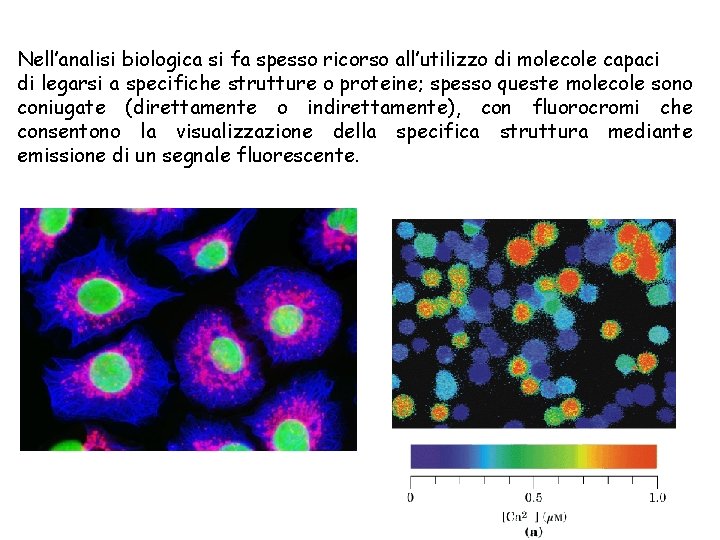
Nell’analisi biologica si fa spesso ricorso all’utilizzo di molecole capaci di legarsi a specifiche strutture o proteine; spesso queste molecole sono coniugate (direttamente o indirettamente), con fluorocromi che consentono la visualizzazione della specifica struttura mediante emissione di un segnale fluorescente.

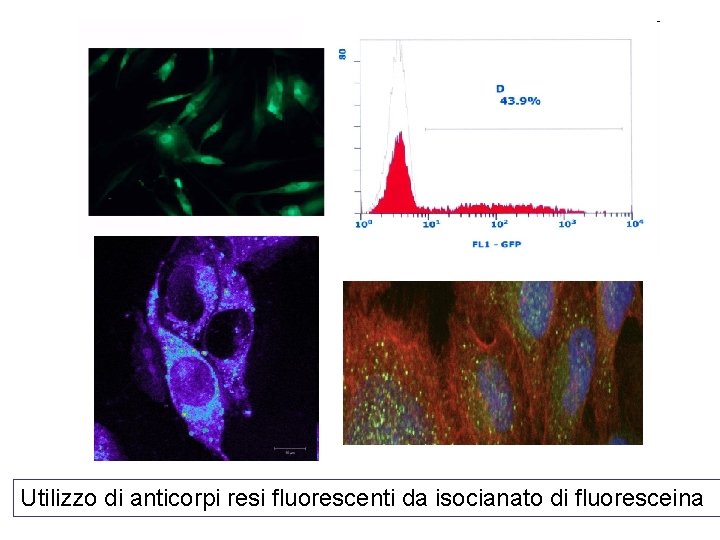
Utilizzo di anticorpi resi fluorescenti da isocianato di fluoresceina
 La doppia natura della luce zanichelli
La doppia natura della luce zanichelli Lenti convergenti
Lenti convergenti Deflessione della luce
Deflessione della luce Metafora della luce illuminismo
Metafora della luce illuminismo Natura particellare della luce
Natura particellare della luce Diffrazione luce zanichelli
Diffrazione luce zanichelli Unità di misura della luce
Unità di misura della luce Teorie e tecniche della televisione
Teorie e tecniche della televisione Sensori a fibre ottiche
Sensori a fibre ottiche Fibre ottiche spente
Fibre ottiche spente Illusioni ottiche
Illusioni ottiche Dispersione cromatica fibra ottica
Dispersione cromatica fibra ottica Disegni reversibili
Disegni reversibili Passaggio segreto san pietro
Passaggio segreto san pietro Lingue indoeuropee mappa
Lingue indoeuropee mappa Temporizzazione passaggio di ruolo
Temporizzazione passaggio di ruolo Gradi celsius
Gradi celsius Passaggio dalla preistoria alla storia
Passaggio dalla preistoria alla storia Il passaggio dalla preistoria alla storia
Il passaggio dalla preistoria alla storia Calorimetria esercizi
Calorimetria esercizi Indovinello veronese mappa concettuale
Indovinello veronese mappa concettuale Cometa halley 1986
Cometa halley 1986 Rozptylka a spojka
Rozptylka a spojka Luce che sorgi
Luce che sorgi Steinbeck's letter to claire luce
Steinbeck's letter to claire luce Spazio di minkowski
Spazio di minkowski Funere mersit acerbo analisi
Funere mersit acerbo analisi Luce in sanscrito
Luce in sanscrito Nulla ha senso
Nulla ha senso Riflessione luce
Riflessione luce Diodi emettitori di luce
Diodi emettitori di luce Spettro luce visibile
Spettro luce visibile Quadrambe
Quadrambe Luce township regional sewer district
Luce township regional sewer district Luce duval
Luce duval Luce nella bibbia
Luce nella bibbia Dal punto di luce entro la mente di dio
Dal punto di luce entro la mente di dio Rilievo punti luce
Rilievo punti luce Extradiegetica
Extradiegetica La luce sul lago
La luce sul lago Tecniche narrative
Tecniche narrative Tecniche di rappresentazione dello spazio
Tecniche di rappresentazione dello spazio Linguaggi e tecniche comunicative non verbali slide
Linguaggi e tecniche comunicative non verbali slide Tecniche associate al pensiero computazionale
Tecniche associate al pensiero computazionale Animazione
Animazione Sezioni di solidi con piani inclinati
Sezioni di solidi con piani inclinati Le 5 c della comunicazione
Le 5 c della comunicazione Elementi della fabula
Elementi della fabula Metodi e tecniche del servizio sociale slide
Metodi e tecniche del servizio sociale slide Tecniche investigative carabinieri
Tecniche investigative carabinieri Tecniche di catalogazione
Tecniche di catalogazione Tecniche di gestione del comportamento
Tecniche di gestione del comportamento Foundation subjects traduzione
Foundation subjects traduzione Metodi di separazione dei miscugli estrazione
Metodi di separazione dei miscugli estrazione Tecniche analitiche di laboratorio
Tecniche analitiche di laboratorio Testo narrativo schema
Testo narrativo schema I cartelli di sicurezza di colore rosso cosa indicano anfos
I cartelli di sicurezza di colore rosso cosa indicano anfos Tecniche narrative schema
Tecniche narrative schema Che cos'è lo schema narrativo
Che cos'è lo schema narrativo