Tecniche spettroscopiche Interazione tra luce e materia Tecniche



































- Slides: 53

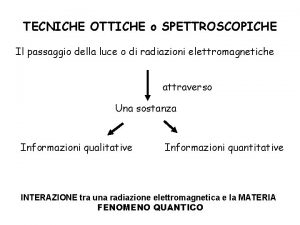
Tecniche spettroscopiche Interazione tra luce e materia Tecniche spettroscopiche • Informazione qualitativa (elementi, composti) • Informazione quantitativa (concentrazione)

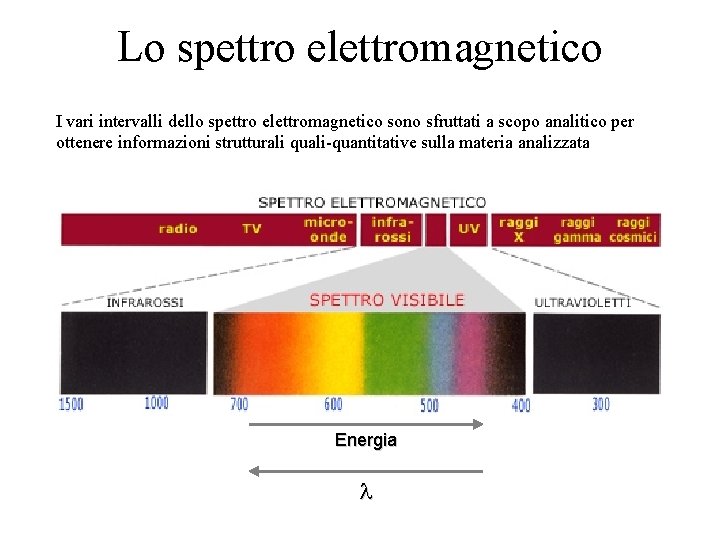
Lo spettro elettromagnetico I vari intervalli dello spettro elettromagnetico sono sfruttati a scopo analitico per ottenere informazioni strutturali quali-quantitative sulla materia analizzata Energia

Classificazione delle tecniche spettroscopiche • In base al meccanismo – assorbimento – emissione – fluorescenza • In base alla specie interessata • atomica • molecolare • In base alla regione spettrale impiegata – raggi g (0. 01 Å) PIGE – raggi X (0. 01 Å – 100 Å) XRF, PIXE – UV-Visibile (10 nm – 800 nm) AAS, ICP-AES – IR (800 nm – 0. 4 mm) FT-IR – microonde (0. 4 mm – 0. 25 m) EPR – radiofrequenze (> 0. 25 m) NMR

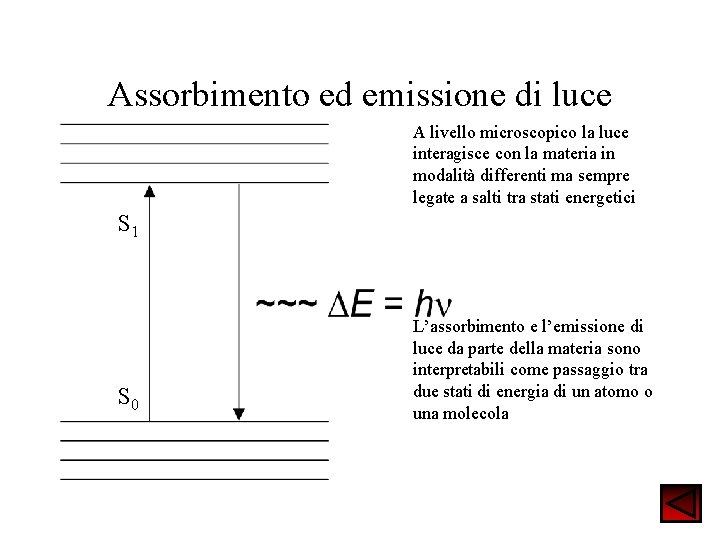
Assorbimento ed emissione di luce A livello microscopico la luce interagisce con la materia in modalità differenti ma sempre legate a salti tra stati energetici S 1 S 0 L’assorbimento e l’emissione di luce da parte della materia sono interpretabili come passaggio tra due stati di energia di un atomo o una molecola

Spettroscopia atomica e molecolare • Spettroscopia atomica: il campione è trasformato in atomi somministrandogli energia si determinano elementi • Spettroscopia molecolare: il campione è analizzato tal quale si determinano composti

Regioni spettrali utilizzate Irraggiando la materia con la radiazione luminosa si creano effetti diversi a seconda dell’energia della radiazione utilizzata: • raggi g e raggi X provocano transizioni elettroniche nei gusci interni e reazioni nel nucleo • raggi UV e visibile causano transizioni elettroniche nei gusci esterni • raggi infrarossi causano transizioni vibrazionali e rotazionali • microonde e onde radio interessano l’orientazione degli spin elettronici e nucleari

Spettroscopia atomica • Il campione è trasformato in atomi con metodi vari di riscaldamento • Il vapore atomico subisce un interazione con la luce oppure con un campo magnetico; l’entità di questa interazione fornisce la risposta analitica, qualitativa e quantitativa

Tecniche atomiche A seconda del tipo di interazione che subisce il vapore atomico, si possono avere le seguenti tecniche di spettroscopia atomica: il vapore è irraggiato con una radiazione monocromatica assorbibile solo dagli atomi di un determinato elemento il vapore subisce un riscaldamento ulteriore e gli atomi emettono il surplus di energia sotto forma di radiazione luminosa il vapore subisce un riscaldamento ulteriore e gli atomi si trasformano in ioni i quali sono separati e rivelati con uno spettrometro di massa Assorbimento atomico Emissione atomica Spettrometria di massa

Spettroscopia atomica: assorbimento • il campione è trasformato in atomi con metodi vari di riscaldamento • il vapore atomico subisce un’interazione con la luce emessa da una sorgente luminosa (righe) • la riga viene assorbita solo dagli atomi corrispondenti mediante l’assorbimento di risonanza • l’entità di questa interazione fornisce la risposta analitica – qualitativa (quali elementi) • identificazione attraverso le assorbite – quantitativa (qual è la concentrazione) • calibrazione con soluzioni a concentrazione nota • legge di Lambert-Beer (A = b. C)

Spettroscopia molecolare • Il campione è irraggiato con luce avente nell’UV, nel visibile o nell’infrarosso • Le molecole che compongono il campione assorbono l’energia irradiata se essa è in quantità sufficiente per far vibrare i loro gruppi funzionali (visibile, IR) oppure per promuovere transizioni elettroniche (UV, visibile) • La risposta del campione viene registrata e, in base ai segnali raccolti, è possibile risalire alla composizione del campione in termini di molecole • Le tecniche più comunemente utilizzate sono quelle in assorbimento

Spettroscopia molecolare: assorbimento • il campione è irraggiato con luce avente nell’UV, nel visibile o nell’infrarosso (bande o righe) • le molecole che compongono il campione assorbono l’energia irradiata se essa è in quantità sufficiente per far vibrare i loro gruppi funzionali (visibile, IR) oppure per promuovere transizioni elettroniche (UV, visibile) • la risposta del campione viene registrata e, in base ai segnali raccolti, è possibile risalire alla composizione del campione in termini di molecole • l’entità di questa interazione fornisce la risposta analitica – qualitativa (quali composti) • identificazione attraverso le assorbite – quantitativa (qual è la concentrazione) • calibrazione con soluzioni a concentrazione nota • legge di Lambert-Beer (A = b. C)

Spettrofotometria IR Il campione è irraggiato con un intervallo più o meno ampio di ; le assorbite corrispondono ai gruppi funzionali delle molecole, i quali assorbono l’energia equivalente per vibrare. La risposta è visibile sotto forma di spettro di assorbimento I campioni liquidi sono analizzati tal quali, mentre per i campioni solidi si prepara una pastiglia di KBr nel quale si disperde il campione polverizzato; è possibile analizzare anche i campioni gassosi

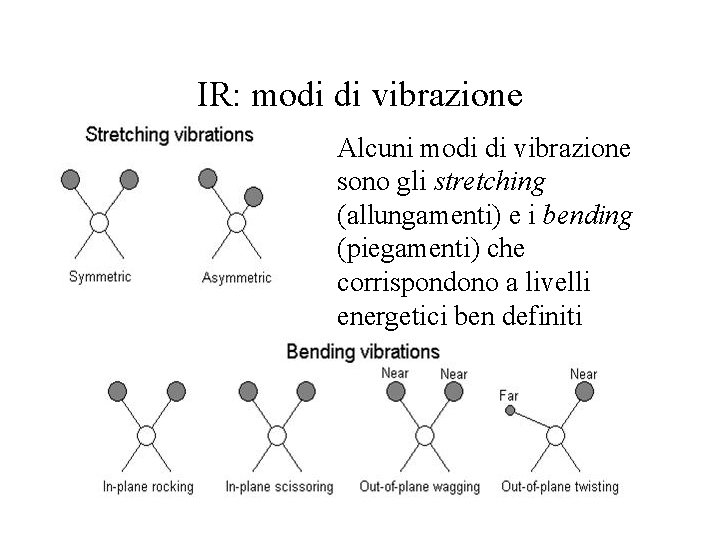
IR: modi di vibrazione Alcuni modi di vibrazione sono gli stretching (allungamenti) e i bending (piegamenti) che corrispondono a livelli energetici ben definiti

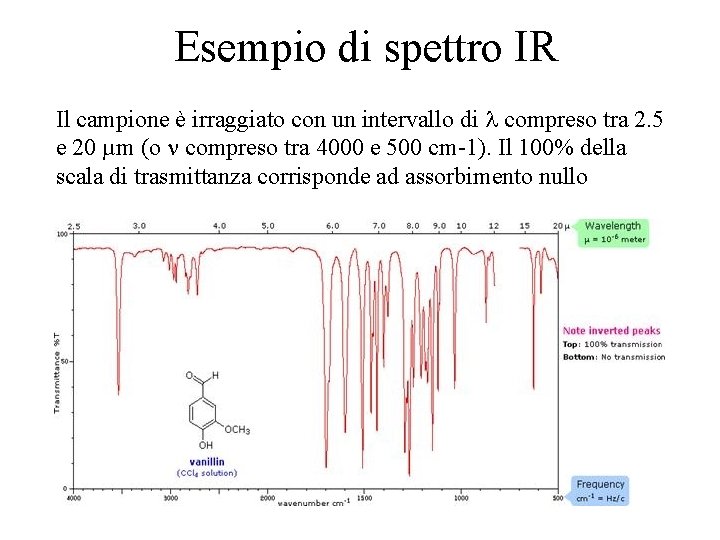
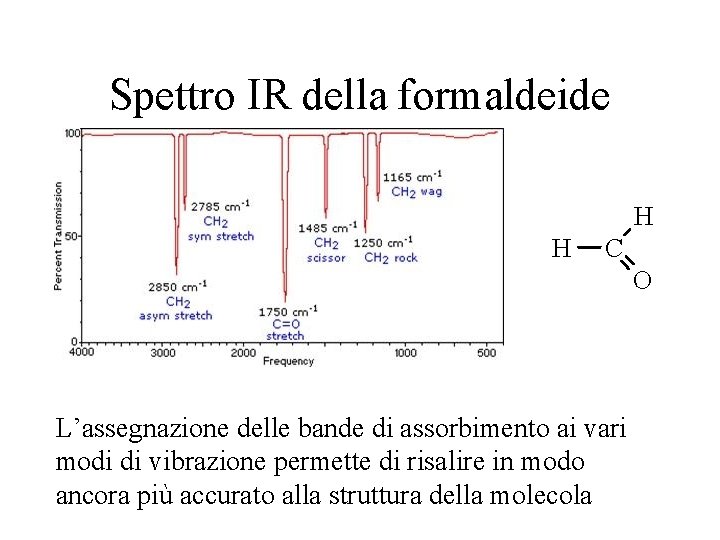
Esempio di spettro IR Il campione è irraggiato con un intervallo di compreso tra 2. 5 e 20 µm (o compreso tra 4000 e 500 cm-1). Il 100% della scala di trasmittanza corrisponde ad assorbimento nullo

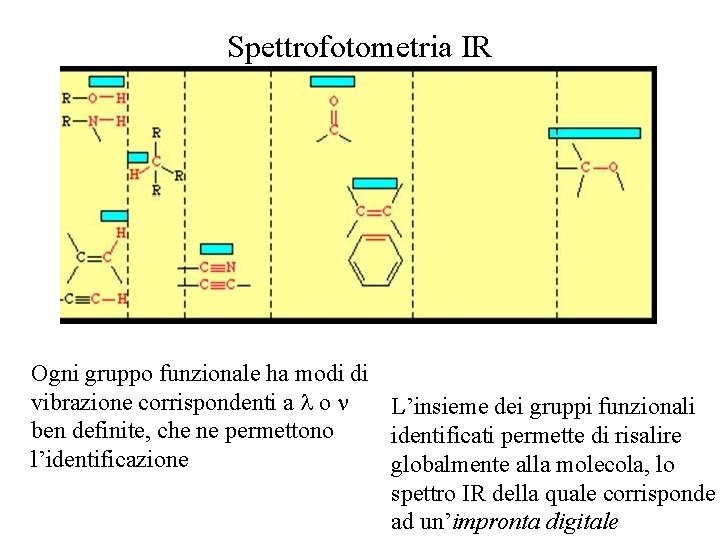
Spettrofotometria IR Ogni gruppo funzionale ha modi di vibrazione corrispondenti a o L’insieme dei gruppi funzionali ben definite, che ne permettono identificati permette di risalire l’identificazione globalmente alla molecola, lo spettro IR della quale corrisponde ad un’impronta digitale

Spettro IR della formaldeide H H C O L’assegnazione delle bande di assorbimento ai vari modi di vibrazione permette di risalire in modo ancora più accurato alla struttura della molecola

Applicazioni IR Esempi di applicazioni della tecnica IR: • caratterizzazione strutturale di prodotti di sintesi • caratterizzazione strutturale di intermedi di sintesi • monitoraggio di cinetiche di reazione • caratterizzazione della purezza di un composto • raramente utilizzata per determinazioni quantitative

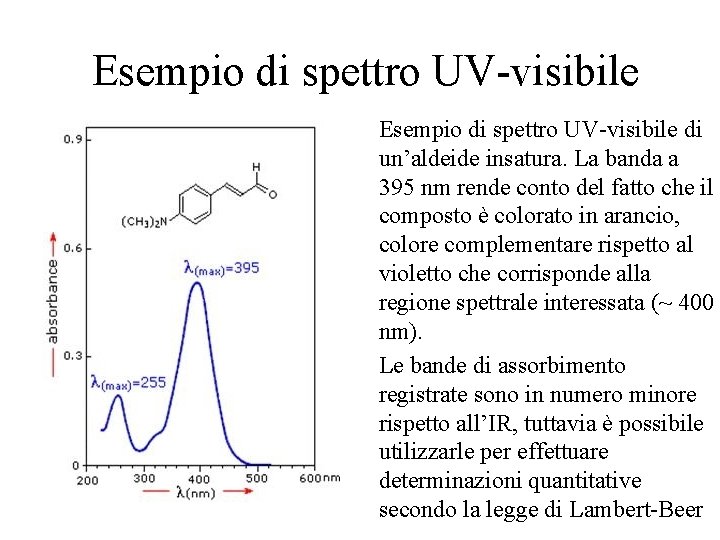
Spettrofotometria UV-visibile Il campione è irraggiato con un intervallo più o meno ampio di ; le assorbite, aventi energia sufficiente a promuovere transizioni elettroniche, corrispondono ai gruppi funzionali delle molecole. La risposta è visibile sotto forma di spettro di assorbimento Gli spettrofotometri UVvisibile sono molto diffusi per la loro semplicità di utilizzo e versatilità e per il basso costo; quasi tutte le sostanze organiche presentano assorbimenti nel range strumentale (180 -800 nm) Un utilizzo molto comune si ha come rivelatore per HPLC

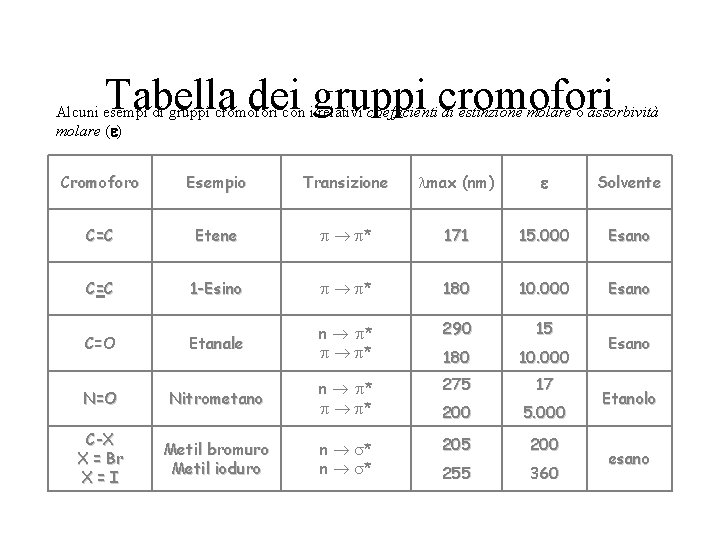
Transizioni elettroniche La spettroscopia UV-visibile è detta anche spettroscopia elettronica perchè è basata su transizioni di elettroni tra livelli energetici diversi Le transizioni elettroniche più comuni sono illustrare nella figura sottostante. Esse si verificano se nel campione sono presenti molecole aventi cromofori, cioè gruppi funzionali in grado di assorbire la luce, come il gruppo –NO 2 (nitro), -N 2 - (azo), ecc. Solo le transizioni di elettroni n e hanno energie nel range 200 -800 nm

Esempio di spettro UV-visibile di un’aldeide insatura. La banda a 395 nm rende conto del fatto che il composto è colorato in arancio, colore complementare rispetto al violetto che corrisponde alla regione spettrale interessata (~ 400 nm). Le bande di assorbimento registrate sono in numero minore rispetto all’IR, tuttavia è possibile utilizzarle per effettuare determinazioni quantitative secondo la legge di Lambert-Beer

Tabella dei gruppi cromofori Alcuni esempi di gruppi cromofori con i relativi coefficienti di estinzione molare o assorbività molare ( ) Cromoforo Esempio Transizione max (nm) Solvente C=C Etene * 171 15. 000 Esano C =C 1 -Esino * 180 10. 000 Esano Etanale n * * 290 15 180 10. 000 N=O Nitrometano n * * 275 17 200 5. 000 C-X X = Br X=I Metil bromuro Metil ioduro n * 205 200 255 360 C=O Esano Etanolo esano

Applicazioni dell’UV-visibile • caratterizzazione strutturale di prodotti di sintesi • monitoraggio di cinetiche di reazione • caratterizzazione della purezza di un composto o di un prodotto naturale (es. olio, vino) • determinazione quantitativa di specie di interesse chimico-clinico o ambientale (A = b. C) • rivelazione in sistemi cromatografici

Caratteristiche tecniche • • • tecniche distruttive o non distruttive si determinano composti si analizzano liquidi, solidi o gas analisi totale o parziale del campione risultati espressi in concentrazione buona sensibilità (mg/l)

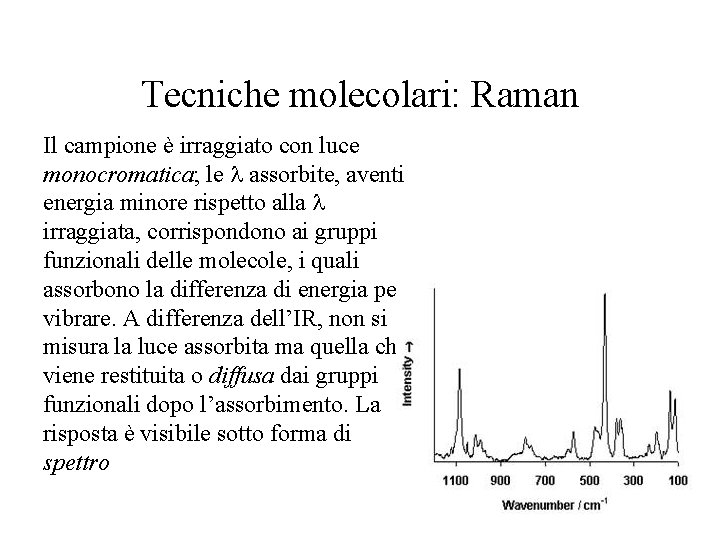
Tecniche molecolari: Raman Il campione è irraggiato con luce monocromatica; le assorbite, aventi energia minore rispetto alla irraggiata, corrispondono ai gruppi funzionali delle molecole, i quali assorbono la differenza di energia per vibrare. A differenza dell’IR, non si misura la luce assorbita ma quella che viene restituita o diffusa dai gruppi funzionali dopo l’assorbimento. La risposta è visibile sotto forma di spettro Spettro Raman di un pigmento

Caratteristiche tecniche • • tecniche distruttive o non distruttive si determinano composti si analizzano liquidi, solidi o gas possibili analisi in situ analisi totale o parziale del campione risultati espressi in concentrazione buona sensibilità

Quando un quanto di luce (fotone) è assorbito da una molecola, un elettrone di valenza è promosso in un orbitale a energia maggiore formando uno stato eccitato. Quando questo elettrone ritorna al suo orbitale originario a minore energia, detto ground state, un quanto di luce viene emesso.

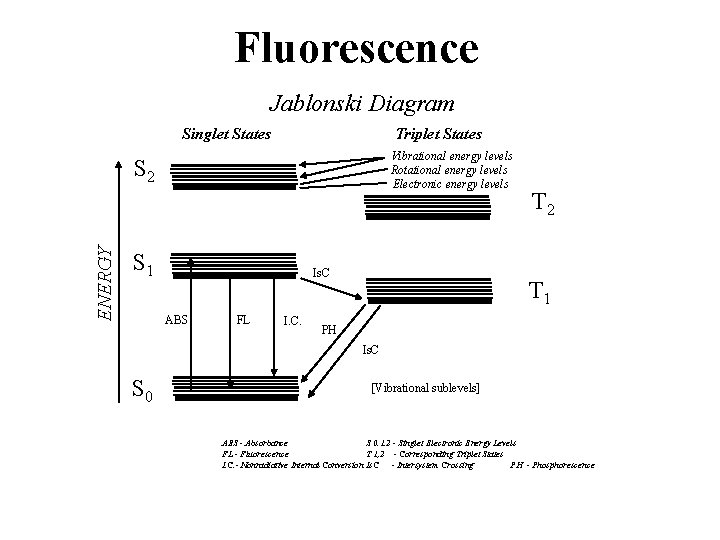
Natura della fluorescenza La fluorescenza è un tipo di luminescenza dove la luce viene emessa da molecole per un breve periodo di tempo, successivo all'assorbimento. Percorsi di diseccitazione La fluorescenza è una dei possibili percorsi del processo di diseccitazione per mezzo dei quali un elettrone in uno stato eccitato cede energia per ritornare al ground state. Il il tempo di vita della fluorescenza è il tempo medio durante il quale la molecola rimane in uno stato eccitato.

Fluorescence Jablonski Diagram Singlet States Triplet States Vibrational energy levels Rotational energy levels Electronic energy levels ENERGY S 2 S 1 Is. C ABS FL I. C. T 2 T 1 PH Is. C S 0 [Vibrational sublevels] ABS - Absorbance S 0. 1. 2 - Singlet Electronic Energy Levels FL - Fluorescence T 1, 2 - Corresponding Triplet States I. C. - Nonradiative Internal Conversion Is. C - Intersystem Crossing PH - Phosphorescence

• La fluorescenza è ritardata se l'elettrone eccitato passa ad uno stato tripletta nascosto prima di tornare indietro al più basso stato singolo eccitato per poi emettere un quanto di luce • Si ha fosforescenza se l'elettrone si muove dal più basso stato eccitato singolo verso uno stato tripletta eccitato per poi passare al ground state, emettendo un quanto di luce. Il tempo di vita dello stato eccitato pari a diversi secondi e lo spettro di emissione si sposta a superiori ( red shift).

L'assorbimento della luce avviene secondo quantità discrete detti quanti. L'energia associata ad un quanto è pari a: dove: h = costante di Plank ( ) c = velocità della luce ( ) = lunghezza d'onda della radiazione [ ] = frequenza della radiazione [ ] La potenza della luce per unità di area è definita intensità o irradianza:


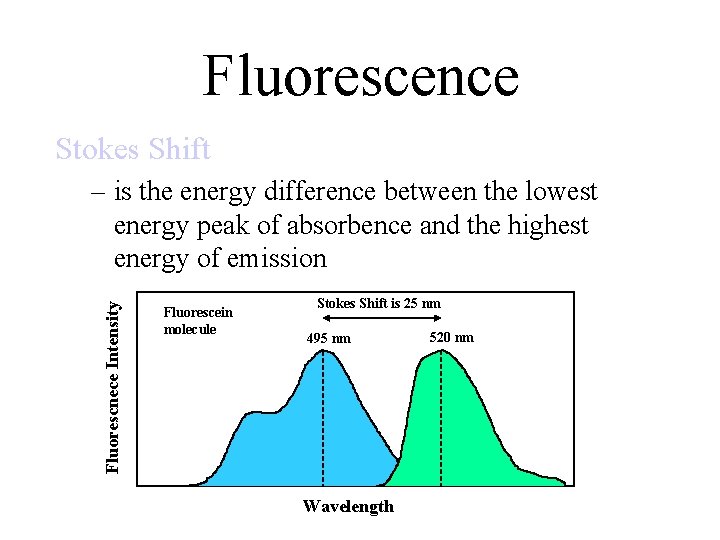
Legge di Stokes La lunghezza d'onda della fluorescenza emessa è usualmente maggiore della lunghezza d'onda della luce assorbita. Solo quando delle collisioni tra le molecole forniscono ulteriore energia all'elettrone nello stato eccitato ci possono essere delle eccezioni.

Tipicamente tali collisioni molecolari sono rare e parte dell'energia dell'elettrone eccitato è persa prima della diseccitazione. Quindi, il quanto di energia della luce emessa è quasi sempre minore di quello relativo alla luce assorbita. Lo spettro di emissione si sposta verso lunghezze d'onda superiori rispetto allo spettro di assorbimento, e si ha anche qui un allargamento rispetto alla riga spettrale d'emissione di un singolo atomo.

Fluorescence Stokes Shift Fluorescnece Intensity – is the energy difference between the lowest energy peak of absorbence and the highest energy of emission Fluorescein molecule Stokes Shift is 25 nm 495 nm Wavelength 520 nm

Fluorescence Lamps Xenon/Mercury Lasers Argon Ion (Ar) Krypton (Kr) Helium Neon (He-Ne) Helium Cadmium (He-Cd) Krypton-Argon (Kr-Ar) • Chromophores are components of molecules which absorb light • They are generally aromatic rings


Probes for Proteins Probe FITC PE APC Per. CP™ Cascade Blue Coumerin-phalloidin Texas Red™ Tetramethylrhodamine-amines CY 3 (indotrimethinecyanines) CY 5 (indopentamethinecyanines) Excitation 488 630 488 360 350 610 550 540 640 525 575 650 680 450 630 575 670 Emission

Probes for Nucleic Acids • • • Hoechst 33342 (AT rich) (uv) DAPI (uv) POPO-1 YOYO-1 Acridine Orange (RNA) Acridine Orange (DNA) Thiazole Orange (vis) TOTO-1 Ethidium Bromide PI (uv/vis) 7 -Aminoactinomycin D (7 AAD) 346 359 434 491 460 502 509 514 526 536 555 460 461 456 509 650 536 525 533 604 620 655

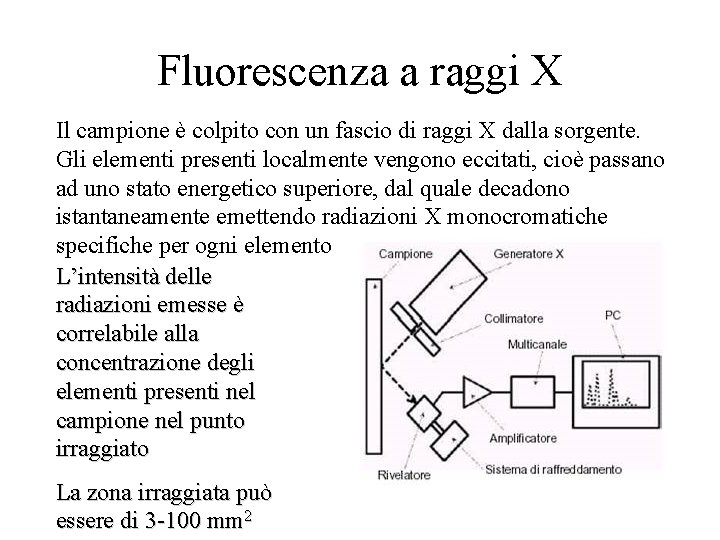
Fluorescenza a raggi X Il campione è colpito con un fascio di raggi X dalla sorgente. Gli elementi presenti localmente vengono eccitati, cioè passano ad uno stato energetico superiore, dal quale decadono istantaneamente emettendo radiazioni X monocromatiche specifiche per ogni elemento L’intensità delle radiazioni emesse è correlabile alla concentrazione degli elementi presenti nel campione nel punto irraggiato La zona irraggiata può essere di 3 -100 mm 2

Caratteristiche tecniche • • tecnica non distruttiva o distruttiva si determinano elementi si analizzano liquidi, solidi possibilità di analisi in situ buona risoluzione spaziale risultati espressi in concentrazione sensibilità discreta

CD Il dicroismo circolare (CD) viene osservato quando molecole otticamente attive assorbono diversamente la luce circolarmente polarizzata destra e sinistra. Viene misurato con un spettropolarimetro CD, che è relativamente costoso. Lo strumento deve essere in grado di misurare accuratamente a lunghezze d'onda fino a 190 -170 nm.

Gli spettri CD di diversi tipi di strutture secondarie presenti sono differenti. Quindi l'analisi dei loro spettri CD può dare informazioni utili su porzioni di strutture secondarie presenti nelle macromolecole biologiche. Circular dichroism (CD) spectroscopy is an optical technique that allows the detection and quantitation of the chirality of molecular structures.

La spettroscopia di dicroismo circolare è usata per ottenere informazioni riguardanti la struttura secondaria di proteine e polipeptidi in soluzione. Vantaggi : Bassa concentrazione dei campioni (200 ml of 0. 5 mg/ml soluzione), tecnica nondistruttiva. Cambiamenti dovuti ad ambienti esterni diversi (p. H, denaturanti, temperatura, . . ) possono essere rilevati con accuratezza. Svantaggi : interferenza con l'ambiente esterno se costituito da solventi che assorbono nella regione dell'UV, misure possibili solo con campioni molto diluiti.

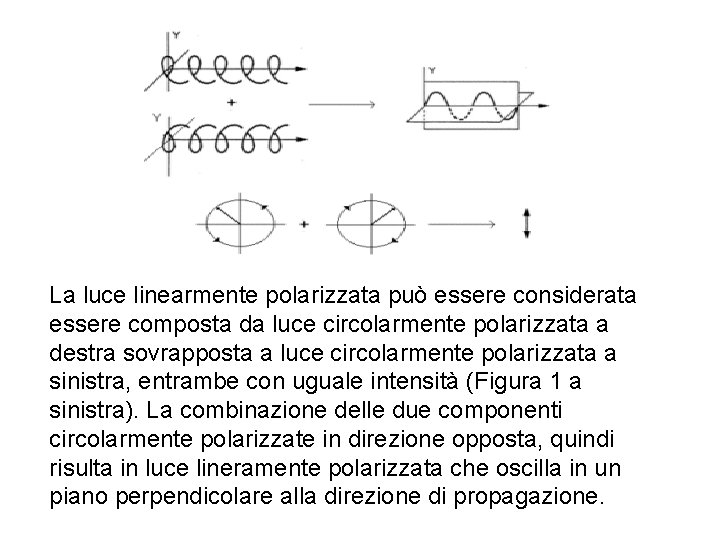
La luce linearmente polarizzata può essere considerata essere composta da luce circolarmente polarizzata a destra sovrapposta a luce circolarmente polarizzata a sinistra, entrambe con uguale intensità (Figura 1 a sinistra). La combinazione delle due componenti circolarmente polarizzate in direzione opposta, quindi risulta in luce lineramente polarizzata che oscilla in un piano perpendicolare alla direzione di propagazione.

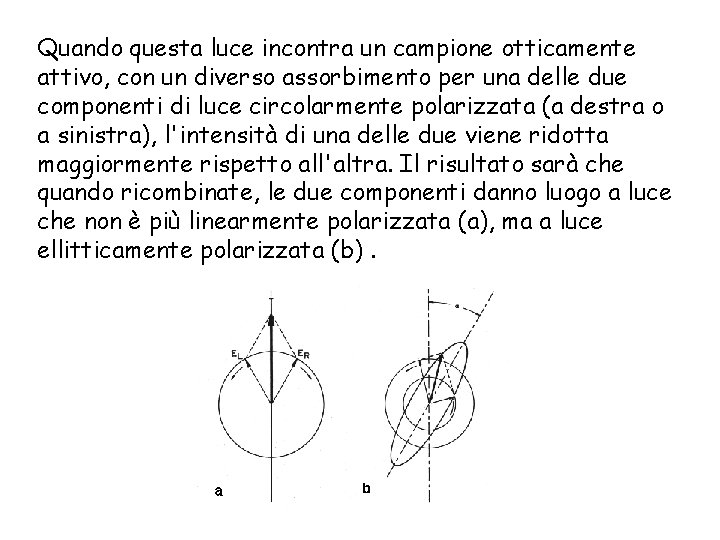
Quando questa luce incontra un campione otticamente attivo, con un diverso assorbimento per una delle due componenti di luce circolarmente polarizzata (a destra o a sinistra), l'intensità di una delle due viene ridotta maggiormente rispetto all'altra. Il risultato sarà che quando ricombinate, le due componenti danno luogo a luce che non è più linearmente polarizzata (a), ma a luce ellitticamente polarizzata (b).

Acquisizione dei dati La differenza in assorbimento delle componenti di luce circolarmente polarizzata a destra ed a sinistra è generalmente è molto piccola ma può essere accuratamente misurata. Inizialmente si eseguono spettri dell'aria e della soluzione senza il campione (bianco) per ottenere il segnale di fondo. Il campione viene poi analizzato e lo spettro viene registrato come media di tre o più accumuli. Il parametro che viene misurato dallo strumento è q che indica l'ellitticità:

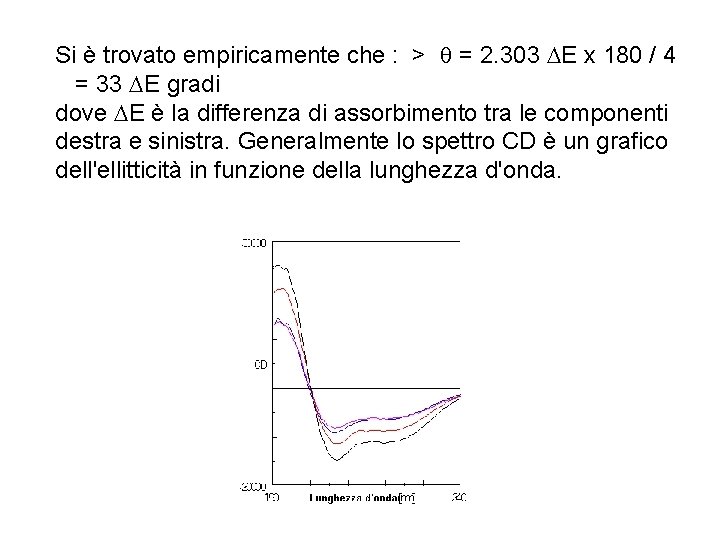
Si è trovato empiricamente che : > q = 2. 303 DE x 180 / 4 = 33 DE gradi dove DE è la differenza di assorbimento tra le componenti destra e sinistra. Generalmente lo spettro CD è un grafico dell'ellitticità in funzione della lunghezza d'onda.

Information CD can provide • Protein secondary structure Used to estimate the secondary structure (conformation) of the polypeptide chain (a-helix, b-sheet) • Nucleic acid conformation Enhanced CD that is representative of the relative base orientation • Interaction studies Direct, noninvasive means of monitoring binding of molecules to proteins or enzymes

CD Signal of Proteins • For proteins we will be mainly concerned with absorption in the ultraviolet region of the spectrum from the peptide bonds (symmetric chromophores) and amino acid side chains in proteins. • Protein chromophores can be divided into three classes: the peptide bond, the amino acid side chains, and any prosthetic groups. • The lowest energy transition in the peptide chromophore is an n → * transition observed at 210 - 220 nm with very weak intensity ( max~100). ---- * → * ~`190 nm max~7000 ----n n → 208 -210, 191 -193 nm max~100 ----

Protein CD Signal • The three aromatic side chains that occur in proteins (phenyl group of Phe, phenolic group of Tyr, and indole group of Trp) also have absorption bands in the ultraviolet spectrum. However, in proteins, the contributions to the CD spectra in the far UV (where secondary structural information is located) is usually negligible. Aromatic residues, if unusually abundant, can have significant effects on the CD spectra in the region < 230 nm, complicating analysis. • The disulfide group is an inherently asymmetric chromophore as it prefers a gauche conformation with a broad CD absorption around 250 nm.

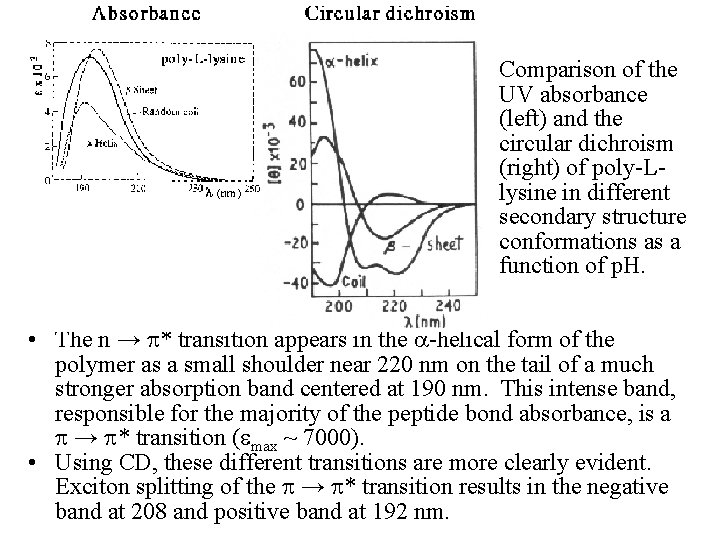
Comparison of the UV absorbance (left) and the circular dichroism (right) of poly-Llysine in different secondary structure conformations as a function of p. H. • The n → * transition appears in the a-helical form of the polymer as a small shoulder near 220 nm on the tail of a much stronger absorption band centered at 190 nm. This intense band, responsible for the majority of the peptide bond absorbance, is a → * transition ( max ~ 7000). • Using CD, these different transitions are more clearly evident. Exciton splitting of the → * transition results in the negative band at 208 and positive band at 192 nm.

CD Spectra of Proteins • Different secondary structures of peptide bonds have different relative intensity of n → * transitions, resulting in different CD spectra at far UV region (180 - 260 nm). • CD is very sensitive to the change in secondary structures of proteins. CD is commonly used in monitoring the conformational change of proteins. • The CD spectrum is additive. The amplitude of CD curve is a measure of the degree of asymmetry. • The helical content in peptides and proteins can be estimated using CD signal at 222 nm 222= 33, 000 degrees cm 2 dmol -1 res-1 • Several curve fitting algorithms can be used to deconvolute relative secondary structures of proteins using the CD spectra of proteins with known structures.

Altre tecniche spettroscopiche Esistono altre tecniche di analisi nelle quali si sfrutta l’interazione della materia con un campo magnetico e/o con una radiazione luminosa Le tecniche principali in questo settore sono due: • la spettrometria di massa • la risonanza magnetica nucleare o NMR Queste tecniche vengono generalmente considerate tecniche spettroscopiche
 Interazione uomo macchina sapienza
Interazione uomo macchina sapienza Interazione nucleare debole
Interazione nucleare debole Interazione nucleare debole
Interazione nucleare debole Interazione nucleare debole
Interazione nucleare debole Interazione nucleare debole
Interazione nucleare debole Esempio forze di london
Esempio forze di london Interazione nucleare debole
Interazione nucleare debole Luce che sorgi
Luce che sorgi Reticolo di diffrazione zanichelli
Reticolo di diffrazione zanichelli Diodi emettitori di luce
Diodi emettitori di luce Rilievo punti luce
Rilievo punti luce Luce duval
Luce duval Thermal energy
Thermal energy Lenti convergenti
Lenti convergenti Luce in sanscrito
Luce in sanscrito Funere mersit acerbo figure retoriche
Funere mersit acerbo figure retoriche La luce nella bibbia
La luce nella bibbia Steinbeck's letter about curley's wife
Steinbeck's letter about curley's wife Spazio di minkowski
Spazio di minkowski Lago della galilea
Lago della galilea Natura particellare della luce
Natura particellare della luce El romanticismo proclama
El romanticismo proclama Unità di misura della luce
Unità di misura della luce Deflessione della luce
Deflessione della luce Nulla ha senso in biologia se non alla luce dell'evoluzione
Nulla ha senso in biologia se non alla luce dell'evoluzione Riflessione luce
Riflessione luce Dal punto di luce entro la mente di dio
Dal punto di luce entro la mente di dio Luce extradiegetica
Luce extradiegetica La doppia natura della luce zanichelli
La doppia natura della luce zanichelli Quadrambe
Quadrambe Zobrazenie spojnou a rozptylnou šošovkou
Zobrazenie spojnou a rozptylnou šošovkou Ltrsd
Ltrsd Schema della fabula
Schema della fabula Testo narrativo sequenze
Testo narrativo sequenze Tecniche di conduzione dei gruppi slide
Tecniche di conduzione dei gruppi slide Tecniche di separazione chimica
Tecniche di separazione chimica Apparecchio di thiele
Apparecchio di thiele Tecniche pittoriche moderne
Tecniche pittoriche moderne Teorie e tecniche della televisione
Teorie e tecniche della televisione Il pensiero e la poetica di svevo
Il pensiero e la poetica di svevo Tecniche di socializzazione
Tecniche di socializzazione Umberto riva
Umberto riva Comunicazione organizzativa interna
Comunicazione organizzativa interna Come e quando matura la conversione di verga il verismo
Come e quando matura la conversione di verga il verismo A cosa servono le tecniche di animazione
A cosa servono le tecniche di animazione Cos'è il testo narrativo
Cos'è il testo narrativo Bibliografia tesina terza media
Bibliografia tesina terza media Tecniche di purificazione
Tecniche di purificazione Tecniche investigative carabinieri
Tecniche investigative carabinieri Linguaggi e tecniche comunicative non verbali slide
Linguaggi e tecniche comunicative non verbali slide Tecniche associate al pensiero computazionale
Tecniche associate al pensiero computazionale Tecniche di rappresentazione dello spazio
Tecniche di rappresentazione dello spazio Tecniche di comunicazione efficace slide
Tecniche di comunicazione efficace slide Tecniche di rappresentazione dello spazio
Tecniche di rappresentazione dello spazio