Gli spettri atomici Propriet della luce La luce












- Slides: 21

Gli spettri atomici Proprietà della luce

• La luce (dal latino, lux, lucis) è l'agente fisico che rende visibili gli oggetti. Teoria elettromagnetica Proposta da James Clerk Maxwell alla fine del XIX secolo, sostiene che le onde luminose sono elettromagnetiche e non necessitano di un mezzo per la trasmissione, mostra che la luce visibile è una parte dello spettro elettromagnetico. Il termine luce si riferisce alla porzione dello spettro elettromagnetico visibile all'occhio umano, ma può includere altre forme della radiazione elettromagnetica.

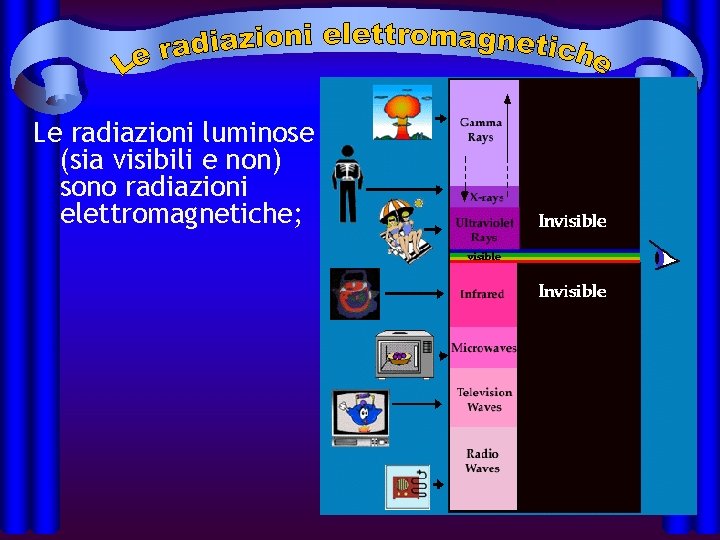
Le radiazioni luminose (sia visibili e non) sono radiazioni elettromagnetiche;

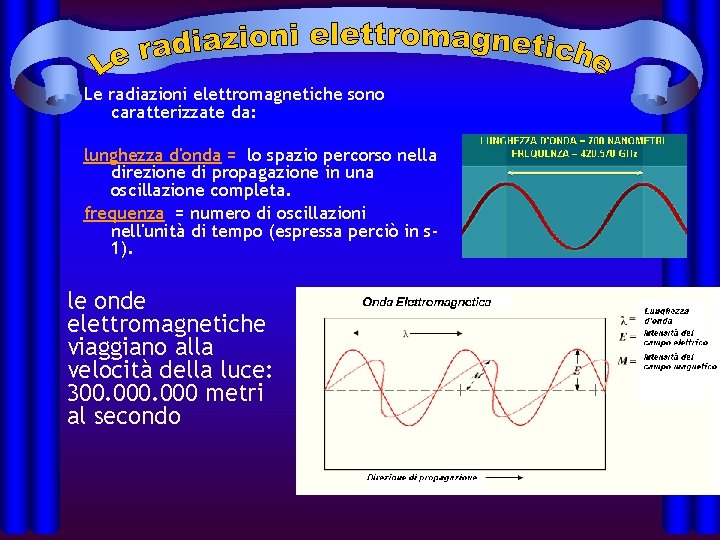
Le radiazioni elettromagnetiche sono caratterizzate da: lunghezza d'onda = lo spazio percorso nella direzione di propagazione in una oscillazione completa. frequenza = numero di oscillazioni nell'unità di tempo (espressa perciò in s 1). le onde elettromagnetiche viaggiano alla velocità della luce: 300. 000 metri al secondo

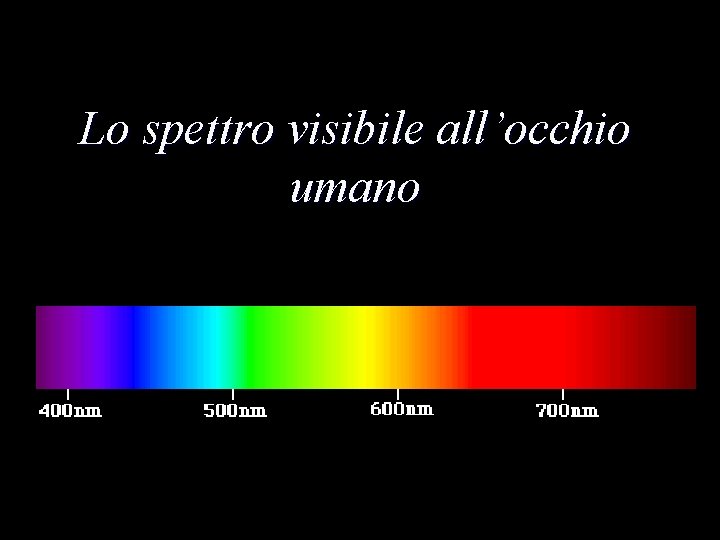
Un po’ di numeri decimeter centimeter millimeter micrometer nanometer 10 -1 meters 10 -2 meters 10 -3 meters 10 -6 meters 10 -9 meters La luce visibile ha una lunghezza d’onda compresa fra 400 e 700 nanometri

Lo spettro visibile all’occhio umano

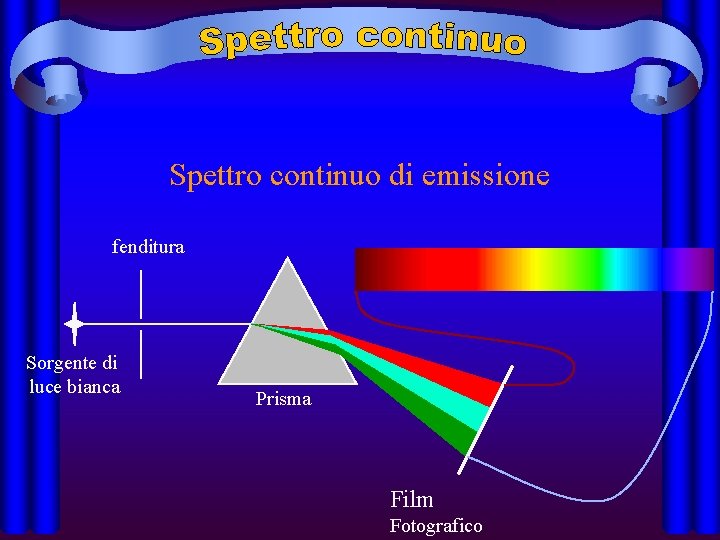
• Spettri di emissione continui o discreti: • sono emessi da una sorgente luminosa; presentano tutti i colori dal rosso al violetto sfumati l'uno nell'altro. Sono emessi da corpi incandescenti, solidi, liquidi o gassosi, fortemente compressi; sono esempi lo spettro solare e quello emesso da una lampada ad incandescenza.

Spettro continuo di emissione fenditura Sorgente di luce bianca Prisma Film Fotografico

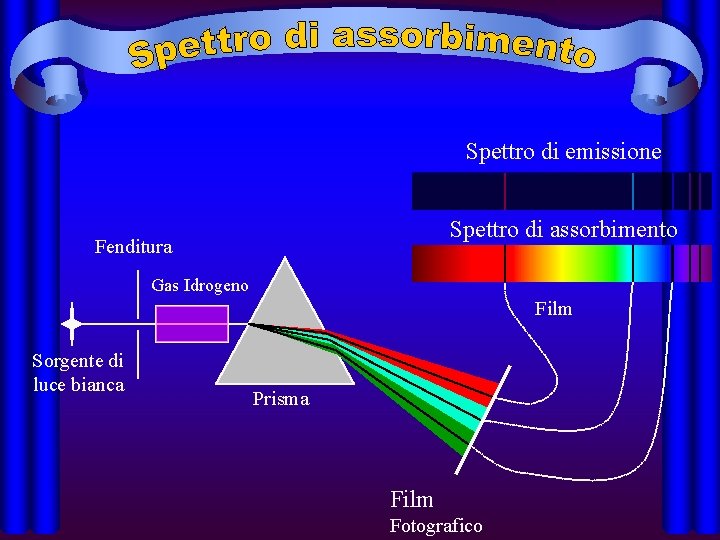
• Spettri di emissione a righe: • presentano righe colorate su sfondo nero; sono emessi da sostanze gassose o rese gassose a bassa pressione. Ogni spettro è caratteristico di ogni sostanza

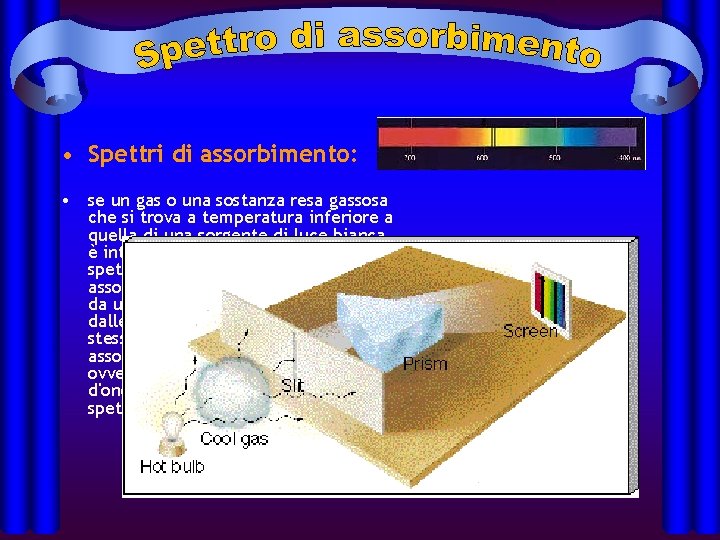
• Spettri di assorbimento: • se un gas o una sostanza resa gassosa che si trova a temperatura inferiore a quella di una sorgente di luce bianca, è interposto tra detta sorgente ed uno spettroscopio si ottiene uno spettro di assorbimento; esso è caratterizzato da uno sfondo colorato continuo e dalle righe di assorbimento. Per una stessa sostanza le righe di assorbimento sono sovrapponibili, ovvero hanno la stessa lunghezza d'onda delle righe colorate dello spettro di emissione.

Spettro di emissione Spettro di assorbimento Fenditura Gas Idrogeno Film Sorgente di luce bianca Prisma Film Fotografico

Hydrogen Helium Oxygen Carbon Ogni elemento possiede un proprio spettro di assorbimento


Rainbows from starlight

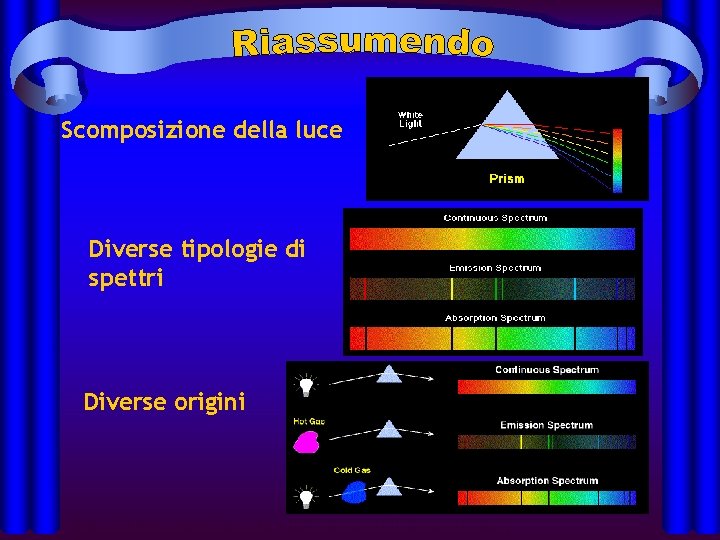
Scomposizione della luce Diverse tipologie di spettri Diverse origini http: //jersey. uoregon. edu/vlab/elements/Elements. html

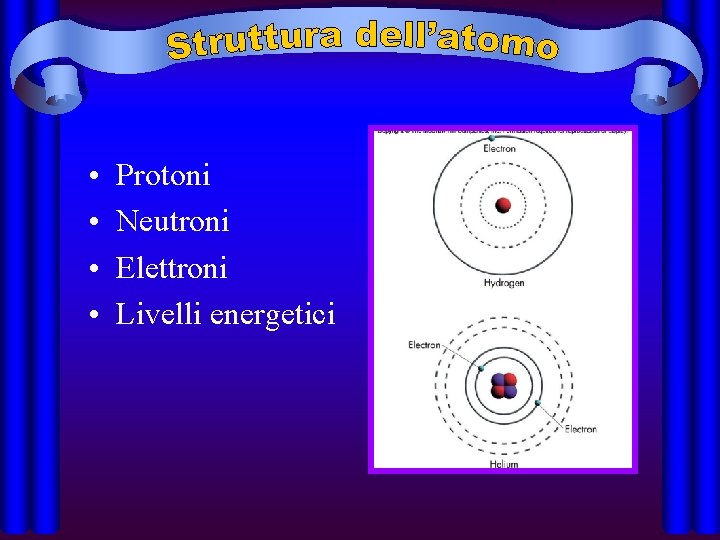
• • Protoni Neutroni Elettroni Livelli energetici

L’elettrone assorbe energia che causa “un salto” ad un livello energetico più alto. Questo fenomeno è definito “stato eccitato”. E 2 Energia Nucleo E 1

L’elettrone, preferisce stare al livello energetico più basso, immediatamente salta indietro al livello energetico inferiore emettendo energia. E 2 E 1 Energia

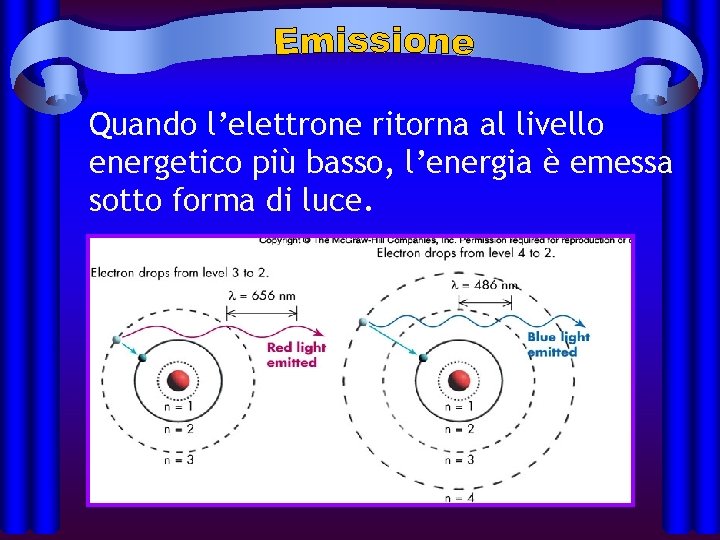
Quando l’elettrone ritorna al livello energetico più basso, l’energia è emessa sotto forma di luce.

In rispetto alla legge di conservazione dell’energia, viene emesso un fotone (quantità discreta di energa). E 2 E 1 Energia del Fotone = E 2 – E 1 L’energia del fotone è uguale alla differenza di energia fra i due livelli.

Differenti salti degli elettroni da alti livelli a bassi livelli producono luce a colori diversi.
 Evoluzione modelli atomici
Evoluzione modelli atomici Dalton
Dalton John dalton 1808
John dalton 1808 Normalità chimica
Normalità chimica Reticolo di diffrazione zanichelli
Reticolo di diffrazione zanichelli Unità di misura della luce
Unità di misura della luce La doppia natura della luce zanichelli
La doppia natura della luce zanichelli Lenti convergenti
Lenti convergenti Deflessione della luce
Deflessione della luce Sehnsucht e streben
Sehnsucht e streben Atomo di bohr
Atomo di bohr Aggettivi qualificativi di seconda classe
Aggettivi qualificativi di seconda classe Gli ostacoli della vita
Gli ostacoli della vita Euclidea significato
Euclidea significato Ic mira 2
Ic mira 2 Elementi di una fiaba
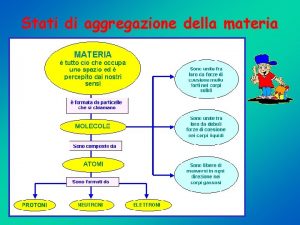
Elementi di una fiaba Gli stati di aggregazione della materia
Gli stati di aggregazione della materia Elementi della comunicazione
Elementi della comunicazione Geografia diagramma cartesiano
Geografia diagramma cartesiano Muta metu
Muta metu 5 assiomi della comunicazione
5 assiomi della comunicazione Elementi costitutivi del testo narrativo
Elementi costitutivi del testo narrativo