SU VE ZELTLER Do Dr Mustafa ALTINIIK ADTF



















































- Slides: 76

SU VE ÇÖZELTİLER Doç. Dr. Mustafa ALTINIŞIK ADÜTF Biyokimya AD 2009

SU Su, bir inorganik maddedir

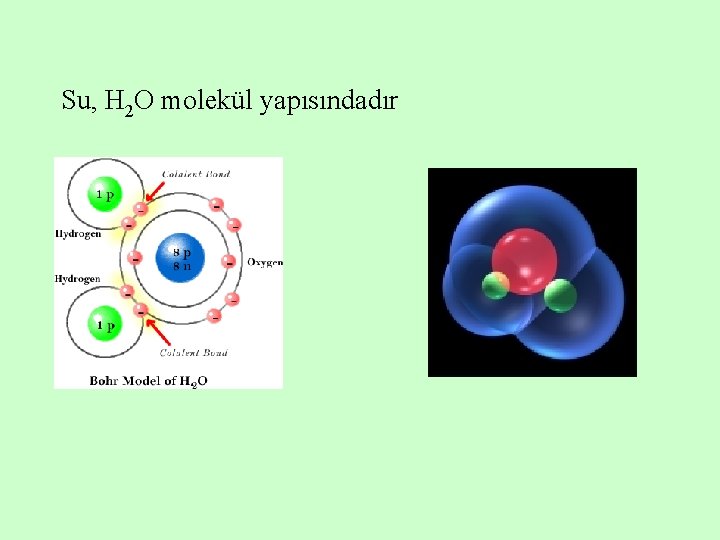
Su, H 2 O molekül yapısındadır

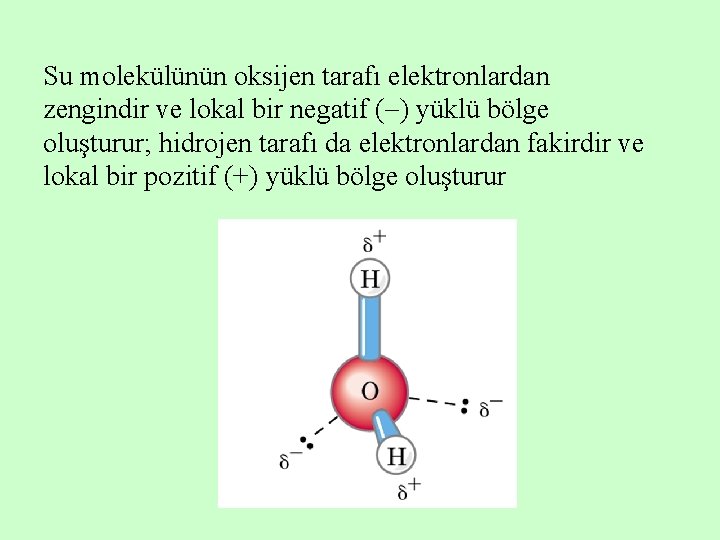
Su molekülünün oksijen tarafı elektronlardan zengindir ve lokal bir negatif ( ) yüklü bölge oluşturur; hidrojen tarafı da elektronlardan fakirdir ve lokal bir pozitif (+) yüklü bölge oluşturur

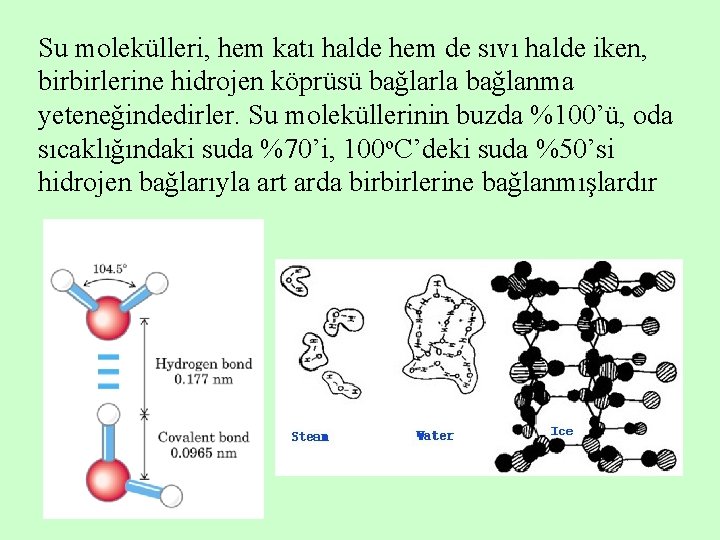
Su molekülleri, hem katı halde hem de sıvı halde iken, birbirlerine hidrojen köprüsü bağlarla bağlanma yeteneğindedirler. Su moleküllerinin buzda %100’ü, oda sıcaklığındaki suda %70’i, 100 o. C’deki suda %50’si hidrojen bağlarıyla art arda birbirlerine bağlanmışlardır

Su, polar bir çözücüdür (solvent). Su içindeki katyonlar su molekülünün negatif yük merkezini çekerler; anyonlar da su molekülünün pozitif yük merkezini çekerler

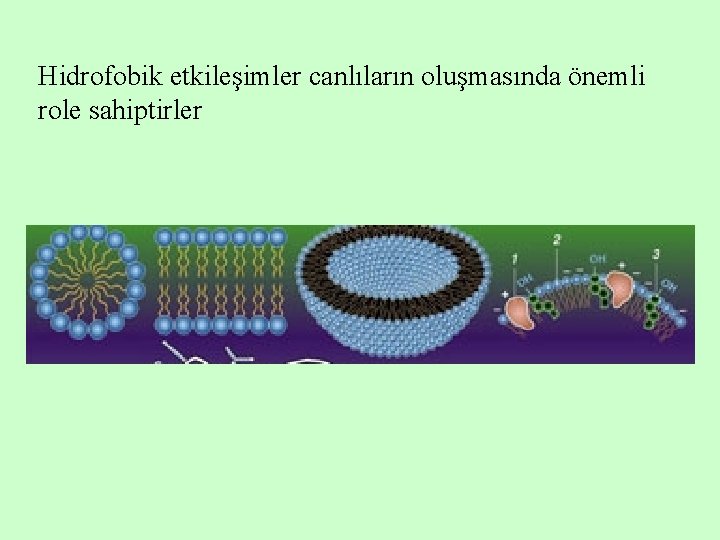
Polar biyomoleküller su içerisinde rahatça çözünürler (hidrofilik-suyu seven-). Nonpolar biyomoleküller su içerisinde zayıf çözünürler ki suda çözünmeyen ve suyla etkileşimden kaçınan maddeler hidrofobik-su sevmezolarak tanımlanırlar

Hidrofobik etkileşimler canlıların oluşmasında önemli role sahiptirler

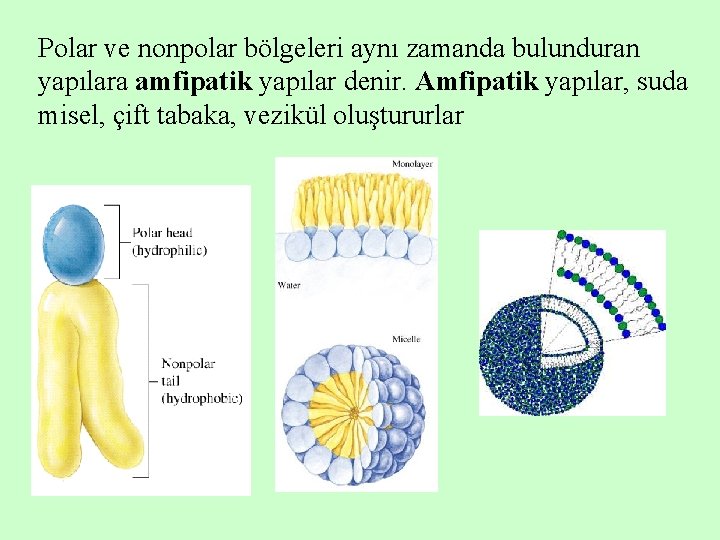
Polar ve nonpolar bölgeleri aynı zamanda bulunduran yapılara amfipatik yapılar denir. Amfipatik yapılar, suda misel, çift tabaka, vezikül oluştururlar

ÇÖZELTİLER Çözücü (solvent) denen dağıtıcı bir faz ile bir veya birçok dağıtılmış fazdan (çözünen, solüt) kurulan sıvı bir örnek durum çözelti (solüsyon) olarak tanımlanır

Partiküllerin yapısına göre çözeltiler 1) Monodispers çözeltide parçacıkların boyutu aynıdır. Polidispers çözeltide parçacıkların boyutu farklıdır ve analitik tekniklerle ayrılabilirler 2) Moleküler çözeltiler (gerçek çözeltiler) çözünenlerin mol kütlesi 10000’in altında iyon ve moleküllerden kurulmuş çözeltilerdir. Makromoleküler çözeltiler çözünenleri büyük moleküllü olanlardır 3) Misel çözeltiler çözünenleri hacimli parçacıklardan veya moleküllerin yığışmasından (agregasyon) kurulur

Makromoleküler çözeltiler ve misel çözeltilere kolloidal çözeltiler veya sol denir

Ortam sıcaklığında suyla çalkalamakla bazı yapılar bir çözelti oluşturmazlar; çabuk çöken, dayanıksız, heterojen ve süspansiyon denen bir durumu yaparlar

Peltemsi bir şekil alan ve katı maddelerin bir çok özelliklerine sahip olan kolloidal sisteme jel denir

Çözünen madde konsantrasyonuna göre çözeltiler 1) Dilüe çözeltiler (seyreltik çözeltiler) 2) Konsantre çözeltiler (derişik çözeltiler) 3) Doymuş çözeltiler (satüre çözeltiler)

Dilüe çözeltiler (seyreltik çözeltiler), çözünmüş madde miktarının az olduğu çözeltilerdir (konsantrasyonu düşük çözeltiler)

Konsantre çözeltiler (derişik çözeltiler), çözünmüş madde miktarının fazla olduğu çözeltilerdir (konsantrasyonu yüksek çözeltiler)

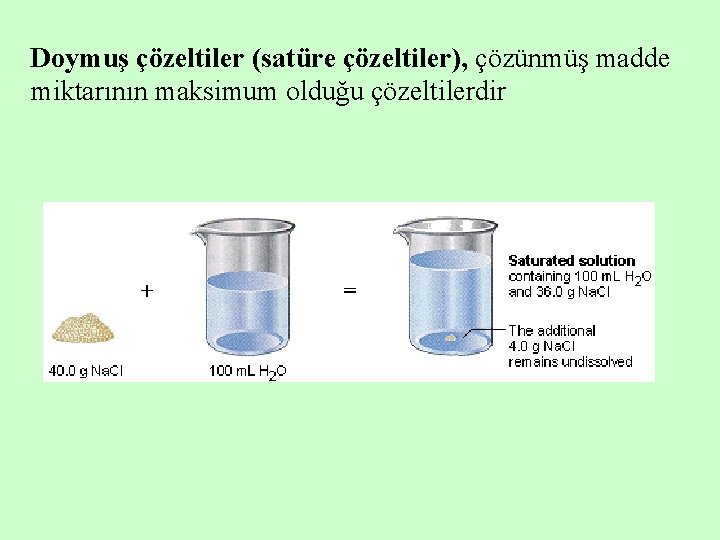
Doymuş çözeltiler (satüre çözeltiler), çözünmüş madde miktarının maksimum olduğu çözeltilerdir

Çözelti konsantrasyonları Bir çözeltinin konsantrasyonu, çözeltinin belirli bir volümü içinde çözünmüş olan madde (substrat) miktarıdır

-Yüzde (% ) -Molarite (M) -Molalite (m) -Normalite (N) çözelti konsantrasyonlarını anlatmak için kullanılan ifadelerdir

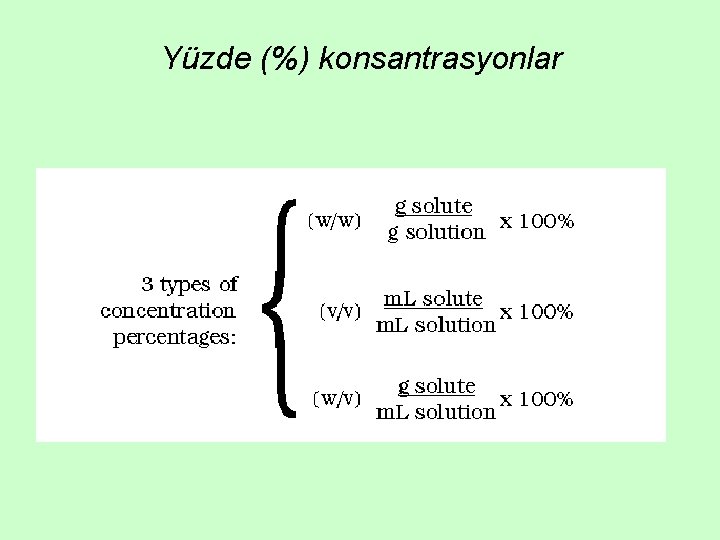
Yüzde (%) konsantrasyonlar

Çözeltinin konsantrasyonu %8 w/w deyince, 8 g çözünenin 100 g çözeltide bulunduğu anlaşılır

Çözeltinin konsantrasyonu %70 v/v deyince, 70 m. L çözünenin 100 m. L çözeltide bulunduğu anlaşılır Hem çözücünün hem çözünenin sıvı olduğu çözelti konsantrasyonunu ifade etmek için kullanılır

%15’lik 500 m. L etanol çözeltisi hazırlamak için 0, 15 x 500=75 m. L etanol 500 m. L’lik balon jojede total volüm 500 m. L olacak şekilde distile su ile karıştırılır H 2 SO 4 gibi asitlerin çözünmeleri sırasında açığa çıkan fazla miktarda ısı balonun aşırı ısınma ile çatlamasına neden olabilir. Bu durumda soğutmak amacıyla balonun dışı, akan çeşme suyu altında tutulmalı, fakat bu sırada balonun içine çeşme suyu kaçmamasına dikkat etmelidir Ayrıca asit üzerine su eklenmemelidir Asit sulandırmalarında daima su üzerine asit eklemelidir

%w/v, genellikle g/d. L (g/100 m. L)’ye karşılık gelir Çözeltinin konsantrasyonu %8 w/v deyince, 8 g çözünenin 100 m. L çözeltide bulunduğu anlaşılır %8= 8 g/100 m. L= 8 g/d. L=80 g/L =8000 mg/100 m. L=8000 mg/d. L=80000 mg/L

%20’lik 250 m. L üre çözeltisi hazırlamak için -0, 20 x 250=50 g üre 250 m. L’lik balon jojeye konur -önce bu miktar üre çözünecek kadar distile su eklenerek bilekten seri hareketlerle çalkalanarak çözünme sağlanır -sonra total hacim distile su ile 250 m. L’ye tamamlanır KOH ve Na. OH gibi bazların çözünmeleri sırasında açığa çıkan fazla miktarda ısı balonun aşırı ısınma ile çatlamasına neden olabilir. Bu durumda soğutmak amacıyla balonun dışı, akan çeşme suyu altında tutulmalı; fakat bu sırada balonun içine çeşme suyu kaçmamasına dikkat etmelidir

Molarite (M) Molarite, 1 L çözeltideki mol sayısıdır Molaritenin ölçüm birimi mol/litre ve sembolü M’dir 1 M çözelti deyince çözeltinin 1 litresinde 1 mol çözünen bulunduğu anlaşılır 1 M=1 mol/L=1000 m. M=1000000 M 1 m. M=1 mmol/L= 0, 001 M 1 M=1 µmol/L= 0, 001 m. M

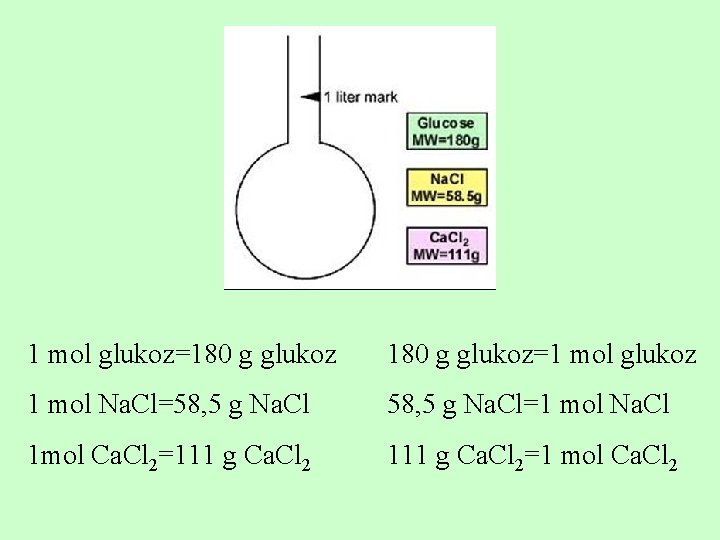
1 mol glukoz=180 g glukoz=1 mol glukoz 1 mol Na. Cl=58, 5 g Na. Cl=1 mol Na. Cl 1 mol Ca. Cl 2=111 g Ca. Cl 2=1 mol Ca. Cl 2

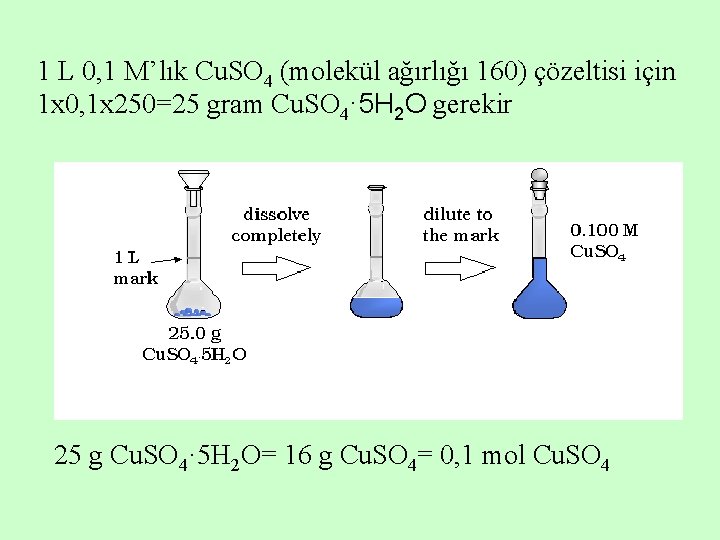
1 L 0, 1 M’lık Cu. SO 4 (molekül ağırlığı 160) çözeltisi için 1 x 0, 1 x 250=25 gram Cu. SO 4· 5 H 2 O gerekir 25 g Cu. SO 4· 5 H 2 O= 16 g Cu. SO 4= 0, 1 mol Cu. SO 4

Dansitesi 1, 19 olan % 38’lik konsantre HCl’den (HCl’nin molekül ağırlığı 36, 46) 500 m. L 2 M’lık HCl çözeltisinin, hazırlamak için gerekir

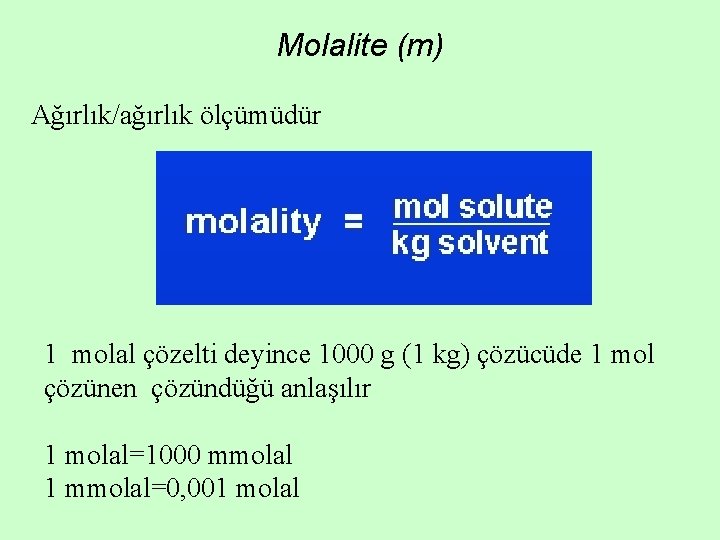
Molalite (m) Ağırlık/ağırlık ölçümüdür 1 molal çözelti deyince 1000 g (1 kg) çözücüde 1 mol çözünen çözündüğü anlaşılır 1 molal=1000 mmolal 1 mmolal=0, 001 molal

Molalite, sıcaklık değişimine bağımlı değildir Konsantrasyon birimi olarak molariteye oranla daha duyarlıdır. Buna rağmen klinik laboratuvarlarda kullanımı yaygın değildir Klinik laboratuvarlarda kullanılan çözeltiler sulu çözeltiler olduklarından molalite ile molarite arasında pek büyük fark yoktur

Normalite (N) Normalite, 1 L çözeltideki ekivalan ağırlık sayısıdır Normalitenin ölçüm birimi Eq/litre ve sembolü N’dir 1 N çözelti deyince çözeltinin 1 litresinde 1 Eq (1000 m. Eq) çözünen bulunduğu anlaşılır 1 N=1 Eq/L=1000 m. Eq/L=1000000 Eq/L 1 m. N=0, 001 N=1000 N=1 m. Eq/L

500 m. L 2, 5 N’lik Na. OH (molekül ağırlığı 40) çözeltisi hazırlamak için gerekir

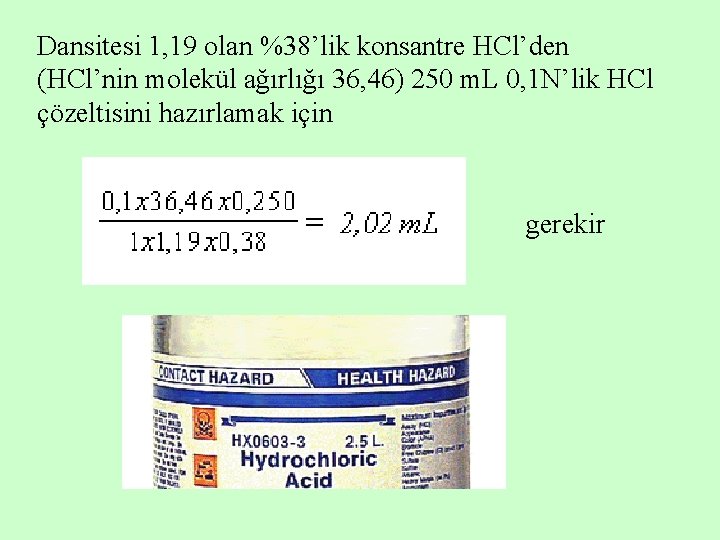
Dansitesi 1, 19 olan %38’lik konsantre HCl’den (HCl’nin molekül ağırlığı 36, 46) 250 m. L 0, 1 N’lik HCl çözeltisini hazırlamak için gerekir

Konsantrasyon birimlerinin birbirine çevrilmesi

Çözeltilerin seyreltilmesi Konsantre bir çözeltiden dilüe bir çözelti hazırlanmasına seyreltme (dilusyon) denir

Biyokimyada yapılan seyreltmeler, toplam çözeltinin bütün özelliklerini içerecek şekilde hazırlanır 1: 100’luk seyreltme yapılırken konsantre çözeltiden 1 birim alınarak toplam hacim olan 100 birime tamamlanır

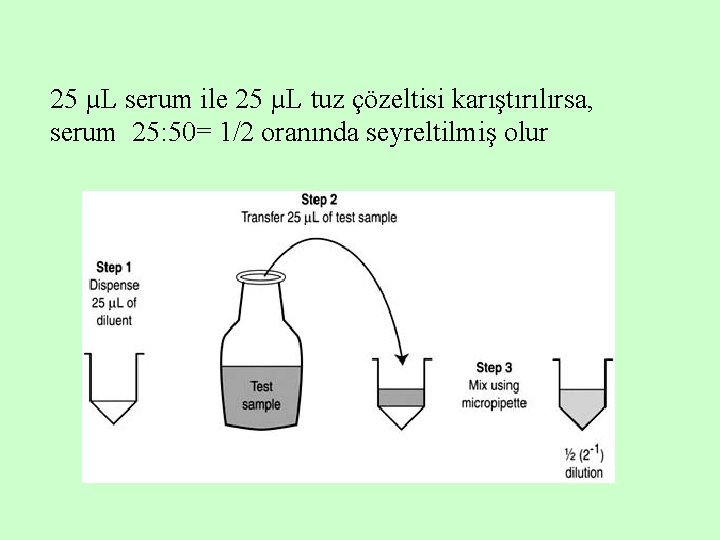
25 µL serum ile 25 µL tuz çözeltisi karıştırılırsa, serum 25: 50= 1/2 oranında seyreltilmiş olur

Sabit konsantrasyondan bir alt düşük konsantrasyona ulaşmak için seri seyreltmeler yapılır


Çözeltilerde C molarite veya normalite olarak ifade edildiği zaman

Hidratlı maddeler Bir kimyasal molekül üretildiğinde, tuz moleküllerine bağlı, değişen miktarlarda su molekülleri (hidrat suyu) içerir Cu. SO 4 molekül ağırlığı 160 Cu. SO 4 H 2 O molekül ağırlığı 178 Cu. SO 4 5 H 2 O molekül ağırlığı 250

Hidratlı maddelerdeki su molekülleri, çözelti hesaplamalarında dikkate alınır. Örneğin; 250 m. L %10’luk Cu. SO 4 çözeltisini hidrasyon suyu olmayan bakır sülfattan (Cu. SO 4, molekül ağırlığı 160) değil de 1 molekül hidrasyon suyu olan bakır sülfattan (Cu. SO 4 H 2 O, molekül ağırlığı 178) ile hazırlayacaksak tartacağımız Cu. SO 4 H 2 O miktarı

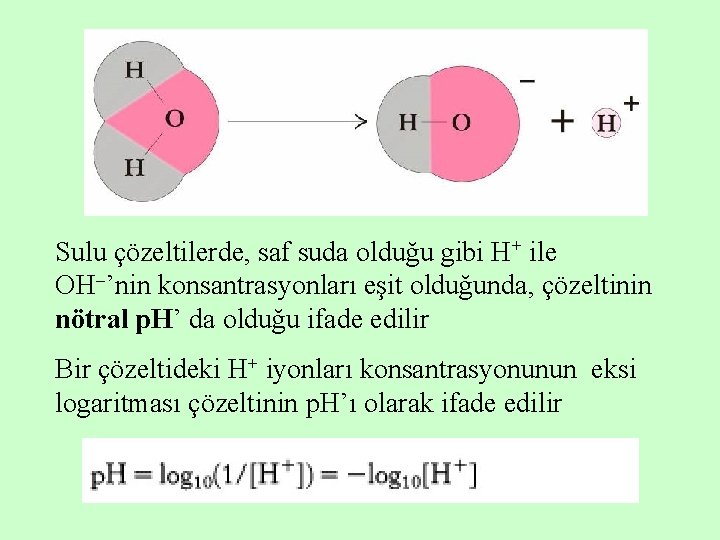
p. H, ASİTLER VE BAZLAR Bir su molekülü, çok az sayıda bile olsa komşu su molekülü lehine bir proton yitirebilir ve böylece bir hidronyum iyonu (H 3 O+) oluşturabilir. Su, az da olsa hidronyum ve hidroksil iyonlarına ayrışır

Sulu çözeltilerde, saf suda olduğu gibi H+ ile OH ’nin konsantrasyonları eşit olduğunda, çözeltinin nötral p. H’ da olduğu ifade edilir Bir çözeltideki H+ iyonları konsantrasyonunun eksi logaritması çözeltinin p. H’ı olarak ifade edilir

Nötral p. H’da H+ ile OH ’nin konsantrasyonu birbirine eşit ve 10 -7 M’dır

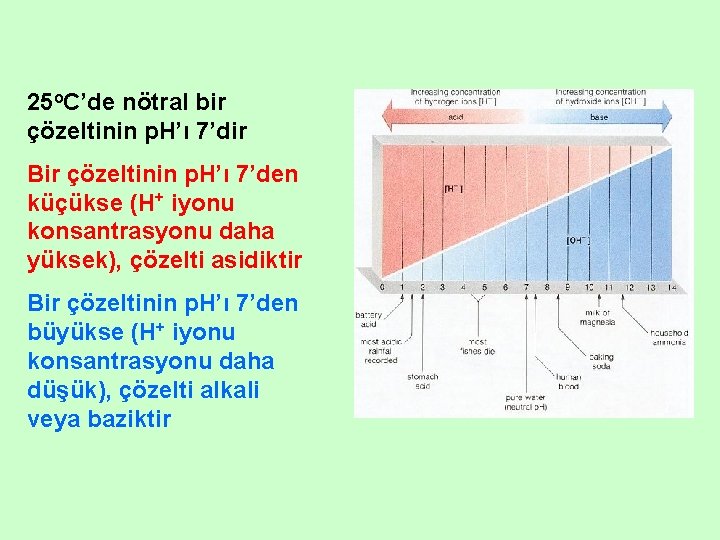
25 o. C’de nötral bir çözeltinin p. H’ı 7’dir Bir çözeltinin p. H’ı 7’den küçükse (H+ iyonu konsantrasyonu daha yüksek), çözelti asidiktir Bir çözeltinin p. H’ı 7’den büyükse (H+ iyonu konsantrasyonu daha düşük), çözelti alkali veya baziktir

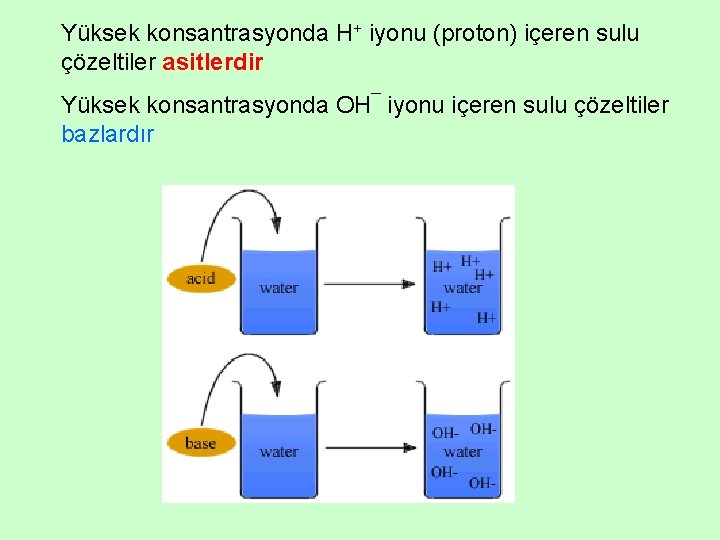
Yüksek konsantrasyonda H+ iyonu (proton) içeren sulu çözeltiler asitlerdir Yüksek konsantrasyonda OH¯ iyonu içeren sulu çözeltiler bazlardır

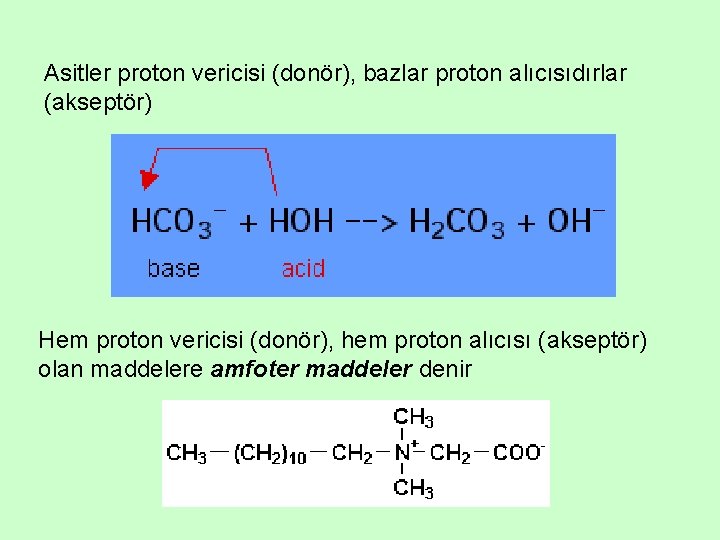
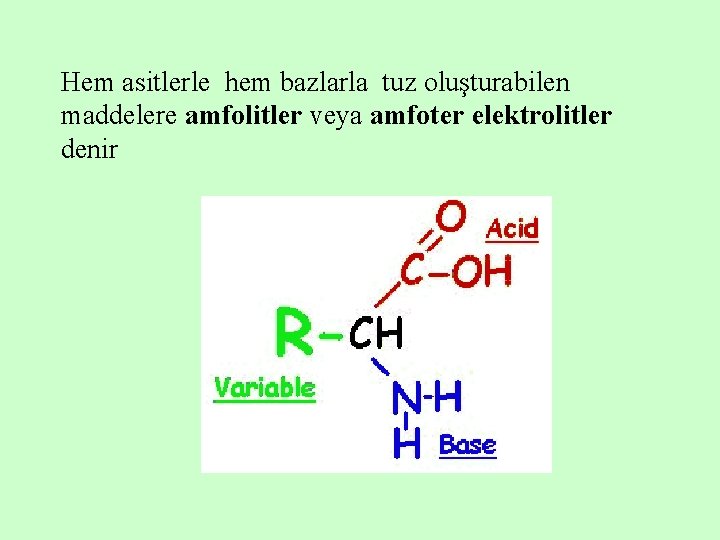
Asitler proton vericisi (donör), bazlar proton alıcısıdırlar (akseptör) Hem proton vericisi (donör), hem proton alıcısı (akseptör) olan maddelere amfoter maddeler denir

Bir proton donörü ve ona uygun proton akseptörü, bir konjuge asit-baz çifti oluştururlar

Asit ve bazların suda çözündüklerinde iyonize oluşları faklıdır. Buna göre zayıf asit – kuvvetli asit veya zayıf baz – kuvvetli baz tanımı yapılır

Biyokimyacılar için, suda çözündüklerinde tamamen iyonize olmayan zayıf asit ve bazların davranışı önemlidir Zayıf asit ve bazlar, biyolojik sistemlerde bulunurlar; metabolizmada ve metabolizmanın düzenlenmesinde önemli rol oynarlar

Suda çözündüklerinde büyük oranda iyonize olan asitler kuvvetli asitlerdir (Ka değerleri büyük, p. Ka değerleri küçük) Suda çözündüklerinde az miktarda iyonize olan asitler zayıf asitlerdir (Ka değerleri küçük, p. Ka değerleri büyük)

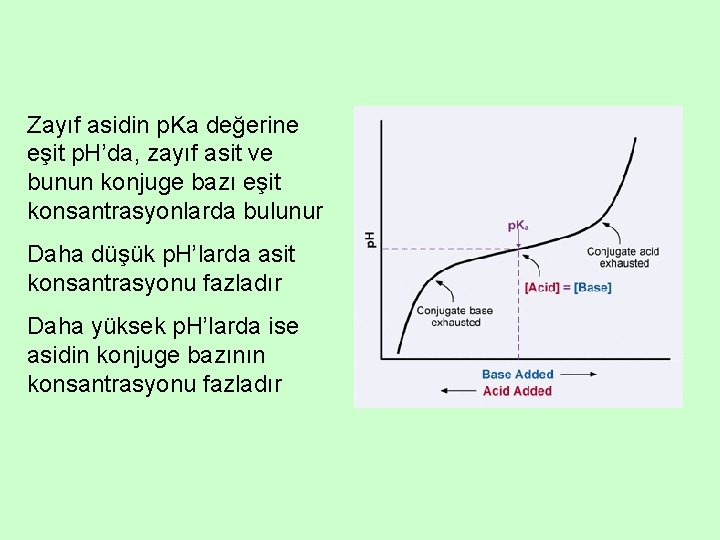
Zayıf asidin p. Ka değerine eşit p. H’da, zayıf asit ve bunun konjuge bazı eşit konsantrasyonlarda bulunur Daha düşük p. H’larda asit konsantrasyonu fazladır Daha yüksek p. H’larda ise asidin konjuge bazının konsantrasyonu fazladır

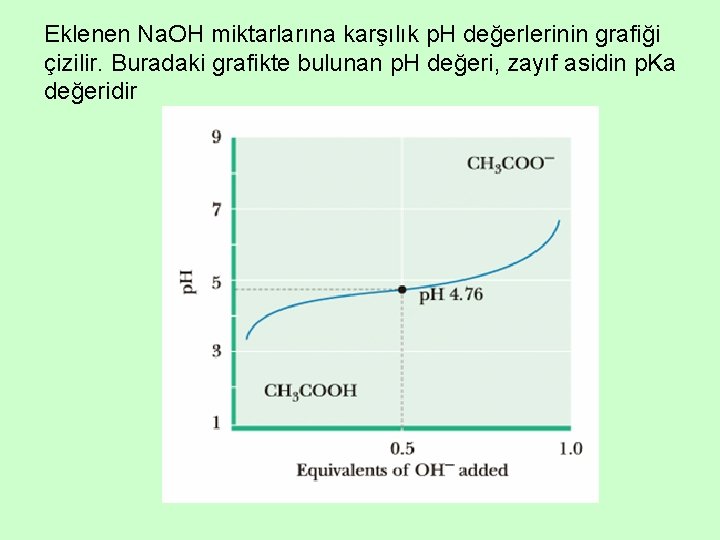
Zayıf asitlerin p. Ka değerleri, titrasyon grafiği çizilerek bulunabilir. Bunun için, belirli volümdeki asit örneği, konsantrasyonu bilinen kuvvetli bir baz (genellikle Na. OH) çözeltisi ile titre edilir Na. OH, bir indikatör boya veya bir p. H metre ile nötralizasyon sağlandığı anlaşılıncaya kadar, aside yavaş ilave edilir Asidin belirli bir volümüne belirli miktarlarda Na. OH eklendikçe p. H ölçümü yapılır

Eklenen Na. OH miktarlarına karşılık p. H değerlerinin grafiği çizilir. Buradaki grafikte bulunan p. H değeri, zayıf asidin p. Ka değeridir

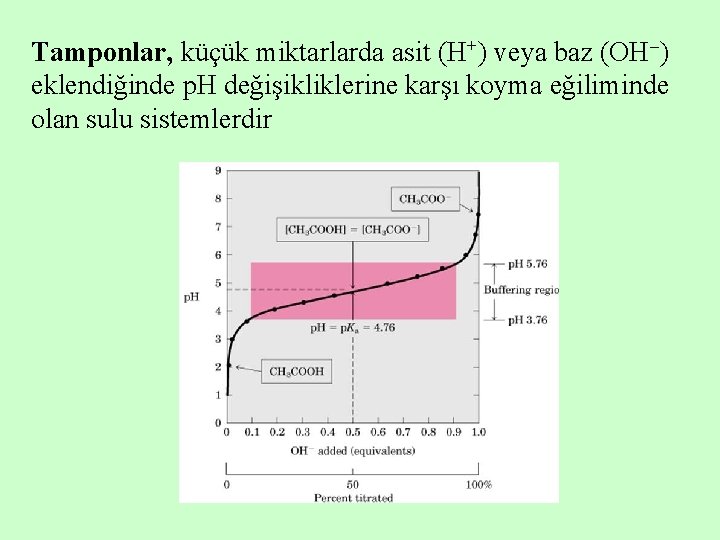
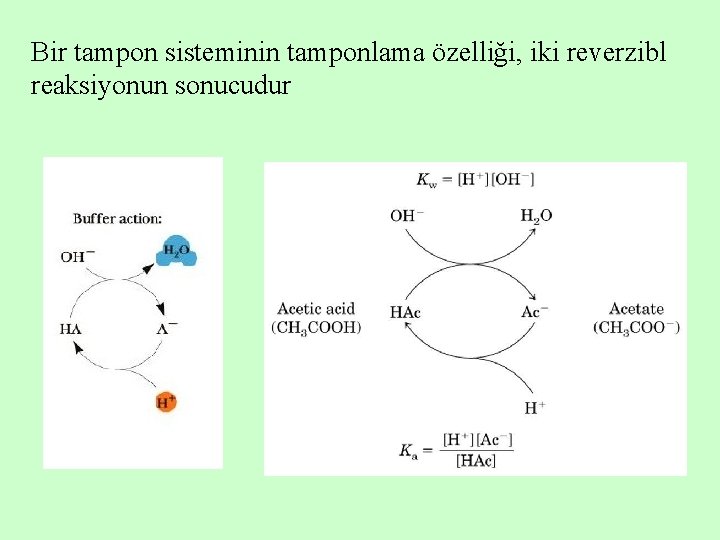
Tamponlar Zayıf bir asit (proton donörü) ve onun konjuge bazını (proton akseptörü) eşit miktarlarda içeren karışımlar tampon sistemi olarak bilinirler

Tamponlar, küçük miktarlarda asit (H+) veya baz (OH ) eklendiğinde p. H değişikliklerine karşı koyma eğiliminde olan sulu sistemlerdir

Bir tampon sisteminin tamponlama özelliği, iki reverzibl reaksiyonun sonucudur


p. H, zayıf asit ile onun konjuge bazının bir karışımının tamponlama etkisi ve zayıf asidin p. Ka’sı arasındaki kantitatif ilişki, Henderson-Hasselbalch denklemi ile ifade edilir

Henderson-Hasselbalch denklemi, her hangi bir p. H’da proton donör ve proton akseptörün molar oranını hesaplamaya yarar Örneğin; asetik asidin p. Ka değeri 4, 76 olduğuna göre asetat ve asetik asitten p. H’ı 5, 30 olan asetat tamponu hazırlamak için gerekli asetat ve asetik asidin molar konsantrasyon oranı

Henderson-Hasselbalch denklemi, verilen bir p. Ka ve molar orana göre bir asit-baz çifti için p. H’ı hesaplamaya yarar. Örneğin; kanda önemli bir tampon sistemi olan bikarbonat/karbonik asit tampon sistemi için

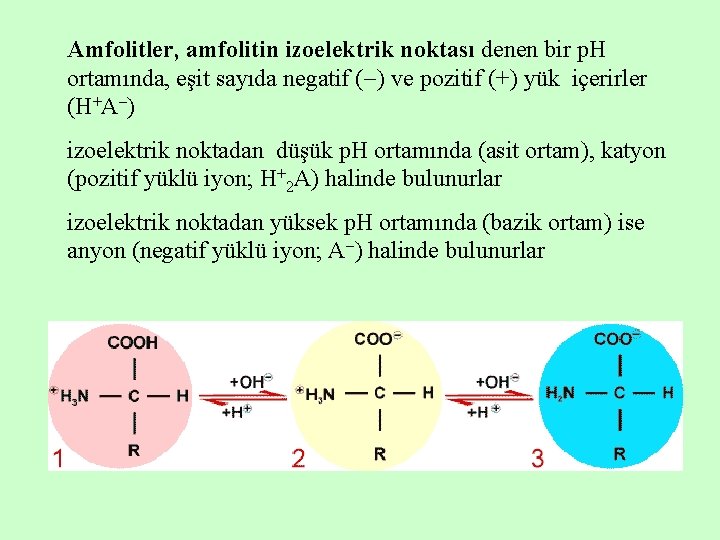
Hem asitlerle hem bazlarla tuz oluşturabilen maddelere amfolitler veya amfoter elektrolitler denir

Amfolitler, amfolitin izoelektrik noktası denen bir p. H ortamında, eşit sayıda negatif ( ) ve pozitif (+) yük içerirler (H+A ) izoelektrik noktadan düşük p. H ortamında (asit ortam), katyon (pozitif yüklü iyon; H+2 A) halinde bulunurlar izoelektrik noktadan yüksek p. H ortamında (bazik ortam) ise anyon (negatif yüklü iyon; A ) halinde bulunurlar

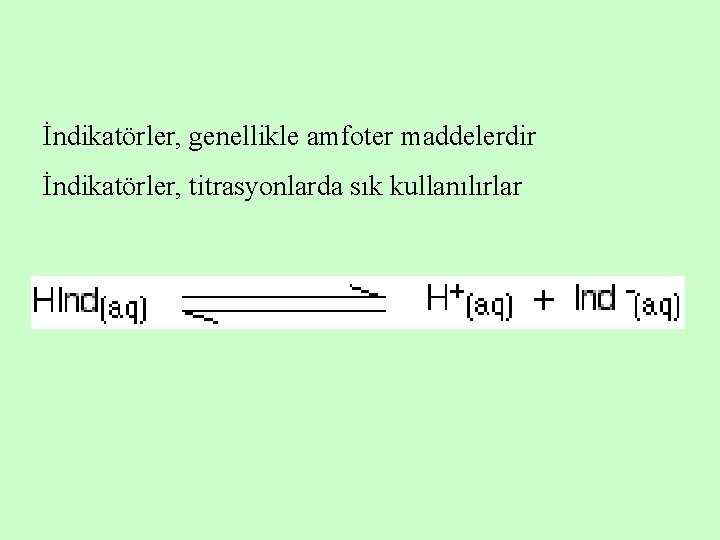
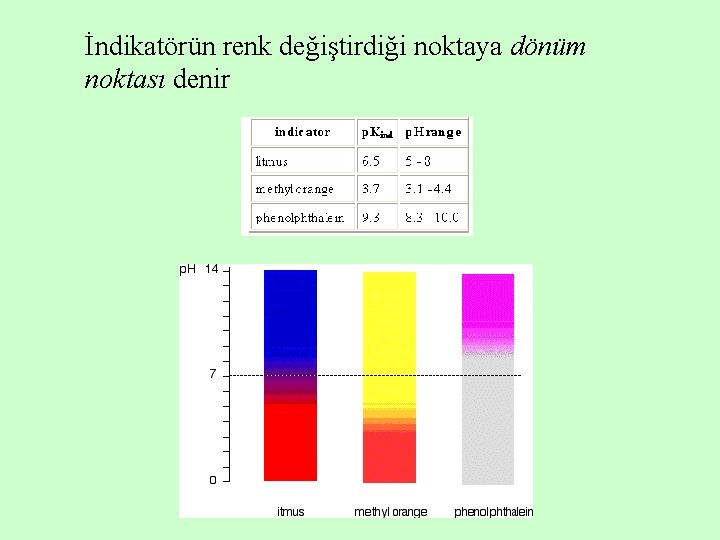
Sulu çözeltide ortamın H+ iyonu konsantrasyonuna (p. H’ına) göre renk değiştiren maddeler indikatör olarak tanımlanırlar

İndikatörler, genellikle amfoter maddelerdir İndikatörler, titrasyonlarda sık kullanılırlar

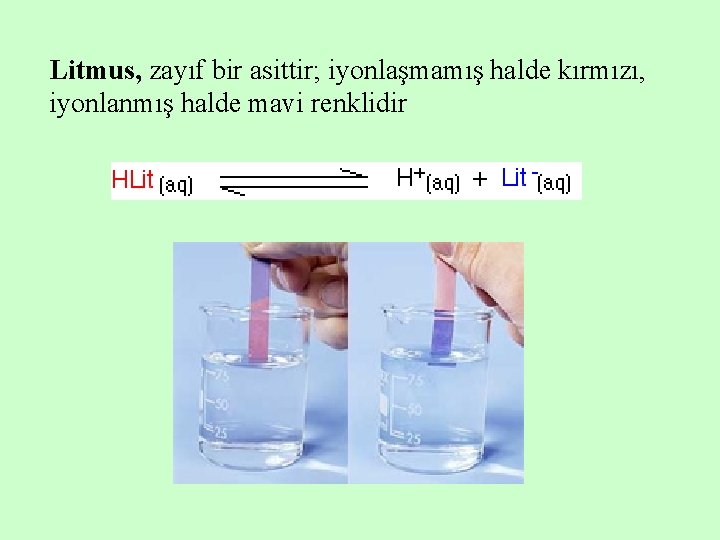
Litmus, zayıf bir asittir; iyonlaşmamış halde kırmızı, iyonlanmış halde mavi renklidir

Methyl orange zayıf bir asittir; iyonlaşmamış halde kırmızı, iyonlanmış halde sarı renklidir

Phenolphthalein, zayıf bir asittir; iyonlaşmamış halde renksiz, iyonlanmış halde pembe renklidir

İndikatörün renk değiştirdiği noktaya dönüm noktası denir

Sulu çözeltilerin p. H’ı, genellikle bir amfolit olan ve ortamın H+ iyonu konsantrasyonuna (p. H’ına) göre renk değiştiren indikatör boyalar yardımıyla ölçülebilir

Sulu çözeltilerin p. H’ını ortamın H+ iyonu konsantrasyonuna (p. H’ına) göre renk değiştiren indikatör boyalar yardımıyla ölçme yöntemlerine kolorimetrik yöntemler denir

Sulu çözeltilerin p. H’ı, elektrometrik yöntemler denen, iki elektrot arasındaki potansiyel farkının bir galvanometre ile ölçülmesi esasına dayanan yöntemlerle daha hassas olarak ölçülebilir

p. H metre denen aletlerde elektrottan çıkan sinyal, şiddetlendirilir ve p. H’ı bilinen bir çözelti tarafından oluşturulan sinyal ile karşılaştırılır
 Mustafa periz
Mustafa periz Mustafa emre ilal
Mustafa emre ilal Saqib mustafa
Saqib mustafa Qellimi i projektit
Qellimi i projektit Hatay yatay geçiş şartları
Hatay yatay geçiş şartları Fehling causse bonnans
Fehling causse bonnans Mustafa beğen
Mustafa beğen Retino motor value
Retino motor value Sana sphere
Sana sphere Ahmet beler
Ahmet beler Dindersimateryal
Dindersimateryal Harran otomasyon
Harran otomasyon International hydrographic organisation
International hydrographic organisation 1881 turkey
1881 turkey Diplomat ymm
Diplomat ymm Mustafa adıyaman ortaokulu
Mustafa adıyaman ortaokulu Mustafa kemal'in hayatını etkileyen şehirler
Mustafa kemal'in hayatını etkileyen şehirler Mustafa sezer pehlivan
Mustafa sezer pehlivan Görünüş
Görünüş Attila margos antlaşması
Attila margos antlaşması Khalid mustafa
Khalid mustafa Pleurat mustafa
Pleurat mustafa Prof dr mustafa şahin endokrin
Prof dr mustafa şahin endokrin Mustafa ferit acar
Mustafa ferit acar Ymm mustafa sezen
Ymm mustafa sezen Nanoelektronik
Nanoelektronik Mustafa uckun los angeles
Mustafa uckun los angeles Vesiletü'n necat mesnevi mi
Vesiletü'n necat mesnevi mi Dr mahmoud salman
Dr mahmoud salman Mustafa arikan
Mustafa arikan Dr mustafa shakir
Dr mustafa shakir Mustafa sheikh
Mustafa sheikh Mustafa kemal seslense
Mustafa kemal seslense Threads consumes cpu in best possible manner
Threads consumes cpu in best possible manner Mustafa gul
Mustafa gul Mustafa altınışık biyokimya
Mustafa altınışık biyokimya Kırma çatı kesiti
Kırma çatı kesiti Mustafa shakir contacts
Mustafa shakir contacts Mustafa atilla
Mustafa atilla Mustafa gözen epdk
Mustafa gözen epdk Hipostenuria
Hipostenuria Doç dr mustafa bulut kimdir
Doç dr mustafa bulut kimdir Amina mustafa
Amina mustafa Dr mustafa oglu
Dr mustafa oglu Dr mustafa shakir
Dr mustafa shakir Prof. dr. mustafa serdar genç
Prof. dr. mustafa serdar genç Tansu ciller
Tansu ciller Bain devresi
Bain devresi Mustafa akpınar gib
Mustafa akpınar gib Mustafa yel matematik soruları
Mustafa yel matematik soruları Thrombofili
Thrombofili Pem hastalığı
Pem hastalığı Dr mustafa shakir
Dr mustafa shakir Mustafa altınışık biyokimya
Mustafa altınışık biyokimya Dr mustafa mete
Dr mustafa mete Marwan hassan mustafa
Marwan hassan mustafa Dr mustafa cengiz
Dr mustafa cengiz Mustafa bulut ymm
Mustafa bulut ymm Mustafa erol deu
Mustafa erol deu Dr mustafa korkut
Dr mustafa korkut Dr mustafa shakir
Dr mustafa shakir ömer ergenç ymm
ömer ergenç ymm Dere yatağına ev yapan mustafa bey
Dere yatağına ev yapan mustafa bey Mustafa emre ilal
Mustafa emre ilal