Srec metody Sren u u u Nezamovat s

















- Slides: 32

Srážecí metody

Srážení u u u Nezaměňovat s denaturací – bílkoviny zůstávají v nativním stavu První metody používané pro separaci bílkovin – Et. OH, (NH 4)2 SO 4 Filtrace nahrazena centrifugací

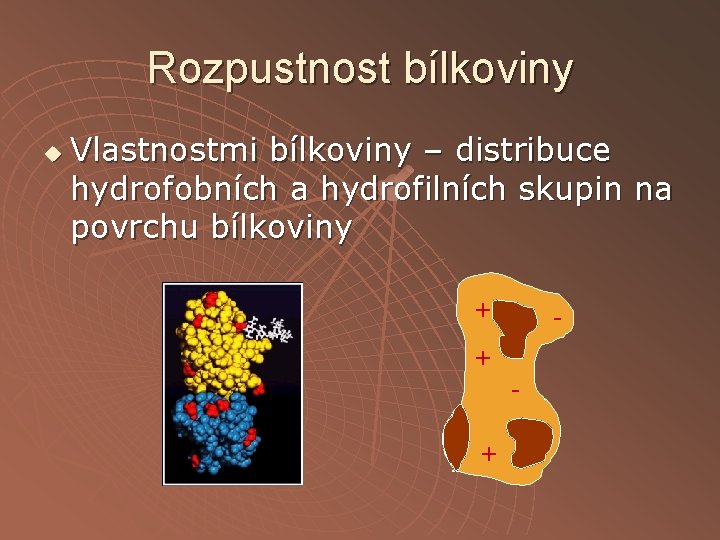
Rozpustnost bílkoviny u Vlastnostmi bílkoviny – distribuce hydrofobních a hydrofilních skupin na povrchu bílkoviny + + + -

Rozpustnost bílkoviny u Vlastnostmi roztoku – p. H, iontová síla, org. rozpouštědla, org. polymery, teplota

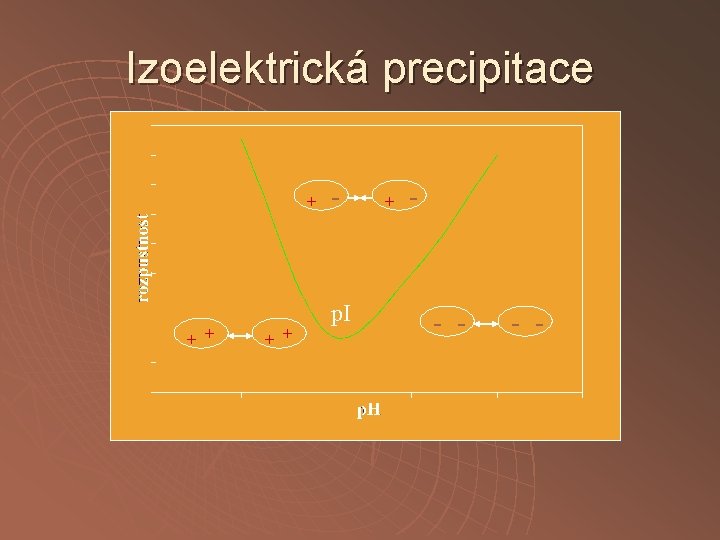
Izoelektrická precipitace + + + - p. I + - - -

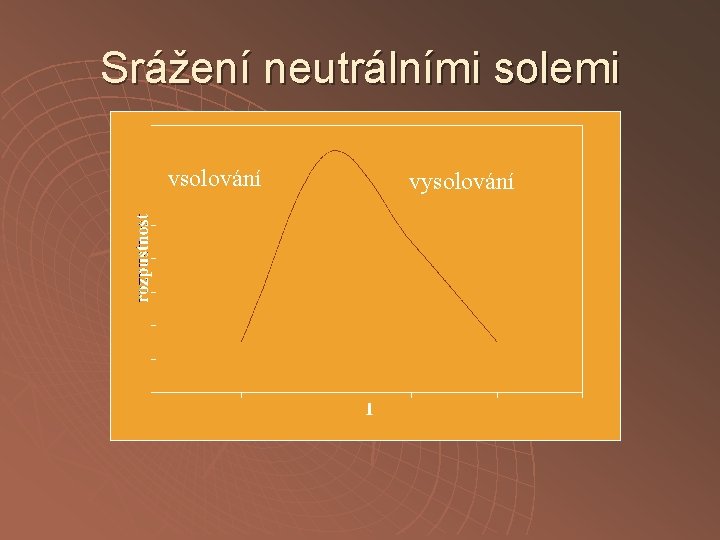
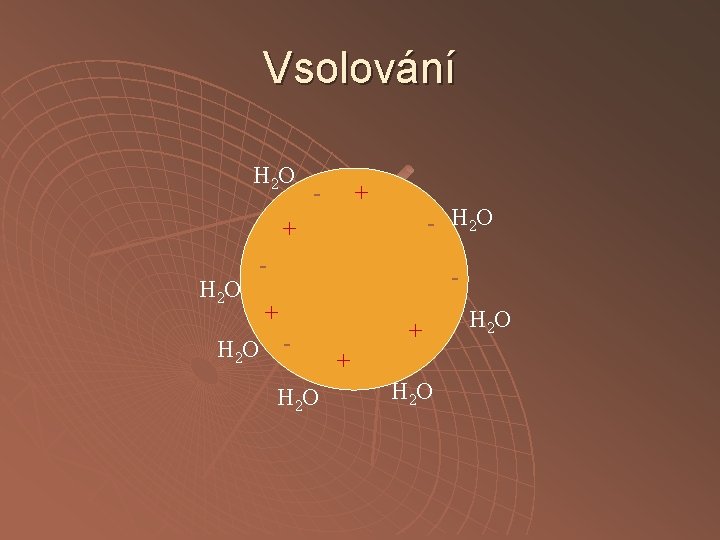
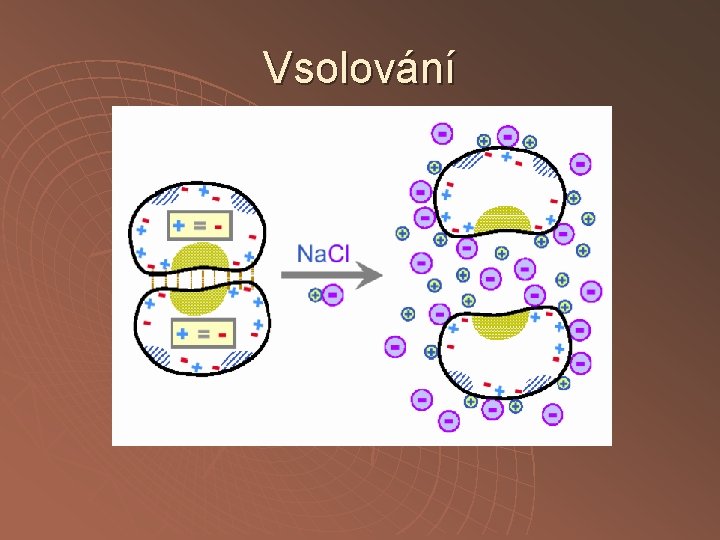
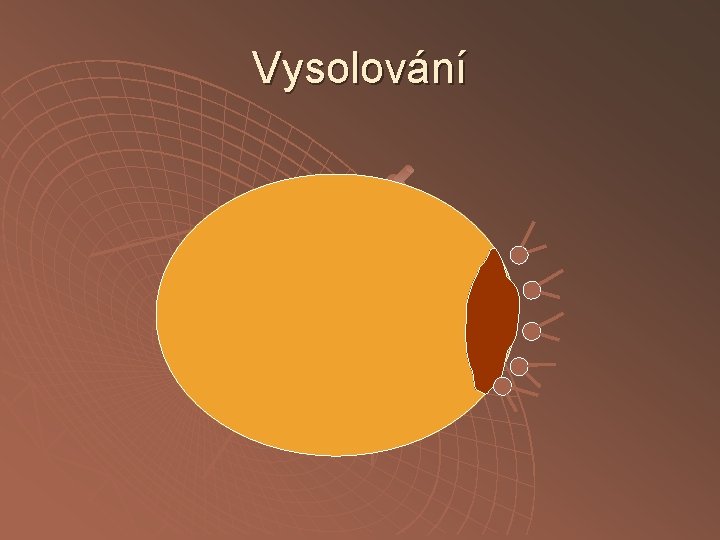
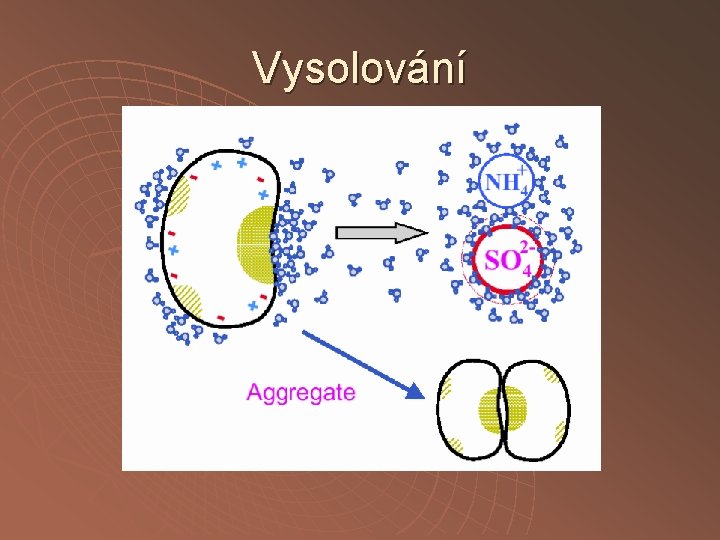
Srážení neutrálními solemi vsolování vysolování

Vsolování H 2 O - + - H 2 O + H 2 O - - + H 2 O + + H 2 O

Vsolování

Vysolování

Vysolování

Praktické aspekty u Hofmeistrova řada Anionty SCN-, J-, Cl. O 4 -, NO 3 -, Br-, Cl-, Ac-, SO 42 -, PO 43 - Kationty Na+, K+, NH 4+

(NH 4)2 SO 4 Rozpustnost se málo mění s teplotou u Saturovaný roztok 4 M - hustota 1, 235 g/cm 3 umožňuje centrifugaci agregovaných bílkovin (hustota 1, 29 g/cm 3) u Levný u Stabilizuje bílkoviny u Relativně čistý u

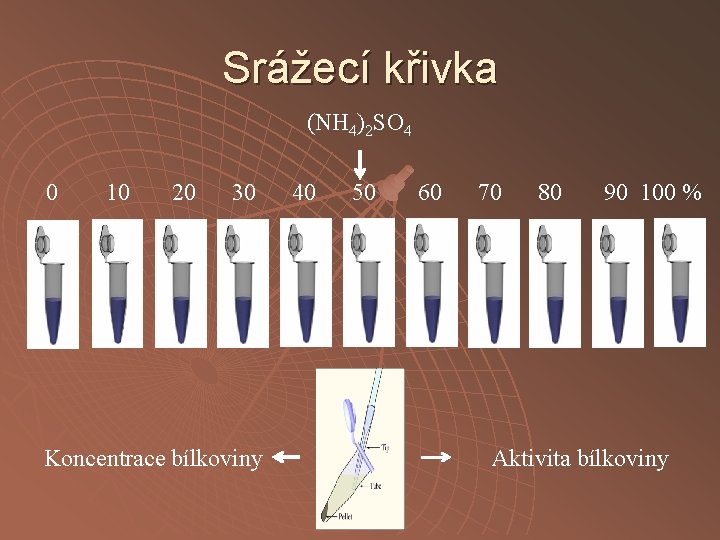
Srážecí křivka (NH 4)2 SO 4 0 10 20 30 Koncentrace bílkoviny 40 50 60 70 80 90 100 % Aktivita bílkoviny

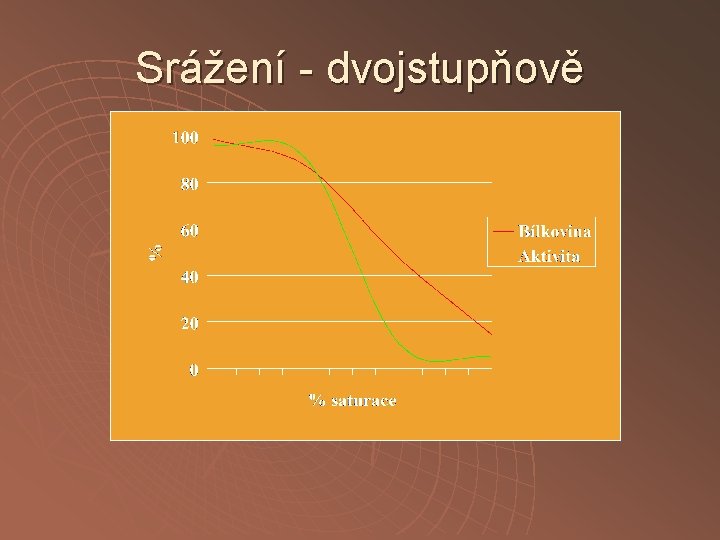
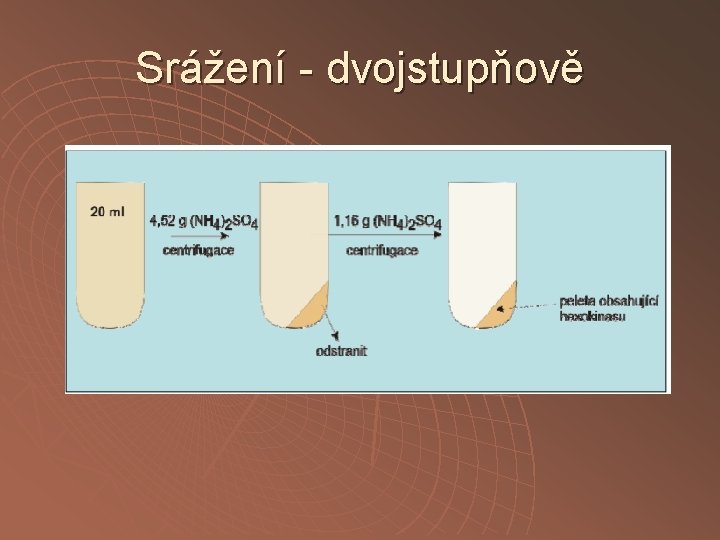
Srážení - dvojstupňově

Srážení - dvojstupňově

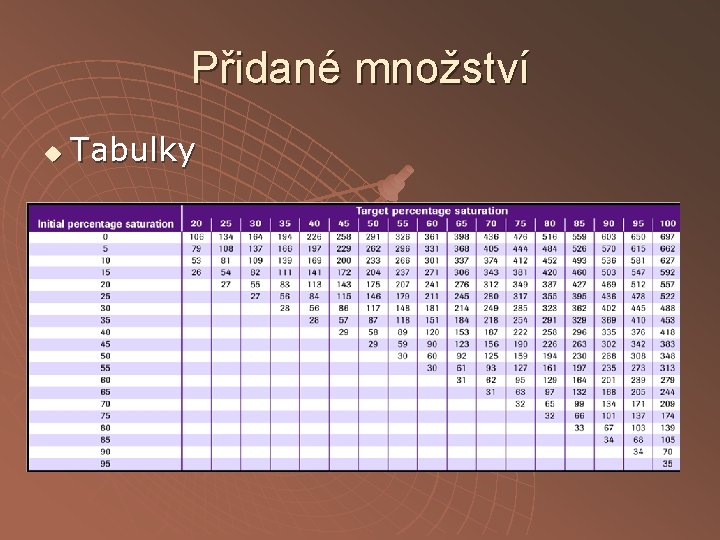
Přidané množství u Tabulky u Vzorce

Přidané množství u Tabulky u Vzorce

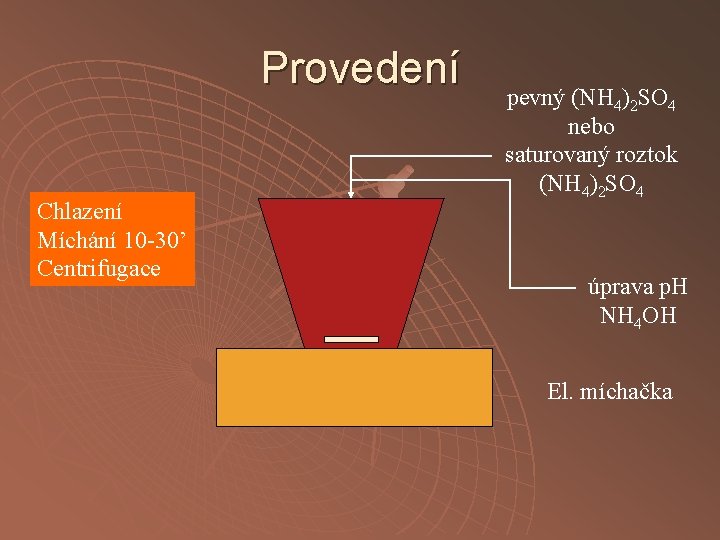
Provedení Chlazení Míchání 10 -30’ Centrifugace pevný (NH 4)2 SO 4 nebo saturovaný roztok (NH 4)2 SO 4 úprava p. H NH 4 OH El. míchačka

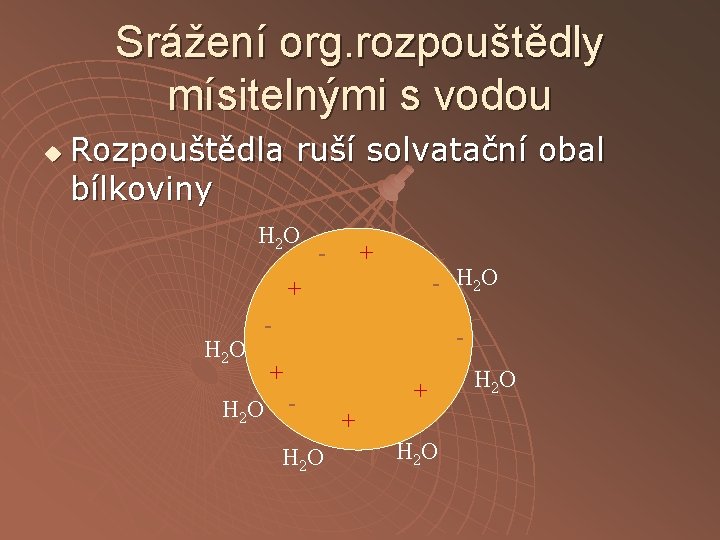
Srážení org. rozpouštědly mísitelnými s vodou u Rozpouštědla ruší solvatační obal bílkoviny H 2 O - + - H 2 O + H 2 O - - + H 2 O + + H 2 O

Srážení org. rozpouštědly mísitelnými s vodou



Výběr rozpouštědla u Kompletně mísitelné s vodou u Nereaguje s bílkovinou u Musí mít dobrý precipitační efekt Et. OH, aceton, Met. OH, propanol, dioxan

Srážení org. rozpouštědly mísitelnými s vodou u Nutno provádět při T < 0 o. C, při větší teplotě dochází k denaturaci u Dvojstupňově u Přídavky z tabulky nebo podle vzorce

Srážení org. polymery Princip identický s rozpouštědly DEAE dextran u PEG u Polyakrylová kyselina u Rivanol u Kaprylová kyselina u

Srážení selektivní denaturací u u u Při této metodě denaturujeme balastní bílkoviny, cílová bílkovina musí zůstat z 85 - 90 % v nativním stavu. Denaturační vlivy – T, p. H, org. rozpouštědla Bílkovina musí nejen denaturovat i precipitovat

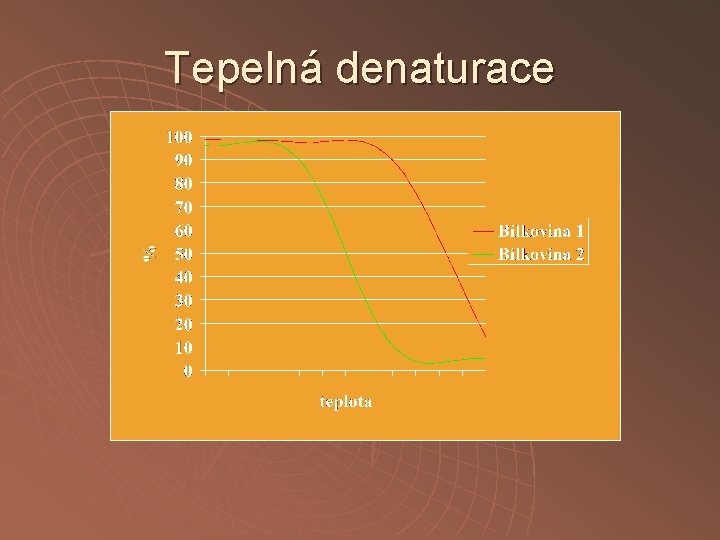
Tepelná denaturace

Tepelná denaturace u u Doba inkubace je důležitá pouze pro reprodukovatelnost – denaturační křivka se tím posouvá po teplotní ose, má význam pro vyhřívání větších objemů Přídavky některých látek (substráty, koenzymy, inhibitory) zvyšují stabilitu cílových bílkovin

u u p. H při tepelné denaturaci musí být přesně definováno Při vyšší teplotě běží více proteolýza

p. H denaturace u Provádět za definované teploty u Změny p. H dělat co nejrychleji u Pro změny pokud možno nepoužívat silné kyseliny a zásady

p. H u 5 4 2 HAc k. mléčná H 3 PO 4, H 2 SO 4 p. H 8 Tris 9 DEA 11 Na. OH Extrémy p. H – bílkovina silně ionizovaná a zůstává v rozpuštěném stavu nutná zpětná úprava p. H

Denaturace org. rozpouštědly u u Pří srážení organickými rozpouštědly – T < 0 o. C Pří denaturaci organickými rozpouštědly – T = 20 – 30 o. C Alkoholy s delšími alifatickými řetězci mají větší denaturační vliv T a p. H musí být přesně definovány Et. OH, Met. OH, aceton
 Oot srec
Oot srec Virginia srec market
Virginia srec market Sren kierkegaard
Sren kierkegaard Metody szacowania ryzyka
Metody szacowania ryzyka Gerydon kelnerski
Gerydon kelnerski Stozek dale'a
Stozek dale'a Autyzm prezentacja
Autyzm prezentacja Czujnik magnetosprężysty
Czujnik magnetosprężysty Zalety mrp
Zalety mrp Metody numeryczne
Metody numeryczne Metody pracy
Metody pracy Chromatografia podziałowa
Chromatografia podziałowa Forma frontalna
Forma frontalna Metoda fizyczna spulchniania ciast
Metoda fizyczna spulchniania ciast Heureza
Heureza Metody nauki pisania
Metody nauki pisania Interaktywne metody nauczania
Interaktywne metody nauczania Haki pamięciowe przykłady
Haki pamięciowe przykłady Metody wychowawcze korczaka
Metody wychowawcze korczaka Rybi szkielet metoda aktywizująca
Rybi szkielet metoda aktywizująca Metody, techniki i narzędzia badawcze
Metody, techniki i narzędzia badawcze Metody badawcze w psychologii
Metody badawcze w psychologii Metódy nácviku čítania
Metódy nácviku čítania źródło
źródło Metoda ruchowej ekspresji twórczej
Metoda ruchowej ekspresji twórczej Pecs symbole
Pecs symbole Umewap
Umewap Metody kinezioterapie
Metody kinezioterapie Metody serwowania potraw
Metody serwowania potraw Blindyzmy
Blindyzmy Stres karta pracy
Stres karta pracy Elektrografické vyšetřovací metody
Elektrografické vyšetřovací metody Trzy metody otrzymywania soli
Trzy metody otrzymywania soli