SIFAT KIMIA TANAH p H TANAH 1 2

































- Slides: 40

SIFAT KIMIA TANAH: p. H TANAH

1. 2. 3. 4. sifat kimia tanah reaksi tanah /p. H tanah cara penetapan p. H tanah faktor yang mempengaruhi p. H tanah 5. hubungan p. H tanah dengan sifat kimia lain

SIFAT KIMIA TANAH • p. H tanah • Pertukaran Ion • Kejenuhan Basa – Hampir semua sifat kimia tanah terkait dengan koloid tanah

SIFAT KIMIA TANAH. . . • Koloid Tanah – Partikel mineral atau organik dalam tanah yang mempunyai diameter kurang dari 0, 001 mm. – Mempunyai permukaan luas; reaksi kimia berlangsung pada permukaan koloid. – Pada beberapa jenis tanah, permukaan koloid bermuatan negatif (-) – Untuk memahami kimia tanah, perlu mengetahui mineral liat apa yang ada dan kontribusinya pada muatan negatif.

SIFAT KIMIA TANAH. . . • Menyebabkan tanah mampu menahan unsur hara dan menyediakannya untuk tanaman. • Menentukan perilaku bahan kimia yang ditambahkan ke tanah, misalnya: – pupuk – Limbah organik – kapur – pestisida – herbisida

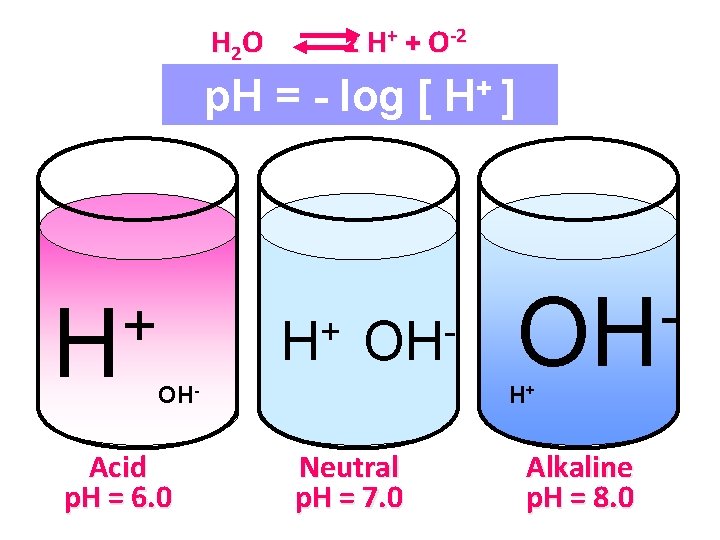
REAKSI TANAH (p. H tanah) Ø Reaksi tanah menunjukkan kemasaman atau alkalinitas tanah yang dinyatakan dengan nilai p. H. Ø Nilai p. H menunjukkan banyaknya konsentrasi ion hidrogen (H+) di dalam tanah. Ø Makin tinggi kadar ion H+ di dalam tanah maka semakin masam tanah tersebut.

REAKSI TANAH (p. H tanah). . . . Ø Selain ion H+ ditemukan pula ion OH-, yang jumlahnya berbanding terbalik dengan banyaknya H+. • Pada tanah masam jumlah ion H+ > ion OH- • Pada tanah alkalis jumlah ion OH- > H+ • Pada tanah netral jumlah ion H+ = OH-

p. H tanah • p. H adalah ukuran kemasaman aktif atau konsentrasi H+ dalam larutan tanah. – p. H = log 1/[H+] dimana H+ adalah konsentrasi dalam mole per liter [H+) (mole/liter. 001. 00001. 0000001 p. H 3 4 5 6 7 Satu unit perubahan p. H berarti 10 kali perubahan dalam konsentrasi H+

• Konsep p. H tanah o p. H = -log (H+) atau o p. H = log 1/(H+) üDimana: p adalah logaritme negatif dan H adalah konsentrasi H+ dalam g/L • Definisi ini berasal dari o (H+) (OH-) = 10 -14 atau o p. H + p. OH = 14 • Sebagian besar jenis tanah memiliki p. H antara 5 dan 8

p. H = Log 1/H+ untuk p. H 7 = Log 1/0, 0000001 = Log 1/10 -7 = Log 107 =7 Yang artinya didalam 1 liter air terdapat 0, 0000001 gram ion H+ Bagaimana dengan p. H 6 dan p. H 8? p. H 6 + p. H 9 = ?

H 2 O 2 H+ + O-2 p. H = - log [ H+ ] + H OH OH- Acid p. H = 6. 0 OH H+ Neutral p. H = 7. 0 Alkaline p. H = 8. 0

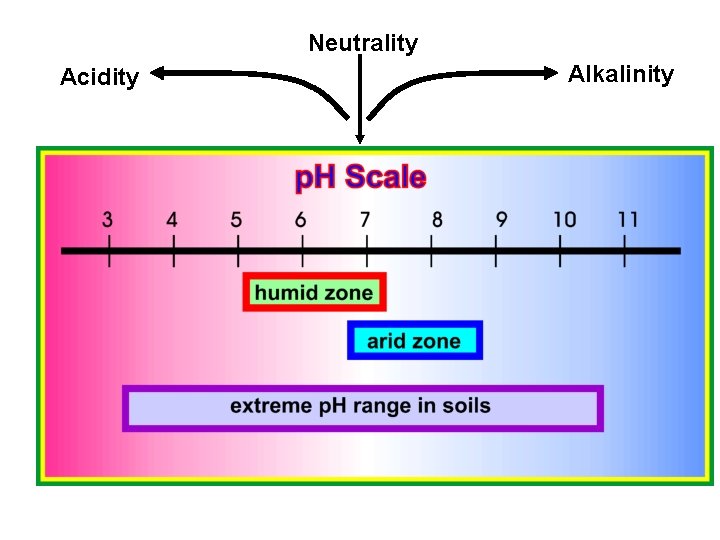
Neutrality Acidity Alkalinity

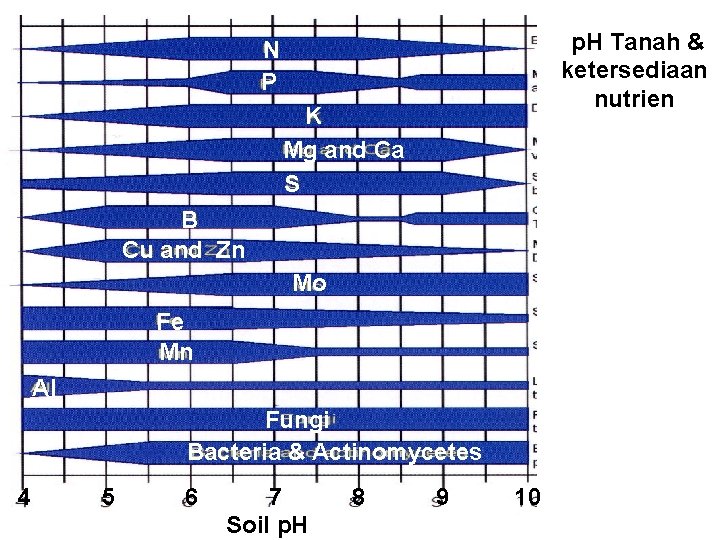
Peranan p. H tanah • p. H menentukan mudah tidaknya unsur hara diserap tanaman: – Pada tanah masam unsur P sulit untuk diserap tanaman karena difiksasi oleh Al; pada tanah alkali unsur P difiksasi Ca. – umumnya unsur hara mudah diserap akar tanaman pada p. H tanah sekitar netral, karena pada p. H tersebut kebanyakan unsur hara mudah larut dalam air.

Peranan p. H tanah. . . • p. H menunjukkan adanya unsur beracun. – Pada tanah masam banyak dijumpai ion Al dalam tanah, yang dapat mengikat P, dan racun bagi tanaman. – Pada tanah masam unsur Fe, Mn, Zn, Cu dan Co mudah larut, maka tanaman dapat keracunan. Pada tanah alkalis, Mo dan B menjadi racun bagi tanaman.

Peranan p. H tanah. . . • p. H mempengaruhi perkembangan mikroorganisme. ØBakteri berkembang dengan baik pada p. H > 5. 5. ØFungi berkembang pada segala tingkat p. H, tetapi pada p. H > 5. 5 fungi harus bersaing dengan bakteri, jadi lebih dominan pada p. H < 5, 5.

p. H Tanah & ketersediaan nutrien N P K Mg and Ca S B Cu and Zn Mo Fe Mn Al Fungi Bacteria & Actinomycetes 4 5 6 7 Soil p. H 8 9 10

Penentuan Kemasaman Aktif Dan Potensial Tanah Ion H+ berada di dua tempat yaitu dalam larutan tanah dan terjerap koloid tanah. 1. Kemasaman Aktif – Kemasaman aktif menunjukkan konsentrasi H+ dan Al+3 di dalam larutan tanah. – Konsentrasi ion hidrogen yang terdapat bebas dalam larutan tanah (p. H H 2 O)

2. Kemasaman Potensial – Kemasaman potensial menunjukkan H+ dan Al+3 pada kapasitas tukar kation (H+ dan Al+3 yang terjerap pada permukaan jerapan). – Banyaknya kadar hidrogen dapat tukar yang dijerap oleh komplek koloid tanah (p. H KCl).

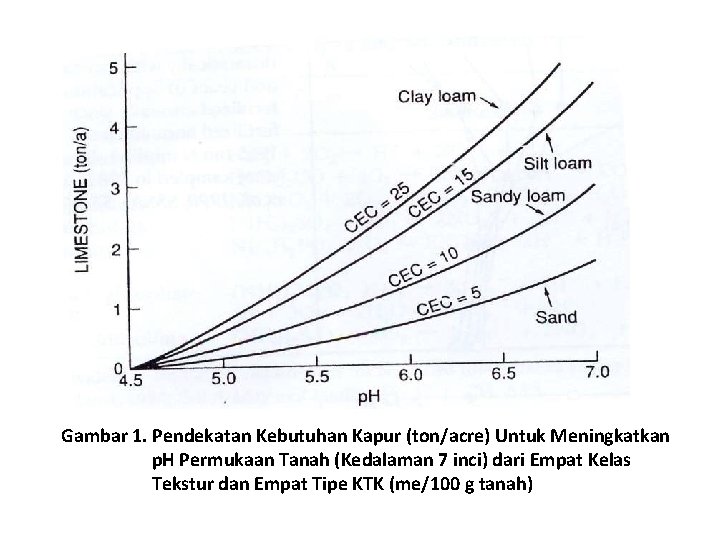
– Perhitungan kemasaman tanah potensial diperlukan titrasi suspensi tanah dengan basa yang dapat digunakan untuk menentukan kebutuhan kapur atau banyaknya Ca. CO 3 yang dibutuhkan untuk menaikkan p. H ke level yang diinginkan. – Jadi, kebutuhan kapur suatu tanah merupakan hubungan tidak hanya dengan p. H tanah, tetapi juga dengan kapasitas sangga (BC) atau KTK (gambar 1)

Gambar 1. Pendekatan Kebutuhan Kapur (ton/acre) Untuk Meningkatkan p. H Permukaan Tanah (Kedalaman 7 inci) dari Empat Kelas Tekstur dan Empat Tipe KTK (me/100 g tanah)

Kemasaman aktif jauh lebih rendah dari kemasaman potensial, kemasaman potensial ini dapat mencapai 1000 kali lebih kuat dari kemasaman aktif, jadi kemasaman potensial inilah yang lebih berbahaya. 21

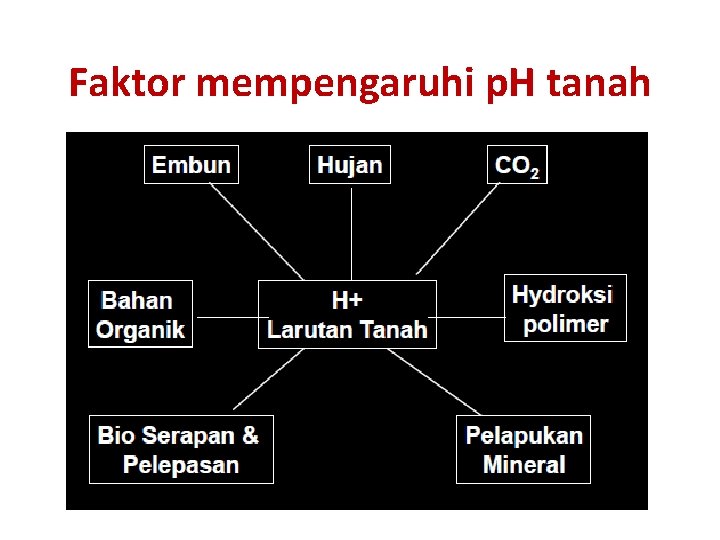
Faktor mempengaruhi p. H tanah

Sumber keasaman tanah 1. Nitrifikasi: Amonium menjadi Nitrat (oksidasi NH 4+) NH 4+ + 2 O 2 ---> NO 3 - + H 2 O + 2 H+ 2. Dekomposisi BO Asam organik di ionisasi: R-COOH ---> R-COO- + H+ Respirasi: CO 2+ H 2 O ----> H 2 CO 3 = H+ + HCO 3 -

3. Hujan asam • Hujan asam disebabkan oleh pembakaran bahan bakar fosil • �Pembakaran minyak, gas dan batubara di pabrik pemangkit listrik melepaskan Sulfur dioksida (SO 2) ke atmosfer • �Pembakaran bensin pada kendaraan bermotor menempatkan nitrogen oksida (NOX) ke atmosfer • �Gas tersebut bercampur dengan butir-butir air di atmosfer menghasilkan larutan asam lemah nitrat dan sulfat • �Ketika terjadi hujan, larutan tersebut jatuh menjadi hujan asam

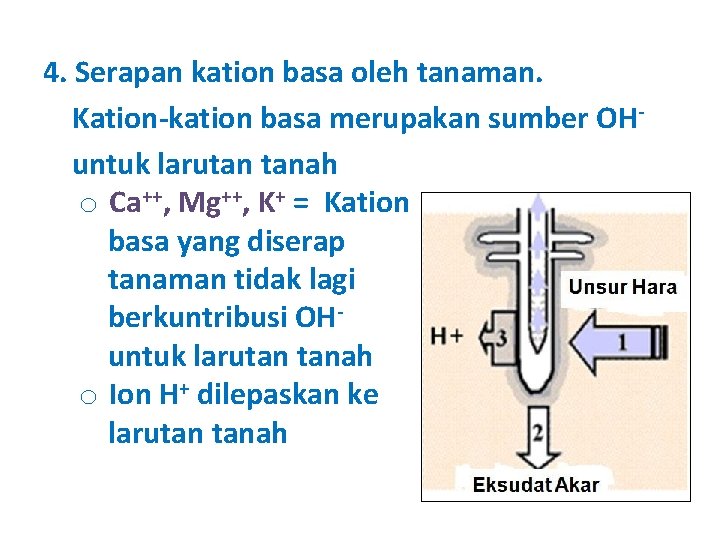
4. Serapan kation basa oleh tanaman. Kation-kation basa merupakan sumber OHuntuk larutan tanah o Ca++, Mg++, K+ = Kation basa yang diserap tanaman tidak lagi berkuntribusi OHuntuk larutan tanah o Ion H+ dilepaskan ke larutan tanah

5. Pencucian kation-kation basa -karena kation basa hilang dari larutan tanah oleh pencucian, kation tersebut tidak lagi berkontribusi ion OH- untuk menetralkan peningkatan jumlah ion H+ Ca++ + 2 H 20 ---> Ca(OH)2 + 2 H+ -----> Ca++ + 2 OH-

Meningkatkan p. H tanah • Penambahan batukapur: karbonat Ca 2+, Mg 2+ Ca. CO 3 + 2 H+ Ca 2+ + CO 2 + H 2 O • Pembakaran/kapur cepat (oksida Ca 2+, Mg 2+) • Kapur terhidrasi (hidroksida Ca 2+, Mg 2+)

Sumber Alkalinitas • Di daerah arid dan semiarid komplek pertukaran didominasi: Ca 2+, Mg 2+, K+, Na+ • Adanya karbonat dan bikarbonat pada tanah alkalin terkait dengan disolusi CO 2: • Kisaran p. H reaksi tsb adalah antara 4, 6 dan juga 8, 6 (Ca-carbonates) atau 10 (Nacarbonates)

Menurunkan p. H • Penambahan senyawa mudah teroksidasi – Sulfur, secara biologi teroksidasi menjadi asam sulfat • Penambahan aluminium sulfat, yang memilah H 2 O untuk hasilkan H+ • Penambahan organik

Sumber Kemasaman a. Curah hujan b. Bahan organik c. Transformasi dan Serapan Hara d. Pencucian e. Mineral liat, Oksida Al dan Besi, Bahan Oranik Tanah f. Hidrolisis Al dan Fe g. Garam-garam terlarut h. Pemupukan

Mengapa tanah menjadi masam : • a. Penyiraman yang berlebihan • b. Drainase kurang baik atau lancar • c. Pemakaian pupuk • d. Tanah terlalu tua atau tanah-tanah terlalu lama diusahakan.

Tanah Sebagai Penyangga • tanah berperilaku sebagai asam lemah yang akan menyangga p. H. • Pada tanah masam Al+3 yang dijerap akan setimbang dengan Al+3 di dalam larutan tanah, yang karena hidrolisis akan menghasilkan H+, bergantung pada p. H larutan. • Jika H+ dinetralisasi oleh basa (misalnya Ca. CO 3), Al+3 larutan diendapkan sebagai Al(OH)3, menyebabkan Al+3 dapat ditukar (Al-dd. ) dilepas dan mensuplai Al+3 larutan. Dengan demikian, p. H tanah kembali sama atau disangga. • Koloid liat dan humus bertindak sebagai penyangga reaksi

• Kemasaman cadangan pada tanah liat kaya bahan organik jauh lebih tinggi daripada tanah berpasir. • Kapasitas sangga tanah organik dan tanah liat > tanah berpasir. • Semakin besar kapasitas sangga tanah semakin tinggi pula kebutuhan kapur yg diperlukan untuk meningkatkan p. H tanah hingga tingkat yang dikehendaki. • Manfaat penyangga tanah selain untuk menahan perubahan reaksi tanah, juga berfungsi menyimpan u. h. yang dibebaskan dari mineral primer agar tidak mudah tercuci, dan melindungi senyawa-senyawa tertentu agar tidak mudah larut

Reaksi-reaksi pengapuran dimulai dengan netralisasi H+ larutan tanah dengan penambahan suatu basa (biasanya OH- atau HCO 3 - ) yang berasal dari bahan kapur. Contoh : Ca. CO 3 + 2 H+ < == > Ca+2 + CO 2 + H 2 O Reaksi selanjutnya dari 2 H+ + CO 3 -2 --- > CO 2 + H 2 O menetralkan H+ dalam larutan. H-dd. dari KTK ke penyangga menurunkan H+ dalam larutan. Dua H+ pada KTK diganti oleh satu Ca+2. Dengan demikian p. H tanah dan % kejenuhan basa meningkat

Apabila sebagian besar kemasaman yang dapat dipertukarkan terjadi karena Al+3, reaksi netralisasinya sebagai berikut : 1. 2 Al+3 dd. pada jerapan akan diganti oleh 3 Ca+2 dari Ca. CO 3 2. Al+3 dalam larutan tanah mengalami hidsrolisis (bereaksi dengan air) menghasilkan 6 H+; Al (OH)3 mengendap keluar dari larutan 2 Al 3+ + 6 H 2 O < ==== > 2 Al(OH)3 + 6 H+ 3. CO 3 -2 (dari Ca. CO 3) menetralkan H+ yang dihasilkan dari langkah 2 3 CO 32 - + 6 H+ < === > 3 CO 2 + 3 H 2 O Reaksi keseluruhan sebagai berikut :



Bahan Pengapuran Bahan kapur yang banyak digunakan untuk menetralkan tanah masam adalah senyawa kalsium oksida, hidroksida, karbonat dan silikat; dan magnesium karbonat. Untuk menentukan bahan pengapuran, maka anion yang menyertainya harus dapat mereduksi aktifitas H+ dan Al 3+ di dalam larutan tanah serta Al pada tempat pertukaran. a. Kalsium oksida (Ca. O) b. Kalsium Hidroksida [Ca(OH)2] c. Kalsit dan Dolomit [Ca. CO 3 dan Ca. Mg(CO 3)2] d. Marl e. Kalsium silikat (Ca. Si. O 3). f. Bahan Pengapuran Lainnya

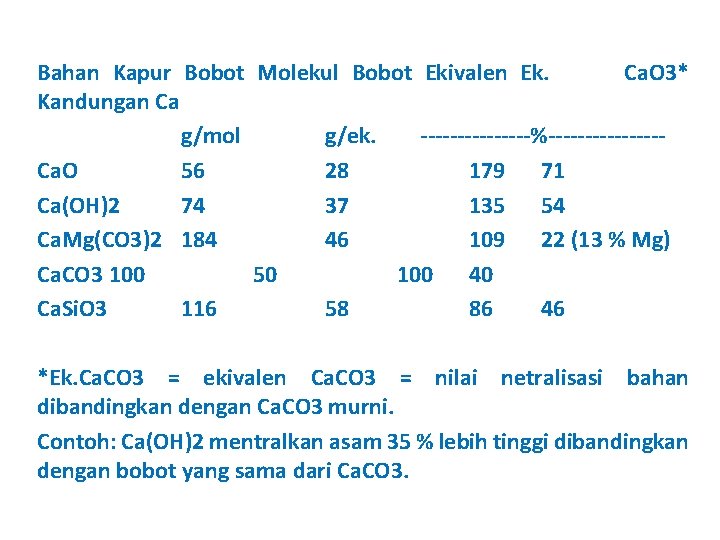
Bahan Kapur Bobot Molekul Bobot Ekivalen Ek. Ca. O 3* Kandungan Ca g/mol g/ek. --------%--------Ca. O 56 28 179 71 Ca(OH)2 74 37 135 54 Ca. Mg(CO 3)2 184 46 109 22 (13 % Mg) Ca. CO 3 100 50 100 40 Ca. Si. O 3 116 58 86 46 *Ek. Ca. CO 3 = ekivalen Ca. CO 3 = nilai netralisasi bahan dibandingkan dengan Ca. CO 3 murni. Contoh: Ca(OH)2 mentralkan asam 35 % lebih tinggi dibandingkan dengan bobot yang sama dari Ca. CO 3.

Unsur tanah yang ideal pada lapisan atas : 1. Air (25 %) 2. Udara (25 %) 3. Bahan Organik (5 %) 4. Mineral tanah (45 %) Nilai p. H berkisar antara 0 – 14 p. H (Potential of higrogen) p. H (Puissance Negative de H) p. H (Derajat Kemasaman) Thursday, June 17, 2021 Jum call 08125875659 Inggris Prancis Indonesia 40
 Peta konsep sifat allah
Peta konsep sifat allah Sifat - sifat -sifat pemerintah reformasi di indonesia
Sifat - sifat -sifat pemerintah reformasi di indonesia Struktur kimia telur
Struktur kimia telur Sifat kimia air laut
Sifat kimia air laut Adakah cuka asid atau alkali
Adakah cuka asid atau alkali Golongan gas mulia
Golongan gas mulia Sifat kimia kalium
Sifat kimia kalium Apa itu homogen dan heterogen
Apa itu homogen dan heterogen Sifat fisikokimia paracetamol
Sifat fisikokimia paracetamol Sifat air tawar
Sifat air tawar Sifat kimia ester
Sifat kimia ester Aluminium amfoter
Aluminium amfoter Fraksi mol
Fraksi mol Sifat kimia air laut
Sifat kimia air laut Perhitungan bulk density
Perhitungan bulk density Pentingnya klasifikasi tanah untuk kesuburan tanah
Pentingnya klasifikasi tanah untuk kesuburan tanah Contoh soal piezometer
Contoh soal piezometer Indonesia, tanah airku tanah tumpah darahku
Indonesia, tanah airku tanah tumpah darahku Sifat biologi tanah
Sifat biologi tanah Diketahui beberapa sifat-sifat zat
Diketahui beberapa sifat-sifat zat Sifat-sifat kas
Sifat-sifat kas Peta konsep iman
Peta konsep iman Fraktil
Fraktil Sifat segitiga
Sifat segitiga Gambar pasangan sudut luar sepihak
Gambar pasangan sudut luar sepihak Panjang dari penjumlahan vektor a 6 4 5
Panjang dari penjumlahan vektor a 6 4 5 Sifat-sifat kubus
Sifat-sifat kubus Sifat sifat kas kecil
Sifat sifat kas kecil Apakah cahaya merupakan gelombang transversal
Apakah cahaya merupakan gelombang transversal Sifat atmosfer adalah
Sifat atmosfer adalah Sifat dasar analisis regresi
Sifat dasar analisis regresi Sifat-sifat tuhan
Sifat-sifat tuhan Manfaat serat karet
Manfaat serat karet Sifat fisik warna
Sifat fisik warna Sifat sifat baja
Sifat sifat baja Arti determinan matriks
Arti determinan matriks Mensyukuri nikmat allah akan menghindarkan kita dari sifat
Mensyukuri nikmat allah akan menghindarkan kita dari sifat Rpp persamaan garis lurus
Rpp persamaan garis lurus Sifat sifat senyawa hidrokarbon
Sifat sifat senyawa hidrokarbon Sifat-sifat struktur data tree
Sifat-sifat struktur data tree 699 artinya
699 artinya