Redoxn reakce Dostupn z Metodickho portlu www rvp



















- Slides: 21

Redoxní reakce Dostupné z Metodického portálu www. rvp. cz, ISSN: 1802 -4785, financovaného z ESF a státního rozpočtu ČR. Provozováno Výzkumným ústavem pedagogickým v Praze.

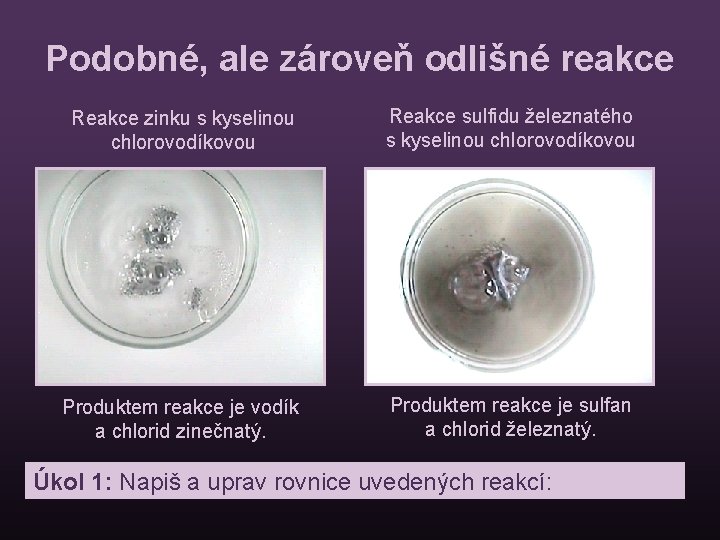
Podobné, ale zároveň odlišné reakce Reakce zinku s kyselinou chlorovodíkovou Reakce sulfidu železnatého s kyselinou chlorovodíkovou Produktem reakce je vodík a chlorid zinečnatý. Produktem reakce je sulfan a chlorid železnatý. Úkol 1: Napiš a uprav rovnice uvedených reakcí:

Kontrola úkolu 1 Zn + 2 HCl → H 2 + Zn. Cl 2 Fe. S + 2 HCl → H 2 S + Fe. Cl 2

Oxidační číslo 1. Hodnotu oxidačního čísla zapisujeme vpravo nahoře (N-III, No, NV). 2. Kladná hodnota oxidačního čísla se pohybuje v rozmezí I až VIII. 3. U nesloučených prvků je oxidační číslo vždy rovno 0. 4. Součet oxidačních čísel ve sloučenině je vždy roven 0. 5. U prvků v hlavních podskupinách je maximální oxidační číslo rovno číslu skupiny. 6. V názvech sloučenin se kladné oxidační číslo významného prvku řídí koncovkou (např. v oxidu železitém je Fe. III). 7. Alkalické kovy (I. A) mají oxidační číslo vždy I, kovy alkalických zemin (II. A) vždy II. 8. Vodík má ve sloučeninách běžně oxidační číslo I (HI). 9. Kyslík má ve sloučeninách běžně oxidační číslo -II (O-II).

Úkol 2: Oxidační čísla Ke všem prvkům v rovnicích úkolu 1 doplň oxidační čísla: Zn + 2 HCl → H 2 + Zn. Cl 2 Fe. S + 2 HCl → H 2 S + Fe. Cl 2

Kontrola úkolu 2 Zn 0 + 2 HICl-I → H 20 + Zn. IICl 2 -I Fe. IIS-II + 2 HICl-I → H 2 IS-II + Fe. IICl 2 -I Úkol 3: a) Podtrhni rovnici, ve které se mění oxidační čísla reaktantů: b) Uveď, které prvky mění oxidační číslo:

Kontrola úkolu 3 a) Zn 0 + 2 HICl-I → H 20 + Zn. IICl 2 -I Fe. IIS-II + 2 HICl-I → H 2 IS-II + Fe. IICl 2 -I b) Zn, H

Redoxní (oxidačně-redukční) reakce Redoxní reakce je chemická reakce, při níž se mění oxidační čísla reaktantů. Úkol 4: Doplň v zápisech oxidační čísla u obou prvků a napiš, který z prvků zvyšuje a který snižuje oxidační číslo: Zn → Zn H →H

Kontrola úkolu 4 Zn 0 → Zn. II zvyšuje oxidační číslo HI → H 0 snižuje oxidační číslo

Oxidace a redukce Redoxní reakce se skládají ze dvou poloreakcí - oxidace a redukce. Při oxidaci se oxidační číslo zvyšuje, při redukci se snižuje. Při redoxních reakcích probíhají oxidace i redukce vždy současně. Úkol 5: Uveď v poloreakcích počet přijatých či odevzdaných elektronů a správně doplň chybějící slova do vět: 30 e 30 p+ 28 e- Zn 0 → Zn. II 30 p+ 1 e 1 p+ HI → H 0 Atom, který se oxiduje, ……. oxidační číslo a ……… elektrony. Atom, který se redukuje, ……. oxidační číslo a ……. elektrony. 1 p+

Kontrola úkolu 5 Zn 0 – 2 e- → Zn. II HI + e - → H 0 Atom, který se oxiduje, zvyšuje oxidační číslo a odevzdává elektrony. Atom, který se redukuje, snižuje oxidační číslo a přijímá elektrony.

Příklady redoxních reakcí 1 Úkol 6: Doplň větu: K nejznámějším redoxním reakcím patří …… (obr. 1) a …… (obr. 2). 2

Kontrola úkolu 6 K nejznámějším redoxním reakcím patří hoření a koroze.

Úkol 7: Hoření uhlí lze vyjádřit jednoduchou chemickou rovnicí: C + O 2 → CO 2 a) Napiš oxidační čísla u reaktantů a produktů: b) Doplň oxidační čísla v poloreakcích: C→C O→O c) Uveď, který prvek se oxiduje a který redukuje:

Kontrola úkolu 7 C 0 + O 20 → CIVO 2 -II C 0 → CIV uhlík se oxiduje O 0 → O-II kyslík se redukuje

Postup vyčíslování redoxních rovnic HNO 3 + I 2 → HIO 3 + NO + H 2 O 1. Napíšeme oxidační čísla u reaktantů a produktů: HINVO 3 -II + I 20 → HIIVO 3 -II + NIIO-II + H 2 IO-II 2. Zjistíme, který prvek se oxiduje, který redukuje, zapíšeme rozdíly oxidačních čísel a výsledek prohodíme: I 20 → IV jód se oxiduje, rozdíl 5 3 NV → NII dusík se redukuje, rozdíl 3 5 3. Zapíšeme tato čísla do rovnice ke sloučeninám jódu a dusíku (pozor: před I 2 napíšeme 1, 5), další prvky upravíme zpaměti: 5 HNO 3 + 1, 5 I 2 → 3 HIO 3 + 5 NO + H 2 O / · 2 Protože stechiometrické koeficienty nemohou být desetinná čísla, vynásobíme rovnici dvěma: 10 HNO 3 + 3 I 2 → 6 HIO 3 + 10 NO + 2 H 2 O

Úkol 8: Úprava redoxní reakce Al 2 O 3 + C → Al + CO a) Napiš oxidační čísla ke všem prvkům. b) Podle snímku 16 napiš , který prvek se oxiduje a který redukuje. c) Vyčísli rovnici.

Kontrola úkolu 8 a) Al 2 IIIO 3 -II + C 0 → Al 0 + CIIO-II b) Al. III → Al 0 redukce 3 2 C 0 → CII oxidace 2 3 c) Al 2 O 3 + 3 C → 2 Al + 3 CO

Úkol 9: Příklady k procvičení Reakce železa s dusičnanem měďnatým b) Zapiš oxidační čísla nesloučených prvků i sloučenin: P 2 O 5, Hg, Ca(OH)2, 5 P 4, H 2 SO 4 Po 1 minutě Po 2 hodinách Fe + Cu. SO 4 → Cu + Fe. SO 4 a) Napiš k atomům Fe a Cu v rovnici oxidační čísla a uveď, který prvek se oxiduje a který redukuje: c) U reakce: Pb. S + H 2 O 2 -I → Pb. SO 4 + H 2 O • napiš oxidační čísla ke všem prvkům • napiš, který prvek se oxiduje a který redukuje • vyčísli rovnici (nepovinné)

Kontrola úkolu 9 a) Fe 0 + Cu. IISVIO 4 -II → Cu 0 + Fe. IISVIO 4 -II Fe 0 → Fe. II oxidace Cu. II → Cu 0 redukce b) P 2 VO 5 -II, Hg 0, Ca(O-IIHI)2, 5 P 40, H 2 ISVIO 4 -II c) Pb. IIS-II + H 2 IO 2 -I → Pb. IISVIO 4 -II + H 2 IO-II S-II → SVI oxidace 8 krátíme 4 1 O 2 -I → O-II redukce 2 krátíme 1 4 Pb. S + 4 H 2 O 2 → Pb. SO 4 + 4 H 2 O

Veškeré obrázky a videoklipy použité v prezentaci pocházejí z wikimedia commons nebo z vlastních zdrojů. Obrázek 1: Large bonfire. jpg [online]. 2004 [cit. 2009 -11 -13]. Dostupný z WWW: <http: //commons. wikimedia. org/wiki/File: Large_bonfire. jpg>. Obrázek 2: Rust 03102006. JPG [online]. 2006 [cit. 2009 -11 -13]. Dostupný z WWW: <http: //commons. wikimedia. org/wiki/File: Rust 03102006. JPG>. Mgr. Vlastimil Vaněk, autor
 Becketov rad
Becketov rad Exotermické reakcie
Exotermické reakcie Redoxní rovnice
Redoxní rovnice Beketova řada kovů
Beketova řada kovů Rvp 30
Rvp 30 Rvp cz
Rvp cz Jim meyer primerica
Jim meyer primerica Traceval da sueño
Traceval da sueño Rvp 30
Rvp 30 Rvp informatika
Rvp informatika Komunikační kompetence
Komunikační kompetence Rvp tv
Rvp tv Tundra klimadiagram
Tundra klimadiagram Somitogeneze
Somitogeneze Redoxní reakce příklady 9.ročník
Redoxní reakce příklady 9.ročník Jodoformová reakce
Jodoformová reakce Cannizarova reakce
Cannizarova reakce Asepse
Asepse Imunokomplexová reakce
Imunokomplexová reakce Redoxní reakce
Redoxní reakce Cannizarova reakce
Cannizarova reakce Paul bunnellova reakce
Paul bunnellova reakce