Redoxn reakcie 1 REDOXN REAKCIE Chemick reakcie pri





- Slides: 15

Redoxné reakcie 1

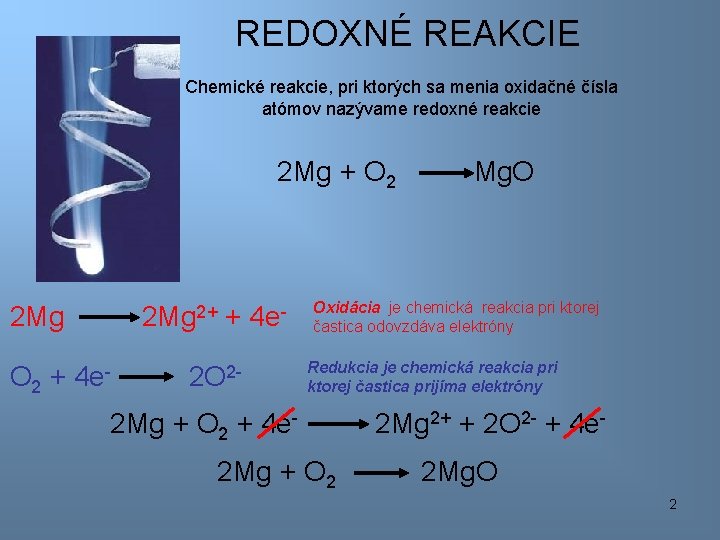
REDOXNÉ REAKCIE Chemické reakcie, pri ktorých sa menia oxidačné čísla atómov nazývame redoxné reakcie 2 Mg + O 2 2 Mg 2+ + 4 e- O 2 + 4 e- 2 O 2 - Mg. O Oxidácia je chemická reakcia pri ktorej častica odovzdáva elektróny Redukcia je chemická reakcia pri ktorej častica prijíma elektróny 2 Mg + O 2 + 4 e 2 Mg + O 2 2 Mg 2+ + 2 O 2 - + 4 e 2 Mg. O 2

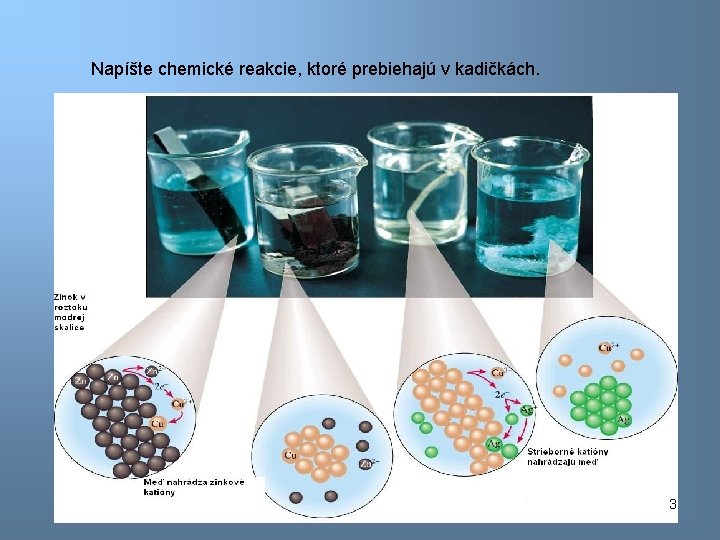
Napíšte chemické reakcie, ktoré prebiehajú v kadičkách. 3

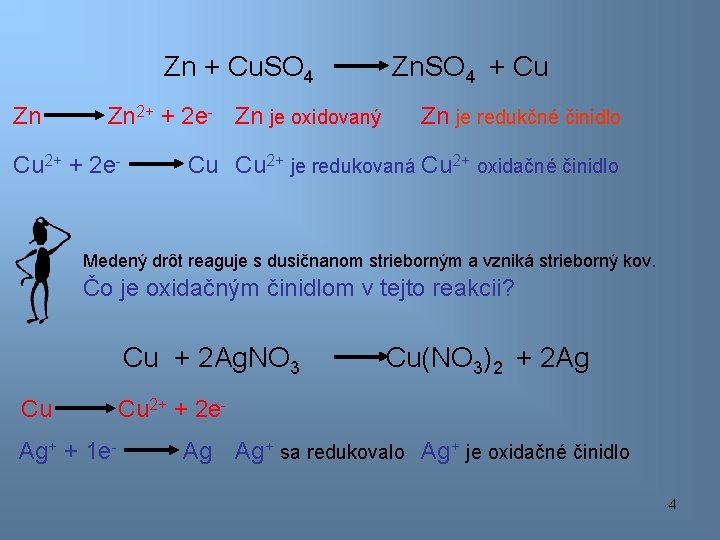
Zn + Cu. SO 4 Zn Zn 2+ + 2 e- Zn je oxidovaný Cu 2+ + 2 e- Zn. SO 4 + Cu Zn je redukčné činidlo Cu Cu 2+ je redukovaná Cu 2+ oxidačné činidlo Medený drôt reaguje s dusičnanom strieborným a vzniká strieborný kov. Čo je oxidačným činidlom v tejto reakcii? Cu + 2 Ag. NO 3 Cu Ag+ + 1 e- Cu(NO 3)2 + 2 Ag Cu 2+ + 2 e. Ag Ag+ sa redukovalo Ag+ je oxidačné činidlo 4

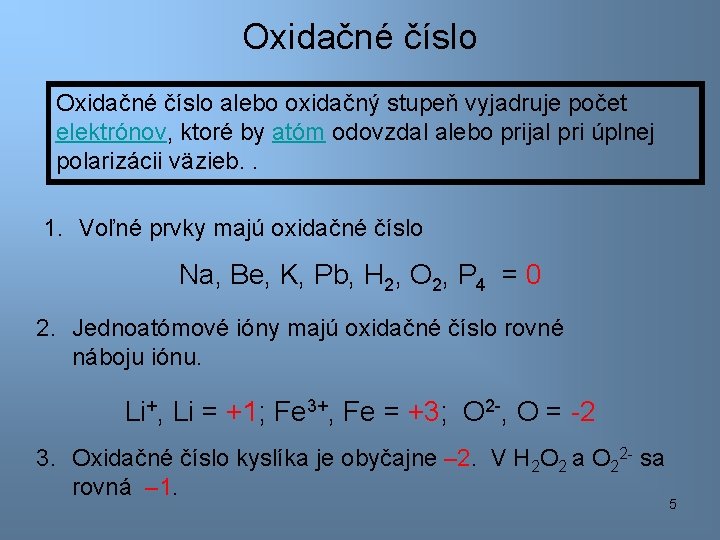
Oxidačné číslo alebo oxidačný stupeň vyjadruje počet elektrónov, ktoré by atóm odovzdal alebo prijal pri úplnej polarizácii väzieb. . 1. Voľné prvky majú oxidačné číslo Na, Be, K, Pb, H 2, O 2, P 4 = 0 2. Jednoatómové ióny majú oxidačné číslo rovné náboju iónu. Li+, Li = +1; Fe 3+, Fe = +3; O 2 -, O = -2 3. Oxidačné číslo kyslíka je obyčajne – 2. V H 2 O 2 a O 22 - sa rovná – 1. 5

4. Oxidačné číslo vodíka je +1. V hydridoch kovov má vodík oxidačné číslo – 1. 5. V skupine IA majú kovy +1, v IIA skupine kovy +2 a halogény – 1. 6. Súčet oxidačných čísel v reakcii sa rovná nule Určite všetky oxidačné čísla v zlúčenine H 2 CO 3 ? O = -2 H = +1 3 x(-2) + 2 x(+1) + ? = 0 C = +4 6

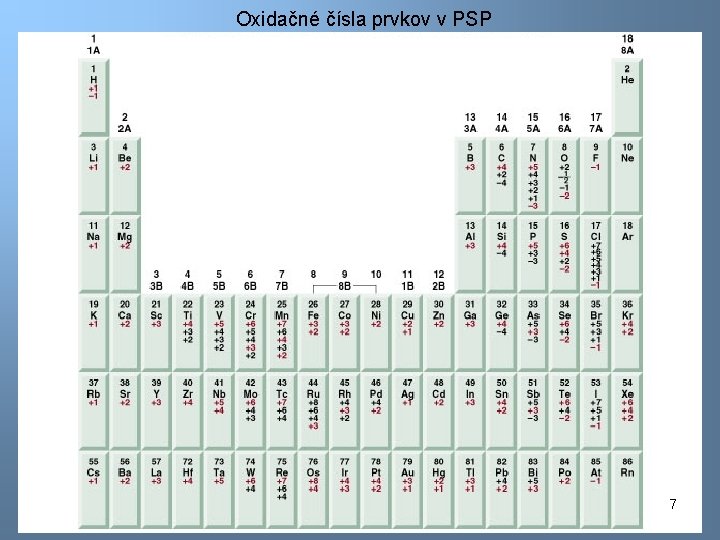
Oxidačné čísla prvkov v PSP 7

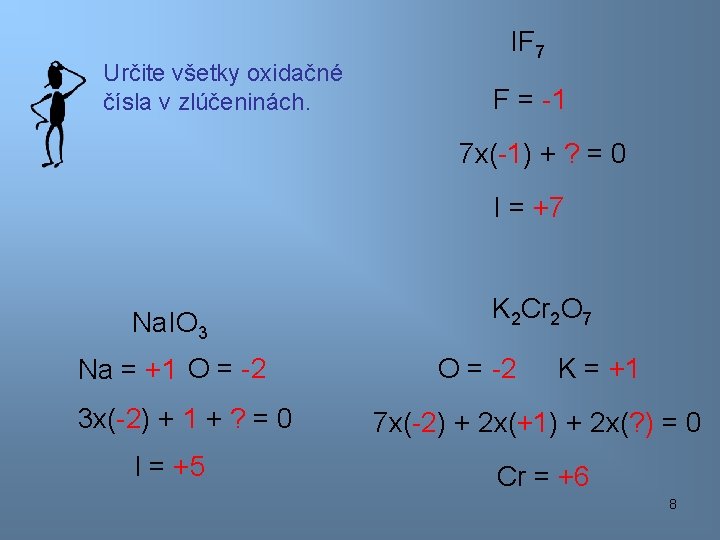
Určite všetky oxidačné čísla v zlúčeninách. IF 7 F = -1 7 x(-1) + ? = 0 I = +7 Na. IO 3 Na = +1 O = -2 3 x(-2) + 1 + ? = 0 I = +5 K 2 Cr 2 O 7 O = -2 K = +1 7 x(-2) + 2 x(+1) + 2 x(? ) = 0 Cr = +6 8

Typy oxidačno-redukčných reakcií Syntéza A+B C 0 +4 -2 0 S + O 2 SO 2 Rozklad C +1 +5 -2 2 KCl. O 3 A+B +1 -1 0 2 KCl + 3 O 2 9

Elektrochemický rad napätia kovov – Beketov rad Rastúca redukčná schopnosť Vylučovanie vodíka M + BC AC + B M je kov BC je kyselina alebo H 2 O B je H 2 Ca + 2 H 2 O Ca(OH)2 + H 2 Pb + 2 H 2 O Pb(OH)2 + H 2 • Kovy nad vodíkom vytláčajú zo zlúčenín kovy pod vodíkom • Kovy pod vodíkom sú ušlachtilé, nad vodíkom neušlachtilé 10

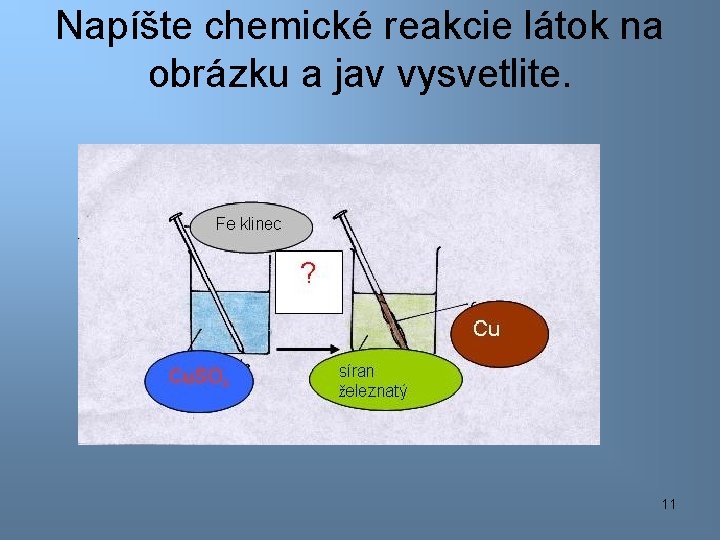
Napíšte chemické reakcie látok na obrázku a jav vysvetlite. 11

Korózia je zmena povrchu kovu pôsobením vonkajších činiteľov- vody, kyslíka, koróznych plynov. Hrdza – vzniká na povrchu železných predmetov, predmety ničí. Príčinou hrdze je vznik korózneho článku 2 Fe + O 2 + 2 H 2 O 2 Fe(OH)2 Medenka – Cu. CO 3. Cu(OH)2 – medené predmety chráni 12

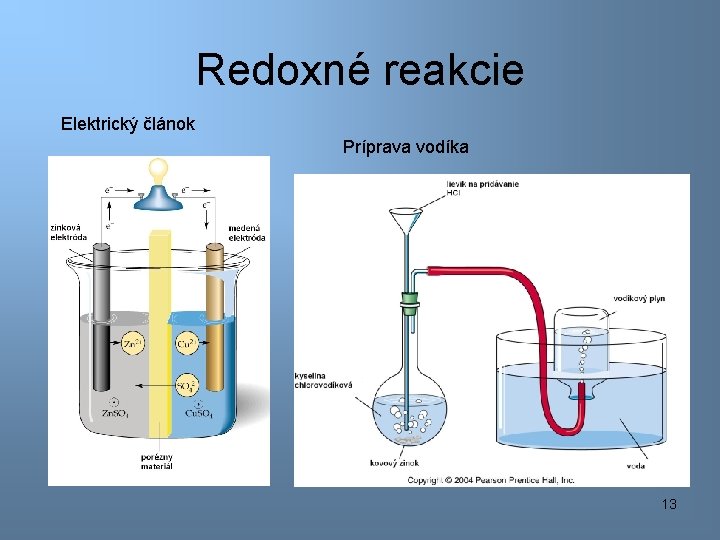
Redoxné reakcie Elektrický článok Príprava vodíka 13

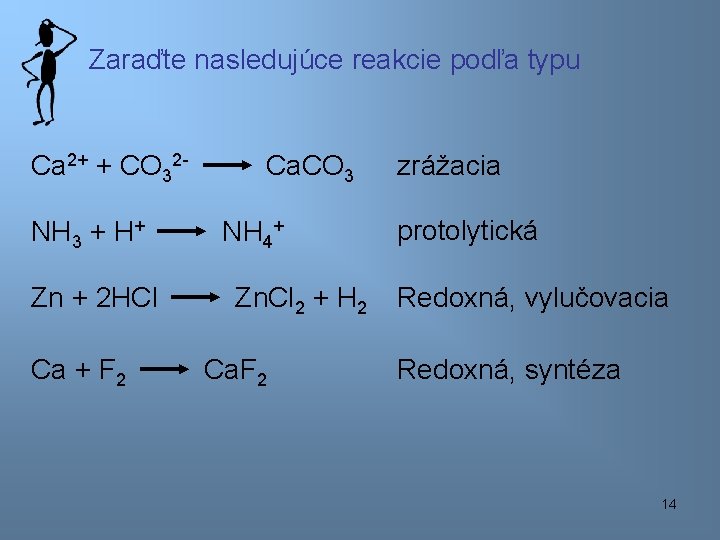
Zaraďte nasledujúce reakcie podľa typu Ca 2+ + CO 32 NH 3 + H+ Zn + 2 HCl Ca + F 2 Ca. CO 3 NH 4+ Zn. Cl 2 + H 2 Ca. F 2 zrážacia protolytická Redoxná, vylučovacia Redoxná, syntéza 14

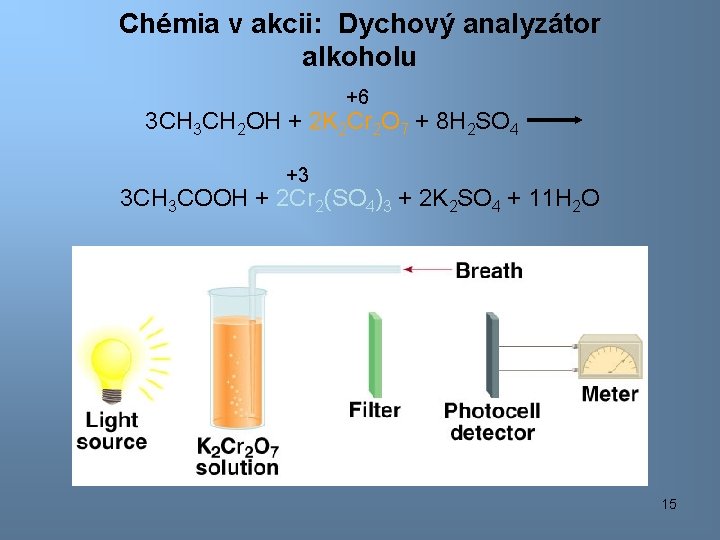
Chémia v akcii: Dychový analyzátor alkoholu +6 3 CH 2 OH + 2 K 2 Cr 2 O 7 + 8 H 2 SO 4 +3 3 CH 3 COOH + 2 Cr 2(SO 4)3 + 2 K 2 SO 4 + 11 H 2 O 15
 Oxokyseliny
Oxokyseliny Adriana chemick
Adriana chemick Adriana chemick
Adriana chemick Adriana chemick
Adriana chemick Vzorce halogenidov
Vzorce halogenidov Adriana chemick
Adriana chemick Beketova řada kovů
Beketova řada kovů Beketov rad napatia kovov
Beketov rad napatia kovov Exotermické reakcie
Exotermické reakcie Redoxní rovnice
Redoxní rovnice Koeficient reakcie
Koeficient reakcie Hypersenzitivita
Hypersenzitivita Endotermicky dej
Endotermicky dej Exotermické reakcie
Exotermické reakcie Faktory ovplyvňujúce rýchlosť chemických reakcií
Faktory ovplyvňujúce rýchlosť chemických reakcií Protolytické reakcie príklady
Protolytické reakcie príklady