REDOXN REAKCE Redoxn reakce jsou reakce pi nich







- Slides: 8

REDOXNÍ REAKCE

Redoxní reakce jsou reakce, při nichž dochází ke změnám oxidačních čísel některých atomů. 2 H+ICl-I + Zn 0 Zn+IICl 2 -I + H 20 Tyto reakce jsou složeny ze dvou dílčích reakcí: 1. Redukce – reakce, při níž oxidační číslo atomu klesá: 2 H+I + 2 e. H 20 2. Oxidace – reakce, při níž oxidační číslo atomu roste: Zn 0 - 2 e. Zn+II Oxidace a redukce nikdy neprobíhá samostatně, počet elektronů uvolněných při oxidaci se musí rovnat počtu elektronů přijatých při redukci.

Oxidační a redukční činidlo Látka obsahující atomy, které se při reakci redukují, se nazývá oxidační činidlo, protože jiné látky oxiduje, ale sama se zároveň redukuje. Látka obsahující atomy, které se při reakci oxidují, se nazývá redukční činidlo, protože jiné látky redukuje. redukce Cu+IIO-II + H 20 H 2+IO-II + Cu 0 oxidace V této reakci je oxidačním činidlem oxid měďnatý, redukčním činidlem je vodík.

Redoxní reakce kovů Chemické prvky mají různou reaktivitu, liší se tedy i schopností atomů prvků podléhat oxidaci nebo redukci. Tato schopnost se projevuje například při reakci kovů s vodou nebo s kyselinami. Například alkalické kovy(sodík, draslík) bouřlivě reagují s vodou za vzniku hydroxidů. Železo reaguje pouze s vodní parou, jiné kovy nereagují vůbec- jsou to měď, stříbro, zlato, platina. Z řady kovů podle této reaktivity byla vytvořena elektrochemická řada napětí kovů. Do této řady je zařazen i vodík, protože také tvoří kation.

Beketovova řada prvků- elektrochemická řada napětí kovů neušlechtilé kovy reagující s kyselinami, popř. i s vodou (vzniká vodík H 2) ušlechtilé kovy s kyselinami většinou nereagující K Na Ca Mg Al Zn Fe Sn Pb H Cu Ag Hg Au Pt směr klesající schopnosti tvořit kationty ve vodném roztoku Každý kov v Beketovově řadě napětí kovů je schopen vyredukovat všechny kovy ležící napravo od něj z jejich sloučenin. Sám se při tom oxiduje.

Vyčíslování redoxních rovnic Při výpočtu koeficientů redoxních rovnic se využívá toho, že počet elektronů uvolněných při oxidaci se musí rovnat počtu elektronů přijatých při redukci. Schéma chemické reakce: Cu. IIO-II + N-IIIHI 3 Oxidace: 2 N-III - 6 e. Redukce: Cu. II + 2 e- Cu 0 + N 02 + HI 2 O-II N 02 Cu 0 /. 3 Výsledná rovnice má tedy následující tvar: 3 Cu. IIO-II + 2 N-IIIHI 3 3 Cu 0 + N 02 + 3 HI 2 O-II

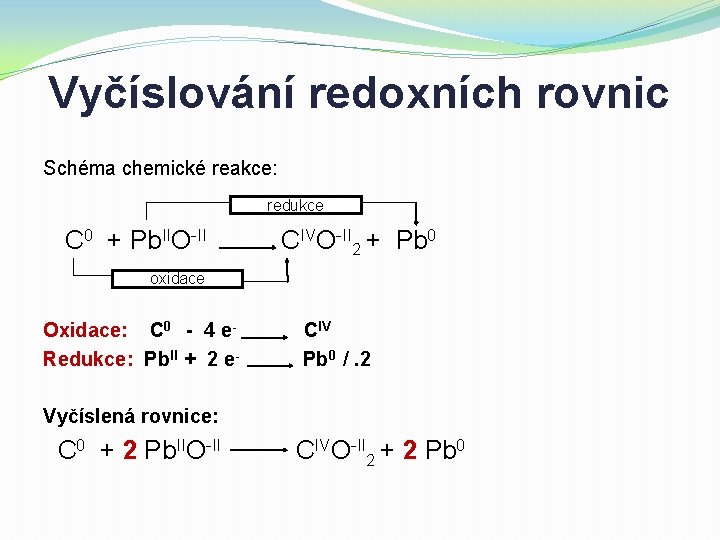
Vyčíslování redoxních rovnic Schéma chemické reakce: redukce C 0 + Pb. IIO-II CIVO-II 2 + Pb 0 oxidace Oxidace: C 0 - 4 e. Redukce: Pb. II + 2 e- CIV Pb 0 /. 2 Vyčíslená rovnice: C 0 + 2 Pb. IIO-II CIVO-II 2 + 2 Pb 0

Použitá literatura: Pavel Beneš-Václav Pumpr- Jiří Banýr, Základy praktické chemie 2, nakladatelství Fortuna Jiří Šibor, Irena Plucková, Josef Mach, Chemie pro 9. ročník, nakladatelství Fortuna Nová Škola, s. r. o. Jiří Škoda, Pavel Doulík, Chemie 9 učebnice pro základní školy a víceletá gymnázia, nakladatelství Fraus 2007