SOLI MGR JITKA POSPILOV CO JSOU TO SOLI











- Slides: 17

SOLI MGR. JITKA POSPÍŠILOVÁ

CO JSOU TO SOLI? • CHEMICKÉ SLOUČENINY SLOŽENÉ Z KATIONTU KOVŮ, PŘÍPADNĚ NH 4+ (AMONNÝ KATION) A ANIONTU KYSELIN

NÁZVOSLOVÍ • PODSTATNÉ JMÉNO: ODVOZENO OD NÁZVU KYSELINY (KYSELINA UHLIČITÁ – UHLIČITAN) • PŘÍDAVNÉ JMÉNO: ODVOZENO OD NÁZVU KATIONTU (VÁPENATÝ)

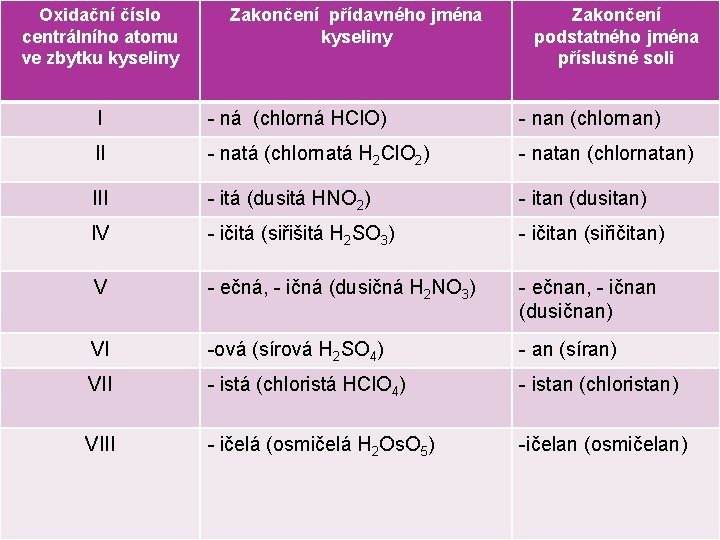
Oxidační číslo centrálního atomu ve zbytku kyseliny Zakončení přídavného jména kyseliny NÁZVOSLOVÍ Zakončení podstatného jména příslušné soli I - ná (chlorná HCl. O) - nan (chlornan) II - natá (chlornatá H 2 Cl. O 2) - natan (chlornatan) III - itá (dusitá HNO 2) - itan (dusitan) IV - ičitá (siřišitá H 2 SO 3) - ičitan (siřičitan) V - ečná, - ičná (dusičná H 2 NO 3) - ečnan, - ičnan (dusičnan) VI -ová (sírová H 2 SO 4) - an (síran) VII - istá (chloristá HCl. O 4) - istan (chloristan) VIII - ičelá (osmičelá H 2 Os. O 5) -ičelan (osmičelan)

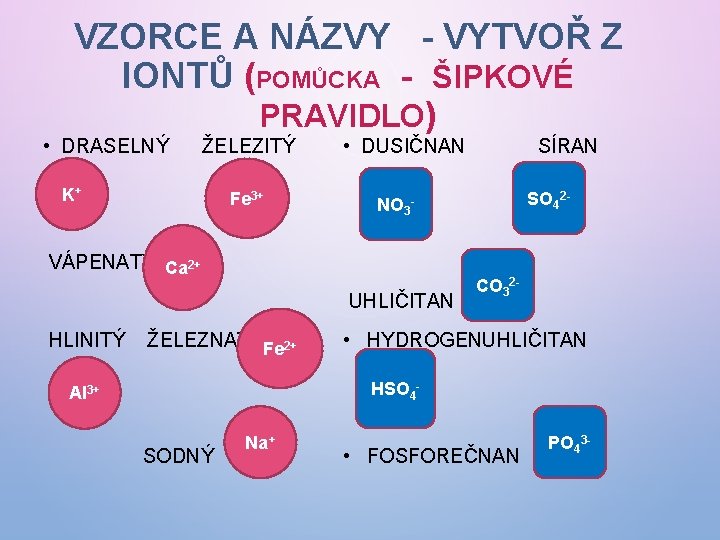
VZORCE A NÁZVY - VYTVOŘ Z IONTŮ (POMŮCKA - ŠIPKOVÉ PRAVIDLO) • DRASELNÝ ŽELEZITÝ K+ Fe 3+ • DUSIČNAN UHLIČITAN ŽELEZNATÝFe 2+ SO 42 - NO 3 - VÁPENATÝ Ca 2+ HLINITÝ SÍRAN CO 32 - • HYDROGENUHLIČITAN HSO 4 - Al 3+ SODNÝ Na+ • FOSFOREČNAN PO 43 -

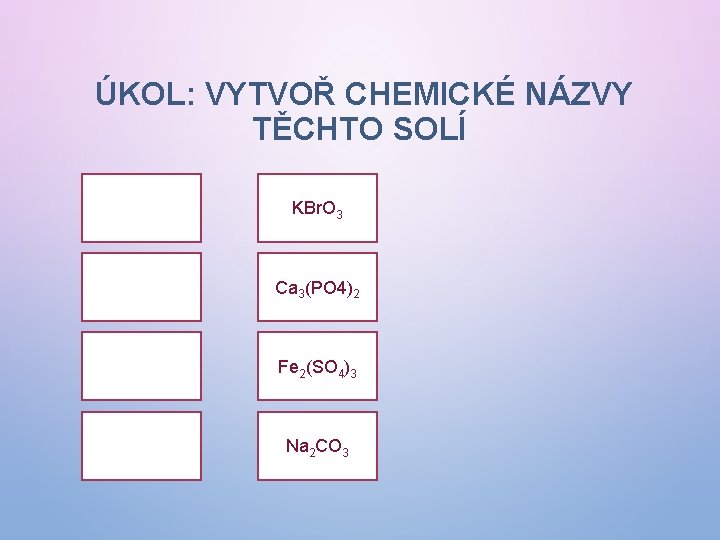
ÚKOL: VYTVOŘ CHEMICKÉ NÁZVY TĚCHTO SOLÍ KBr. O 3 Ca 3(PO 4)2 Fe 2(SO 4)3 Na 2 CO 3

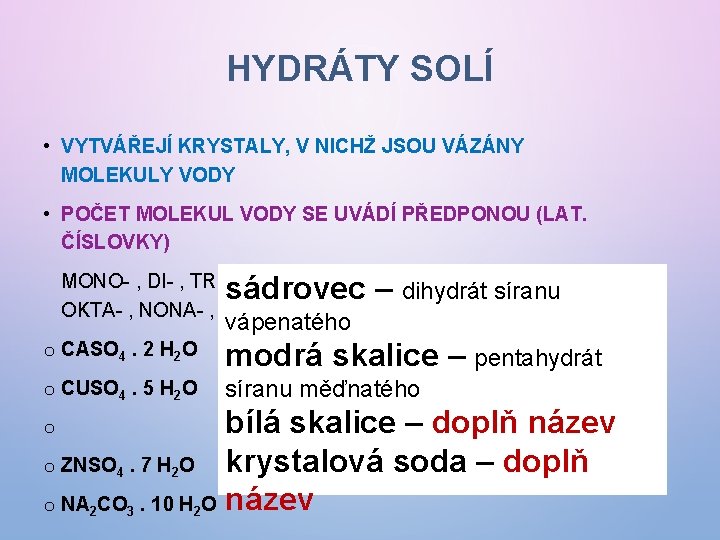
HYDRÁTY SOLÍ • VYTVÁŘEJÍ KRYSTALY, V NICHŽ JSOU VÁZÁNY MOLEKULY VODY • POČET MOLEKUL VODY SE UVÁDÍ PŘEDPONOU (LAT. ČÍSLOVKY) sádrovec – MONO- , DI- , TRI- , TETRA- , PENTA- , HEXA- , HEPTA- , dihydrát síranu OKTA- , NONA- , DEKA- HYDRÁT vápenatého o CASO 4. 2 H 2 O modrá skalice – pentahydrát o CUSO 4. 5 H 2 O síranu měďnatého bílá skalice – doplň název o ZNSO 4. 7 H 2 O krystalová soda – doplň o NA 2 CO 3. 10 H 2 O název o

HYDROGENSOLI • ANIONTY KYSELIN, KTERÉ MAJÍ JEDEN NEBO VÍCE ODŠTĚPITELNÝCH KATIONTŮ VODÍKU HSO 4 - HYDROGENSÍRANOVÝ ANION HPO 42 - HYDROGENFOSFOREČNANOVÝ ANION H 2 PO 4 - DIHYDROGENFOSFOREČNANOVÝ ANION HCO 3 - HYDROGENUHLIČITANOVÝ ANION

VZNIK SOLÍ ØNEUTRALIZACÍ: JE TO REAKCE KYSELINY S HYDROXIDEM, VZNIKÁ SŮL A VODA (DOPLŇ OX. ČÍSLA A NÁZVY SLOUČENIN) HCL + NAOH→ NACL + H 2 O ØREAKCÍ KOVU S KYSELINOU: JE TO REAKCE KOVU S KYSELINOU, VZNIKÁ SŮL A VODÍK OX. ČÍSLA A NÁZVY SLOUČENIN) (DOPLŇ ZN + 2 HCL → ZNCL 2 + H 2

VZNIK SOLÍ ØREAKCÍ KOVU S NEKOVEM: JE TO REAKCE KOVU S NEKOVEM, VZNIKÁ SŮL (DOPLŇ OX. ČÍSLA A NÁZVY SLOUČENIN) 2 CU + S → CU 2 S ØREAKCÍ OXIDU KOVU S OXIDEM NEKOVU: JE TO REAKCE KOVU S NEKOVEM, VZNIKÁ SŮL (DOPLŇ OX. ČÍSLA A NÁZVY SLOUČENIN) CAO + CO 2 → CACO 3

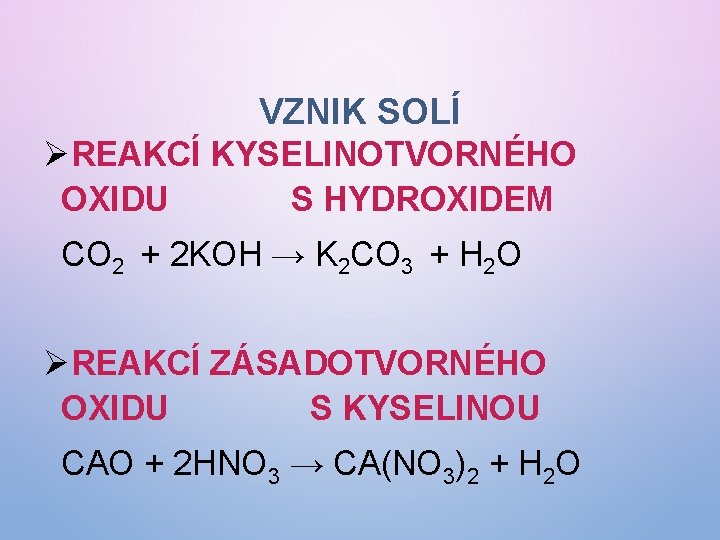
VZNIK SOLÍ ØREAKCÍ KYSELINOTVORNÉHO OXIDU S HYDROXIDEM CO 2 + 2 KOH → K 2 CO 3 + H 2 O ØREAKCÍ ZÁSADOTVORNÉHO OXIDU S KYSELINOU CAO + 2 HNO 3 → CA(NO 3)2 + H 2 O

VZNIK SOLÍ ØSRÁŽECÍ REAKCÍ – REAKCE DVOU SOLÍ AGNO 3 + KCL → AGCL + KNO 3

DEMONSTRAČNÍ POKUS - VZNIK SOLÍ • PRAKTICKÁ UKÁZKA: ZINEK A KYSELINA CHLOROVODÍKOVÁ …… UKÁZKA NA INTERNETU: YOUTUBE

UŽITÍ SOLÍ • DUSIČNANY • LEDKY – PRŮMYSLOVÁ HNOJIVA ( DUSIČNAN SODNÝ, DRASELNÝ, ) DODÁVAJÍ ROSTLINÁM STOPOVÉ PRVKY – N, CA, K • VÝROBA VÝBUŠNIN (DUSIČNAN DRASELNÝ) • FOTO PAPÍRY, KOŽNÍ LÉKAŘSTVÍ (DUSIČNAN STŘÍBRNÝ) - LÁPIS

UŽITÍ SOLÍ • SÍRANY • SÍRAN MĚĎNATÝ: SKALICE MODRÁ POMĚĎOVÁNÍ IMPREGNACE DŘEVA PROTI HNILOBĚ POSTŘIKY ROSTLIN PROTI HOUBÁM A ŠKŮDCŮM • SÍRAN VÁPENATÝ: SÁDROVEC VÝROBA SÁDRY PRO STAVEBNICTVÍ, LÉKAŘSTVÍ

UŽITÍ SOLÍ • HYDROGENUHLIČITANY • SODNÝ: JEDLÁ SODA ŠUMIVÉ PRÁŠKY NÁPOJŮ, KYPŘÍCÍ PRÁŠKY DO PEČIVA ZMÍRNĚNÍ KYSELOSTI ŽALUDKU • UHLIČITANY o SODNÝ: ZMĚKČOVÁNÍ VODY VÝROBA MÝDLA A SKLA o DRASELNÝ: VÝROBA SKLA A MAZLAVÝCH MÝDEL o VÁPENATÝ: VÁPENEC o VÝROBA PÁLENÉHO VÁPNA o PŘÍSADA PŘI VÝROBĚ ŽELEZA – STRUSKA o STAVEBNÍ KÁMEN, OBKLADY - MRAMOR

UŽITÍ SOLÍ • KŘEMIČITANY • ŽIVCE, SLÍDY • KERAMIKA, STAVEBNÍ MATERIÁLY • FOREČNANY • VÁPENATÝ: FOSFORIT, APATIT VÝROBA FOSFOREČNÝCH HNOJIV VÝROBA FOSFOREČNÝCH SLOUČENIN