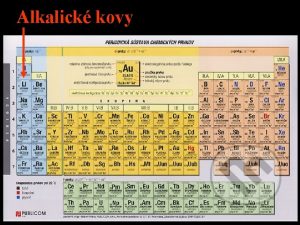
Prvky I A skupiny alkalick kovy charakteristika zsadotvorn












































- Slides: 45

Prvky I. A skupiny - alkalické kovy • charakteristika: • zásadotvorné kovy • elektropozitivní prvky – jejich atomy mají nízké hodnoty elektronegativit • s – prvky – valenční elektron(y) v orbitalech s

vodík (1 H) • výskyt: • nejrozšířenější prvek ve vesmíru a třetí nejrozšířenější prvek na Zemi • volný vodík se nachází např. v plynném obalu hvězd • na Zemi se volný vodík za běžných podmínek nevyskytuje • významný biogenní prvek

Slunce

• laboratorní příprava: • reakcí elektropozitivních kovů s vodou: 2 Na + 2 H 2 O → Na. OH + H 2 • reakcí zředěných kyselin s elektropozitivními kovy: Mg + 2 HCl → H 2 + Mg. Cl 2 • elektrolýzou okyselené vody s platinovými elektrodami: (katoda – H 2, anoda – O 2)

• průmyslová výroba: • reakcí vodní páry s koksem nebo methanem: H 2 O + C → CO + H 2 (t = 1000°C) CH 4 + H 2 O → CO + H 2 (t = 1100°C) • vedlejší produkt při výrobě chlóru a hydroxidu sodného

• fyzikální vlastnosti: • v přírodě se vyskytuje jako směs tří izotopů: 1 H, 2 H, 3 H • bezbarvý plyn, bez chuti a zápachu, 14, 4 x lehčí než vzduch • obtížně se zkapalňuje a přeměňuje na pevnou látku, uchovává se v tlakových lahvích s červeným pruhem

• chemické vlastnosti: • molekulový vodík je málo reaktivní - vysoká vazebná energie • zapálen na vzduchu shoří - reaguje se vzdušným kyslíkem za vzniku vody - exotermická reakce: 2 H 2(g) + O 2(g) → 2 H 2 O(l) • při laboratorní teplotě oba plyny spolu nereagují (bez iniciace)

• při teplotě větší než 600°C probíhá slučování explozivně, tím prudčeji, čím je směs H 2 a O 2 blíže poměru 2: 1, (třaskavý plyn) • redukční vlastnosti - výroba kovů: Cu. O + H 2 → H 2 O + Cu

• elektrickým výbojem vzniká atomární vodík (H) (vodík ve stavu zrodu, nascentní vodík) – velmi reaktivní – nestálý - existuje velmi krátkou dobu a slučuje se na molekulární vodík

1 H • využití • • • výroba amoniaku, methanolu, chlorovodíku hydrogenace olejů redukční činidlo - výroba kovů řezání kovů raketové palivo

motocykl využívající vodík jako palivo

2 H • využití - výroba těžké vody pro jaderné reaktory 3 H – vzniká působením kosmického záření na vzdušný dusík • využití - sledování pohybu spodních vod, tritiová barva (displeje hodinek)

využití tritia

sodík (11 Na) - alkalický kov • výskyt: • • kamenná sůl - Na. Cl chilský ledek - Na. NO 3 kryolit – Na 3 Al. F 6 borax - Na 2 B 4 O 7· 10 H 2 O glauberit - Na 2 SO 4·Ca. SO 4 Glauberova sůl - Na 2 SO 4· 10 H 2 O mořská voda (Na. Cl)

• průmyslová výroba: • elektrolýzou roztavené směsi 40% Na. Cl a 60% Ca. Cl 2 při teplotě 580 °C (Ca. Cl 2 snižuje teplotu tání) • katoda: Na + + e- Na • anoda: Cl- - e- Cl (Cl 2)

• fyzikální vlastnosti: • měkký, nízkotající, stříbrolesklý kov, lze jej krájet nožem • krystalizuje v kubické soustavě

sodík

• chemické vlastnosti: • uchovává se pod vrstvou petroleje • s kyslíkem reaguje za vzniku oxidu (Na 2 O) a peroxidu sodného (Na 2 O 2) • reaguje s vodou: 2 Na + 2 H 2 O → 2 Na. OH + H 2

• má redukční vlastnosti: Al 2 O 3 + 6 Na → Al + 3 Na 2 O • barví plamen žlutě

reakce sodíku s vodou


hoření sodíku v chlóru – vzniká chlorid sodný

• sloučeniny: • halogenidy – bezbarvé, krystalické látky – mají vysokou teplotu tání

• chlorid sodný – získává se z přírodního materiálu – kamenná sůl (dolování) nebo vyluhováním některých ložisek vodou – mořská sůl (odpařování) – kuchyňská sůl vlhne (obsahuje malé množství nečistot, které jsou hygroskopické - hlavně Mg. Cl 2)

krystal halitu na jílovci

• využití: • výchozí látka pro přípravu řady anorganických sloučenin, např. hydroxidu sodného, sody, chlóru, sodíku

• sulfid sodný – bílá krystalická látka, činidlo v analytické chemii

• hydroxid sodný – výroba elektrolýzou roztoku chloridu sodného a) amalgámovým způsobem: od tohoto postupu se v současné době již upouští Na. Cl → Na+ + Cl. K : Na+ + e- → Na Na + Hg → Na. Hg 2 Na. Hg + 2 H 2 O → 2 Na. OH(aq) + 2 Hg + H 2 A : Cl- - e- → Cl 2 Cl → Cl 2

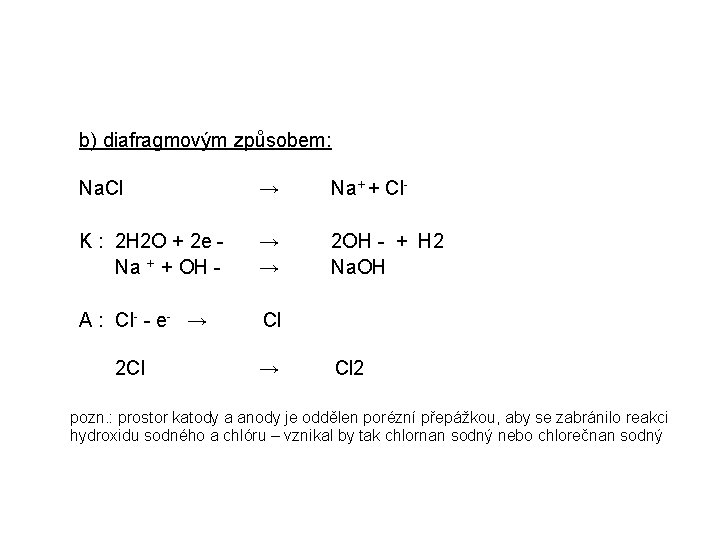
b) diafragmovým způsobem: Na. Cl → Na+ + Cl- K : 2 H 2 O + 2 e Na + + OH - → → 2 OH - + H 2 Na. OH A : Cl- - e- → Cl 2 Cl → Cl 2 pozn. : prostor katody a anody je oddělen porézní přepážkou, aby se zabránilo reakci hydroxidu sodného a chlóru – vznikal by tak chlornan sodný nebo chlorečnan sodný

– bezbarvá krystalická látka, dobře rozpustná ve vodě, hygroskopická, silná zásada – absorbuje oxid uhličitý: 2 Na. OH + CO 2 → Na 2 CO 3 + H 2 O – absorbuje sulfan: 2 Na. OH + H 2 S →Na 2 S + H 2 O • thiosíran sodný – ve vodě dobře rozpustný – bezvodý nebo pentahydrát (Na 2 S 2 O 3· 5 H 2 O) – využívá se v analytické chemii (odměrná analýza)

• uhličitan sodný (bezvodá soda) – výroba – E. Solvay: NH 3 + CO 2 + H 2 O + Na. Cl → Na. HCO 3 + NH 4 Cl 2 Na. HCO 3 → Na 2 CO 3 + H 2 O + CO 2, t = 150 C (v pecích) – bezvodá soda – bílý prášek, dobře rozpustný ve vodě – krystalová soda – krystalický dekahydrát (Na 2 CO 3· 10 H 2 O), na vzduchu větrá – heptahydrát (Na 2 CO 3· 7 H 2 O) až monohydrát (Na 2 CO 3·H 2 O) • využití - výroba mýdel, skla

• hydrogenuhličitan sodný (jedlá soda) • využití - šumivé prášky k přípravě limonád, lékařství (proti překyselení žaludku)

• dusičnan sodný • získává se z přírodních ložisek – chilský ledek • využití - hnojivo • dusitan sodný – příprava tepelným rozkladem dusičnanu sodného – bílá krystalická látka, dobře rozpustná ve vodě • využití – výroba azobarviv

• síran sodný – vedlejší produkt při výrobě kyseliny chlorovodíkové: 2 Na. Cl + H 2 SO 4 → Na 2 SO 4 + HCl

draslík (19 K) • výskyt: • sylvín - KCl • mořská voda (0, 06 % KCl)

sylvín

draslík

• fyzikální vlastnosti: • stříbrobílý, měkký kov • dobře vede teplo a elektrický proud • krystalizuje v kubické soustavě • chemické vlastnosti: • reaktivnější než sodík, s vodou prudce reaguje: • 2 K + 2 H 2 O → H 2 + 2 KOH

• barví plamen fialově, redukční vlastnosti • sloučeniny: • hydroxid draselný – bezbarvá krystalická látka, dobře rozpustná ve vodě, hygroskopická, silná zásada – vyrábí se elektrolýzou roztoku chloridu draselného

– absorbuje oxid uhličitý: 2 KOH + CO 2 → K 2 CO 3 + H 2 O – absorbuje sulfan: 2 KOH + H 2 S → K 2 S + H 2 O

• uhličitan draselný (potaš) – bílá hygroskopická látka • využití - výroba tabulového skla

potaš

• dusičnan draselný • využití - silné oxidační činidlo (střelný prach, pyrotechnika)

• chlorečnan draselný – příprava zaváděním chloru za tepla do roztoku hydroxidu draselného: 6 KOH + 3 Cl 2 → KCl. O 3 + 5 KCl +3 H 2 O – bílá hygroskopická látka • využití - v malém množství v zápalkách a výbušninách

• síran draselný – bílá, hygroskopická látka – dobře rozpustná ve vodě • využití - hnojivo
 Prvky 17 skupiny
Prvky 17 skupiny Diagonální podobnost
Diagonální podobnost Prvky 17 skupiny
Prvky 17 skupiny Kyslk
Kyslk Prvky iii.a skupiny
Prvky iii.a skupiny Hyperperoxid
Hyperperoxid Prvky viii.a skupiny
Prvky viii.a skupiny Sfarbenie plameňa alkalické kovy
Sfarbenie plameňa alkalické kovy Biogénne kovy
Biogénne kovy Kujnost a tažnost
Kujnost a tažnost Rozličné kovy zpracovávali
Rozličné kovy zpracovávali Sociometrická matice
Sociometrická matice Hierarchický model spolupráce
Hierarchický model spolupráce Krevní skupiny
Krevní skupiny Sociální skupiny
Sociální skupiny Krevni skupiny
Krevni skupiny Krvne skupiny tabulka
Krvne skupiny tabulka Nuklida stabil
Nuklida stabil Socialne skupiny delenie
Socialne skupiny delenie Sociální skupiny
Sociální skupiny Skupiny vzdušnicovců
Skupiny vzdušnicovců Krevní skupiny dědičnost
Krevní skupiny dědičnost Sociální status
Sociální status Pseudocholinesteráza
Pseudocholinesteráza Jevko
Jevko Literarne druhy
Literarne druhy Krevni skupiny
Krevni skupiny Krevní skupiny dědičnost
Krevní skupiny dědičnost Sociální skupiny
Sociální skupiny Název skupiny prvohorních obojživelníků
Název skupiny prvohorních obojživelníků Oporn h
Oporn h Skupiny řas
Skupiny řas Krevni skupiny
Krevni skupiny Krevni skupiny
Krevni skupiny Dekameron renesanční prvky
Dekameron renesanční prvky Makrobiogenní prvky
Makrobiogenní prvky Oxidační čísla prvků tabulka
Oxidační čísla prvků tabulka Významné prvky trojuholníka
Významné prvky trojuholníka Prvky
Prvky Mikrobiogenní prvky
Mikrobiogenní prvky Halogeny prezentace
Halogeny prezentace Prvky symetrie
Prvky symetrie Halové prvky
Halové prvky Nonsens je
Nonsens je Meteorologické prvky
Meteorologické prvky Význam nnn
Význam nnn