HALOGENIDY Prvky 7 skupiny Prvky 7 skupiny VII



















- Slides: 20

HALOGENIDY Prvky 7. skupiny

Prvky 7. skupiny (VII. A) jiný název = halogeny jsou reaktivní tvoří dvouatomové molekuly „barevné“ jsou jedovaté Mají 7 valenčních elektronů – skupina VII. A.

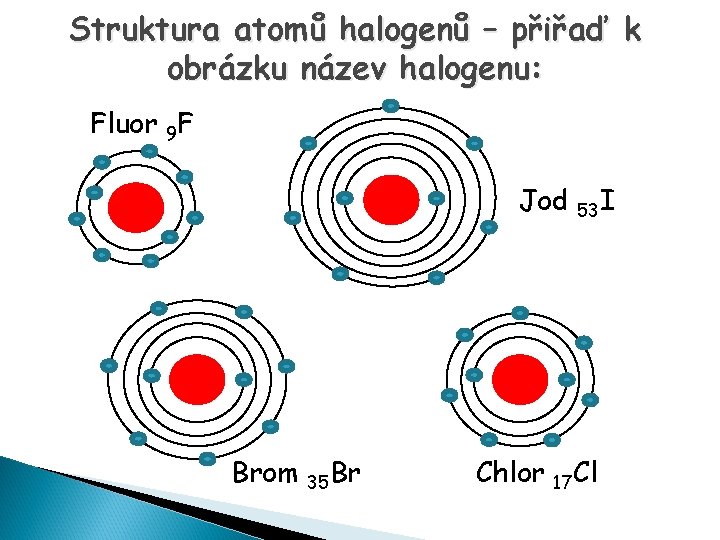
Struktura atomů halogenů – přiřaď k obrázku název halogenu: Fluor 9 F Jod Brom 35 Br Chlor 53 I 17 Cl

HALOGENIDY Dvouprvkové sloučeniny halogenů s jinými prvky (kovy). Připomeň si halogeny - doplň značky prvků a protonové číslo. • • Fluor Chlor Brom Jod ___ F ___ Cl ___ Br ___ I 9 17 35 53 ÚKOL: Z daných sloučenin vyber a podtrhni halogenidy: Na. Cl, Na. OH, K 2 O, SCl 4, Ca. F 2, Pb. S, Al. Cl 3

Oxidační číslo prvků udává zdánlivý náboj prvku ve sloučenině může nabývat hodnoty kladné nebo záporné u volných atomů nebo víceatomových molekul prvku má hodnotu 0! jeho velikost ve sloučenině závisí na elektronegativitě daného prvku (čím vyšší – záporné, čím nižší – kladné) zapisuje se římskými číslicemi od I – VIII ÚKOL: Zjisti v PSP elektronegativitu těchto prvků: Na ……. . , 1, 01 F. ……. . , 4, 10 Ca ………. . , 1, 04 Cl ……. . 2, 83. Na základě zjištění urči znaménko oxidačního čísla + 2 -. ve sloučeninách Na. Cl + -a Ca. F

Křížové pravidlo 1) Pro tvorbu vzorců i názvů platí v chemii obecně tzv. křížové pravidlo, tj. co je v názvu na prvním místě, je ve vzorci na místě druhém a naopak. 2) Pro psaní vzorců je důležité oxidační číslo prvků, které zapisujeme vpravo nahoře. 3) Ve vzorcích dvouprvkových sloučenin má jeden prvek kladné a druhý záporné oxidační číslo. 4) Součet oxidačních čísel ve vzorci = 0. 5) Oxidační číslo halogenů v halogenidu je vždy –I (F-I, Cl-I, Br-I, I-I). 6) Oxidační číslo druhého prvku se řídí koncovkou přídavného jména.

Vzorový příklad – tvoření vzorce Chlorid vápenatý Ca Cl Ca +II Cl-I Ca +II Cl 2 -I Ca. Cl 2 Název halogenidu je tvořen podstatným jménem fluorid, chlorid, bromid, jodid a přídavným jménem odvozeným od druhého prvku.

Procvičování Fluorid vápenatý Chlorid draselný Bromid hlinitý Jodid arseničný Fluorid sírový Jodid olovnatý Řešení

FLUOR – F 2 nažloutlý plyn prudce reaktivní (reaguje téměř se všemi prvky) ve starším českém názvosloví – „kazík“ (protože ochotně reaguje s každou látkou a tím ji „kazí“) ve sloučeninách pevně drží, např. snižuje kazivost zubů (jeho sloučenina je součást zubní skloviny) Použití: součást zubních past, výroba teflonu

Minerály obsahující fluorit (kazivec) Obr. 1 apatit Obr. 2

CHLOR – Cl 2 žlutozelený plyn je těžší než vzduch je silně jedovatý Použití: dezinfekce pitné vody výroba plastů(PVC), kyseliny chlorovodíkové bělení látek a papíru Zneužití: bojový plyn (1. svět. válka) – yperit (1915 – Belgie - Yprés – popsal E. M. Remarque – Na západní frontě klid)

Obr. 3

BROM – Br 2 hnědá kapalina rychle se vypařuje poškozuje oči a pokožku Použití: - chemická výroba - léčiva - jeho sloučenina se stříbrem se používá při výrobě fotografií (negativ x pozitiv)

JOD –I 2 pevná látka barva - černá, s kovovým leskem sublimuje (při zahřívání se mění přímo v páru) je nezbytný pro správný vývoj člověka (funkce štítné žlázy – jeho nedostatek může způsobit duševní poruchy) Použití: přidává se do kuchyňské soli, dezinfekce (jodová tinktura)

Obr. 4

Procvičování Doplň značky halogenů a přiřaď jim vlastnosti: fluor jod brom chlor F …. . I …. . Br …. . Cl …. . 1, 4 ………. . 3, 7 ………. . 2, 6 ………. . 1, 5 ………. . 1) plynná látka 2) kapalina 3) pevná látka 4) nažloutlá barva 5) žlutozelená barva 6) hnědá barva 7) černá barva

Sůl kamenná (halit) (Na. Cl) má krystaly tvaru krychle obsažena v solných jezerech (až 30 %), v mořích (3, 5 %) čirá nebo zbarvená do šeda průsvitná, dokonale štěpná váže vzdušnou vlhkost do ČR se dováží z Polska

využití soli kamenné Solný důl ve městě Wieliczka v Polsku posypový materiál na vozovky chemický průmysl (výroba sodíku, chlóru, jedlé soli) sklářství keramický a kožedělný průmysl obarvená koupelová sůl římští legionáři dostávali část peněz „v soli“ nejstarší hlubinný solný důl je v Polsku – město

fluorit (kazivec) (ca. F 2) fluorid vápenatý dobře štěpný, křehký zbarvení: fialový, žlutý, hnědý, zelený Využití: hutnictví (urychluje tavení rud) výroba teflonu výroba fluorovodíku (HF) výroba leptaných skel získává se z něj fluor (fluoridace pitné vody)

Citace a zdroje: Obr. 1: Soubor: USDA Mineral Flourite 93 c 3962. jpg. In: Wikipedia: the free encyclopedia [online]. San Francisco (CA): Wikimedia Foundation, 2001 -2005 [cit. 2013 -11 -13]. Dostupné z: http: //cs. wikipedia. org/wiki/Soubor: USDA_Mineral_Flourite_93 c 3962. jpg Obr. 2: Soubor: Apatite crystals. jpg. In: Wikipedia: the free encyclopedia [online]. San Francisco (CA): Wikimedia Foundation, 2001 -2006 [cit. 2013 -11 -13]. Dostupné z: http: //cs. wikipedia. org/wiki/Soubor: Apatite_crystals. jpg Obr. 3: Soubor: Chlorine. jpg. In: Wikipedia: the free encyclopedia [online]. San Francisco (CA): Wikimedia Foundation, 2001 -2007 [cit. 2013 -11 -13]. Dostupné z: http: //cs. wikipedia. org/wiki/Soubor: Chlorine. jpg Obr. 4: File: Iodine-sample. jpg. In: Wikipedia: the free encyclopedia [online]. San Francisco (CA): Wikimedia Foundation, 2001 -2007 [cit. 2013 -11 -13]. Dostupné z: http: //commons. wikimedia. org/wiki/File: Iodine-sample. jpg
 Vii.a skupina
Vii.a skupina Iii.a skupina
Iii.a skupina Prvky vi.a skupiny
Prvky vi.a skupiny 16. skupina prvků
16. skupina prvků Prvky viii.a skupiny
Prvky viii.a skupiny Prvky 17 skupiny
Prvky 17 skupiny Prvky 13. skupiny
Prvky 13. skupiny Halogenidy vzorce
Halogenidy vzorce Halogenidy vzorce
Halogenidy vzorce Halogenidy priklady
Halogenidy priklady Halogenidy koncovky
Halogenidy koncovky Halogenidy prezentace
Halogenidy prezentace Co jsou halogenidy
Co jsou halogenidy Vzorec halogenidu
Vzorec halogenidu Halogenidy karboxylových kyselin
Halogenidy karboxylových kyselin Jodid sírový
Jodid sírový Jodid hlinitý
Jodid hlinitý Oporn h
Oporn h Krevní skupiny dědičnost
Krevní skupiny dědičnost Krevni skupiny
Krevni skupiny Název skupiny prvohorních obojživelníků
Název skupiny prvohorních obojživelníků






































