Opakovanie Nzvoslovie Halogenidy Halogenigy s dvojprvkov zleniny halognov

















- Slides: 21

Opakovanie Názvoslovie

Halogenidy

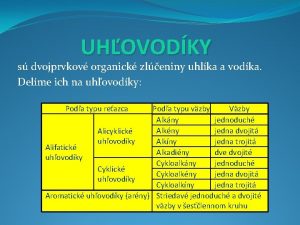
Halogenigy Ø sú dvojprvkové zlúčeniny halogénov s inými prvkami (väčšinou kovmi) Ø oxidačné číslo halogénov je – I F-I, Cl-I, Br-I, I-I Ø názov sa skladá z podstatného a prídavného mena Ø podstatné meno je halogenid Ø prídavné meno má príponu podľa oxidačného čísla príslušného prvku

Utvorme vzorec chloridu železitého Ø značky prvkov zapíšeme v opačnom poradí Fe. Cl Ø doplníme oxidačné číslo chlóru -I a železa podľa prípony itý = III -I Fe Cl

Ø použijeme krížové pravidlo III -I Fe Cl Fe. Cl 3 Ø súčet oxidačných čísel atómov obidvoch prvkov vo vzorci sa rovná nule 1. (III) + 3. (-I) = 0

Skúsme napísať vzorec fluoridu vápenatého Ø značky prvkov zapíšeme v opačnom poradí Ø doplníme oxidačné čísla Ø krížové pravidlo Ø pomer atómov prvkov je Ø výsledný vzorec bude Ca. F Ca. IIF-I Ca. F 2 1: 2 Ca. F 2

Oxidy

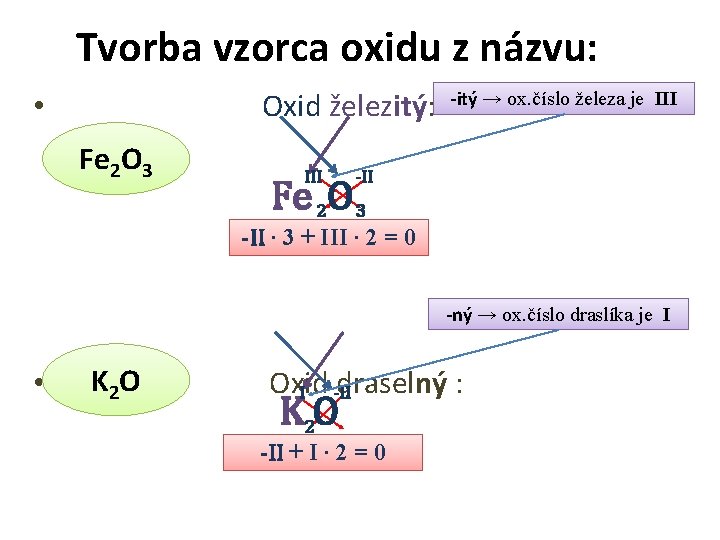
Tvorba vzorca oxidu z názvu: Oxid železitý: • Fe 2 O 3 III -itý → ox. číslo železa je III -II Fe 2 O 3 -II ∙ 3 + III ∙ 2 = 0 -ný → ox. číslo draslíka je I • K 2 O Oxid draselný : I -II K 2 O -II + I ∙ 2 = 0

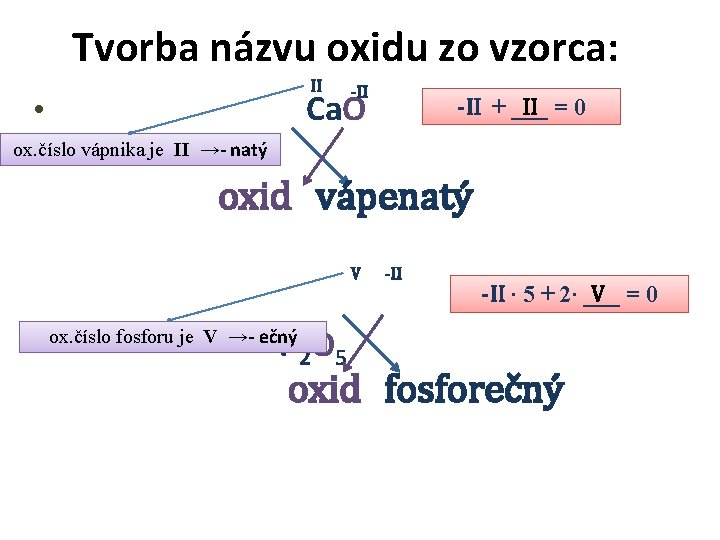
Tvorba názvu oxidu zo vzorca: II -II Ca. O • -II + ___ II = 0 ox. číslo vápnika je II →- natý oxid vápenatý V • P 2 O 5 -II ∙ 5 + 2∙ ___ V =0 ox. číslo fosforu je V →- ečný oxid fosforečný

Kyseliny

Bezkyslíkaté kyseliny • v molekule halogenovodíkovej kyseliny má atóm vodíka oxidačné číslo +I a atóm halogénu oxidačné číslo –I, napr. : +I -I kyselina chlorovodíková H Cl kyselina jodovodíková +I -I H I

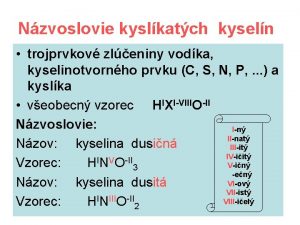
Kyslíkaté kyseliny • kyslíkaté kyseliny sú trojprvkové zlúčeniny vodíka, kyslíka a kyselinotvorného prvku – H X O, • v molekule kyseliny má vodík oxidačné číslo +I, kyslík –II a kyselinotvorný prvok +I až +VIII, • názov kyslíkatých kyselín sa tvorí z dvoch slov: – podstatné meno je slovo kyselina – prídavné meno je utvorené z názvu kyselinotvorného prvku a prípony zodpovedajúcej oxidačnému číslu

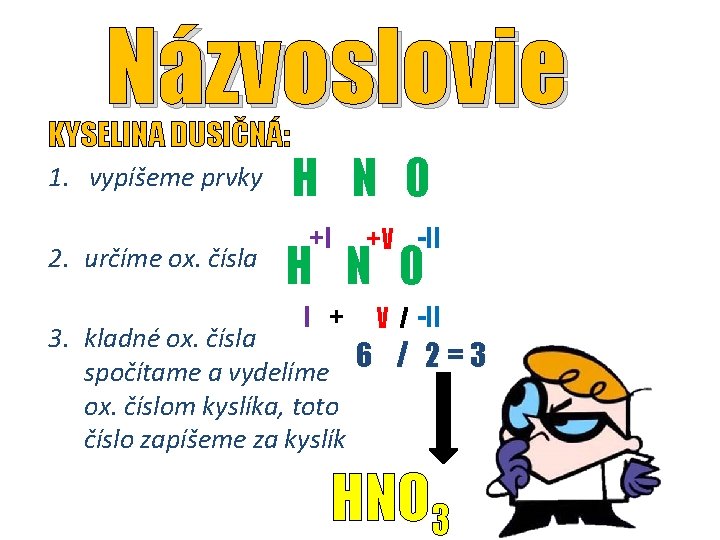
Názvoslovie KYSELINA DUSIČNÁ: 1. vypíšeme prvky 2. určíme ox. čísla H N O +I +V -II I + V / -II H N O 3. kladné ox. čísla 6 / 2 = 3 spočítame a vydelíme ox. číslom kyslíka, toto číslo zapíšeme za kyslík HNO 3

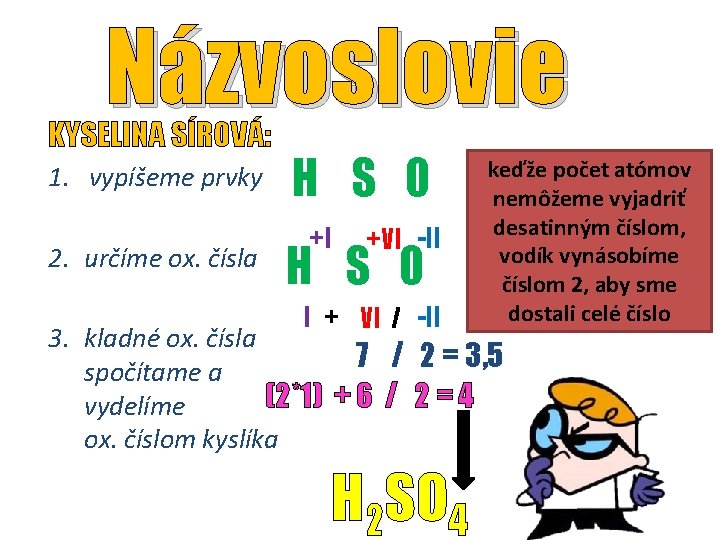
Názvoslovie KYSELINA SÍROVÁ: 1. vypíšeme prvky 2. určíme ox. čísla H S O +I +VI -II H S O I + VI / -II keďže počet atómov nemôžeme vyjadriť desatinným číslom, vodík vynásobíme číslom 2, aby sme dostali celé číslo 3. kladné ox. čísla 7 / 2 = 3, 5 spočítame a (2*1) + 6 / 2 = 4 vydelíme ox. číslom kyslíka H 2 SO 4

Hydroxidy

NÁZVOSLOVIE • názvy hydroxidov sa podobne ako názvy kyselín skladajú z dvoch slov: – podstatné meno – tvorí ho slovo hydroxid, – prídavné meno – je odvodené od názvu hydroxidotvorného prvku s príponou, ktorá zodpovedá oxidačnému číslu: K+I -ný hydroxid draselný KOH Ca+II -natý hydroxid vápenatý Ca(OH)2 Al+III-itý hydroxid hlinitý Al(OH)3

PRÍKLAD HYDROXID DRASELNÝ K OH 1. vypíšeme prvky 2. určíme ox. čísla +I K OH 3. krížovým pravidlom +I prenesieme ox. čísla -I K OH 4. vytvoríme vzorec KOH -I

PRÍKLAD HYDROXID ŽELEZITÝ Fe O H 1. vypíšeme prvky 2. určíme ox. čísla +III Fe OH 3. krížovým pravidlom +III prenesieme ox. čísla -I Fe OH 4. vytvoríme vzorec -I Fe(OH)3 ak je oxidačné číslo hydroxidotvorného prvku vyššie ako +I, celá hydroxidová skupina sa dáva do zátvoriek

Napíšte vzorce daných halogenidov a oxidov Jodid strieborný Chlorid železitý Jodid sodný Fluorid jodistý Chlorid olovičitý Fluorid lítny Chlorid antimoničný Fluorid sírový Bromid draselný Chlorid telúrový Oxid ortuťnatý Oxid kobaltitý Oxid brómový Oxid manganistý Oxid tantalečný Oxid strieborný Oxid kremičitý Oxid titaničný Oxid osmičelý

Napíšte vzorce daných kyselín a hydroxidov Hydroxid strieborný Hydroxid hlinitý Hydroxid sodný Hydroxid zlatistý Hydroxid olovičitý Hydroxid lítny Hydroxid antimoničný Hydroxid chrómový Hydroxid germáničitý Hydroxid telúrový Kyselina olovnatá Kyselina kobaltitá Kyselina chloristá Kyselina bromovodíková Kyselina tantalečná Kyselina trihydrogén tantalečná Kyselina kremičitá Kyselina titaničitá Kyselina dusitá

Ďakujem za pozornosť!
 Halogenidy koncovky
Halogenidy koncovky Bromid vanadičný
Bromid vanadičný Halogenidy prezentace
Halogenidy prezentace Halogenidy zástupci
Halogenidy zástupci Jodid sírový
Jodid sírový Halogenidy karboxylových kyselin
Halogenidy karboxylových kyselin Halogenidy vzorce priklady
Halogenidy vzorce priklady Halogenidy vzorce
Halogenidy vzorce Chlorid selenový
Chlorid selenový Halogenidy priklady
Halogenidy priklady Opakovanie vybraných slov
Opakovanie vybraných slov Opakovanie vybraných slov
Opakovanie vybraných slov Podstatne mena
Podstatne mena Parove znele
Parove znele Pomocka premena jednotiek
Pomocka premena jednotiek Staroveký rím opakovanie
Staroveký rím opakovanie Present continuous vety
Present continuous vety Jaroslava koníčková
Jaroslava koníčková