OXIDACINREDUCCIN Fernando Carrillo rea de Qumica Inorgnica UCLM











- Slides: 20

OXIDACIÓN-REDUCCIÓN Fernando Carrillo Área de Química Inorgánica UCLM

OXIDACIÓN-REDUCCIÓN TRANSFERENCIA DE ELECTRONES ENTRE ESPECIES QUÍMICAS Ø No existen electrones libres Ø Reductor: cede electrones se oxida Ø Oxidante: acepta electrones se reduce

TABLAS DE POTENCIALES Recogen semirreacciones redox Reacción redox: combinación de semirreacciones de oxidación y reducción (de manera formal) e. o. I e. o. 0 2 H+(aq) + 2 ee. o. 0 H 2(g) REDUCCIÓN e. o. II Zn(s) Zn 2+(aq) + 2 e- OXIDACIÓN Zn(s) + 2 H+(aq) Zn 2+(aq) + H 2(g) REDOX Par redox: H+/H 2 Zn 2+/Zn forma ox. / forma red.

TABLAS DE POTENCIALES CONVENIO: SE TABULAN SEMIRREACCIONES DE REDUCCIÓN, DE TAL FORMA QUE UNA REACCIÓN REDOX SE PUEDE EXPRESAR COMO LA DIFERENCIA DE DOS SEMIRREACCIONES DE REDUCCIÓN , DESPUÉS DE IGUALAR EL NÚMERO DE ELECTRONES INTERCAMBIADOS 2 H+(aq) + 2 e- - H 2(g) Zn 2+(aq) + 2 e- Zn(s) + 2 H+(aq) Zn 2+(aq) + H 2(g) REDOX

TABLAS DE POTENCIALES EN TÉRMINOS DE DGo - Ox 1 + ne- Red 1 DGo 1 Ox 2 + ne- Red 2 DGo 2 Ox 1 + Red 2 Red 1 + Ox 2 DGo. T= DGo 1 - DGo 2

TABLAS DE POTENCIALES POR CONVENIO 2 H+(aq) + 2 e- H 2(g) DGo= 0 p(H 2)= 1 atm p. H = 0 (1 M) Por la relación con esta semirreacción (electrodo de hidrógeno) se mide el resto.

TABLAS DE POTENCIALES

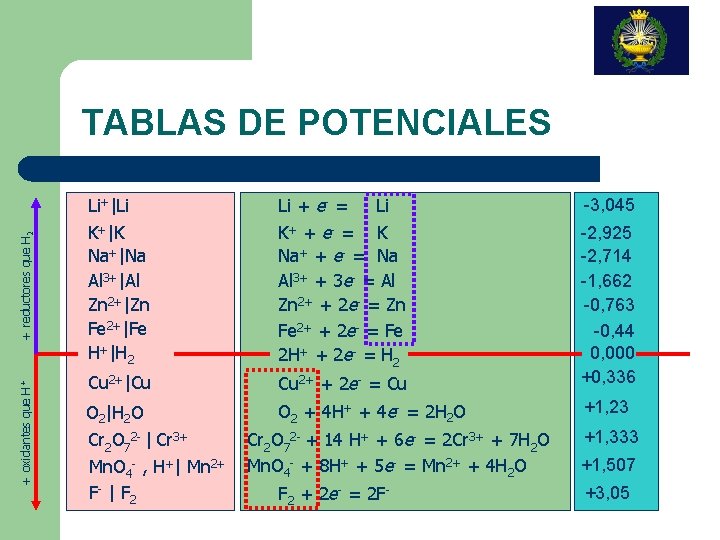
TABLAS DE POTENCIALES SE TABULAN SEMIRREACCIONES DE REDUCCIÓN CON SUS POTENCIALES DE REDUCCIÓN. 2 H+(aq) + 2 e- - Zn 2+(aq) + 2 e- Zn(s) + 2 H+(aq) H 2(g) Zn(s) Eo= 0 V a cualquier T Eo=-0. 76 V a 25ºC Zn 2+(aq) + H 2(g) Eo= 0 – (-0. 76)= 0. 76 V DGo=-n. FEo DGo>0 ESPONTÁNEA

+ oxidantes que H + + reductores que H 2 TABLAS DE POTENCIALES Li+|Li Li + e- = Li -3, 045 K+|K Na+|Na Al 3+|Al Zn 2+|Zn Fe 2+|Fe H+|H 2 K+ + e- = K Na+ + e- = Na Al 3+ + 3 e- = Al Zn 2+ + 2 e- = Zn Fe 2+ + 2 e- = Fe 2 H+ + 2 e- = H 2 Cu 2+|Cu Cu 2+ + 2 e- = Cu -2, 925 -2, 714 -1, 662 -0, 763 -0, 44 0, 000 +0, 336 O 2|H 2 O Cr 2 O 72 - | Cr 3+ Mn. O 4 - , H+| Mn 2+ F- | F 2 O 2 + 4 H+ + 4 e- = 2 H 2 O Cr 2 O 72 - + 14 H+ + 6 e- = 2 Cr 3+ + 7 H 2 O Mn. O 4 - + 8 H+ + 5 e- = Mn 2+ + 4 H 2 O F 2 + 2 e- = 2 F- +1, 23 +1, 333 +1, 507 +3, 05

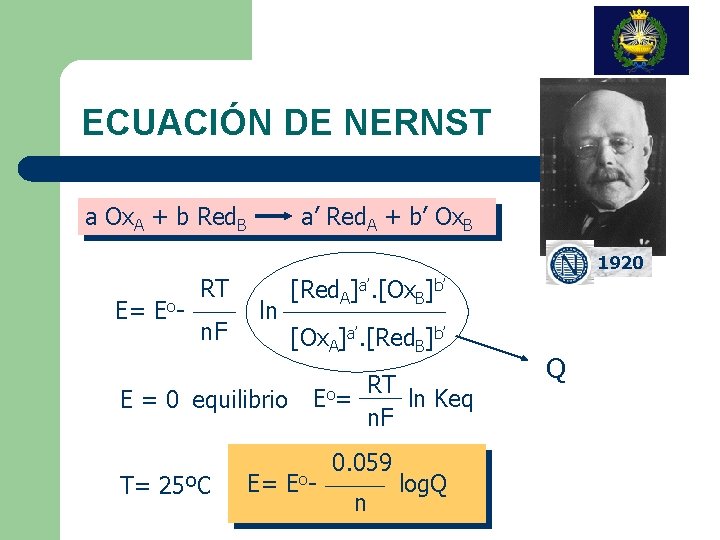
ECUACIÓN DE NERNST a Ox. A + b Red. B a’ Red. A + b’ Ox. B 1920 E= Eo- RT n. F ln E = 0 equilibrio T= 25ºC [Red. A]a’. [Ox. B]b’ [Ox. A]a’. [Red. B]b’ Eo = RT ln Keq n. F 0. 059 E= Eo log. Q n Q

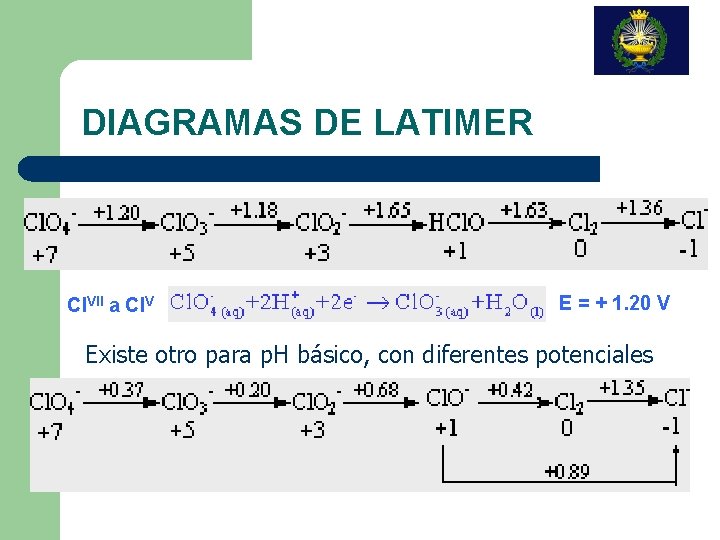
DIAGRAMAS DE LATIMER Cl. VII a Cl. V E = + 1. 20 V Existe otro para p. H básico, con diferentes potenciales

DIAGRAMAS DE LATIMER Calculo de potenciales de reducción para especies no adyacentes del Diagrama de Latimer Consideremos la semirreacción para ir de Cl(+1) a Cl(0): Y la semirreacción para ir de Cl(0) a Cl(-1): El potencial de la semirreacción 1 es: E 1 = +1. 63 V Y el potencial de la semirreacción 2 es: E 2 = +1. 36 V Entonces, la energía libre de la semirreacción 1 ( donde n es el nº de e transferidos = 1) es: DG 1 = -n. FE = -1. 63 F Y para la 2 (n = 1) es: Entonces, la energía libre para la conversión de Cl(+1) a Cl(-1) es: DG 2 = -n. FE = -1. 36 F DG = DG 1 + DG 2 = -2. 99 F Pero la conversión de Cl(+1) a Cl(-1) es una reacción que intercambia 2 electrones. Luego el potencial para la transformación de Cl. O- a Cl- (n = 2) es: DG = -2 FE E = DG/-n. F = -2. 99 F/-2 F = +1. 50 V • DE FORMA GENERAL LA ECUACIÓN QUEDA ASÍ

DESPROPORCIÓN DIAGRAMA DE LATIMER DEL OXÍGENO E 1 = +1. 76 V - E 2 = +0. 70 V E = E 1 - E 2 = +1. 06 V E >0 ENTONCES DG<0 REACCIÓN ESPONTÁNEA

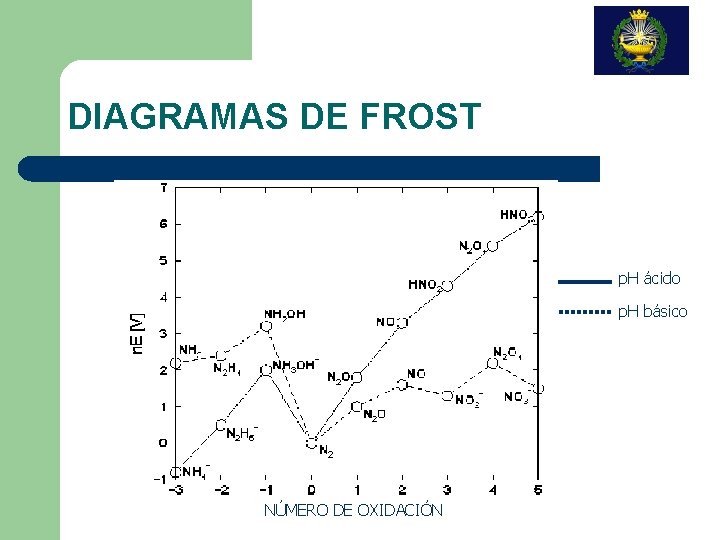
DIAGRAMAS DE FROST p. H ácido p. H básico NÚMERO DE OXIDACIÓN

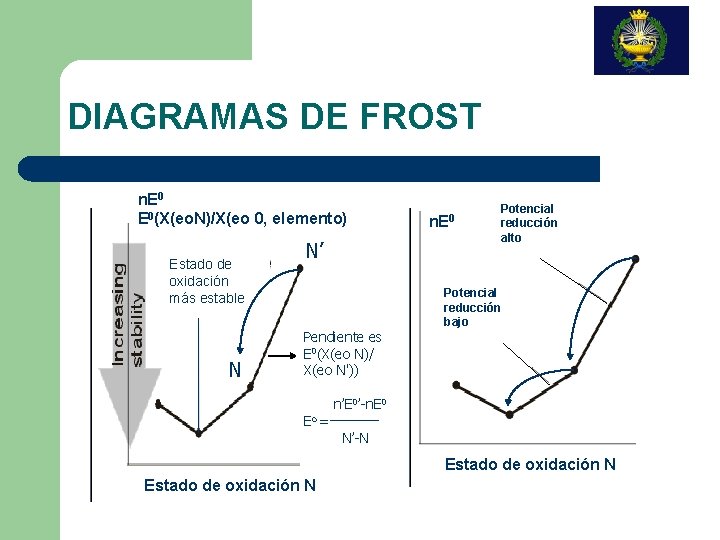
DIAGRAMAS DE FROST ES OTRA FORMA DE PRESENTAR LOS POTENCIALES DE REDUCCIÓN, PARA VARIOS ESTADOS DE OXIDACIÓN DE UN ELEMENTO. REPRESENTAN n. E FRENTE AL ESTADO OXIDACIÓN N, DONDE E ES EL POTENCIAL REDUCCIÓN DEL PAR X(N)/X(0), Y n ES NÚMERO DE ELECTRONES INTERCAMBIADOS LA CONVERSIÓN DE X(N) A X(0) DE DE EL EN

DIAGRAMAS DE FROST n. E 0(X(eo. N)/X(eo 0, elemento) Estado de oxidación más estable N N’ Pendiente es E 0(X(eo N)/ X(eo N')) n. E 0 Potencial reducción alto Potencial reducción bajo n’E 0’-n. E 0 Eo = N’-N Estado de oxidación N

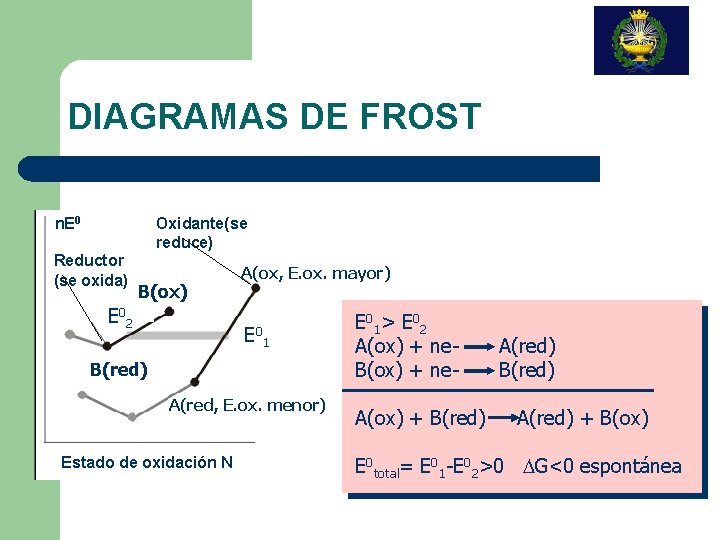
DIAGRAMAS DE FROST Oxidante(se reduce) n. E 0 Reductor (se oxida) B(ox) E 0 2 A(ox, E. ox. mayor) E 0 1 B(red) A(red, E. ox. menor) Estado de oxidación N E 01> E 02 A(ox) + ne. B(ox) + ne- A(red) B(red) A(ox) + B(red) A(red) + B(ox) E 0 total= E 01 -E 02>0 DG<0 espontánea

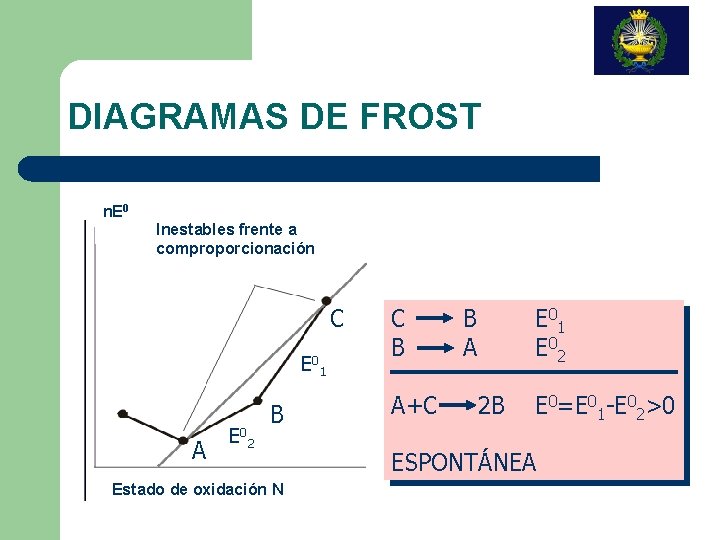
DIAGRAMAS DE FROST n. E 0 Inestables frente a comproporcionación C E 0 1 A E 0 2 B Estado de oxidación N C B B A E 0 1 E 0 2 A+C 2 B E 0=E 01 -E 02>0 ESPONTÁNEA

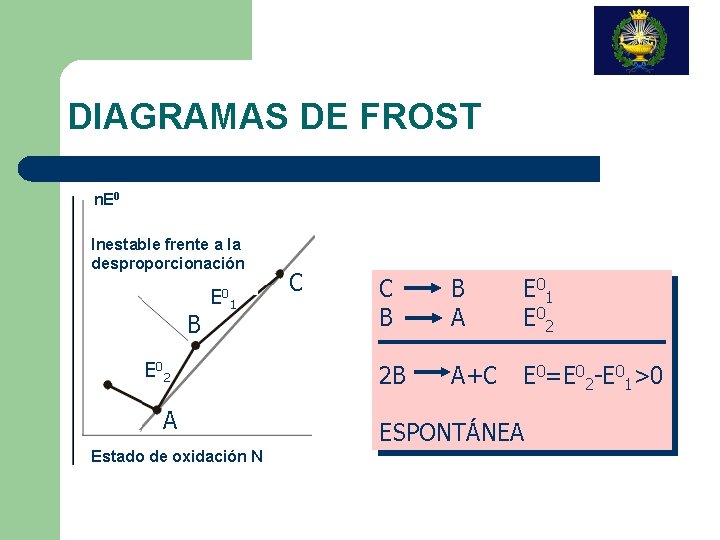
DIAGRAMAS DE FROST n. E 0 Inestable frente a la desproporcionación E 0 B 1 E 0 2 A Estado de oxidación N C C B B A E 0 1 E 0 2 2 B A+C E 0=E 02 -E 01>0 ESPONTÁNEA

DIAGRAMAS DE FROST UN DIAGRAMA DE FROST A MENUDO DA UNA MEJOR IDEA DE LA TERMODINÁMICA DE UNA OXIDACIÓN Y REDUCCIÓN DE UN ELEMENTO, MIENTRAS QUE UN DIAGRAMA DE LATIMER ES MÁS ÚTIL PARA LLEVAR A CABO CÁLCULOS SOBRE EL SISTEMA EN CUESTIÓN.
 Etitulo uclm
Etitulo uclm Uclm tic
Uclm tic Mens rea actus reus
Mens rea actus reus Siu lang carrillo yap
Siu lang carrillo yap Different types of serial killers
Different types of serial killers Alberto carrillo pineda
Alberto carrillo pineda David carrillo
David carrillo Marta carrillo digestivo
Marta carrillo digestivo Isolina carrillo
Isolina carrillo Salvador carrillo moreno
Salvador carrillo moreno Ramon carrillo bastos
Ramon carrillo bastos Jessie carrillo
Jessie carrillo Salvador carrillo ibero
Salvador carrillo ibero José baquíjano y carrillo
José baquíjano y carrillo Amado carrillo fuentes
Amado carrillo fuentes Father robert carrillo
Father robert carrillo Syväjohtamisen malli
Syväjohtamisen malli Qumica
Qumica Formula general de los eteres
Formula general de los eteres Setas curvas
Setas curvas Decantação
Decantação







































