MD 1 2016 Corrosin El estudio de la





























- Slides: 36

MD 1 – 2016 Corrosión

El estudio de la Corrosión consiste en la investigación del deterioro de los materiales por el medio en el que son usados. La corrosión se puede definir como: n La tendencia que tienen los metales a volver al estado combinado (buscar su forma más estable o de menor energía interna). Es decir, al mismo estado en que se encontraban en la naturaleza. n El deterioro de un material a consecuencia de un ataque electroquímico por su entorno. n Reacción electroquímica (oxidación / reducción).

Los metales se encuentran en la naturaleza en forma de minerales (Bauxita: Aluminio, Cormita: Cromo, etc. ) y para ser obtenidos en su forma refinada deben pasar por diversos tratamientos en los cuales mediante la entrega de energía se los lleva del estado mineral al estado utilizado en la industria. Al entregarles energía estos pierden su estado de equilibrio natural y tienden, por ejemplo, mediante la corrosión a volver a su estado natural (de menor energía). Cuanto mayor es la energía gastada en la obtención del metal a partir del mineral, mas favorecida termodinámicamente está la reacción de corrosión. (metalurgia extractiva y corrosión son procesos de acción opuestas)

n Perdida económica Costos directos generados al año por la corrosión alcanzan alrededor de un 3, 5% del PBI en países desarrollados. n el 10 -12% de la producción mundial anual del acero es destruida por la corrosión (estimación del 2001). n En 1971 en USA la corrosión tiene un costo de 70 000 millones de dólares (4 % PBI) de los cuales 20 al 25 % pueden ser economizados a través de una mejor aplicación de las diferentes técnicas de control ya conocidas.

Clasificación de los distintos procesos de corrosión n Según la morfología del ataque:

Clasificación de los distintos procesos de corrosión n Según el mecanismo: – Corrosión electroquímica: se deba a la actuación de pilas electroquímicas, el las cual el metal sufre disolución en las regiones anódicas. El proceso no afecta por igual a toda la superficie metálica, el las regiones catódicas no hay ataque. – Corrosión directa (Química): se da cuando el metal opera a altas temperaturas. El mecanismo consiste en la reacción química directa entre la superficie metálica y un gas, con formación de película de óxido.

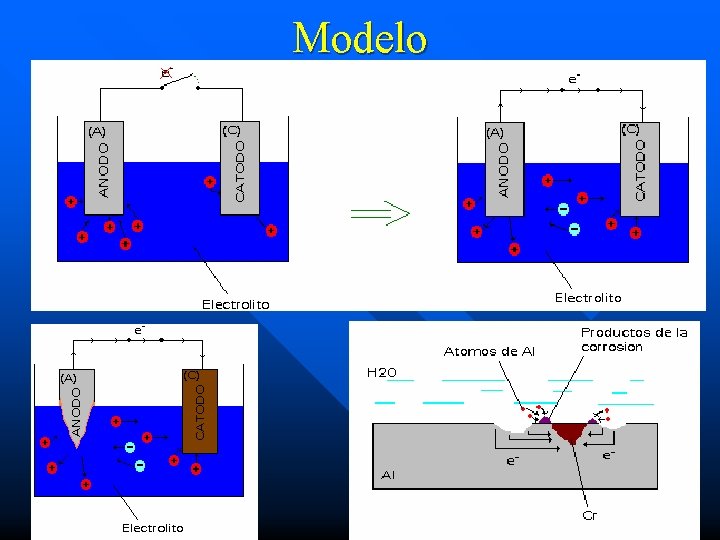
n n n Principios La corrosión es un proceso electroquímico que origina que el metal se transforme del estado metálico al iónico. Requiere de un flujo de electricidad entre ciertas áreas del electrolito. Electrólito: es cualquier solución que contiene iones libres, los que se comportan como un medio conductor eléctrico (ej. : agua, agua salada y soluciones ácidas). Requiere completar el circuito eléctrico por lo que debe haber dos electrodos, un ánodo y un cátodo conectados. Para que fluya electricidad debe haber una diferencia de potencial entre los electrodos (naturaleza química). Los productos de los procesos del ánodo y cátodo frecuentemente chocan y entran en reacciones ulteriores dando los productos de la corrosión.

Principios n n La corrosión ocurre en presencia de un electrólito, ocasionando regiones plenamente identificadas, llamadas estas anódicas y catódicas: una reacción de oxidación es una reacción anódica, en la cual los electrones son liberados dirigiéndose a otras regiones catódicas. En la región anódica se producirá la disolución del metal (corrosión) y, consecuentemente en la región catódica la inmunidad del metal. Los enlaces metálicos tienden a convertirse en enlaces iónicos, los favorece que el material puede en cierto momento transferir y recibir electrones, creando zonas catódicas y zonas anódicas en su estructura.

n Oxidación: reacción química en el cual un metal pierde electrones (reacción electroquímica). Zn Fe Zn 2+ + 2 e-Fe 2+ + 2 e-- Ánodo: lugar en done ocurre la oxidación n Reducción: formación de una nueva especie química por la adición de electrones. 2 H+ + 2 e-- H 2 Cátodo: lugar donde ocurre la reducción n En el ánodo tienen lugar las reacciones de oxidación, mientras que en el cátodo tienen lugar las de reducción.

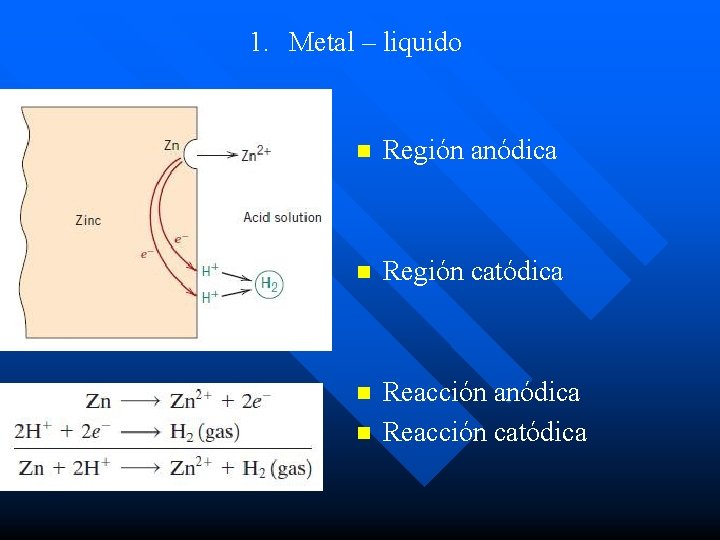
Naturaleza de la corrosión n La corrosión puede presentarse en diferentes formas en la naturaleza. En todos los casos termia por la deterioración o destrucción del metal y pude ser caracterizada de las siguientes tres formas: 1. Metal – liquido 2. Metal – gas 3. Metal - Metal

1. Metal – liquido n Región anódica n Región catódica n Reacción anódica Reacción catódica n

Factores que influyen en la corrosión n La diferencia de potencial eléctrico de metales no similares en presencia de un electrolito es uno de los factores mas importantes. Este potencial se debe a la naturaleza químicas de los metales y/o de las regiones anódicas/catódicas. – Repaso: Repaso un metal es un conjunto de enlaces que forma una gran molécula en el cual cada átomo tendrá una cierta electronegatividad. Los elementos mas electronegativos tienden a ganar electrones reduciéndose mientras que los de menor electronegatividad entregan electrones oxidándose y por lo tanto corroyéndose. n Los mátales más activos se comportan como cátodos y las menos activos como ánodos.

Potencial del electrodo: Todos los metales presentan una tendencia a oxidarse (perder electrones) que se cuantifica por medio del potencial de oxidación o electronegatividad; cuanto más alto sea este valor, más noble es el metal, es decir, se oxida con mayor dificultad. La tabla en la que se representan estos valores se conoce como serie galvánica, y es de gran utilidad a la hora de seleccionar un material para una aplicación específica. Reacciones de oxidación: los metales ceden electrones a otras sustancias. M → Mn+n + nen

Potencial de referencia Puede observarse como a medida que disminuye el potencial el elemento va pasando de un estado catódico a uno más anódico.

Serie galvánica Cuando dos metales están en sumergidos en un electrolito, a la vez que están conectados eléctricamente, el metal mas activo de esta serie será anódico y sufrirá corrosión. Nota: en este caso el electrolito es agua de mar.

Modelo


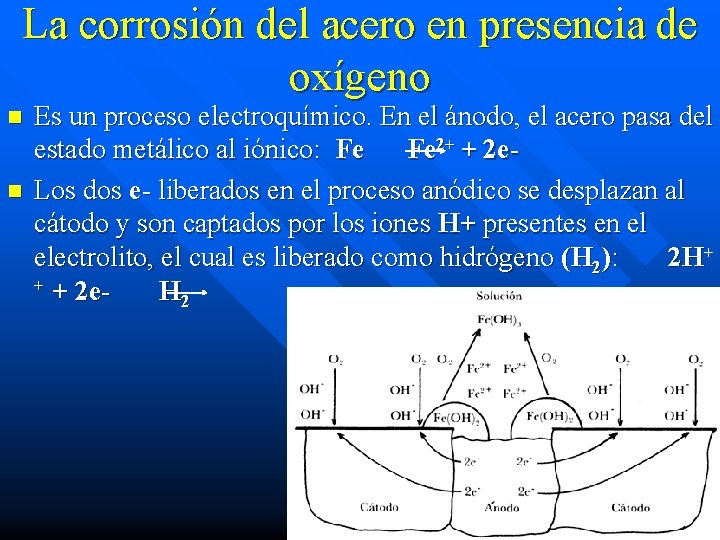
La corrosión del acero en presencia de oxígeno n n Es un proceso electroquímico. En el ánodo, el acero pasa del estado metálico al iónico: Fe Fe 2+ + 2 e. Los dos e- liberados en el proceso anódico se desplazan al cátodo y son captados por los iones H+ presentes en el electrolito, el cual es liberado como hidrógeno (H 2): 2 H+ + + 2 e. H 2

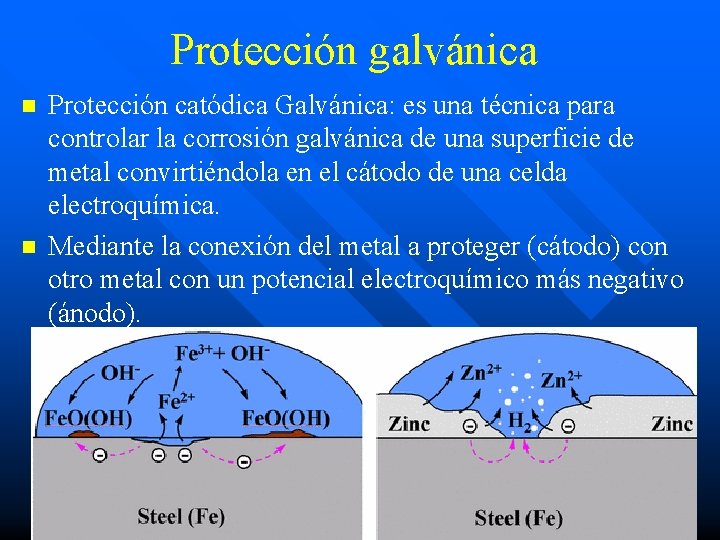
n n El hidróxido ferroso (Fe(OH)2) es un resultado de los iones ferrosos (Fe 2+) formados en el ánodo y los iones hidróxilo (OH-) formados en el cátodo. La carga negativa de los iones hidróxilo dará lugar a que estos iones migren hacia las áreas anódicas, en las cuales hay un exceso de carga positiva, debido a la presencia de los iones ferrosos formados. El hidróxido ferroso se forma cuando ambos iones con carga opuesta se encuentran, estos reaccionan y se precipita: Fe 2+ + 2 OHFe(OH)2 Este hidróxido ferroso se oxida a hidróxido férrico (Fe (OH)3) la conocida herrumbre, por el oxígeno disuelto en el agua (electrolito)

2. Metal – gas n n En la reacción entre el metal y un medio gaseoso las moléculas de gas son absorbidas sobre la superficie del metal mediante la reacción de los átomos del metal y el gas formando productos de corrosión. Oxidación química: cuando un metal se combina con el oxígeno (pierde electrones), transformándose en un óxido. La corrosión Metal – Gas puede ser expresada químicamente como: Metal + No Metal Oxido Dependiendo del metal, el no metal y el medio (Temperatura, humedad, etc. ) la tasa de corrosión puede variar. Por ejemplo, el aluminio en aire es muy activo y la corrosión actúa rápidamente sobre la superficie.

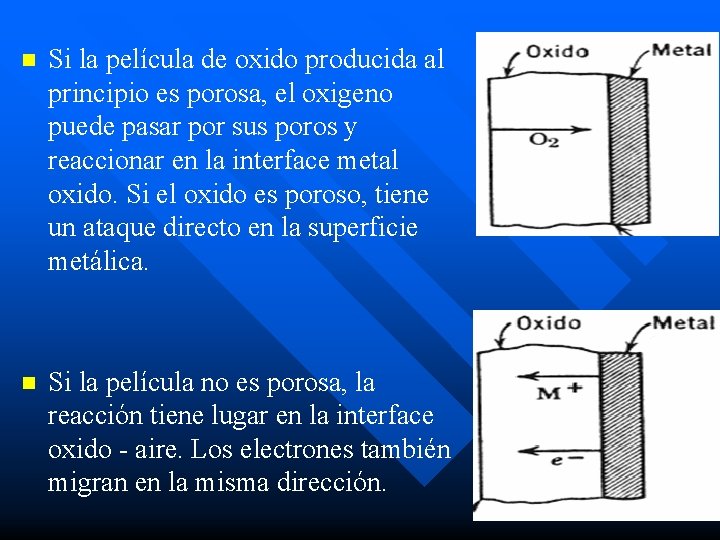
Pasivación n Todo efecto corrosivo (medio liquido o gaseoso) forma una capa con los productos de la corrosión sobre la superficie del metal (estos son mas estables que el metal puro). Esta película puede ser: – Continua y protectora ó – Porosa y ser relativamente no-protectora. Volumen de oxido generado = Volumen de metal consumido > 1= oxido sometido a tensiones de compresión. Probable oxido con grietas. < 1= oxido no poroso, puede ser protector.

n Si la película de oxido producida al principio es porosa, el oxigeno puede pasar por sus poros y reaccionar en la interface metal oxido. Si el oxido es poroso, tiene un ataque directo en la superficie metálica. n Si la película no es porosa, la reacción tiene lugar en la interface oxido - aire. Los electrones también migran en la misma dirección.

3. Metal – Metal n n n Los sólidos no presentan una superficie idealmente lisa sino una superficie rugosa. Esta propiedad, que es la causa de fricción entre superficies, también es la causa fundamental de la corrosión por fricción y del efecto de erosión de superficies. En ambos casos la corrosión del metal es consecuencia de la remoción de la película protectora (elemento sobre la superficie del metal que retarda la acción corrosiva) que como resultado incrementa la tasa corrosiva.

Formas de corrosión La corrosión se presenta de diversas formas. También aparecen combinadas entre sí, sin embargo usualmente una predomina. Identificar el tipo de corrosión presente es muy valioso, conocido el tipo de corrosión se comprenderá la causa y se buscará la forma de mitigar. Podemos dividir la corrosión en: – – – Uniforme Localizada (Picado) Erosión (cavitación y erosión por corrosión) Ataque selectivo (intergranular) Cracking (corrosión por tensión, corrosión por fatiga) Corrosión galvánica

Uniforme n n La corrosión uniforme puede presentarse tanto en corrosión metal – liquido como metal – gas (actúa uniformemente sobre toda la superficie). Es la mas común y la que genera mayores pérdidas. Sin embargo es la mas fácil de controlar

Localizada (Picado / Pitting) Dentro de los factores que pueden generar ataque localizado podemos nombrar a las celdas de concentración, Erosión – Corrosión, inclusiones, imperfecciones, bordes de grano y dislocaciones.

Erosión (cavitación y erosión por corrosión) n n Efecto conjunto de la erosión mecánica y la corrosión. Prospera en condiciones de alta velocidad, turbulencia, choques, etc. Con frecuencia se ven en bombas y tuberías (codos).

Ataque selectivo (intergranular) n n El mecanismo es debido a las diferencias de potencial entre los bordes de grano y el grano mismo. El potencial puede verse influenciada durante el tratamiento térmico que genera precipitaciones en el borde de grano. Origina perdida en la resistencia del material.

Cracking (corrosión por tensión, corrosión por fatiga) n n Corrosión por tensión: ocurre en la estructura cristalográfica del metal con la influencia combinada del esfuerzo de tensión y un entorno corrosivo. El material se puede agrietar sin deformaciones significativas ni deterioro obvio del material. Las tensiones pueden ser el resultado de las cargas debidas a la concentración de tensiones (tenciones residuales), o de montaje desde la fabricación.

Cracking (corrosión por tensión, corrosión por fatiga) n Corrosión por fatiga: causa una reducción de la capacidad de un metal para soportar esfuerzos cíclicos o repetidos, los cuales producen la rotura de las películas de protección de óxidos que evitan la corrosión con una mayor rapidez. Tiene como consecuencia la formación anódica en los puntos de rotura; esas zonas producen además picaduras que sirven como punto de concentración del esfuerzo para el origen de grietas que provocan fallos finales.

Corrosión galvánica n n Es la más común de todas y se establece cuando dos metales distintos entre si actúan uno de ellos como ánodo y el otro como cátodo. Esto resulta de un fenómeno de electrólisis entre dos metales de potencial eléctrico diferente que se hallan en contacto y en presencia de humedad (o un electrolito).

Protección a la corrosión n La corrosión es inevitable y por lo tanto la elección de un método de protección eficiente y acorde a la situación dará como resultado mayor vida útil del metal reduciendo los costos de mantenimiento. n tipos de protección: – Protección galvánica – Recubrimientos Metálicos – Pasivado de metales (Películas delgada adherentes y no porosas).

Protección galvánica n n Protección catódica Galvánica: es una técnica para controlar la corrosión galvánica de una superficie de metal convirtiéndola en el cátodo de una celda electroquímica. Mediante la conexión del metal a proteger (cátodo) con otro metal con un potencial electroquímico más negativo (ánodo).

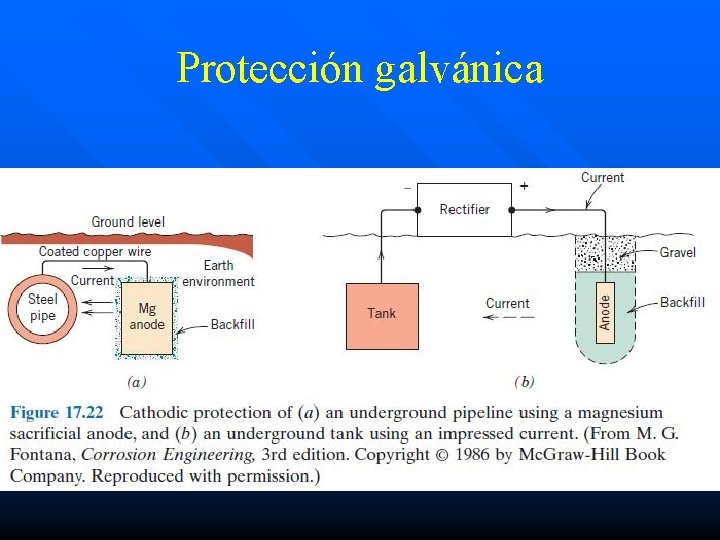
Protección galvánica n n n Protección catódica por corriente forzada: para estructuras grandes, los ánodos galvánicos no pueden suministrar (de forma económica) suficiente corriente para proporcionar una protección completa. Para estos casos se utiliza un sistema de ánodos conectados a un rectificador (protección catódica). Sistema típico: rectificador de AC accionado con una potencia máxima de salida de DC de entre 10 y 50 A y 50 V. El terminal negativo DC se conecta a la estructura a proteger (cátodo) mientras que el terminal positivo es conectado al ánodo.

Protección galvánica

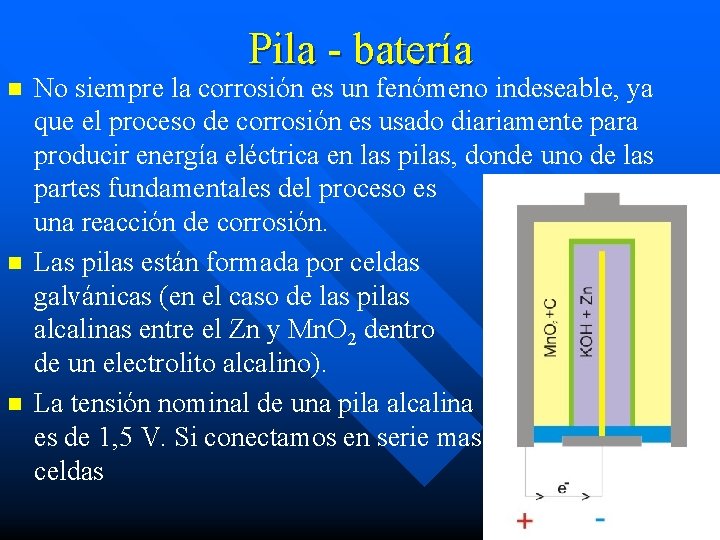
Pila - batería n n n No siempre la corrosión es un fenómeno indeseable, ya que el proceso de corrosión es usado diariamente para producir energía eléctrica en las pilas, donde uno de las partes fundamentales del proceso es una reacción de corrosión. Las pilas están formada por celdas galvánicas (en el caso de las pilas alcalinas entre el Zn y Mn. O 2 dentro de un electrolito alcalino). La tensión nominal de una pila alcalina es de 1, 5 V. Si conectamos en serie mas celdas