CELULAS MADRE Y REGENERACION MIOCARDICA Dra Elvira Dortics
















- Slides: 22

CELULAS MADRE Y REGENERACION MIOCARDICA. Dra. Elvira Dorticós Instituto de Hematología e Inmunología 2007

Dogma” el corazón es un tejido terminal, sin capacidad de autorenovación. ” • Existen evidencias de que el miocardio puede regenerarse a partir de células madre cardiacas • Los miocitos cardiacos pueden dividirse durante la vida adulta • El remodelado cardiaco, en el caso de la estenosis aortica, puede ser por proliferación de las células madres. • El quimerismo encontrado en pacientes trasplantados de corazón puede representar un mecanismo de auto renovación.

Existe proliferación celular en el miocardio normal y dañado • En los dos últimos años se han comunicado poblaciones de células cardiacas primitivas con capacidad de diferenciarse hacia cardiomiocitos, regenerar las áreas de IM o ambas cosas. • Entre ellas una denominada como población lateral, o "side population” cardiaca (SPC), están presentes en el corazón adulto normal y son capaces de diferenciarse desde el punto de vista bioquímico y funcional, hacia cardiomiocitos maduros y por tanto identifica a esta SPC como una fuente de progenitores cardiacos diferentes • La relación entre los diversos tipos de progenitores cardiacos no esta clara, al igual que los mecanismos por los que se mantiene una reserva de CPC bajo condiciones normales y patológicas. • El origen puede ser: células cardiacas residentes en el corazón y/o procedentes de fuentes extracardiacas.

Porque no son suficientes para reparar el tejido dañado? • Tienen una capacidad de proliferación y de reparación miocárdica limitada • Se movilizan durante la fase aguda de un IM, pero no alcanzan la maduración necesaria para incorporarse al miocardio dañado • La falta de riego sanguíneo en el área afectada reduce el número de células madre cardiacas que pueden llegar al sitio ocluido • La incapacidad de las células madre cardiacas para reparar el miocardio dañado ha dado lugar a que se busquen células procedentes de otras fuentes, tanto para producir miogénesis como angiogénesis

Medicina regenerativa • Se basa en el empleo de la terapia celular y en la ingeniería de tejidos para sustituir las células dañadas de un órgano por células sanas procedentes de otros • Se fundamenta en la capacidad de las células madres de convertirse en células especificas de diferentes tejidos • Constituye una importante revolución en el campo de la medicina.

Células propuestas para la regeneración cardiaca • Mioblastos esqueléticos • Fibroblastos • Células del músculo liso • Miocitos fetales • Células embrionarias • Células adultas de la médula ósea

Células empleadas para la regeneración cardiaca Características Mioblastos autólogos Mioblastos alogénicos Cel madre hematopoyéticas Cel embrionarias Inmunosupresión _ +_ Carcinogénicas _ ? _ ++ Disponibilidad + +_ ++ +_ Transformación en miocitos (plasticidad) + + Arritmogenésis + + _ _ Problemas éticos _ +_ _ ++

CÉLULAS MADRE PRESENTES EN LA MÉDULA ÓSEA • Hematopoyéticas • Mesenquimatosas (estromales) • Células laterales (En citofluorometría) • Ovales (originan células hepáticas y epitelio biliar) • MAPC (Multipotent Adult Progenitor Cells)

Mecanismos de acción • Transdiferenciación de las células trasplantadas (Plasticidad) • Efecto paracrínico: aumento de la angiogénesis por liberación de múltiples factores de crecimiento (factor de crecimiento endotelial, factor-1 derivado de células estromales etc

Métodos de utilización de las células madre • Colocadas en medios de cultivos con medios que propicien su diferenciación hacia otros tejidos. • Cultivadas para aumentar su número. • Procesadas para extraer la fracción de células con marcadores de células madre. • Células madres sin procesar o sea sin fraccionamiento • Células madres movilizadas hacia la sangre periférica mediante citocinas.

FORMAS DE ADMINISTRACION • Como terapia única o • Conjuntamente con una cirugía de revascularización coronaria y/o angioplastia.

MOMENTO DE LA ADMINISTRACION • En patologías agudas, como en el infarto agudo del miocardio, traumas cardiacos. • Enfermedades crónicas Cardiopatía isquémica crónica, miocardiopatias dilatadas , cardiopatía en el curso de la enfermedad de Chagas etc.

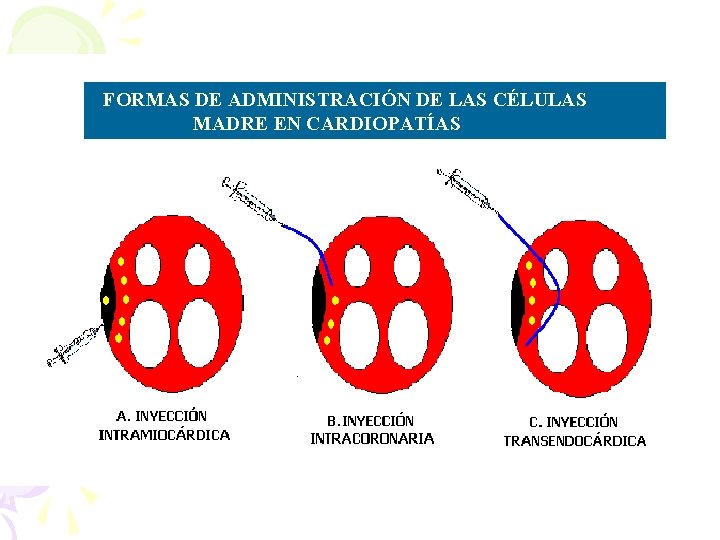
VIAS DE ADMINISTRACION • TRANSVASCULAR 1. 2. 3. Intracoronaria conjuntamente con revascularización Intravenosa Movilización desde la sangre periférica, con o sin inyección posterior en el miocardio • INYECCION DIRECTA EN EL MUSCULO CARDIACO 1. 2. 3. Transepicardica conjuntamente con cirugía Transendocardica Inyección a través de las venas coronarias

FFORMAS DE ADMINISTRACIÓN DE LAS CÉLULAS MADRE EN CARDIOPATÍAS

Medicina regenerativa y corazón • Este proceder fue considerado por la American Heart Association entre los 10 avances mas relevantes en el año 2002. Objetivos: 1. Reemplazar los miocitos dañados necróticos e hipofuncionantes por miocitos funcionantes (miogénesis) 2. Mejorar la angiogénesis y la vascularización del corazón dañado 3. Mejorar la función contráctil del corazón

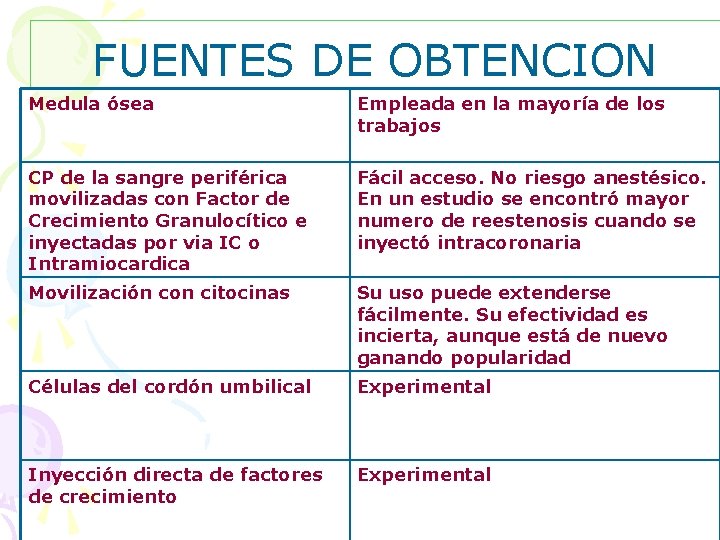
FUENTES DE OBTENCION Medula ósea Empleada en la mayoría de los trabajos CP de la sangre periférica movilizadas con Factor de Crecimiento Granulocítico e inyectadas por via IC o Intramiocardica Fácil acceso. No riesgo anestésico. En un estudio se encontró mayor numero de reestenosis cuando se inyectó intracoronaria Movilización con citocinas Su uso puede extenderse fácilmente. Su efectividad es incierta, aunque está de nuevo ganando popularidad Células del cordón umbilical Experimental Inyección directa de factores de crecimiento Experimental

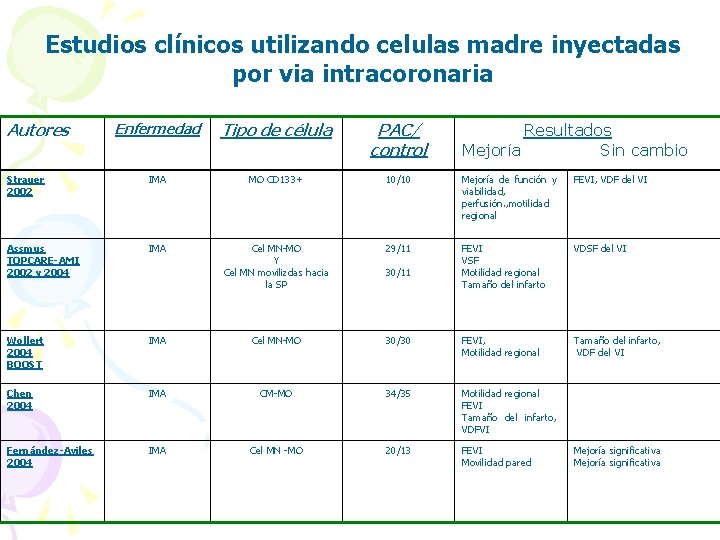
Estudios clínicos utilizando celulas madre inyectadas por via intracoronaria Autores Enfermedad Tipo de célula PAC/ control Strauer 2002 IMA MO CD 133+ 10/10 Mejoría de función y viabilidad, perfusión. , motilidad regional FEVI, VDF del VI Assmus TOPCARE-AMI 2002 y 2004 IMA Cel MN-MO Y Cel MN movilizdas hacia la SP 29/11 FEVI VSF Motilidad regional Tamaño del infarto VDSF del VI Wollert 2004 BOOST IMA Cel MN-MO 30/30 FEVI, Motilidad regional Tamaño del infarto, VDF del VI Chen 2004 IMA CM-MO 34/35 Motilidad regional FEVI Tamaño del infarto, VDFVI Fernández-Aviles 2004 IMA Cel MN -MO 20/13 FEVI Movilidad pared 30/11 Resultados Mejoría Sin cambio Mejoría significativa

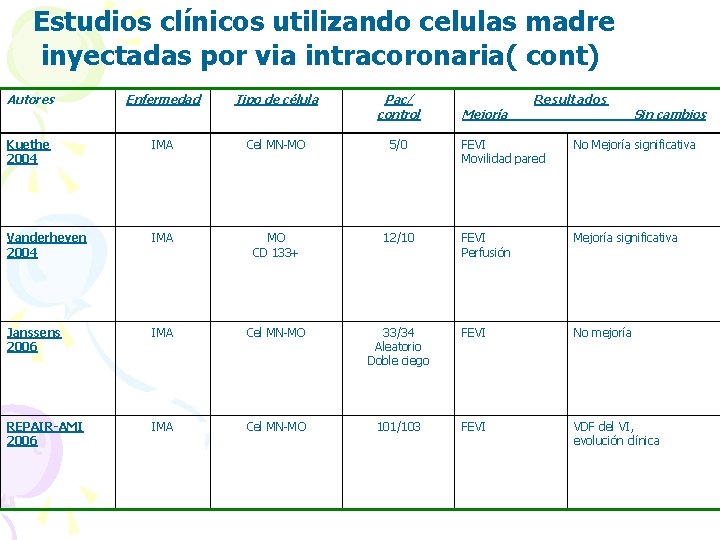
Estudios clínicos utilizando celulas madre inyectadas por via intracoronaria( cont) Autores Enfermedad Tipo de célula Pac/ control Kuethe 2004 IMA Cel MN-MO 5/0 Vanderheyen 2004 IMA MO CD 133+ 12/10 Janssens 2006 IMA Cel MN-MO REPAIR-AMI 2006 IMA Cel MN-MO Mejoría Resultados Sin cambios FEVI Movilidad pared No Mejoría significativa FEVI Perfusión Mejoría significativa 33/34 Aleatorio Doble ciego FEVI No mejoría 101/103 FEVI VDF del VI, evolución clínica

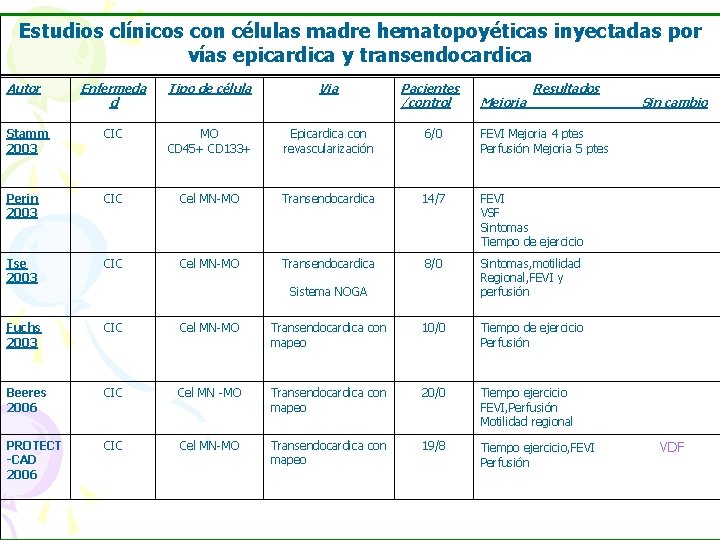
Estudios clínicos con células madre hematopoyéticas inyectadas por vías epicardica y transendocardica Autor Enfermeda d Tipo de célula Via Pacientes /control Stamm 2003 CIC MO CD 45+ CD 133+ Epicardica con revascularización 6/0 FEVI Mejoria 4 ptes Perfusión Mejoria 5 ptes Perin 2003 CIC Cel MN-MO Transendocardica 14/7 FEVI VSF Sintomas Tiempo de ejercicio Tse 2003 CIC Cel MN-MO Transendocardica 8/0 Sintomas, motilidad Regional, FEVI y perfusión Fuchs 2003 CIC Cel MN-MO Transendocardica con mapeo 10/0 Tiempo de ejercicio Perfusión Beeres 2006 CIC Cel MN -MO Transendocardica con mapeo 20/0 Tiempo ejercicio FEVI, Perfusión Motilidad regional PROTECT -CAD 2006 CIC Cel MN-MO Transendocardica con mapeo 19/8 Tiempo ejercicio, FEVI Perfusión Sistema NOGA Mejoria Resultados Sin cambio VDF

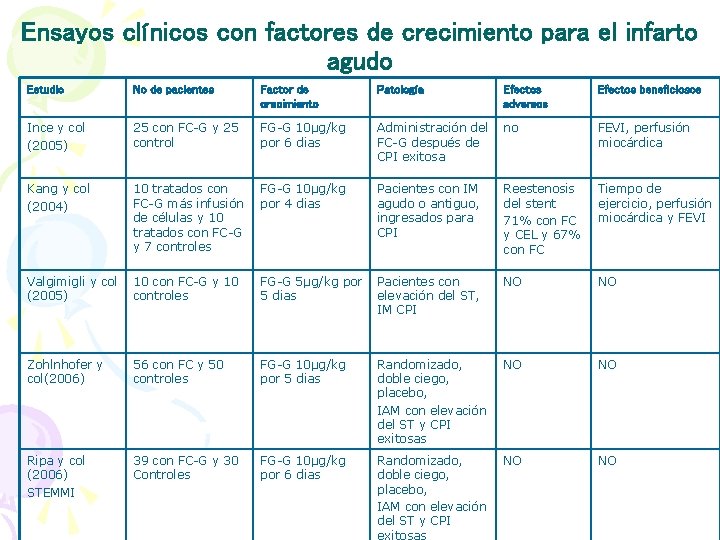
Ensayos clínicos con factores de crecimiento para el infarto agudo Estudio No de pacientes Factor de crecimiento Patología Efectos adversos Efectos beneficiosos Ince y col (2005) 25 con FC-G y 25 control FG-G 10µg/kg por 6 dias Administración del FC-G después de CPI exitosa no FEVI, perfusión miocárdica Kang y col (2004) 10 tratados con FC-G más infusión de células y 10 tratados con FC-G y 7 controles FG-G 10µg/kg por 4 dias Pacientes con IM agudo o antiguo, ingresados para CPI Reestenosis del stent 71% con FC y CEL y 67% con FC Tiempo de ejercicio, perfusión miocárdica y FEVI Valgimigli y col (2005) 10 con FC-G y 10 controles FG-G 5µg/kg por 5 dias Pacientes con elevación del ST, IM CPI NO NO Zohlnhofer y col(2006) 56 con FC y 50 controles FG-G 10µg/kg por 5 dias Randomizado, doble ciego, placebo, IAM con elevación del ST y CPI exitosas NO NO Ripa y col (2006) STEMMI 39 con FC-G y 30 Controles FG-G 10µg/kg por 6 dias Randomizado, doble ciego, placebo, IAM con elevación del ST y CPI exitosas NO NO

Ensayos clínicos con factores de crecimiento para la isquemia crónica Estudio No de pacientes Factor de crecimiento Patología Efectos beneficiosos Efectos adversos Hill y col (2005) 16 pacientes con F-CG FC-G 10 µg/Kg por 5 dias Isquemia coronaria crónica , III/IV con viabilidad No 1 paciente con angina inestable 1 paciente falleció de IM 2 dos semanas después del tto Zbinden y col (2005) 7 pacientes FC-GM 10 tratados µg/Kg por con FC-GM 14 dias y 7 controles Angina crónica estable, ingresados para CPI Aumento del flujo colateral 2/7 en el grupo tratado desarrollo angina inestable

Perspectivas • • Tipo de células Número de células Fuente para su obtención Mejor momento de administración en las fases aguda y crónica • Mejor vía de administración que asegure la viabilidad y el implante de las células • Sobrevida a corto y largo plazo de las células inyectadas • Son necesarios ensayos clínicos randomizados con series grandes de pacientes, que permitan evaluar el papel de el trasplante de células madre en la mejoría de la función cardiaca y disminución de la morbilidad y mortalidad de estos de los pacientes con cardiopatías
 Que es la regeneracion
Que es la regeneracion Dolor precordial
Dolor precordial Contusione miocardica
Contusione miocardica Isquemia miocardica
Isquemia miocardica Marcadores de necrose cardiaca
Marcadores de necrose cardiaca Isquemia miocardica
Isquemia miocardica Conclusiones de las celulas madre
Conclusiones de las celulas madre Autloog
Autloog Trasplante celulas madre
Trasplante celulas madre Celulas madre embrionaria
Celulas madre embrionaria Oracion de la salve
Oracion de la salve Lumen gentium finalidad
Lumen gentium finalidad La hija de mi hermana es mi ___
La hija de mi hermana es mi ___ El padre de mi madre es mi _______.
El padre de mi madre es mi _______. Justicia electoral mendoza
Justicia electoral mendoza Elvira valleri
Elvira valleri Paniagua
Paniagua Elvira thanksgiving
Elvira thanksgiving Bahman sadeghi
Bahman sadeghi Elvira nimac
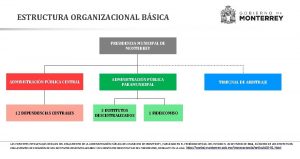
Elvira nimac Presidente municipal de monterrey
Presidente municipal de monterrey Biografia elvira lindo
Biografia elvira lindo Elvira de souza lima
Elvira de souza lima