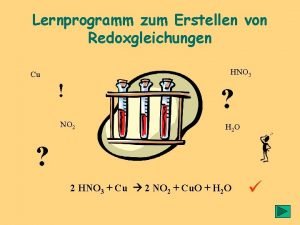
Lernprogramm zum Erstellen von Redoxgleichungen HNO 3 Cu


































- Slides: 42

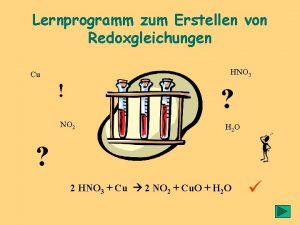
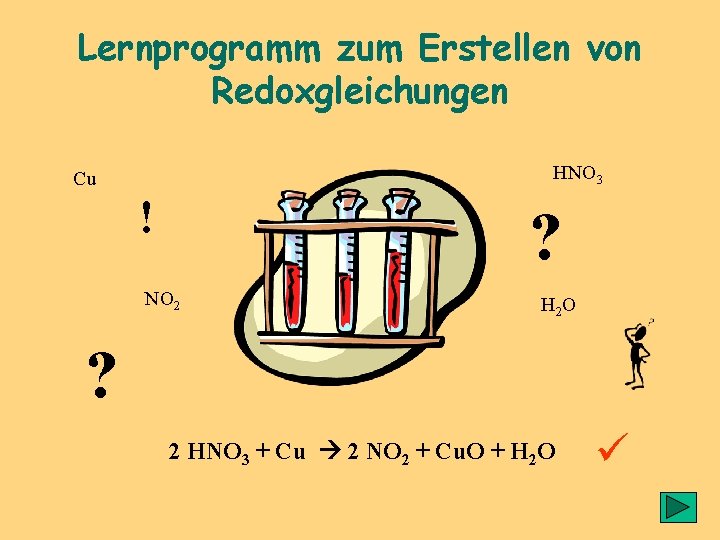
Lernprogramm zum Erstellen von Redoxgleichungen HNO 3 Cu ! ? NO 2 H 2 O ? 2 HNO 3 + Cu 2 NO 2 + Cu. O + H 2 O ü

Rein ins Übungsprogramm! Mit dem Zeichen, das hier (bei Mausbewegung) erscheint, kann man das Programm jederzeit beenden.

Bedienungsanleitung zum Lernprogramm: • Das Pflichtprogramm (9 Regeln mit dazugehörigen Übungen) muss seitenweise durchgearbeitet werden. Dabei immer alle Interaktionen: aufmerksam durchführen! (Zuerst lesen und nachdenken, dann anklicken! Die Interaktionen lassen sich leider nicht wiederholen! Zuviele Mausklicks führen u. U. auf falsche Seiten. ) Nach Erarbeiten einer Regel (incl. Beispiel) zur Übung weiterklicken! Die dunkelgrünen Schaltflächen dienen zum Vor- und Zurückblättern im Hauptprogramm: • Bei allen rot unterlegten Begriffen erscheint entweder eine Kurzerklärung oder man kommt durch Anklicken zu einer ausführlichen Erklärung, so dass Wissenslücken aufgefüllt werden können zurück (= Zusatzprogramm mit hellgrünen Pfeilen: usw. ) • Zettel und Stift für die Übungen Hier findet man außerdem ein Inhaltsverzeichnis (=Gehe zu->Foliennavigator) bereithalten!

Grundsätzliches zu den Redoxgleichungen: • Bei der Erstellung einer Redoxgleichung arbeitet man ausschließlich mit den reagierenden Teilchen, d. h. Begleitionen werden weggelassen (oder höchstens ganz am Schluss dazugeschrieben)! • Nachdem man die Oxidationszahlen der beteiligten Atome ermittelt hat, formuliert man in zwei getrennten Arbeitsgängen zwei Teilgleichungen (Oxidations- und Reduktionsgleichung), die anschließend zur eigentlichen Redoxgleichung „addiert“ werden. • Die Regeln dieser Übung müssen in genau der angegebenen Reihenfolge befolgt und gelernt werden, weil alle Arbeitsschritte aufeinander aufbauen!

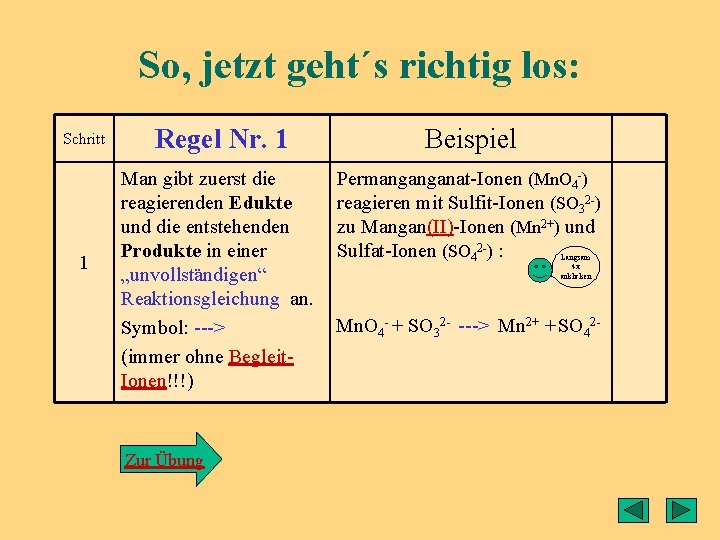
So, jetzt geht´s richtig los: Schritt 1 Regel Nr. 1 Beispiel Man gibt zuerst die reagierenden Edukte und die entstehenden Produkte in einer „unvollständigen“ Reaktionsgleichung an. Symbol: ---> (immer ohne Begleit. Ionen!!!) Permanganganat-Ionen (Mn. O 4 -) reagieren mit Sulfit-Ionen (SO 32 -) zu Mangan(II)-Ionen (Mn 2+) und Sulfat-Ionen (SO 42 -) : Zur Übung Langsam 4 x anklicken Mn. O 4 - + SO 32 - ---> Mn 2+ + SO 42 -

Schritt Regel Nr. 2 Mit Hilfe der Oxidationszahl wird ermittelt, welche Teilchen oxidiert bzw. reduziert werden und Redoxpaare festgelegt: 1 2 Regel 2 Oxidationszahlen ermitteln und über die Elemente schreiben: Ermitteln der Redoxpaare und Festlegen der Begriffe Oxidation und Reduktion Zur Übung +VII +IV Beispiel +II +VI Mn. O 4 - + SO 32 - ---> Mn 2+ + SO 42(Die OZ der Sauerstoffatome verändern sich nicht und werden wegen besserer Übersichtlichkeit hier weggelassen ) Reduktion 4 x anklicken Oxidation +VII +IV +II +VI 22+ Mn. O 4 + SO 3 ---> Mn + SO 42 - 8 x anklicken

Schritt Regel Nr. 3 Regel 3 Man zerlegt nun die Reaktionsgleichung in zwei Teilgleichungen, die separat bearbeitet werden und ganz am Ende zur Redoxgleichung „addiert“ werden. 1 1. Unvollständige Teilgleichung: Reduktion: 2 2. Unvollständige Teilgleichunge: Oxidation: Zur Übung Beispiel Oxidation Reduktion +VII +IV +II +VI 22+ Mn. O 4 + SO 3 ---> Mn + SO 42 - +VII +II Mn. O 4 - ---> Mn 2+ +IV 1 x klicken 1 +VI SO 32 - ---> SO 42 - 1 x klicken!

Schritt Regel Nr. 4 Beispiel Ermittlung der Elektronenzahlen: Regel 4 1 2 Die Differenz der Oxidationszahlen (ggf. multipliziert mit dem Index/Koeffizient – siehe Übung) ergibt die Anzahl der abgegebenen bzw. aufgenommenen Elektronen in jeder Teilgleichung: Reduktion: Da bei einer Reduktion Elektronen aufgenommen werden, müssen diese links vom Reaktionspfeil stehen. Oxidation: Da bei einer Oxidation Elektronen abgegeben werden, müssen diese rechts vom Reaktionspfeil stehen. Zur Übung Red. : Mn. O 4 - D OZ = 5 ---> Mn 2+ D OZ = 2 Ox. : SO 32 - ---> +VII SO 42+II Red. : Mn. O 4 - + 5 e- ---> Mn 2+ +IV Ox. : 4 x klicken! 1 x klicken! +VI SO 32 - ---> SO 42 - + 2 e 1 x klicken!

Schritt Regel Nr. 5 Beispiel Regel 5 Ladungsbilanz ausgleichen: Die Summe aller Ladungen (also Ionen- und Elektronenladungen) auf der linken Seite wird mit der Summe aller Ladungen auf der rechten Seite verglichen. Dann wird die Differenz (in sauren und neutralen Lösungen) mit Oxonium- oder (in alkalischen Lösungen) mit Hydroxidionen ausgeglichen. Reduktion: 1 Summe aller Ladungen links: - 6 Summe aller Ladungen rechts: +2 Differenz: +8 (links: 8 H 3 Summe aller Ladungen links: -2 Summe aller Ladungen rechts: -4 Differenz: -2 (rechts: 2 H 3 Zur Übung Mn. O 4 - + 5 e- + 8 H 3 O+ ---> Mn 2+ O+ ) Oxidation: 2 Da in der Angabe nichts weiter über das Milieu der Lösung stand, kann man annehmen, dass es sich um eine neutrale Lösung handelt; somit muss in diesem Beispiel mit Oxoniumionen ausgeglichen werden. O+ ) Summe: +2 = +2 4 x klicken! SO 32 - ---> SO 42 - + 2 e- + 2 H 3 O+ -2 = Summe: -2 4 x klicken!

Schritt Regel Nr. 6 Beispiel Regel 6 Atombilanz ausgleichen Die Anzahl der Sauerstoff- oder Wasserstoff-Atome auf der linken Seite mit der auf der rechten Seite vergleichen: Die Differenz wird mit Wassermolekülen ausgeglichen. Merke: Nach dem Ausgleich müssen links und rechts in der Reaktionsgleichung gleich viele Atome stehen! Reduktion: 1 Anzahl der Sauerstoffatome links: 12 Anzahl der Sauerstoffatome rechts: 0 Mn. O 4 -+5 e-+ 8 H 3 O+ Mn 2+ + 12 H 2 O 2 x klicken! Differenz: - 12 Oxidation: 2 Anzahl der Sauerstoffatome links: 3 Anzahl der Sauerstoffatome rechts: 6 Differenz: 3 Zur Übung SO 32 - + 3 H 2 O SO 42 - + 2 e- + 2 H 3 O+ 2 x klicken!

Regel Nr. 7 Schritt Beispiel Regel 7 Elektronenzahlen in den zwei Teilreaktionen angleichen. Aus den zwei Elektronenzahlen der beiden Teilgleichungen wird das kleinste gemeinsame Vielfache (kg. V) ermittelt und die Teilgleichungen werden entsprechende erweitert: Red. : 5 1 2 x 2 Mn. O 4 -+5 e- + 8 H 3 O+ x 5 SO 32 - + 3 H 2 O 10 (=kg. V) Ox. : 2 Erweiterte Teilreaktionen: Mn 2+ + 12 H 2 O x 2 SO 42 - + 2 e- + 2 H 3 O+ x 5 2 Mn. O 4 -+10 e- + 16 H 3 O+ 5 SO 32 - + 15 H 2 O Zur Übung 2 Mn 2+ + 24 H 2 O 5 SO 42 - + 10 e- + 10 H 3 O+

Regel Nr. 8 Schritt Beispiel Regel 8 Teilgleichungen „addieren“ Die Redoxgleichung wird erstellt, indem man die Teilgleichungen „addiert“, wobei die Elektronen und alle „überzähligen“ Ionen „wegfallen“: 1 2 „addierte“ Teilgleichungen: 2 Mn. O 4 -+10 e- + 16 H 3 O+ 5 SO 32 - + 15 H 2 O 2 Mn 2+ + 24 H 2 O 5 SO 42 - + 10 e- + 10 H 3 O+ 2 Mn. O 4 - + 16 H 3 O+ + 5 SO 32 - + 15 H 2 O 2 Mn 2+ + 24 H 2 O + 5 SO 42 - + 10 H 3 O+ Redox: (um überzählige Ionen gekürzt) Zur Übung 2 Mn. O 4 - + 6 H 3 O+ + 5 SO 32 - 2 Mn 2+ + 9 H 2 O + 5 SO 42 -

Schritt Regel Nr. 9 Wichtig am Schluss noch die Probe durchführen! Also kontrollieren, ob in der Redoxgleichung die Atomund Ladungsbilanzen stimmen! 1 Atombilanz: z. B. : Beispiel Regel 9 2 Mn. O 4 - + 6 H 3 O+ + 5 SO 32 - 2 Mn 2+ + 9 H 2 O + 5 SO 4218 H 2 Ladungsbilanz: 18 H 2 Mn. O 4 + 6 H 3 O+ + 5 SO 32 - 2 Mn 2+ + 9 H 2 O + 5 SO 42 - -6 weiter = = -6

Glückwunsch! Du hast dich tatsächlich durch das ganze Lernprogramm hindurchgearbeitet und bekommst hiermit das „Redoxdiplom“ verliehen! Mit dem Zeichen, das hier bei Mausbewegung erscheint, kann das Programm beendet werden.

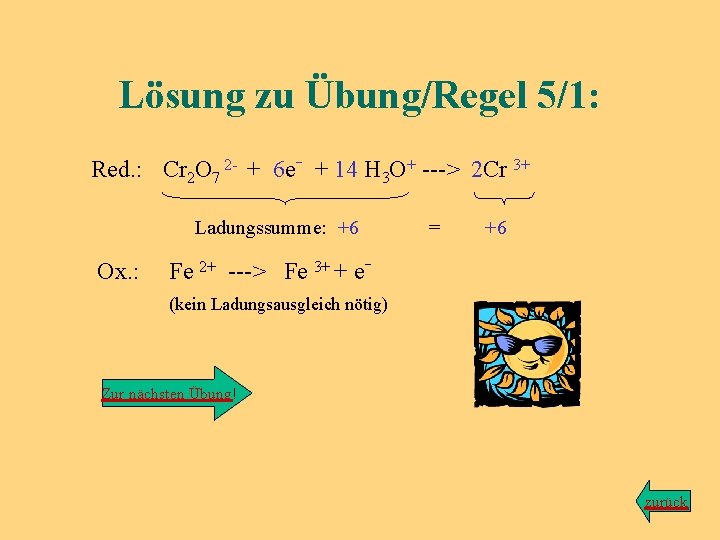
Übung zu Regel Nr. 1 Kaliumdichromat (Ion: Cr 2 O 7 2 - ) wird durch Eisen-(II)-chlorid (Fe. Cl 2) zu grünen Chrom-(III)-Ionen (Cr 3+ ) reduziert. Als zweites Produkt entstehen Eisen-(III)-Ionen Fe 3+. Aufgabe: Gib die Edukte sowie die Produkte in der unvollständigen Gleichungsform an! Lösung Zurück zum Hauptprogramm

Lösung zu Übung/Regel 1: Cr 2 O 7 2 - + Fe 2+ ---> Cr 3+ + Fe 3+ zurück

Übung zu Regel Nr. 2 Aus Dichromationen (Cr 2 O 7 2 - ) und Eisen-(II)-ionen bilden sich grüne Chrom-(III)-Ionen und Eisen-(III)-Ionen. Aufgabe: Formuliere die unvollständige Gleichung und ermitttle die Oxidationszahlen sowie die Redoxpaare! Lösung Zurück zum Hauptprogramm

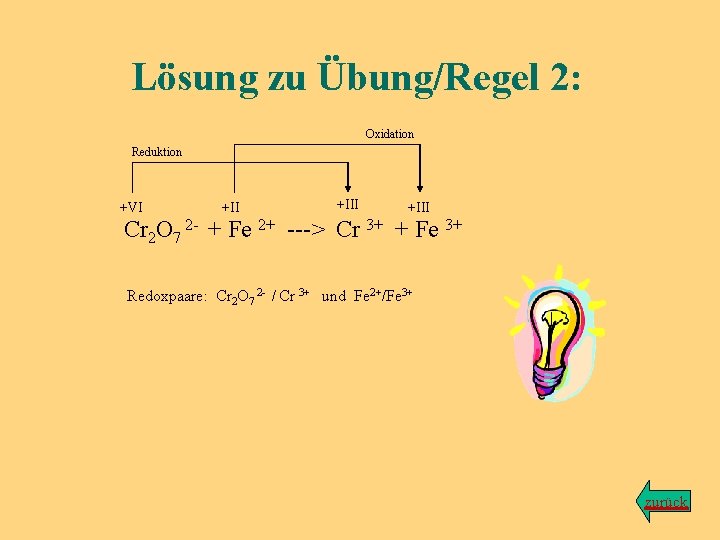
Lösung zu Übung/Regel 2: Oxidation Reduktion +VI +III Cr 2 O 7 2 - + Fe 2+ ---> Cr 3+ + Fe 3+ Redoxpaare: Cr 2 O 7 2 - / Cr 3+ und Fe 2+/Fe 3+ zurück

Übung zu Regel Nr. 3 Wir bleiben bei der Reaktion von Dichromationen mit Eisen-(II)-ionen, wobei Chrom(III)-Ionen sowie Eisen(III)-Ionen entstehen. . . Aufgabe: Formuliere die unvollständigen Teilgleichungen (Red. , Ox. )! Lösung Zurück zum Hauptprogramm

Lösung zu Übung/Regel 3: Red. : Cr 2 O 7 2 - ---> Cr 3+ Ox. : Fe 2+ ---> Fe 3+ zurück

Übung zu Regel Nr. 4 Wir bleiben bei der Reaktion von Dichromationen mit Eisen-(II)-ionen, wobei Chrom(III)-Ionen sowie Eisen(III)-Ionen entstehen. . . Aufgabe: Ermittle für die unvollständigen Teilgleichungen (Red. , Ox. ) die Elektronenzahlen und schreibe sie auf der richtigen Seite dazu! ACHTUNG: Da auf der linken Seite der Reduktionsgleichung zwei Chromatome (Cr 2 O 7 2 -) stehen, die beide reduziert werden, muss man zuerst auf der rechten Seite mit einem Koeffizienten 2 die Atombilanz ausgleichen (Cr 2 O 7 2 - ---> 2 Cr 3+ ) und folgerichtig dann auch die Differenz der OZ mit 2 multiplizieren, um die Elektronenzahl zu erhalten! Lösung Zurück zum Hauptprogramm

Lösung zu Übung/Regel 4: +VI +III • Red. : Cr 2 O 7 2 - + 6 e- ---> 2 Cr 3+ (2 x DOZ = 6) • Ox. : +II Fe 2+ +III ---> Fe 3+ + e- zurück

1. Übung zu Regel Nr. 5 Wir bleiben bei der Reaktion von Dichromationen mit Eisen-(II)-ionen, wobei Chrom(III)-Ionen sowie Eisen(III)-Ionen entstehen. . . Die Reaktion läuft in saurem Milieu ab! Aufgabe: Führe den Ladungsausgleich bei den beiden Teilgleichungen durch! (Achte darauf, ob die Oxonium-Ionen nach links oder nach rechts geschrieben werden müssen. . . Hinterher muss auf alle Fälle links und rechts die gleiche Anzahl Ladungen stehen. ) Lösung

Lösung zu Übung/Regel 5/1: Red. : Cr 2 O 7 2 - + 6 e- + 14 H 3 O+ ---> 2 Cr 3+ Ladungssumme: +6 Ox. : = +6 Fe 2+ ---> Fe 3+ + e(kein Ladungsausgleich nötig) Zur nächsten Übung! zurück

2. Übung zu Regel Nr. 5 • Diese 2. Übung ist notwendig, weil man nur in sauren und neutralen Lösungen – wie gerade geübt – mit Oxonium-Ionen ausgleicht. • • In alkalischen Lösungen wird dagegen mit Hydroxid-Ionen ausgeglichen; dazu folgende Aufgabe: Ergänze nachstehende Teilgleichungen erst um die Elektronenzahl (dazu musst du die OZ ermitteln!) und führe dann – wo nötig - den Ladungsausgleich mit Hydroxid-Ionen durch! • • Red. : Mn. O 4 - ---> Mn. O 42 Ox. : SO 32 - ---> SO 42 - Lösung Zurück zum Hauptprogramm

Lösung zu Übung/Regel 5/2: - • Red. : Mn. O 4 + e- ---> Mn. O 42 - (kein Ladungsausgleich nötig!) • Ox. : SO 32 - + 2 OH- ---> SO 42 - + 2 e 4 - = 4 - Wenn´s richtig war, dann hast du die größte Hürde schon geschafft! Wenn nicht, dann wiederhole die Regel samt den zwei Übungen lieber noch einmal. zurück

Übung zu Regel Nr. 6 • Wir bleiben bei der Reaktion von Dichromationen mit Eisen-(II)-ionen. . . • Aufgabe: Gleiche die Atombilanz in den beiden Teilgleichungen auf deinem Blatt Papier aus! Lösung Zurück zum Hauptprogramm

Lösung zu Übung/Regel 6: Red. : Cr 2 O 7 2 - + 6 e- + 14 H 3 O+ ---> 2 Cr 3+ + 21 H 2 O Ox. : Fe 2+ ---> Fe 3+ + e- (kein Ausgleich nötig) zurück

Übung zu Regel Nr. 7 • Wir bleiben bei der Reaktion von Dichromationen mit Eisen-(II)-ionen. . . • Aufgabe: Erweitere die zwei Teilgleichungen so, dass die Elektronenzahlen übereinstimmen! Lösung Zurück zum Hauptprogramm

Lösung zu Übung/Regel 7: Red. : Cr 2 O 7 2 - + 6 e- + 14 H 3 O+ ---> 2 Cr 3+ + 21 H 2 O Ox. : 6 Fe 2+ ---> 6 Fe 3+ + 6 e- zurück

Übung zu Regel Nr. 8 • Aufgabe: • Erstelle aus den beiden Teilgleichungen die fertige Redoxreaktion! Lösung Zurück zum Hauptprogramm

Lösung zu Übung/Regel 8: Redox: Cr 2 O 7 2 - + 14 H 3 O+ + 6 Fe 2+ 2 Cr 3+ + 21 H 2 O + 6 Fe 3+ (trotzdem noch Regel 9 durchlesen!) zurück

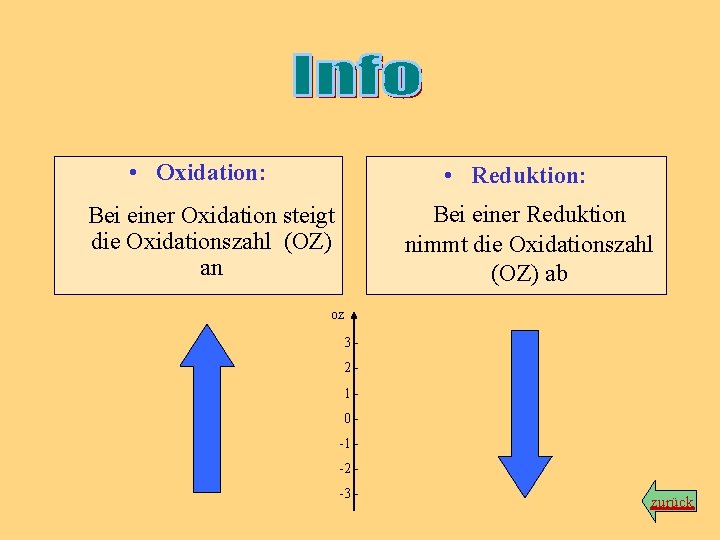
• Oxidation: • Reduktion: Bei einer Reduktion nimmt die Oxidationszahl (OZ) ab Bei einer Oxidation steigt die Oxidationszahl (OZ) an OZ 3210 -1 -2 -3 - zurück

• Die römische Ziffer gibt die Oxidationszahl des davorstehenden Ions an. • Bsp. : Bei Eisen-(III)-chlorid liegen Fe 3+ -Ionen vor. (Daraus lässt sich wiederum die Formel für Eisen(III)-chlorid erschließen, wenn man weiß, dass Chlorid-Ionen einwertig sind: Cl- ) Fe. Cl 3 zurück

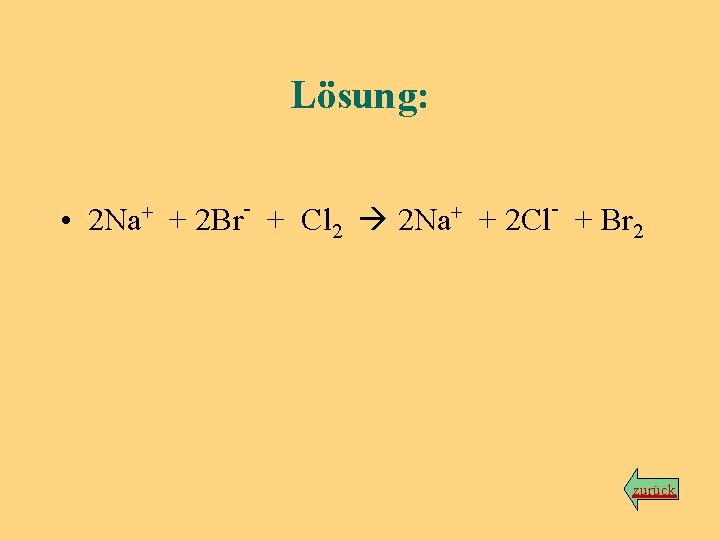
Begleit-Ionen • Begleit-Ionen liegen vor und nach der Reaktion unverändert (und hydratisiert) vor und werden weggelassen: Bsp. : H 3 O+ + Cl + Na+ + OH 2 H 2 O + Na+ + Cl kurz: H O+ + OH 2 H O 3 2 • Übungsbeispiel: Leitet man durch eine Natriumbromidlösung Chlorgas hindurch, entstehen eine Natriumchloridlösung und elementares Brom. Aufgaben: a) Formuliere die Reaktionsgleichung mit allen beteiligten einzelnen Teilchen! Lösung b) Kürze die Gleichung um die Begleit-Ionen! Lösung Zurück zum Hauptprogramm

Begleit-Ionen • Begleit-Ionen liegen vor und nach der Reaktion unverändert (und hydratisiert) vor und werden weggelassen: Bsp. : H 3 O+ + Cl + Na+ + OH 2 H 2 O + Na+ + Cl kurz: H O+ + OH 2 H O 3 2 • Übungsbeispiel: Leitet man durch eine Natriumbromidlösung Chlorgas hindurch, entstehen eine Natriumchloridlösung und elementares Brom. Aufgaben: a) Formuliere die Reaktionsgleichung mit allen beteiligten einzelnen Teilchen! Lösung b) Kürze die Gleichung um die Begleit-Ionen! Lösung Zurück zum Hauptprogramm

Lösung: • 2 Na+ + 2 Br- + Cl 2 2 Na+ + 2 Cl- + Br 2 zurück

Lösung: 2 Br- + Cl 2 2 Cl- + Br 2 zurück

Oxidationszahl • Die Oxidationszahl beschreibt die Oxidationsstufe, in der sich ein Atom befindet und ist eine formale Hilfsgröße beim Aufstellen von Redoxgleichungen. • Die Oxidationszahl wird mit pos. oder neg. Vorzeichen über das Elementsymbol geschrieben: Bsp. : +IV -II S O 3 2 - +IV -II S O 2 zurück

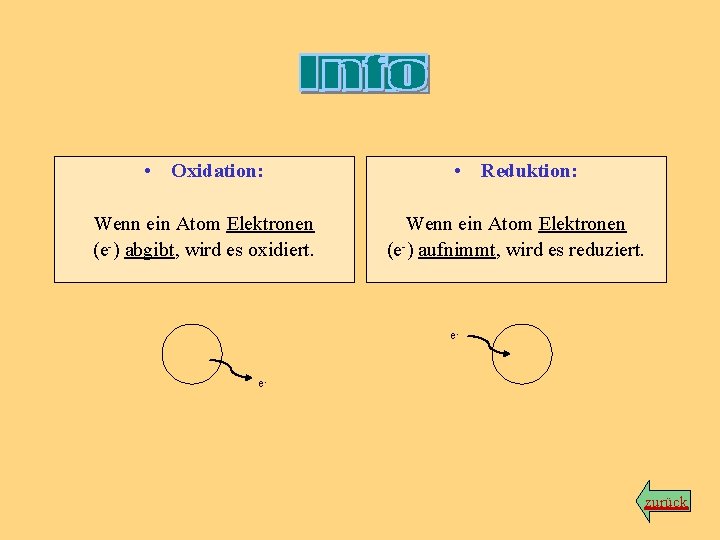
• Oxidation: • Reduktion: Wenn ein Atom Elektronen (e-) abgibt, wird es oxidiert. Wenn ein Atom Elektronen (e-) aufnimmt, wird es reduziert. e- e- zurück

Indices und Koeffizienten • Die kleinen Zahlen, die rechts unten an einem Elementsymbol stehen, heißen Indices (Singular: Index). Bsp: H 2 Ein Index bezieht sich immer nur genau auf das Atom/oder auf die (eingeklammerte) Atomgruppe hinter dem/der er steht. Bsp. : a) In einem Molekül CO 2 liegen zwar 2 Sauerstoffatome (O) vor, aber nur ein Kohlenstoffatom (C). ) b) Ein Harnstoffmolekül mit der Formel CO(NH 2)2 besteht aus folgenden Atomen: 1 x. C, 1 x. O, 2 x. N und 2 x 2 H = 4 x. H. • Die großen Zahlen, die links vor einer Formel stehen, heißen Koeffizienten. Bsp. : 2 HCl Ein Koeffizient bezieht sich immer auf alle Atome der gesamten Formel (samt deren Indices). Bsp. : 2 H 2 CO 3 bedeutet soviel wie : 2 x (H 2 CO 3), also: 2 x 2 H = 4 x. H, 2 x. C und 2 x 3 O =6 x. O zurück

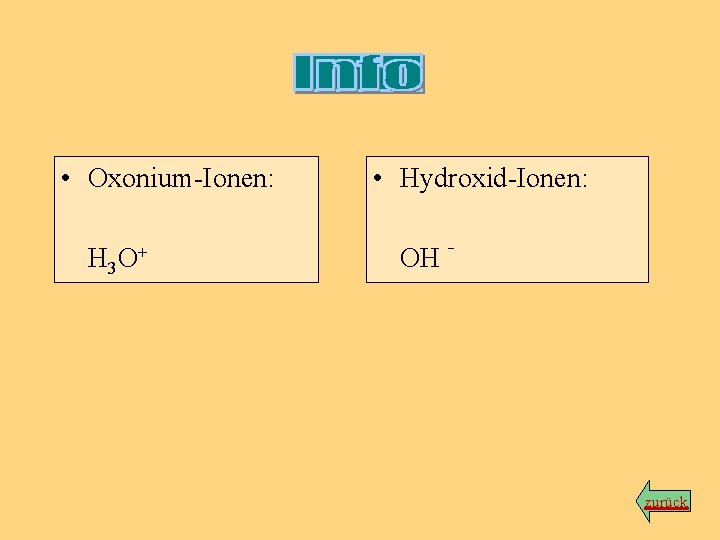
• Oxonium-Ionen: H 3 O+ • Hydroxid-Ionen: OH - zurück
 Lisa lustich
Lisa lustich Zum fressen geboren zum kraulen bestellt
Zum fressen geboren zum kraulen bestellt Redoxgleichungen
Redoxgleichungen Von der idee zum text
Von der idee zum text Von der idee zum markterfolg
Von der idee zum markterfolg Hno3 vsepr
Hno3 vsepr Hno lewis dot structure
Hno lewis dot structure Hno element
Hno element Vsepr quiz
Vsepr quiz Farmastil
Farmastil Suda çözündüğünde hidroksit iyonu veren madde
Suda çözündüğünde hidroksit iyonu veren madde Hno lewis structure
Hno lewis structure Hno hybridization
Hno hybridization Ch2o charge
Ch2o charge Erasmus von rotterdam beeinflusst von
Erasmus von rotterdam beeinflusst von Kurshalter
Kurshalter Ereignisgesteuerte prozesskette erstellen
Ereignisgesteuerte prozesskette erstellen Https learningapps org myapps php
Https learningapps org myapps php Puschi bedeutung
Puschi bedeutung Oszilloskop simulation
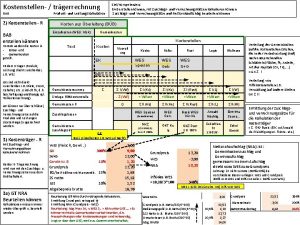
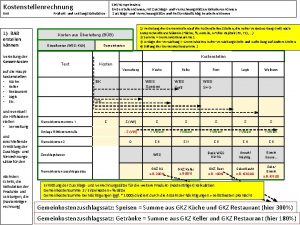
Oszilloskop simulation Kostenstellenplan erstellen
Kostenstellenplan erstellen Preis absatz funktion excel
Preis absatz funktion excel Kompetenzmatrix erstellen
Kompetenzmatrix erstellen Kochrezept vorlage word
Kochrezept vorlage word Kostenstellenrechnung bab
Kostenstellenrechnung bab Epk auftragsbearbeitung
Epk auftragsbearbeitung Fu berlin informatik master
Fu berlin informatik master Lsf fh dortmund
Lsf fh dortmund Interviewfragen erstellen chemieingenieur
Interviewfragen erstellen chemieingenieur Analysespinne erstellen
Analysespinne erstellen Learning snacks erstellen
Learning snacks erstellen Glossar erstellen
Glossar erstellen Grafstat fragebogen erstellen
Grafstat fragebogen erstellen Differenzierung im chemieunterricht
Differenzierung im chemieunterricht Libre office als pdf speichern
Libre office als pdf speichern Vertriebsprozess erstellen
Vertriebsprozess erstellen Wirkungsmodell erstellen
Wirkungsmodell erstellen Routing tabelle erstellen
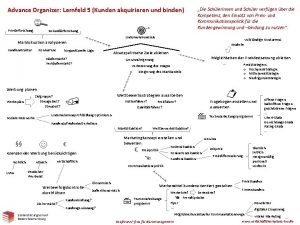
Routing tabelle erstellen Advance organizer erstellen
Advance organizer erstellen Interviewfragen erstellen finanzplaner
Interviewfragen erstellen finanzplaner Kontrollflussgraph online erstellen
Kontrollflussgraph online erstellen Morphologischen kasten erstellen
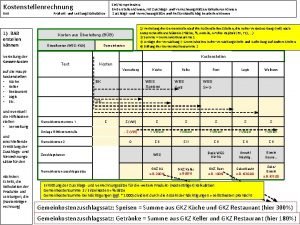
Morphologischen kasten erstellen Bab erstellen
Bab erstellen