Kmiai vltozsok Energia munkavgz vagy hkzl kpessg Energiamegmarads















- Slides: 33

Kémiai változások

Energia: munkavégző, vagy hőközlő képesség. Energiamegmaradás törvénye: Az energia nem keletkezik, nem is szűnik meg, csak átalakul. A világegyetem energiája állandó.

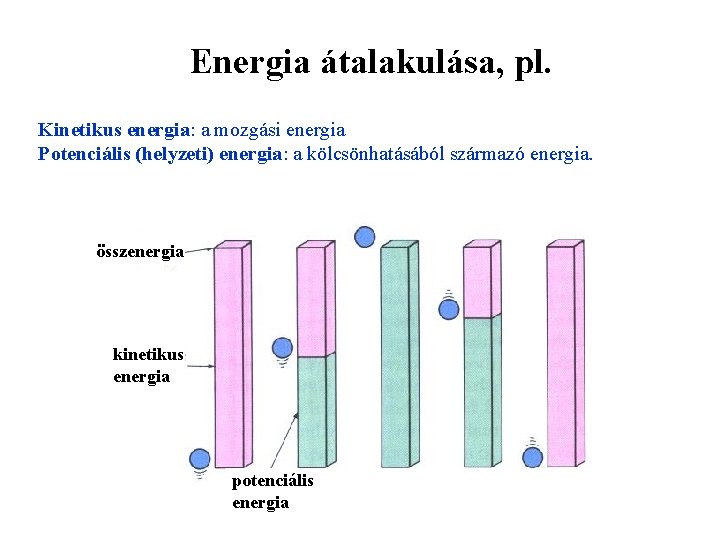
Energia átalakulása, pl. Kinetikus energia: a mozgási energia Potenciális (helyzeti) energia: a kölcsönhatásából származó energia. összenergia kinetikus energia potenciális energia

A kémiai energia a potenciális energia egy fajtája, ami más energiafajtává alakulhat kémiai reakció következtében. …. . hővé ! …. . „játék” energiává !

Rendszer és környezet Rendszer-nek nevezzük a világnak azt a képzelt, vagy valós határfelülettel elkülönített részét, amelynek tulajdonságait vizsgáljuk. Mindent, ami a rendszeren kívül van környezet-nek hívjuk. Zárt rendszer: nincs anyagátadás energiaátadás lehetséges Izolált rendszer: nincs anyagátadás nincs energiaátadás

Belső energia A rendszert felépítő részecskék összenergiája a belső energia (U). Részei: 1. Termikus (molekulák mozgásával kapcsolatos) 2. Intermolekuláris (molekulák közötti erőkkel kapcsolatos) 3. Kémiai (kémiai kötések létesítésével, felbontásával kapcs. ) 4. Mag (magenergiával kapcs. )

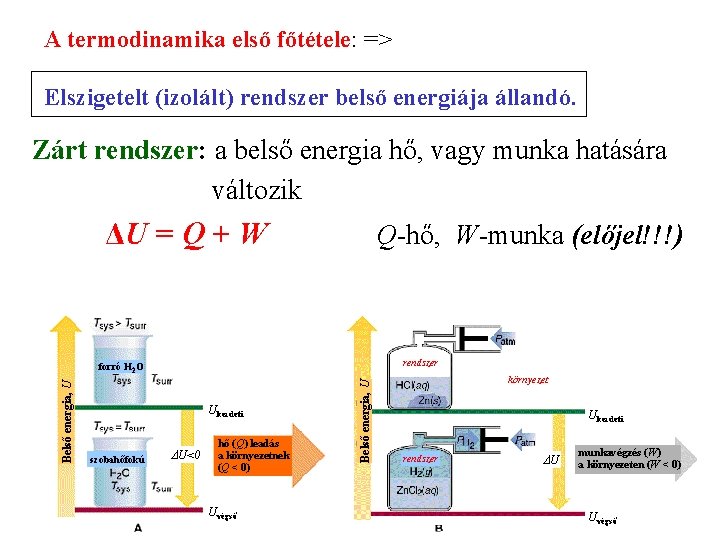
A termodinamika első főtétele: => Elszigetelt (izolált) rendszer belső energiája állandó. Zárt rendszer: a belső energia hő, vagy munka hatására változik ΔU = Q + W Q-hő, W-munka (előjel!!!) rendszer Ukezdeti szobahőfokú ΔU<0 hő (Q) leadás a környezetnek (Q < 0) Uvégső Belső energia, U forró H 2 O környezet Ukezdeti rendszer ΔU munkavégzés (W) a környezeten (W < 0) Uvégső

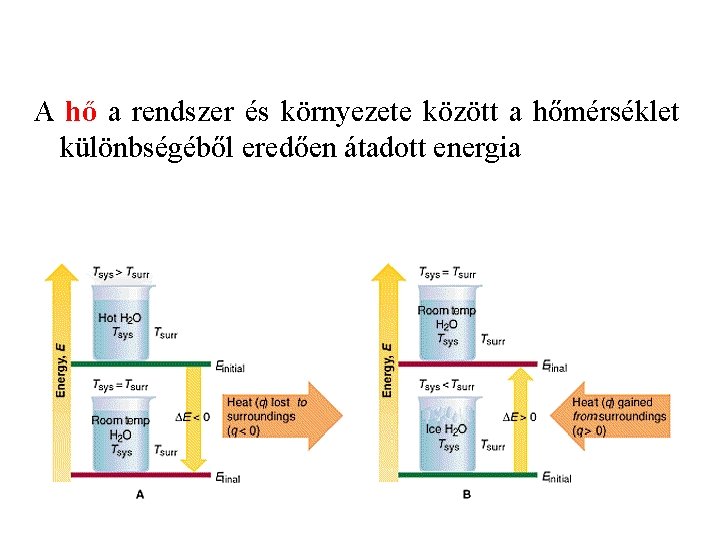
A hő a rendszer és környezete között a hőmérséklet különbségéből eredően átadott energia

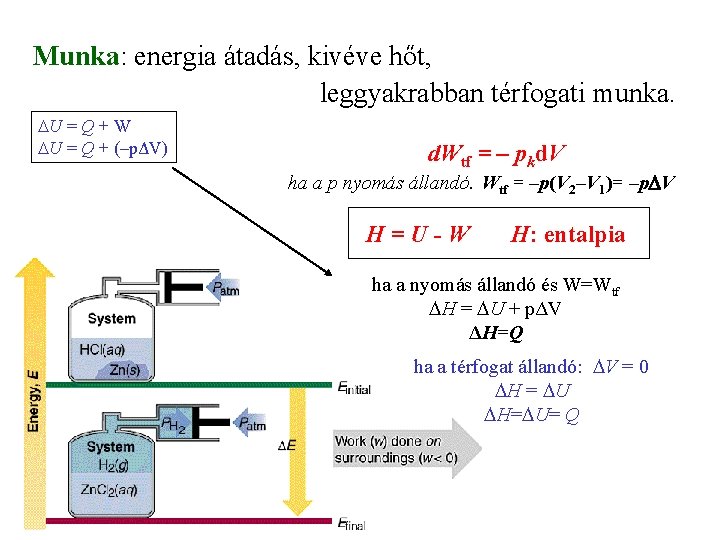
Munka: energia átadás, kivéve hőt, leggyakrabban térfogati munka. U = Q + W U = Q + (–pΔV) d. Wtf = – pkd. V ha a p nyomás állandó. Wtf = –p(V 2–V 1)= –p V H=U-W H: entalpia ha a nyomás állandó és W=Wtf H = U + pΔV ΔH=Q ha a térfogat állandó: V = 0 H = U H= U= Q

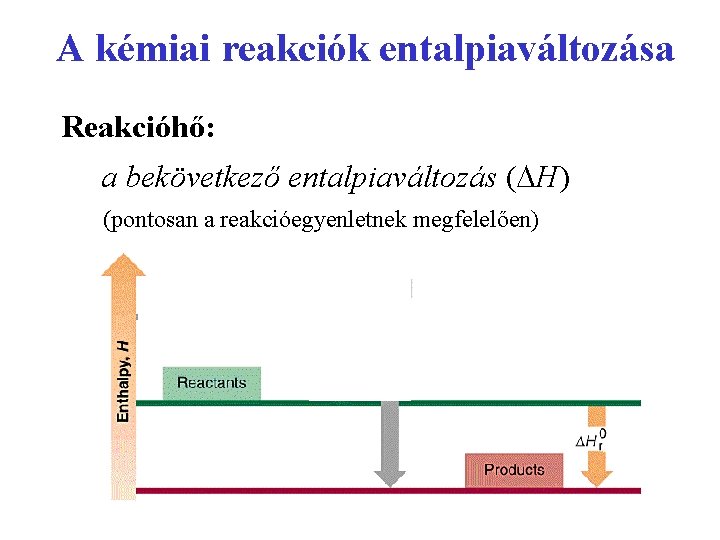
A kémiai reakciók entalpiaváltozása Reakcióhő: a bekövetkező entalpiaváltozás ( H) (pontosan a reakcióegyenletnek megfelelően)

Egy anyag standard állapotán azt értjük, hogy tiszta állapotban van és a nyomás 1 atm (101, 325 k. Pa) és a hőmérséklet 25 ºC (298, 15 K). A standard reakcióhő az az entalpiaváltozás, amit akkor mérhetünk, ha a reagáló anyagok és a termékek is standard állapotban vannak. ΔH 0298, 15 K

Egy vegyület standard képződéshője (ΔHf 0) annak a reakciónak az entalpiaváltozása egy mólra vonatkoztatva, ahol a vegyület standard állapotú elemeiből képződik. Az elemek képződéshője nulla.

Hess tétel: Mindegy, hogy milyen úton jutunk a kezdeti állapotból a végállapotba, a reakció entalpiaváltozása, csak a kezdeti és végállapottól függ. Az entalpia állapotfüggvény, változása csak a kezdeti és végállapottól függ.

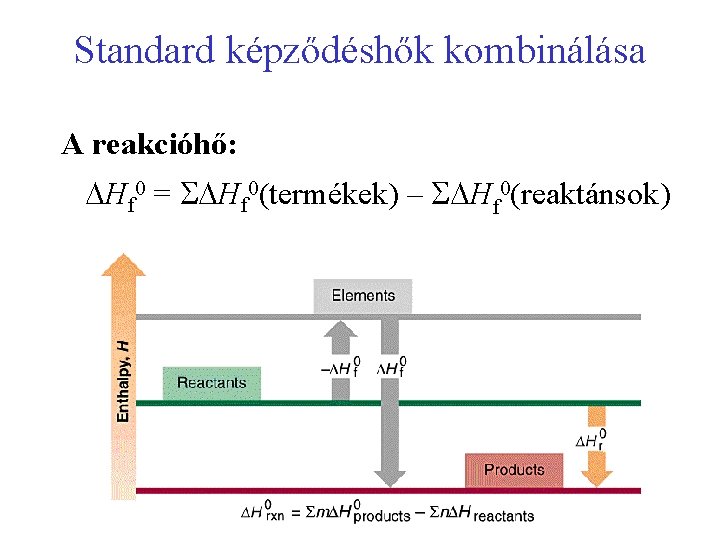
Standard képződéshők kombinálása A reakcióhő: Hf 0 = Hf 0(termékek) – Hf 0(reaktánsok)

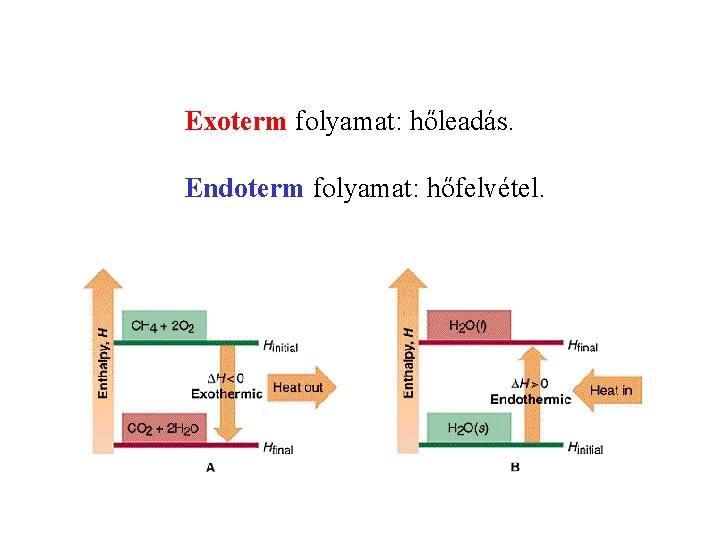
Exoterm folyamat: hőleadás. Endoterm folyamat: hőfelvétel.

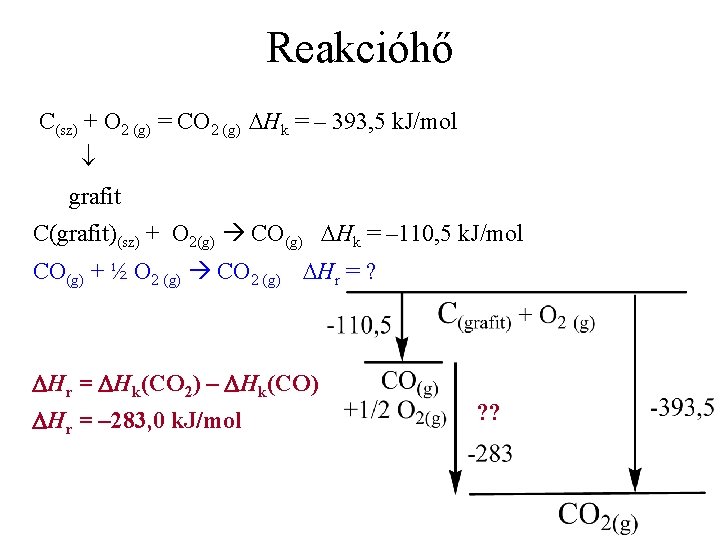
Reakcióhő C(sz) + O 2 (g) = CO 2 (g) Hk = – 393, 5 k. J/mol grafit C(grafit)(sz) + O 2(g) CO(g) Hk = – 110, 5 k. J/mol CO(g) + ½ O 2 (g) CO 2 (g) Hr = ? Hr = Hk(CO 2) – Hk(CO) Hr = – 283, 0 k. J/mol ? ?

Mennyi hő keletkezett az alábbi reakcióban ? 3 Mn. O 2 + 4 Al = 3 Mn + 2 Al 2 O 3 19, 2 g Mn. O 2 és Al por (Mn=55, O=16) 19, 2/(55+2· 16)=0, 22 mol ∆Hr 0 = 2∙∆Hk 0(Al 2 O 3) + 3∙∆Hk 0(Mn) – 3∙∆Hk 0(Mn. O 2) – 4∙∆Hk 0(Al) ∆Hr 0 = 2(-1588) + 3(0, 0) – 3(-514) – 4(0, 0) = -1634 k. J 3 mol esetén 1634 k. J keletkezik 0, 22 mol x ----------------------x= 120 k. J hő keletkezett

Reakcióhő CH 4 (g) + 2 O 2 (g) CO 2 (g) + 2 H 2 O (g) ∆Hr 0 = ∆Hk 0(CO 2) + 2∙∆Hk 0(H 2 O) – ∆Hk 0(CH 4) – 2∙∆Hk 0(O 2) ∆Hr 0 = 1(-393, 5) + 2(-241, 8) – 1(-74, 81) – 2(0, 0) = -802, 29 k. J 1 mol metán égésekor felszabaduló hő: 802, 29 k. J 4 Fe (sz) + 3 O 2 (g) 2 Fe 2 O 3 (sz) ∆Hr 0 = 2∙∆Hk 0(Fe 2 O 3) – 4∙∆Hk 0(Fe) – 3∙∆Hk 0(O 2) ∆Hr 0 = 2(-831, 1) – 4(0, 0) – 3(0, 0) = -1662, 2 k. J 1 mol Fe „rozsdásodása” során felszabaduló hő: 1662, 2 / 4 = 415, 55 k. J

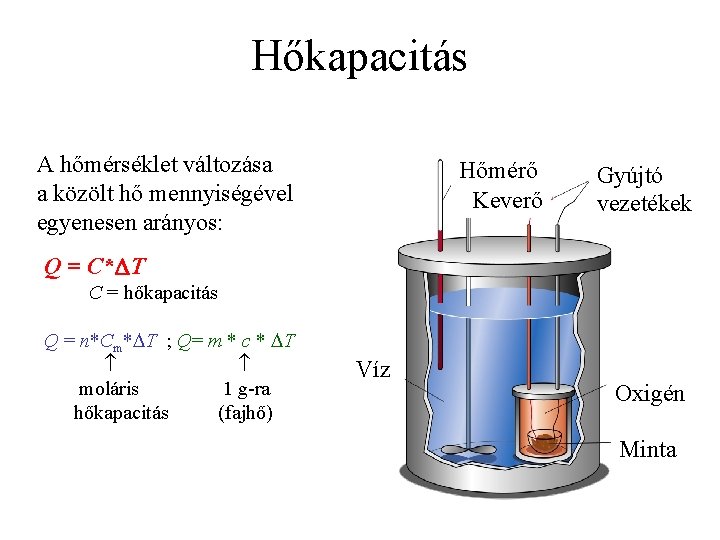
Hőkapacitás A hőmérséklet változása a közölt hő mennyiségével egyenesen arányos: Hőmérő Keverő Gyújtó vezetékek Q = C* T C = hőkapacitás Q = n*Cm* T ; Q= m * c * T moláris 1 g-ra hőkapacitás (fajhő) Víz Oxigén Minta

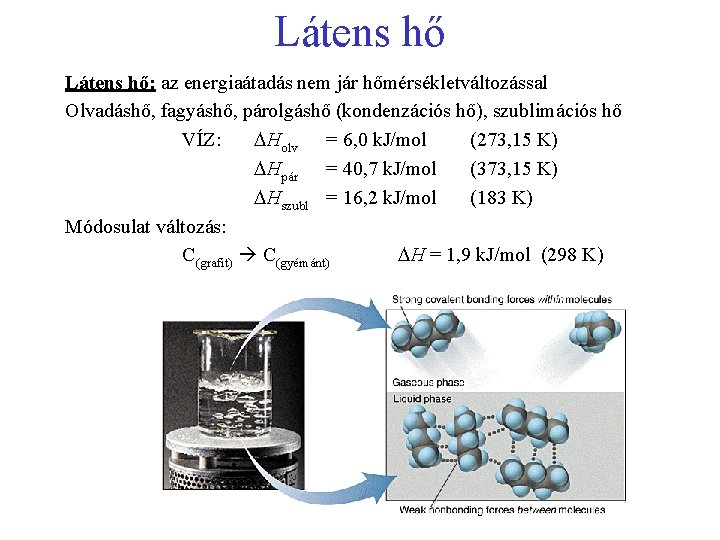
Látens hő: az energiaátadás nem jár hőmérsékletváltozással Olvadáshő, fagyáshő, párolgáshő (kondenzációs hő), szublimációs hő VÍZ: Holv = 6, 0 k. J/mol (273, 15 K) Hpár = 40, 7 k. J/mol (373, 15 K) Hszubl = 16, 2 k. J/mol (183 K) Módosulat változás: C(grafit) C(gyémánt) H = 1, 9 k. J/mol (298 K)

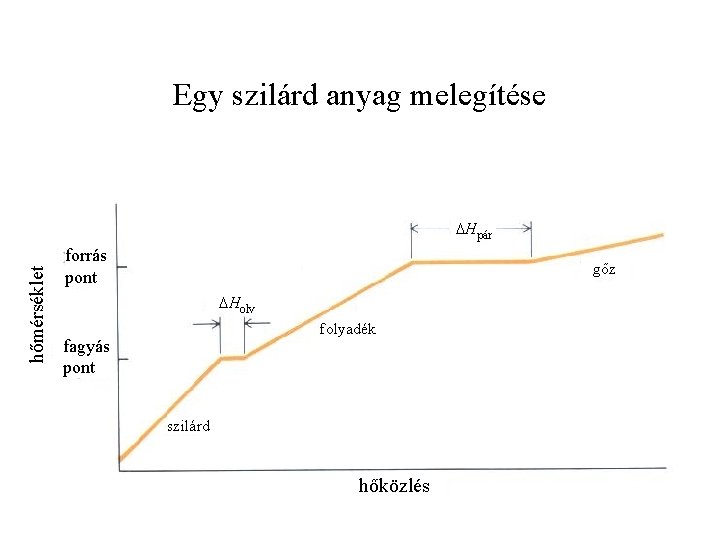
Egy szilárd anyag melegítése hőmérséklet Hpár forrás pont gőz Holv folyadék fagyás pont szilárd hőközlés

Megoldandó feladat: A szén-tetraklorid (CCl 4) forráspontján az anyag párolgáshője 29, 92 k. J/mol. Ha 50 g CCl 4 -ot a forráspontján, normál légköri nyomáson elpárologtatunk, számítsuk ki Q, W, ΔU és ΔH értékeit ! A CCl 4 forráspontja 76, 8 ºC.

Megoldás n= 50 g/154 g/mol = 0, 325 mol Q= n·L = 0, 325 mol · 29, 92 k. J/mol = 9, 71 k. J pΔV=Δn·RT = 0, 325· 8, 314·(273, 15+76, 8)= 945, 45 J Nyomás állandó => Q=ΔH ΔH= 9, 71 k. J ΔU= ΔH–p ΔV =9, 71 – 0, 945 k. J = 8, 765 k. J

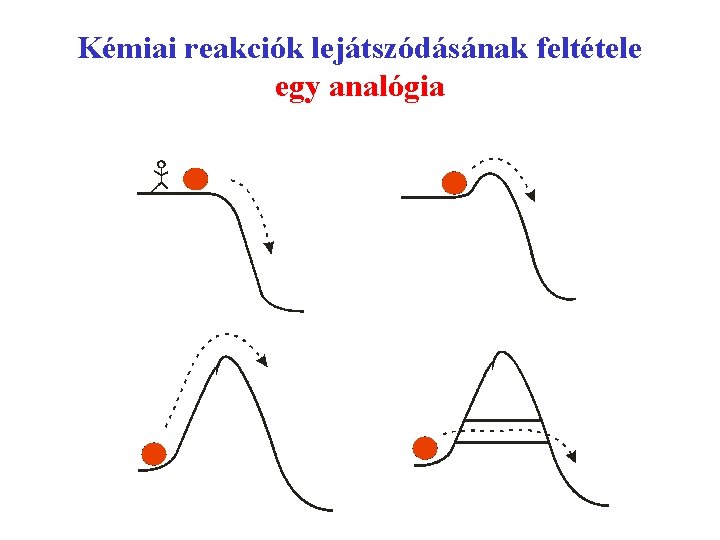
Kémiai reakciók lejátszódásának feltétele egy analógia

Kémiai reakciók lejátszódásának feltétele

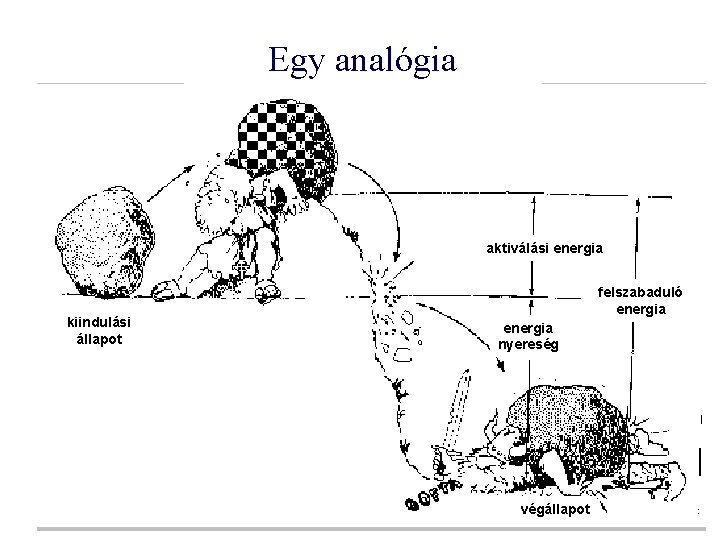
Egy analógia aktiválási energia kiindulási állapot felszabaduló energia nyereség végállapot

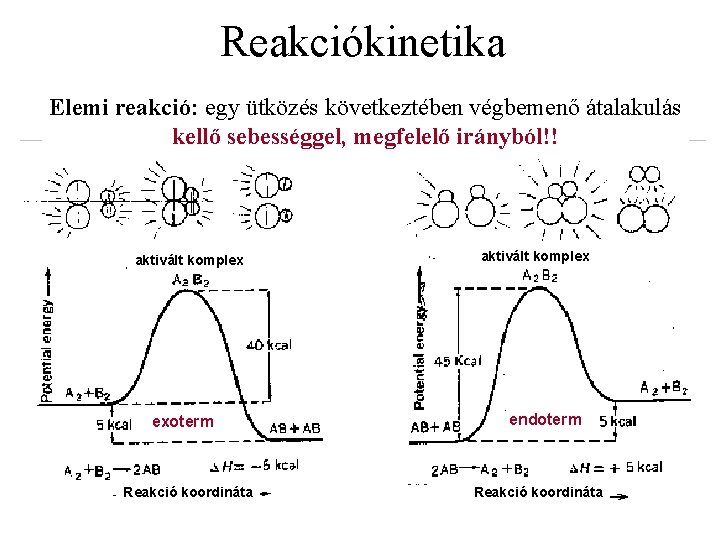
Reakciókinetika Elemi reakció: egy ütközés következtében végbemenő átalakulás kellő sebességgel, megfelelő irányból!! aktivált komplex exoterm Reakció koordináta aktivált komplex endoterm Reakció koordináta

Kémiai reakciók lejátszódásának feltétele

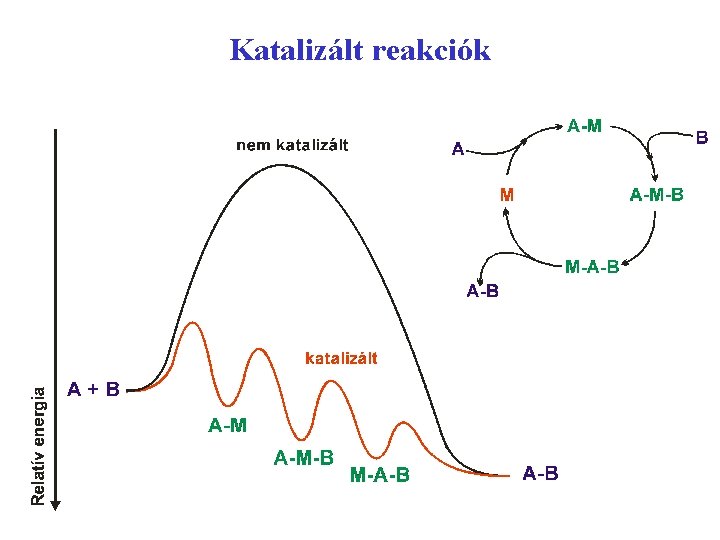
Katalizált reakciók

Katalizátor - Iniciátor • Katalizátor: olyan anyag, mely a reakció sebességét gyorsítja és egy meghatározott irányba vezeti a nélkül, hogy a reakció végtermékében megjelenne. A katalizátor a reakcióban „látszólag” nem vesz részt és a reakció lejátszódása után visszakapjuk. • Homogén katalízis: a katalizátor ugyanabban a fázisban van, mint a reakciórendszer. • Heterogén katalízis: a katalizátor és a reagáló anyagok egymással érintkező különböző fázisokban vannak. • Iniciátor: reakciókat, rendszerint láncreakciókat megindító anyagok. A katalizátorokkal ellentétben az iniciátorok megváltoznak a reakció során, beépülnek vagy megváltozott állapotban maradnak vissza.

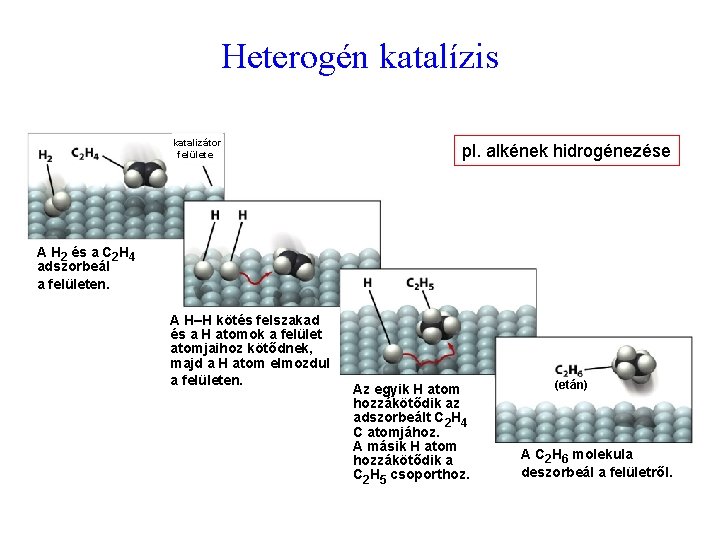
Heterogén katalízis katalizátor felülete pl. alkének hidrogénezése A H 2 és a C 2 H 4 adszorbeál a felületen. A H–H kötés felszakad és a H atomok a felület atomjaihoz kötődnek, majd a H atom elmozdul a felületen. Az egyik H atom hozzákötődik az adszorbeált C 2 H 4 C atomjához. A másik H atom hozzákötődik a C 2 H 5 csoporthoz. (etán) A C 2 H 6 molekula deszorbeál a felületről.

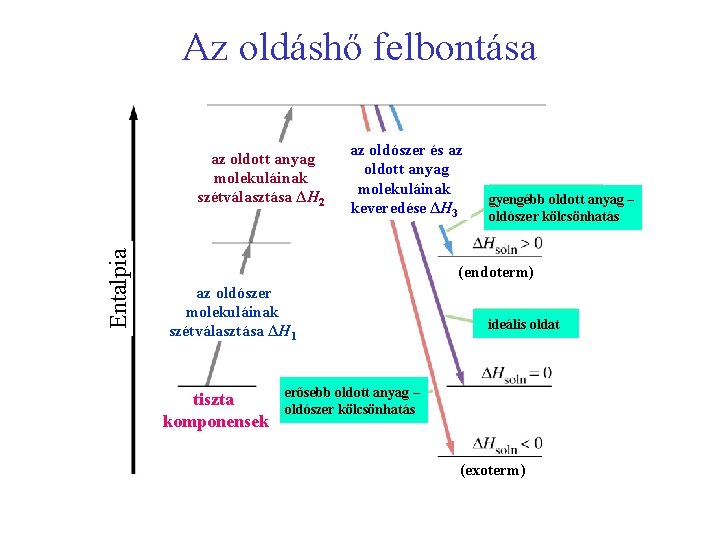
Az oldáshő felbontása Entalpia az oldott anyag molekuláinak szétválasztása ΔH 2 az oldószer és az oldott anyag molekuláinak keveredése ΔH 3 gyengébb oldott anyag – oldószer kölcsönhatás (endoterm) az oldószer molekuláinak szétválasztása ΔH 1 tiszta komponensek ideális oldat erősebb oldott anyag – oldószer kölcsönhatás (exoterm)

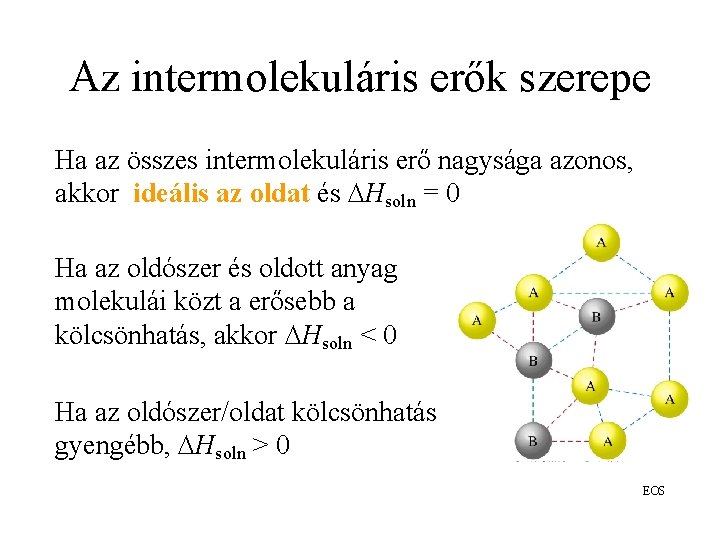
Az intermolekuláris erők szerepe Ha az összes intermolekuláris erő nagysága azonos, akkor ideális az oldat és Hsoln = 0 Ha az oldószer és oldott anyag molekulái közt a erősebb a kölcsönhatás, akkor Hsoln < 0 Ha az oldószer/oldat kölcsönhatás gyengébb, Hsoln > 0 EOS
 Kmiai
Kmiai Redukál
Redukál Arna kmiai
Arna kmiai Energia potenziale per bambini
Energia potenziale per bambini Ce este energia mecanica
Ce este energia mecanica Pressao absoluta
Pressao absoluta Max lucado értékes vagy
Max lucado értékes vagy Nagyobb relációs jel
Nagyobb relációs jel Hervadj rózsa hervadj mert az enyém nem vagy
Hervadj rózsa hervadj mert az enyém nem vagy Bitfolyam vagy pcm
Bitfolyam vagy pcm Alanyos összetett szavak
Alanyos összetett szavak Fejtetű serke vagy korpa
Fejtetű serke vagy korpa Bactroban orrkenőcs
Bactroban orrkenőcs Rómeó és júlia műfaja
Rómeó és júlia műfaja Candide tézisregény
Candide tézisregény Mgszki
Mgszki Kulminációs pont
Kulminációs pont Nagy istenem ha nézem a világot
Nagy istenem ha nézem a világot Idelye vagy ideje
Idelye vagy ideje Hőelnyelő folyamatok
Hőelnyelő folyamatok Nem azert szeretlek aki vagy hanem
Nem azert szeretlek aki vagy hanem Jónéhány egybe vagy külön
Jónéhány egybe vagy külön Energia in greco antico
Energia in greco antico Manipulación de energías sexuales
Manipulación de energías sexuales Calcula la fuerza con que se atraen una libreta de 150g
Calcula la fuerza con que se atraen una libreta de 150g Energia immagazzinata in un condensatore
Energia immagazzinata in un condensatore Energia classe quinta
Energia classe quinta Variaçao da energia mecanica
Variaçao da energia mecanica Energa potencial
Energa potencial Reações quimicas dependem de energia e colisões eficazes
Reações quimicas dependem de energia e colisões eficazes Sistema cerrado ejemplo
Sistema cerrado ejemplo Potencial electrico
Potencial electrico Klaudia hofman
Klaudia hofman Objetivos de la mecánica corporal
Objetivos de la mecánica corporal