Kmiai alapismeretek Kmiai BSc Savbzis egyenslyok Feladatok az

Kémiai alapismeretek Kémiai BSc Sav-bázis egyensúlyok

Feladatok: az előző órán tanultakhoz… 1. Hogyan készít 500 gramm 6 m/m %-os Na. Cl oldatot? M. : 30 g só, 470 gramm, cm 3 víz 2. Hogyan készít 400 cm 3 3 m/v %-os cukoroldatot? M. : 12 g cukor oldva 400 cm 3 -re 3. 40 gramm Na. OH-ból mennyi a) 2 m/v %-os; b) 2 m/m %-os oldatot lehet készíteni? M. : a) 2 dm 3 -t; b) 2 kg-ot 4. Hány m/m %-os a 15, 95 m/v %-os 1, 063 g/cm 3 sűrűségű répacukoroldat? M. : 15 m/m %-os

5. Mennyi kénsavat tartalmaz 500 cm 3 0, 5 mol/dm 3 -es kénsavoldat? (H=1, S= 32, O=16) M. : 24, 5 grammot 6. Hány mólos (mol/dm 3 -es koncentrációjú) a 4, 9 m/v % kénsavoldat? M. : 0, 5 mol/dm 3 7. Hány m/v %-os a 2 mol/dm 3 -es koncentrációjú kénsavoldat? (M=98 g) M. : 19, 6 m/v % 8. A réz (II)-szulfát (rézgálic) 5 mól kristályvizet tartalmaz: Cu. SO 4*5 H 2 O mólnyi mennyisége: 160 g és 90 g víz, együttesen 250 g. Kérdés: 1 dm 3 1 m/v %-os oldat elkészítéséhez mennyi kristályvizes rézszulfátot kell bemérni? M. : ha kristályvíz nélküli lenne 10 g-ot, de így 250/160*10=15, 625 g-ot

Pufferoldatok Erős savak (bázisok) gyenge savakra (bázisokra) kifejtett hatásának gyakorlati jelentősége a pufferoldatokban van. Pufferek az olyan oldatok, amelyek gyenge savat és ennek erős bázissal alkotott sóját, ill. gyenge bázist és ennek erős savval alkotott sóját tartalmazzák. Pl. : CH 3 COOH és CH 3 COONa, ill. NH 4 OH és NH 4 Cl. Az ilyen oldatok p. H-ja jelentős mértékben „stabil”, kisebb mennyiségű erős sav vagy lúg hozzáadásának hatására nem változik lényegesen. Pufferként viselkednek, pl. a többértékű gyenge savak savanyú sói is (Na 2 HPO 4 vagy Na. H 2 PO 4)

A pufferoldatok működése a tömeghatás törvénye alapján értelmezhető, és a disszociációs állandóban (Kd) szereplő koncentráció értékek megfelelő arányba történő állítása, az elhanyagolások és átrendezések után a pufferoldat p. H-ját a következő összefüggések segítségével számíthatjuk ki:

Tehát a gyenge savat és sóját tartalmazó pufferoldat hidrogénion koncentrációja (p. H-ja) a gyenge sav és só koncentrációjának arányától és a gyenge sav disszociáció állandójától függ. Ks=KCH 3 COOH= 1, 86*10 -5 Kb=KNH 4 OH= 1, 8*10 -5

Látható, hogy a puffer hidrogénion koncentrációja, p. H-ja jól definiálható érték, amely az oldat hígításával nem változik. A gyenge sav és sójának koncentrációaránya hígításkor nem változik észrevehető mértékben. Ha a gyenge sav relatív koncentrációját növeljük, a puffer H+-ion koncentrációja kismértékben nő, viszont a só relatív koncentrációjának növelésére a hidrogénion koncentráció kismértékben csökken. A puffer alkotórészeinek arányát változtatva tehát különböző, előre kiszámítható p. H-jú pufferoldatok készíthetők.

A pufferoldat kiegyenlítő működése azon alapszik, hogy a puffer p. H-ja kisebb mennyiségű erős sav vagy bázis hozzáadására alig változik. Ez annak a következménye, hogy erős sav hatására a pufferben lévő gyenge sav a sójából felszabadul, s így nem a hidrogénionok koncentrációja nő, hanem a gyenge sav és a só aránya tolódik el. Ezzel szemben az erős sav ugyanezen mennyisége tiszta vízben radikális p. H-változást váltana ki. A pufferoldatok az erős bázisok hatását úgy képesek kiegyenlíteni, hogy a pufferben lévő gyenge sav az erős bázissal sót képez. Ezzel csökken ugyan a gyenge sav koncentrációja és nő a só mennyisége, de nem növekedett jelentősen a hidroxidionok koncentrációja. Megváltozik ugyan a sav és a só aránya, de alig változik a hidrogén- és hidroxidionok koncentrációja.

A pufferoldatok kiegyenlítő képességének a mértéke a pufferkapacitás. Ez egy erős bázisnak vagy savnak azon mólokban megadott mennyiségével egyenlő, amely 1 dm 3 pufferoldat p. H-jában egységnyi változást okoz. A pufferkapacitás akkor nagy, ha a pufferoldat a gyenge savat és sóját (ill. a gyenge bázist és sóját) egyenlő arányban és minél nagyobb koncentrációban tartalmazza. Általában jó pufferhatás akkor lép fel, ha az arány 10 és 0, 1 közé esik. A vér pufferrendszere az ún. bikarbonát-puffer: H 2 CO 3 és Na HCO 3 p. H= 7, 35

Indikátorok Az indikátorok olyan vegyületek, amelyek valamely komponensnek a reakcióelegyében való megjelenését vagy eltűnését jelzik. A savbázis indikátor rendszerint olyan gyenge sav vagy gyenge bázis, amelynek disszociációja színváltozással jár. Ez annak a következménye, hogy a kation vagy az anion más színű, mint a disszociálatlan indikátor molekula színe.

A sav-bázis indikátorok színváltozása – Ostwald elmélete szerint – egyszerűen az elektrolitos disszociáció következménye, és működésük az elektrolitok disszociáció elméletével magyarázható. Azonban számos indikátor színváltozását a molekulán belüli atomátrendeződés is kísér. Savas kémhatású oldatokban a gyenge sav jellegű indikátorok disszociációja visszaszorul, s az oldat a nem disszociált indikátor molekula színét mutatja. Lúgos oldatban a gyenge sav sóvá alakul át, amely nagymértékben disszociál, és ekkor az indikátor színe az anion színének felel meg.

Vegyük példának a fenolftalein indikátort. A fenolftalein olyan gyenge savnak tekinthető, amelynek nem disszociált molekulái (HA) színtelenek, a disszociáció során keletkezett anionja (A-) pedig vörös színűek: HA ⇌ H+ + Amolekula anion színtelen vörös

Félig disszociált állapotban a fenolftalein indikátort tartalmazó oldat színe a disszociálatlan molekulák és az anionok keveréke, így egy keverékszínt észlelhetünk (rózsaszínű). Nagyobb hidrogénion koncentráció mellett a fenolftalein disszociációja visszaszorul, és az oldatban a nem disszociált, színtelen fenolftalein molekulák lesznek túlsúlyban, ezért az oldat színtelen. Ha a H+-ion koncentrációt csökkentjük (lúgosítjuk), a fenolftalein molekula disszociációja fokozódik, és az oldatban a vörös színű fenolftalein-anionok kerülnek többségbe.

Az indikátorok színváltozása, átcsapási tartománya disszociáció állandójuk (Kd) értékétől függ. Ha a hidrogénion koncentráció ennél 10 -szer nagyobb, a disszociálatlan indikátormolekulák színe a domináns. Amikor pedig a H+-ion koncentrációja a Kd értéknél 10 szer kisebb lesz, az indikátor-anion színe válik uralkodóvá. A két szín közötti p. H-intervallum az átcsapási zóna. A színváltozás tehát kb. két p. H-egységre terjed ki. Az indikátorok ezen átcsapási intervallumát elsősorban az indikátor disszociációs állandója szabja meg. A különböző indikátorok különböző erősségű savaknak, ill. bázisoknak tekinthetők. Néhány indikátor kísérleti úton meghatározott átcsapási tartományát a következő táblázat tartalmazza:
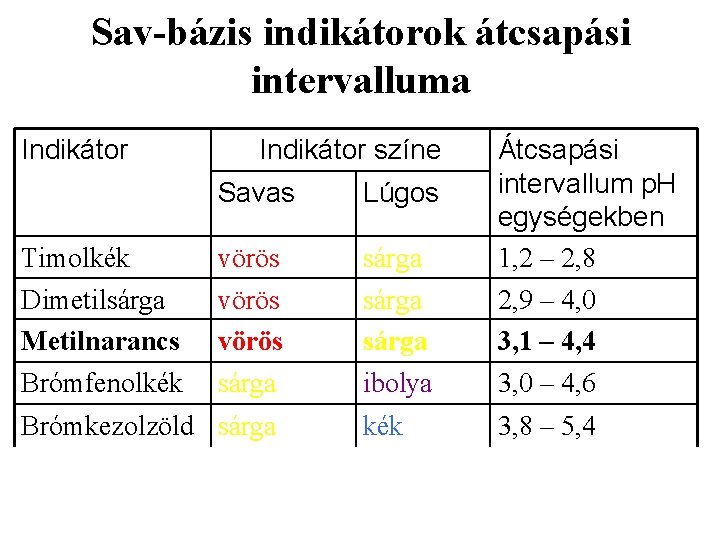
Sav-bázis indikátorok átcsapási intervalluma Indikátor színe Savas Lúgos Timolkék vörös sárga Átcsapási intervallum p. H egységekben 1, 2 – 2, 8 Dimetilsárga Metilnarancs vörös sárga 2, 9 – 4, 0 3, 1 – 4, 4 Brómfenolkék sárga ibolya 3, 0 – 4, 6 kék 3, 8 – 5, 4 Brómkezolzöld sárga
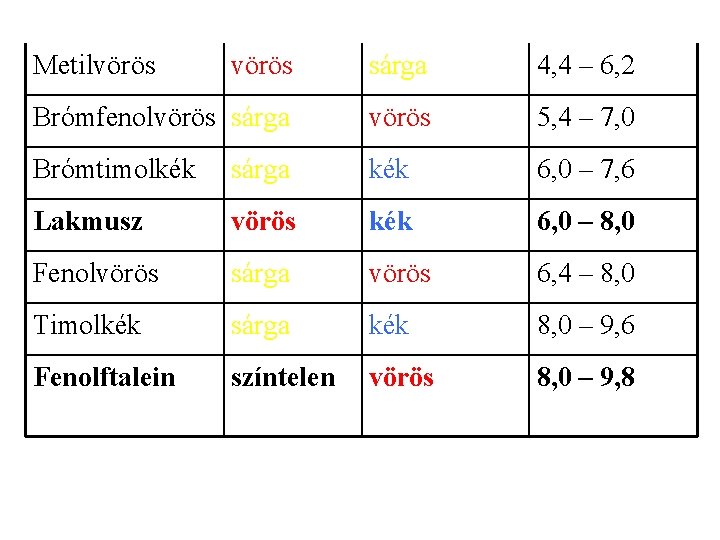
Metilvörös sárga 4, 4 – 6, 2 Brómfenolvörös sárga vörös 5, 4 – 7, 0 Brómtimolkék sárga kék 6, 0 – 7, 6 Lakmusz vörös kék 6, 0 – 8, 0 Fenolvörös sárga vörös 6, 4 – 8, 0 Timolkék sárga kék 8, 0 – 9, 6 Fenolftalein színtelen vörös 8, 0 – 9, 8

Sók hidrolízise A sók ionkristályos vegyületek, többségük jól oldódik vízben. A sók oldódása során előfordul, hogy a só valamely ionja nemcsak hidratálódik, hanem kémiai reakcióba is lép a vízzel. Az olyan sav-bázis folyamatokat, amelyekben a víz nemcsak oldószer, hanem reakciópartnerként is részt vesz, hidrolízisnek nevezzük.

Az ionvegyületek oldatának lúgos kémhatását a hidrolízis okozza. Az erős savakból és gyenge bázisokból származtatható sók savasan hidrolizálnak (pl. NH 4 Cl), az erős bázisokból és gyenge savakból származtatható sók lúgosan hidrolizálnak (pl. Na 2 CO 3). Az erős bázisokból és erős savakból származtatható sók nem hidrolizálnak (pl. Na. Cl, KNO 3, Na 2 SO 4). Csak disszociáció! A hidrolízis lényegében sav-bázis reakció.

A hidrlolízis jelenségével gyakran találkozunk mindennapi életünkben. Például a mosóporok és mosogatószerek anyagai vízben oldva lúgosan hidrolizálnak. A nátrium-klorid (Na. Cl) vizes oldatában jelenlévő nátriumionok (Na+) és kloridionok (Cl-) nem tudnak protont megkötni vagy leadni, nem lépnek kölcsönhatásba a vízzel. Így nem változik meg sem az oxóniumionok, sem a hidroxidionok száma, tehát az oldat semleges kémhatású. Na. Cl(sz)=Na+(aq)+Cl-(aq)

Az ammónium-kloridból (NH 4 Cl) keletkező ammóniumionok reakcióba lépnek a vízzel, a kloridionok viszont nem. NH 4 Cl(sz)=NH 4+(aq)+Cl-(aq) Az ammóniumion (NH 4+) elég erős sav ahhoz, hogy „reagáljon” a vízzel, leadja a protonját a víznek, a keletkező oxóniumion miatt az oldat savas kémhatású. (Brönsted) NH 4++H 2 O⇌NH 3+H 3 O+

A nátrium-karbonátból (Na 2 CO 3) keletkező nátriumionok nem lépnek reakcióba a vízzel, a karbonátionok viszont igen. Na 2 CO 3(sz)=2 Na+(aq)+3 CO 32 -(aq) A karbonátion (CO 32 -) elég erős bázis ahhoz, hogy protont vegyen fel a víztől. A keletkező hidroxidionok miatt az oldat lúgos kémhatású lesz. (Brönsted) CO 32 -+H 2 O⇌HCO 3 -+OH-
- Slides: 21