Kmiai ktsek Ktstpusok elektronegativits Kmiai ktsek atomok ill























- Slides: 32

Kémiai kötések

Kötéstípusok, elektronegativitás • Kémiai kötések: atomok ill. atomcsoportok között kialakuló kapcsolatok, amelyek létrejöttével a rendszer stabilabb (alacsonyabb energiaszintű) állapotba jut. • Elsőrendű kémiai kötések: azok a kötések, amelyek kialakulása során a kapcsolódó atomok vegyértékhéjszerkezete megváltozik (ún. intramolekuláris kapcsolatok). • Másodrendű kötések: azok a kötések, amelyek gyenge elektrosztatikus kölcsönhatás révén az anyagi halmazok részecskéi (molekulák ill. ionok) között alakulnak ki (ún. intramolekuláris kapcsolatok). • Kötési energia: az adott típusú kémiai kötés felbontásához szükséges (vagy a kötés létrejöttekor felszabaduló) energia átlagos értéke, 1 mól anyagra viszonyítva.

Kötéstípusok Kötési energia k. J/mól Elsőrendű kémiai kötések: • Ionkötés 80 – 800 • Kovalens kötés –Tiszta –Datív –Fémes Másodrendű kötések: • Hidrogénkötés • van der Waals-féle kötés 8 – 40 0, 8 – 12

• Elektronegativitás (elektronvonzó képesség), EN: annak az erőnek a mértéke, amellyel egy atom a kémiai kötésben lévő elektronokat magához vonzani képes. • A Pauling-féle EN skála alappontjai: – a lítium EN-értéke 1, 0 – a fluor EN-értéke 4, 0 A többi atom EN-értékét ezekhez viszonyítva állapították meg.

Az EN-érték a periódusos rendszerben: • a periódusokon belül balról jobbra haladva nő • a csoportokon belül felülről lefelé csökken

Az EN-i értékek kiszámítási módjai: – Allred és Rochoev szerint: ahol Zeff az effektív magtöltés; r az atomsugár • Az effektív magtöltés az atommagnak egyetlen vegyértékelektronra gyakorolt hatása, figyelembe véve, hogy az atommag töltésének egy részét a többi elektron leköti. ahol Zeff az effektív magtöltés; r az atomsugár

– Mulliken szerint: ahol E 1 az atomok ionizációs energiája; Ea az atom elektronaffinitás.

Az EN és a kötéstípus: a kötés jellegét a kapcsolódó atomok EN-értékeinek különbsége (∆EN), ill. összege (∑EN) határozza meg. ionkötés: ∆EN nagy (>2), ∑EN közepes (3, 5 – 5, 5) kovalens kötés: ∆EN kicsi (<2), ∑EN nagy (>4) fémes kötés: ∆EN kicsi (<1), ∑EN kicsi (<3, 5)

KÖTÉSEK RÉSZLETEZÉSE: • Ionkötés: Ellentétes töltésű ionok között elektronátadással kialakuló elsőrendű kémiai kötés. Az ionokat a kristályrácsban Coulomb-féle elektrosztatikus vonzóerők kapcsolják össze.

Kovalens kötés: • Az atomok között egy vagy több közös elektronpárral kialakuló kötés. A kötést létesítő elektronpárok, a vegyértékhéjon leszakadó, de a kötésben részt nem vevő elektronpárok a nemkötő elektronpárok. (az elektronpárok jelölése az elektronképletben két pont, a szerkezeti képletben egy vonal)

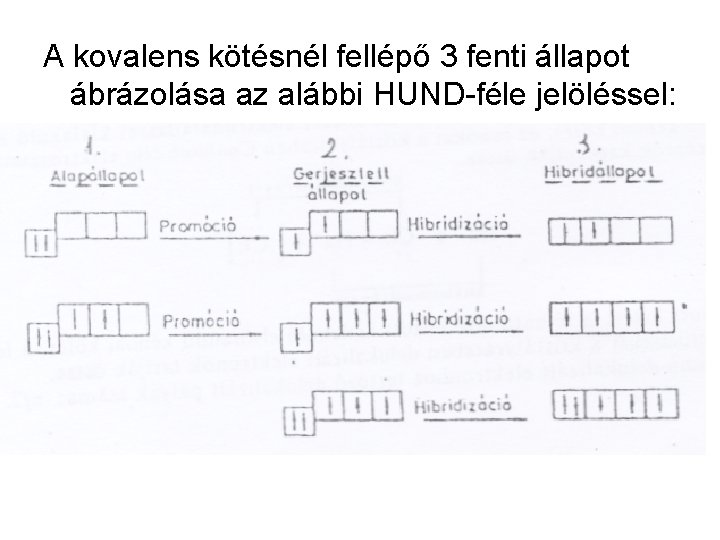
Az itt fellépő jelenségek: • Promóció: Az a folyamat, amely során a vegyértékhéjon lévő párosított elektronok energiaközlés hatására nagyobb energiájú atompályákra mennek át (kötés létrehozására képes párosítatlan elektronok alakulnak ki). • Hibridizáció: Az a folyamat, amely során a vegyértékhéj atompályái úgy kombinálódnak, hogy az atompályák energiaszintjei azonossá válnak (az atompályákon egyenletes elektroneloszlás jön létre) (ábrára hivatkozás) • Alapállapot: Az atom kiindulási (nem gerjesztett) elektron elhelyezkedési állapota.

A kovalens kötésnél fellépő 3 fenti állapot ábrázolása az alábbi HUND-féle jelöléssel:

A kötéskor molekulák ill. molekulapályák jönnek létre. Molekulapályák: Kettő vagy több atomhoz tartozó közös elektronok pályája, amelyek az atompályák átfedéséből alakulnak ki. A Paulielv molekulapályákra is érvényes (egy molekulapályán legfeljebb két, ellentétes töltésű elektron lehet).

A kovalens kötés szimmetriái 3 fajta kötési szimmetria ismert: a) szigma-( σ) kötés: a kötő elektronpár elektronsűrűsége a kötés tengelye mentén a legnagyobb. A σ- kötés s – s, s – px, px – px atompályák kapcsolódásával alakulhat ki.

b) pí- (π) kötés: a kötő elektronpár elektronsűrűsége a kötés tengelyére merőlegesen a legnagyobb. A π-kötés 2 py, ill. 2 pz atompálya kapcsolódásával alakulhatnak ki.

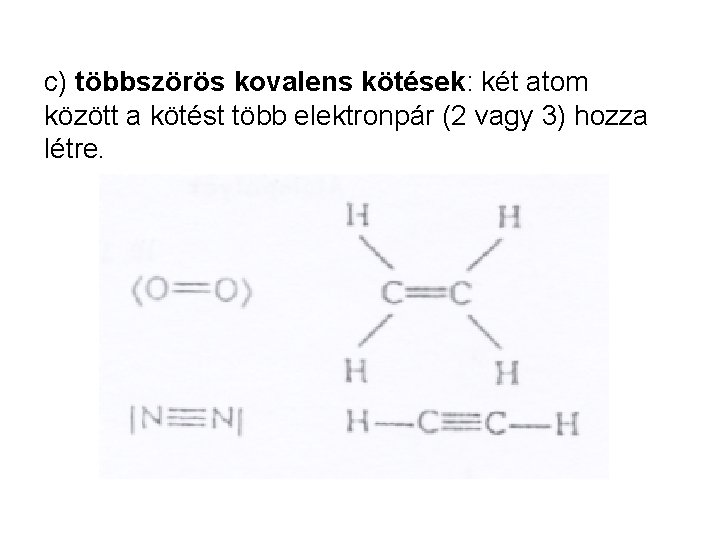
c) többszörös kovalens kötések: két atom között a kötést több elektronpár (2 vagy 3) hozza létre.

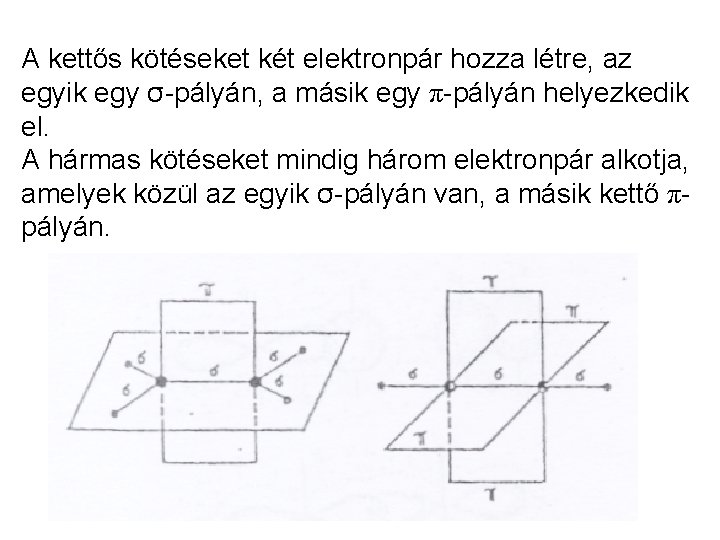
A kettős kötéseket két elektronpár hozza létre, az egyik egy σ-pályán, a másik egy π-pályán helyezkedik el. A hármas kötéseket mindig három elektronpár alkotja, amelyek közül az egyik σ-pályán van, a másik kettő πpályán.

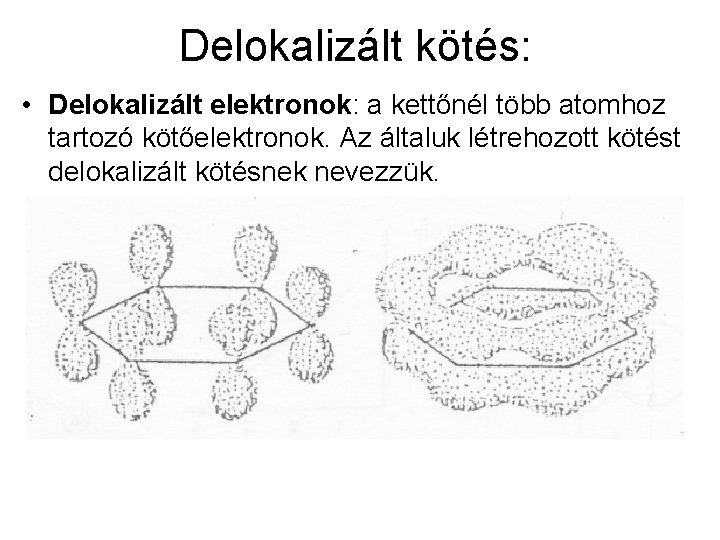
Delokalizált kötés: • Delokalizált elektronok: a kettőnél több atomhoz tartozó kötőelektronok. Az általuk létrehozott kötést delokalizált kötésnek nevezzük.

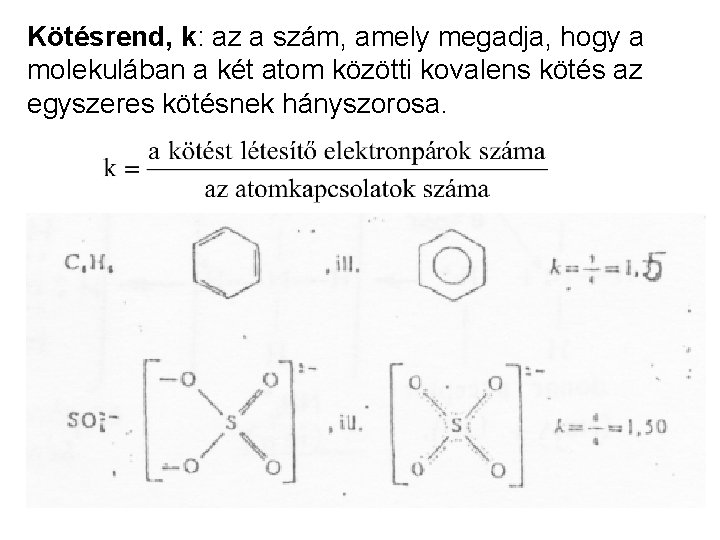
Kötésrend, k: az a szám, amely megadja, hogy a molekulában a két atom közötti kovalens kötés az egyszeres kötésnek hányszorosa.

Kötéssűrűség (kötésfelszakítási energia), E: 1 mól molekulában két adott atom közötti kötés felszakításához szükséges energia. A kovalens kötés erőssége a kötések számának növekedésével nő.

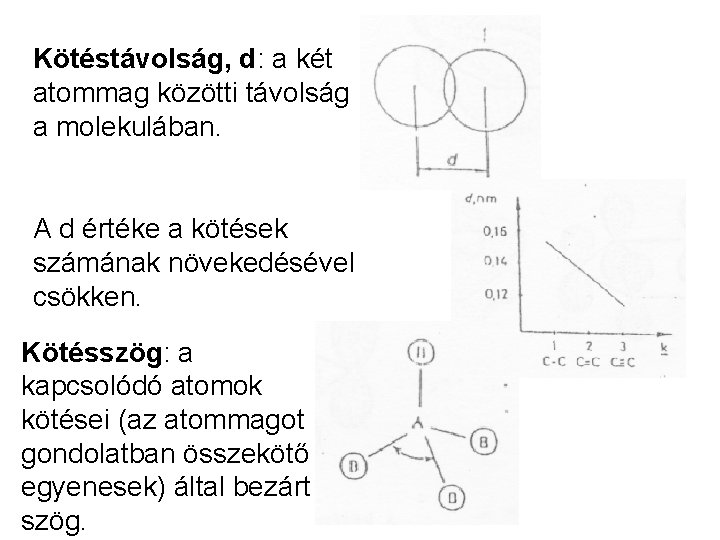
Kötéstávolság, d: a két atommag közötti távolság a molekulában. A d értéke a kötések számának növekedésével csökken. Kötésszög: a kapcsolódó atomok kötései (az atommagot gondolatban összekötő egyenesek) által bezárt szög.

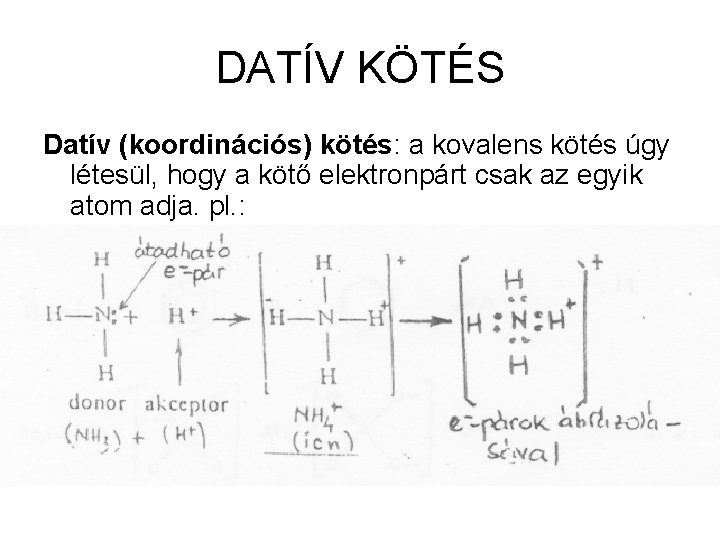
DATÍV KÖTÉS Datív (koordinációs) kötés: a kovalens kötés úgy létesül, hogy a kötő elektronpárt csak az egyik atom adja. pl. :

Datív kötés fajtái: • Molekula – Ion datív kötés (NH 4+) • Atom – Atom datív kötés (CO) • Molekula – Molekula (NH 3

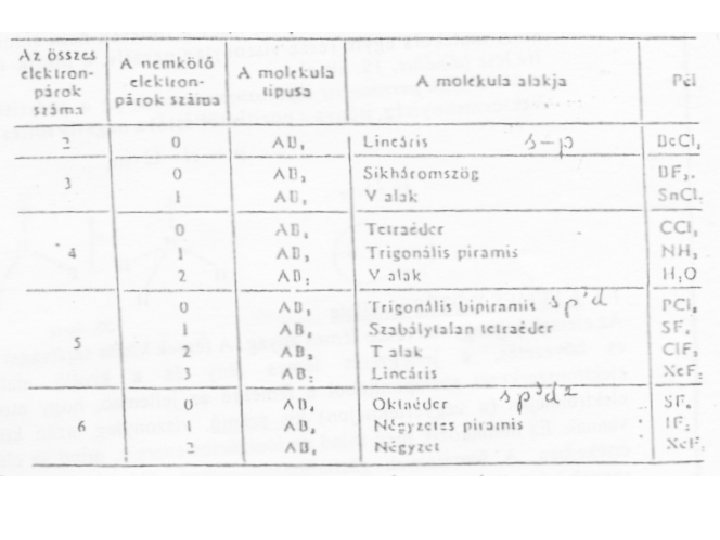
Kovalens molekulák térbeli felépítése • Molekulák alakja: a kapcsolódó atomok térbeli elrendeződése. A kovalens kötésű molekulák alakját döntően a központi atom kötő és nemkötő elektronpárjainak száma és ezek aránya határozza meg. • Központi atom: a kovalens kötésű molekulában a legtöbb kötő elektront tartalmazó atom, amelyhez a többi atom kapcsolódik. (A) • Lígand (oldallánc) (B): a kapcsolódó atomok


Kötésszögre ható, az alakot befolyásoló tényezők: • A nemkötő elektronpárok nagyobb térigénye a kötésszöget csökkenti; • A delokalizálódott nemkötő elektronpárok a kötésszöget nem változtatják meg; • A molekula alakját döntően a σ-kötések határozzák meg, a π-kötések a kötésszöget csak kismértékben módosítják; • Azonos téralkat esetén a kötésszög csökken, ha a központi atom EN-értéke csökken, vagy ha a kapcsolódó atomoké nő.

A kötés, ill. a molekula POLARITÁSA és DIPÓLMOMENTUMA Kovalens kötés polaritása: a kötés apoláris, ha a kötő elektronpár a kapcsolódó két atomhoz egyenlő mértékben tartozik (a töltéseloszlás szimmetrikus); ellenkező esetben a kötés poláris. A kötés polaritását a kapcsolódó atomok elektronegativitásának különbsége (∆EN) alapján ítéljük meg.

Ha ∆EN=0, akkor a kötés apoláris Ha ∆EN>0, akkor a kötés poláris (a gyakorlatban apolárisnak tekinthető a kovalens kötés akkor, ha ∆EN<0) A molekula polaritását a kötések polaritásának irány és nagyság szerinti összege határozza meg. Egy molekula akkor poláris, ha benne poláris kötések vannak, és a molekula téralakja olyan, hogy a töltések nem szimmetrikusan oszlanak el. A molekula egyik része viszonylag negatív, a másik része viszonylag pozitív lesz.

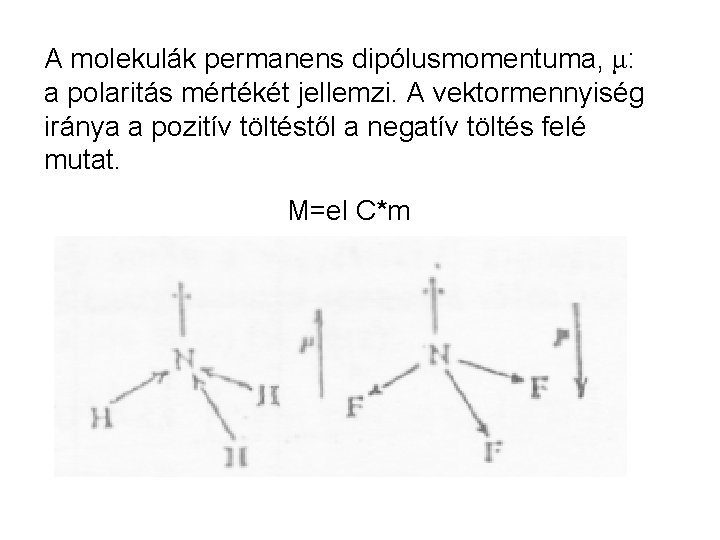
A molekulák permanens dipólusmomentuma, μ: a polaritás mértékét jellemzi. A vektormennyiség iránya a pozitív töltéstől a negatív töltés felé mutat. Μ=el C*m

A FÉMES KÖTÉS • Az elemek legnagyobb része fémes anyag. A fémek közös sajátságai a jó elektromos és hővezetés, és jellegzetes fémes fény és a kiváló alakíthatóság. Az elektronszerkezet szempontjából a fémekre jellemző, hogy atomjaik legkülső elektronhéján (vegyértékhéjon) kis számú, viszonylag lazán kötött elektronok vannak. Ez mutatkozik meg mind az ionizációs energia, mind az elektonegativitás értékeiben. A fématomok gázhalmazállapotban többnyire egyatomos formában vannak jelen. Szilárd állapotban (és folyadékokban) nincsenek különálló molekulák, sem szabad atomok, hanem a leglazábban kötött elektronok a fématomokról leszakadva valamennyi visszamaradt fémionhoz közösen tartoznak (tehát nem helyhez kötöttek). A fémben a részecskék közötti kapcsolatot az un. delokalizált (nem helyhez kötött) elektronrendszer teremti meg. Az ilyen kötést fémes kötésnek nevezzük. Szilárd állapotban a fémionok kristályrácsokba rendeződnek, és ez a fémrács.

MÁSODRENDŰ kötések • Hidrogénkötés (hidrogénhíd) a molekulában kötött H-atom hozza létre a kötést egy másik molekula nagy elekronegativitású atomjával (F, N, O), vagyis egy hidrogénatom létesít kötést két másik atom között. • (A kötés molekulán belül is kialakulhat, ekkor gyűrűképződés jön létre)

van der Waals-féle kötés: gyenge elektrosztatikus vonzóerőn alapuló és semleges atomok ill. molekulák között fellépő igen gyenge kötőerők.