KIMIA UNSUR 32 Ge Germanium 28 Ni Nikel

















- Slides: 34

KIMIA UNSUR 32 Ge Germanium 28 Ni Nikel 92 U Uranium 16 S Sulfur Oleh: Tia Nurdianty Ameylia XII MIPA 4

Periode Ketiga Alkali Tanah Gas Mulia Alkali Halogen Periode Keempat

Unsur Gas Mulia Sangat stabil, karena memenuhi kaidah oktet atau duplet Keberadaan di alam: - Berbentuk monoatomik - Sumber utama: udara, kecuali radon(di kerak bumi) - Gas mulia terbanyak di atmosfer: Argon - Ne, Ar, Kr, Xe diperoleh dari hasil penyulingan bertingkat udara cair - He dari hasil pengolahan gas alam

Sifat Fisis Dari He Rn Gaya London Mr makin besar, gaya London semakin kuat Titik Didih Makin besar Titik Leleh Makin besar Kerapatan Makin besar Sifat Atomik Dari He Rn Jari-jari Atom Makin besar Energi Ionisasi Makin kecil Afinitas Elektron Cenderung rendah Keelektronegatifan He, Ne, Ar = 0 Kr Rn, makin kecil Sifat-sifat Gas Mulia Sifat Kimia Dari He Rn kereaktifan Cenderung tak reaktif Kr Rn makin reaktif Rn = Zat radioaktif Kr, Xe, Rn membentuk ikatan dengan usur yang elektronegatif

K E G U N A A N Helium • Pengisi bola lanpu pijar • Pelarut gas selam Neon • Cairan pendingin • Pengisi lampu reklame Argon • Pengisi bohlam • Membentuk atmosfer inert Kripton • Merawat retina • Standar ukuran 1 meter Xenon • Penghasi cahaya pada blitz • Zat zanestesi Radon • Terapi kanker


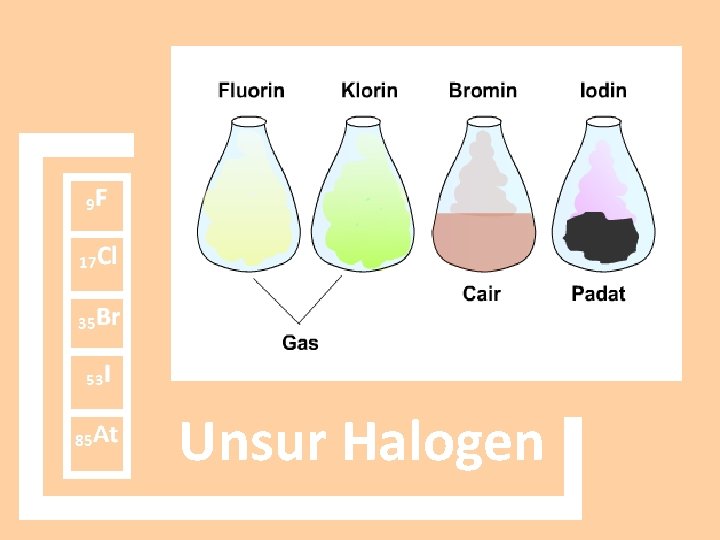
Unsur Keberadaan di Alam Fluorin Flouspar(Ca. F 2), Kriolit(Na 3 Al. F 6) Klorida Na. Cl, KCl, Mg. Cl 2 dalam air laut Bromin Air laut dan air mineral Iodin Senyawa iodat(Na. IO 3) Astatin Kerak bumi Unsur Halogen

Sifat Fisik Dari F At Gaya London Mr makin besar, gaya London makin besar Titik didih X 2 Makin besar Titik didih HX HF>HI>HBr>HCl Sifat Halogen Sifat Atomik Dari F At Jari-jari atom Makin besar Energi ionisasi Makin kecil Titik leleh Makin besar Afinitas elektron Makin kecil Kerapatan Makin besar keelektronegatifan Makin kecil Wujud dalam F 2 = gas kuning muda suhu ruang Cl 2 = gas hijau muda Br 2 = cairan coklat I 2 = padat kehitaman At = padatan radioaktif Kelarutan Sukar larut dalam air, mudah larut dalam pelarut nonpolar Sifat Kimia Dari F At Kerektifan Makin berkurang Kekuatan ooksidator F 2>CL 2>Br 2>I 2 Keasaman (p. H) HF<HCl<HBr<HI

Reaksi-reaksi Halogen Reaksi Halogen dan Logam Dapat membentuk garam dan reaksinya sangat hebat Ex: Fe + Cl 2 Fe. Cl 2 Reaksi Halogen dengan Halogen Unsur di atas dapat mendesak unsur di bawahnya Ex: F 2 + KCl KF + Cl 2 Reaksi Halogen dengan Basa Reaksi Halogen dengan Air Halogen akan mengalami reaksi autoredoks di dalam basa autoredoks di dalam air (kecuali F) F) Ex: Cl 2 + KOH KCl. O 3 + 5 KCl + Ex: Cl 2 + H 2 O 5 KCl + 3 H 2 O

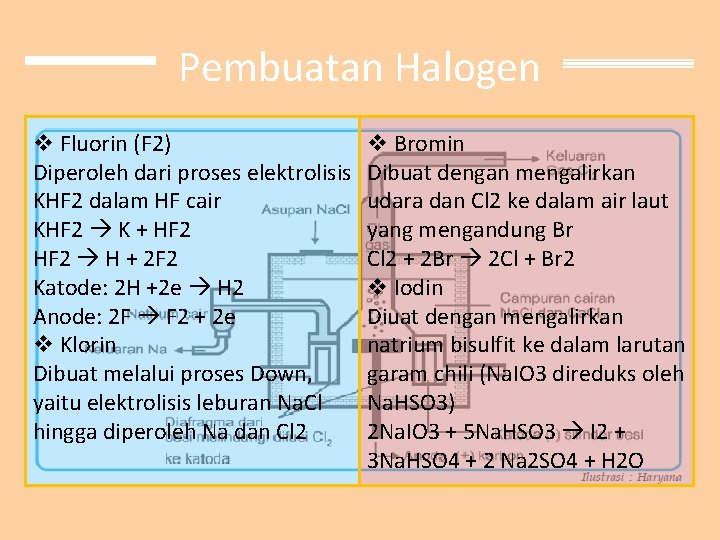
Pembuatan Halogen v Fluorin (F 2) Diperoleh dari proses elektrolisis KHF 2 dalam HF cair KHF 2 K + HF 2 H + 2 F 2 Katode: 2 H +2 e H 2 Anode: 2 F F 2 + 2 e v Klorin Dibuat melalui proses Down, yaitu elektrolisis leburan Na. Cl hingga diperoleh Na dan Cl 2 v Bromin Dibuat dengan mengalirkan udara dan Cl 2 ke dalam air laut yang mengandung Br Cl 2 + 2 Br 2 Cl + Br 2 v Iodin Diuat dengan mengalirkan natrium bisulfit ke dalam larutan garam chili (Na. IO 3 direduks oleh Na. HSO 3) 2 Na. IO 3 + 5 Na. HSO 3 I 2 + 3 Na. HSO 4 + 2 Na 2 SO 4 + H 2 O

K E G U N A A N Senyawa Fluorin Kegunaan HF Mengukir kaca Freon(CCl 2 F 2) Pendingin kulkas dan AC Kriolit Pelarut bauksit dalam pengolahan aluminium Na. F Pengawet kayu Teflon Anti lengket Senyawa Fluorida Mencegah kerusakan gigi Senyawa Iodin Kegunaan Iodioform(CHI 2) Antiseptik luka Na. IO 3, KIO 3 Pencegah gondok KI Obat antijamur

Senyawa Klorin Kegunaan NH 4 Cl Elektrolit, pengisi batu baterai KCl. O 3 Pembuat mesiu, korek api KCl Pupuk Kaporit Pembunuh bakteri Na. Cl. O pemutih Senyawa Bromin Kegunaan C 2 H 4 Br 2 Zat aditif bensin Na. Br Penenang saraf Ag. Br Film fotografi CH 3 Br Pemadam kebakaran K E G U N A A N

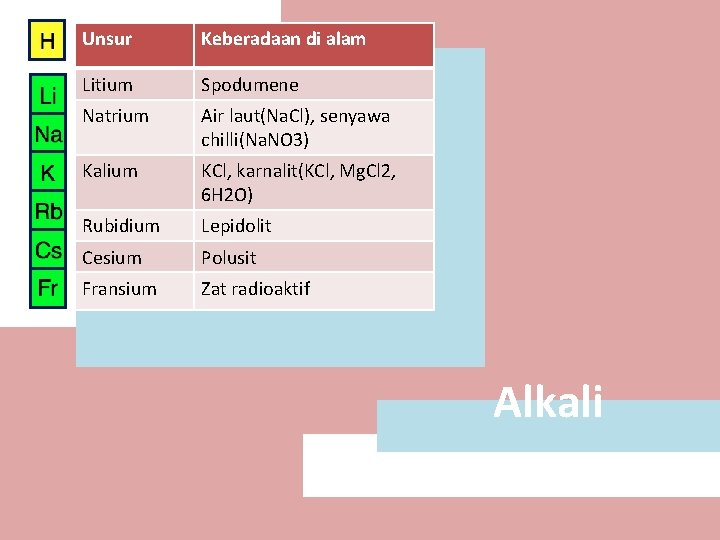
Unsur Keberadaan di alam Litium Spodumene Natrium Air laut(Na. Cl), senyawa chilli(Na. NO 3) Kalium KCl, karnalit(KCl, Mg. Cl 2, 6 H 2 O) Rubidium Lepidolit Cesium Polusit Fransium Zat radioaktif Alkali

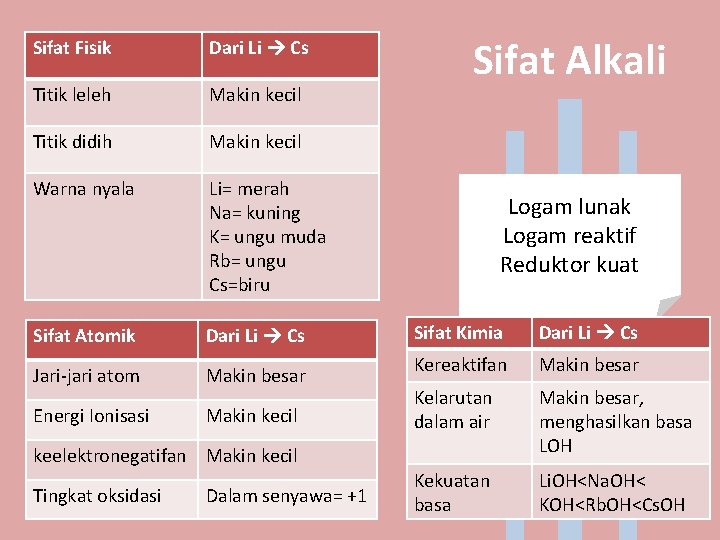
Sifat Fisik Dari Li Cs Titik leleh Makin kecil Titik didih Makin kecil Warna nyala Li= merah Na= kuning K= ungu muda Rb= ungu Cs=biru Sifat Atomik Dari Li Cs Jari-jari atom Makin besar Energi Ionisasi Makin kecil Sifat Alkali Logam lunak Logam reaktif Reduktor kuat Sifat Kimia Dari Li Cs Kereaktifan Makin besar Kelarutan dalam air Makin besar, menghasilkan basa LOH Kekuatan basa Li. OH<Na. OH< KOH<Rb. OH<Cs. OH keelektronegatifan Makin kecil Tingkat oksidasi Dalam senyawa= +1

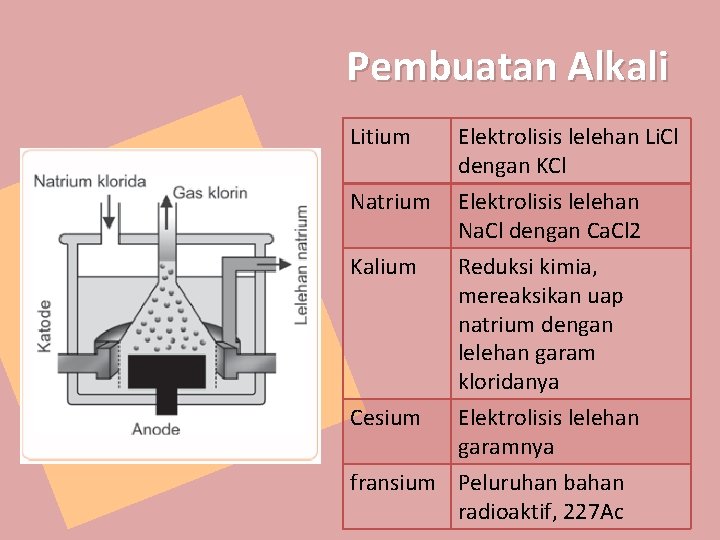
Pembuatan Alkali Litium Natrium Kalium Cesium Elektrolisis lelehan Li. Cl dengan KCl Elektrolisis lelehan Na. Cl dengan Ca. Cl 2 Reduksi kimia, mereaksikan uap natrium dengan lelehan garam kloridanya Elektrolisis lelehan garamnya fransium Peluruhan bahan radioaktif, 227 Ac

KEGUNAAN ALKALI Li Baterai, alat pacu jantung, pembuat komponen pesawat Na Pendingin reaktor, lmpu penerangan jalan, Na. OH sebagai deterjen, Na 2 CO 3 untuk pembuatan kaca, Na. HCO 3 sebagai soda kue K KO 2 untuk masker gas, KOH untuk sabun Rb Cs Fiamen sel fotolistrik Katode pada lampu elektronik

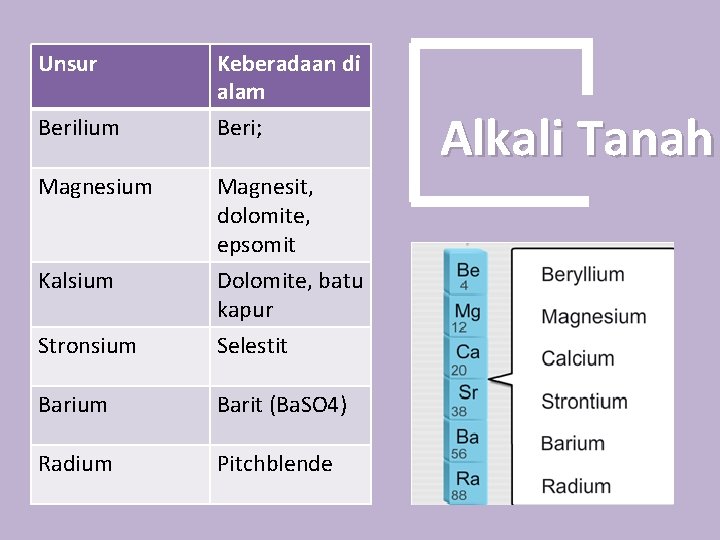
Unsur Berilium Magnesium Keberadaan di alam Beri; Stronsium Magnesit, dolomite, epsomit Dolomite, batu kapur Selestit Barium Barit (Ba. SO 4) Radium Pitchblende Kalsium Alkali Tanah

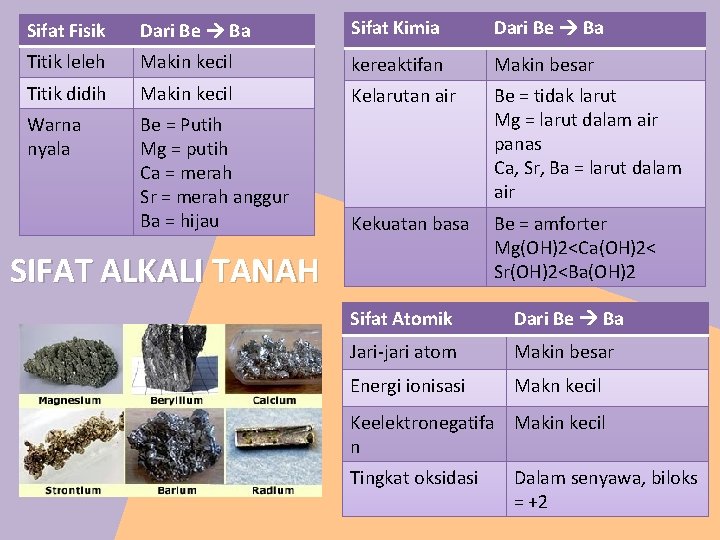
Sifat Fisik Dari Be Ba Sifat Kimia Dari Be Ba Titik leleh Makin kecil kereaktifan Makin besar Titik didih Makin kecil Kelarutan air Warna nyala Be = Putih Mg = putih Ca = merah Sr = merah anggur Ba = hijau Be = tidak larut Mg = larut dalam air panas Ca, Sr, Ba = larut dalam air Kekuatan basa Be = amforter Mg(OH)2<Ca(OH)2< Sr(OH)2<Ba(OH)2 SIFAT ALKALI TANAH Sifat Atomik Dari Be Ba Jari-jari atom Makin besar Energi ionisasi Makn kecil Keelektronegatifa Makin kecil n Tingkat oksidasi Dalam senyawa, biloks = +2

PEMBUATAN ALKALI TANAH Berilium Reduksi Be. Cl 2 dengan logam Ca atau Mg Magnesium Elektrolisis lelehan Mg. Cl 2 yang diampur dengan Ca. Cl 2 dan Na. Cl Kalsium Elektrolisis lelehan Ca. Cl 2 dan reduksi Ca. O oleh alumunium dalam keadaan vakum Stronsium Reduksi oksida oleh alumunium Barium Reduksi oksida oleh alumunium

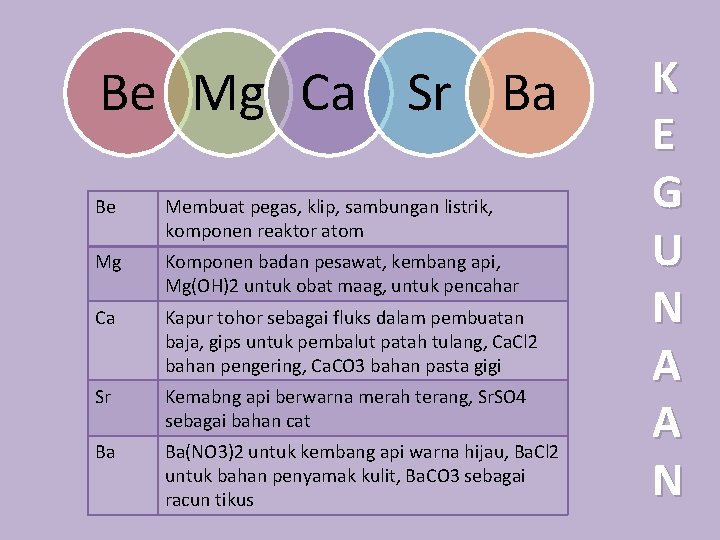
Be Mg Ca Sr Ba Be Membuat pegas, klip, sambungan listrik, komponen reaktor atom Mg Komponen badan pesawat, kembang api, Mg(OH)2 untuk obat maag, untuk pencahar Ca Kapur tohor sebagai fluks dalam pembuatan baja, gips untuk pembalut patah tulang, Ca. Cl 2 bahan pengering, Ca. CO 3 bahan pasta gigi Sr Kemabng api berwarna merah terang, Sr. SO 4 sebagai bahan cat Ba Ba(NO 3)2 untuk kembang api warna hijau, Ba. Cl 2 untuk bahan penyamak kulit, Ba. CO 3 sebagai racun tikus K E G U N A A N

Unsur Periode Ketiga


Na Mg Al Si Sifat Fisis: § Kerapatan bertambah dari Na ke Al, laluberkurang dari Al ke Ar § Kekerasan bertambah dari Na ke Si § Titik didih bertambah dari Na ke Si, lalu berkurang dari Si ke Ar § Titik leleh bertambah dari Na ke Si, lalu berkurang dari Si ke Ar P S Cl Ar Sifat Atomik dan Kimia: § Jari-jari atom dari Na ke Ar semakin kecil § Energi ionisasi semakin besar dari Na ke Ar § Semakin ke kanan semakin mudah mengalami reduksi § Semakin ke kanan asam oksi semakin kuat § Semakin ke kanan sifat basa semakin lemah

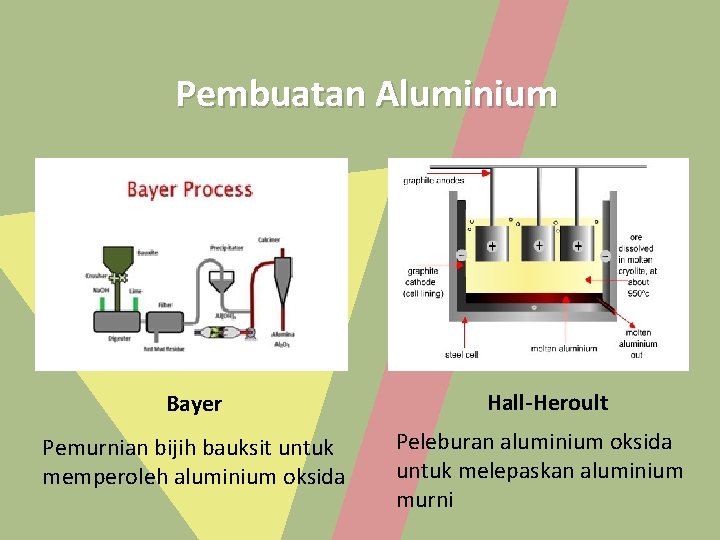
Pembuatan Aluminium Bayer Pemurnian bijih bauksit untuk memperoleh aluminium oksida Hall-Heroult Peleburan aluminium oksida untuk melepaskan aluminium murni

Pembuatan Fosfor Pembuatan Silikon Reduksi silika dengan logam Mg Reaksi: Si. O 2 + 2 Mg Si +2 Mg. O Reduksi Ca 3(PO 4)2 dengan reduktor C dan pasir silikon (Proses Wahler) Reaksi: Ca 3(PO 4)2 + 6 Si. O 2 + 10 C 6 Ca. SIO 3 + !0 CO + P 4 Fosfor yang diperoleh didistilasi dan dikondensasi sehingga terbentuk P 4 (harus disimpan dalam air)

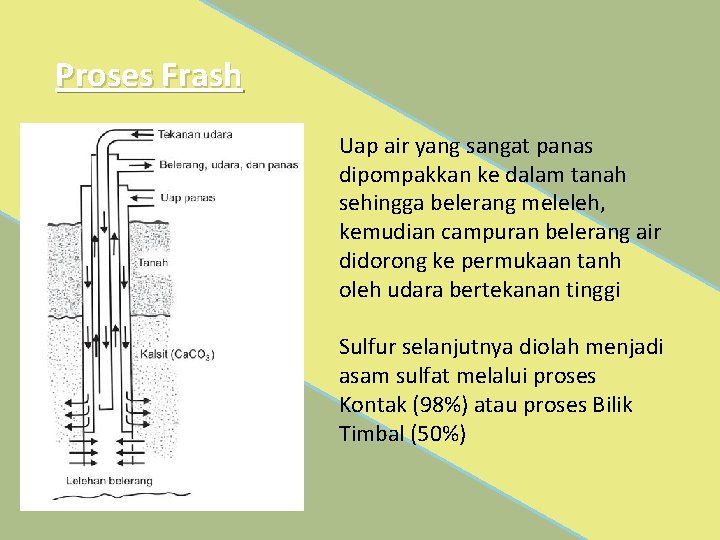
Proses Frash Uap air yang sangat panas dipompakkan ke dalam tanah sehingga belerang meleleh, kemudian campuran belerang air didorong ke permukaan tanh oleh udara bertekanan tinggi Sulfur selanjutnya diolah menjadi asam sulfat melalui proses Kontak (98%) atau proses Bilik Timbal (50%)

K E G U N A A N Al • Alat rumah tangga (ringan &tahan korosi) • Pembungkus makanan (Aluminium foil) • Kabel pada tiang listrik Si • Bahan pembuat transistor, komputer, kalkulator, sel surya • Menghilangkan kelembaban pada obat-obatan, kamera P • Asam fosfat untuk fosfor putih • Bidang gesek korek api (fosfor merah dicampur Sb 2 S 3) • Bahan baku pupuk fosfat S • Pembuatan asam sulfat • Fungisida, insektisida, dan pengawet makanan • Bahan pencucian film

Unsur Periode Keempat (Transisi)

Sifat Fisis Sifat Magnetik Sifat Kimia Daya hantar listrik dan panas yang baik Paramagnetik dapat ditarik magnet ex: Sc Memiliki beberapa bilangn oksidasi, kecuali Zn dan Ni Keras Titik didih dan titik leleh tinggi Mempunyai warna yang khas jika subkulit d terisii sebagian Ferromagnetik ditarik kuat oleh magnet ex: Fe, Co, Ni Diamagnetik tidak ditarik magnet ex: Zn Logam transisi dapat dijadikan katalis Dapat membentuk senyawa kompleks Mempunyai kisi kristal Sifat

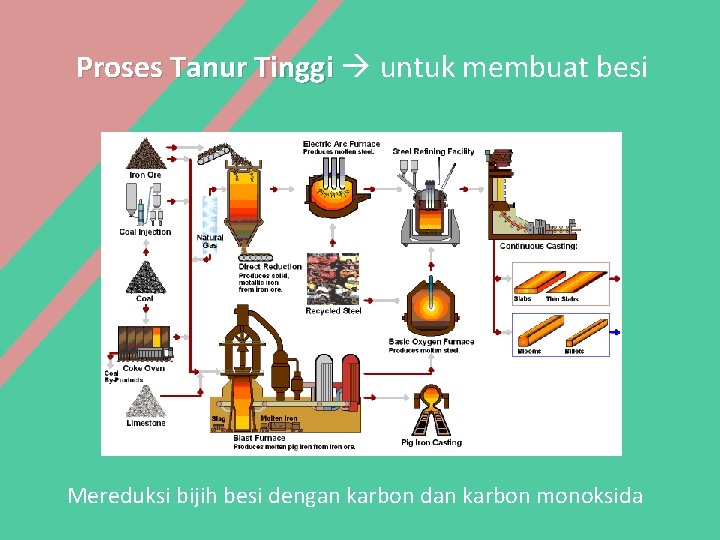
Proses Tanur Tinggi untuk membuat besi Mereduksi bijih besi dengan karbon dan karbon monoksida

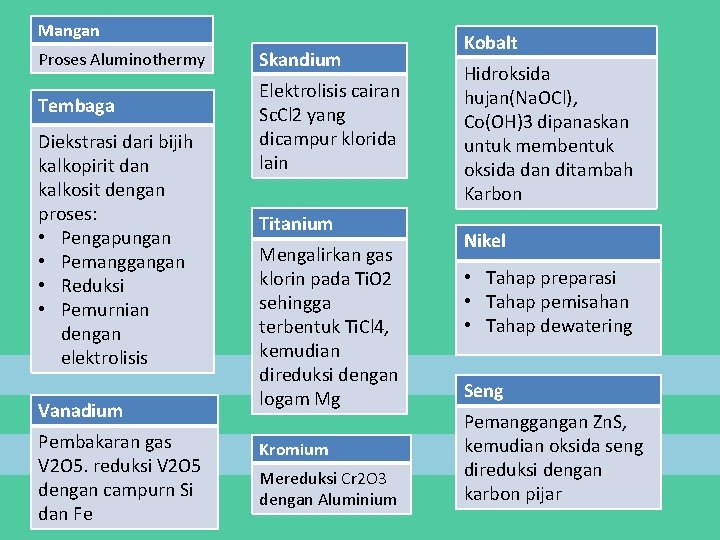
Mangan Proses Aluminothermy Tembaga Diekstrasi dari bijih kalkopirit dan kalkosit dengan proses: • Pengapungan • Pemanggangan • Reduksi • Pemurnian dengan elektrolisis Vanadium Pembakaran gas V 2 O 5. reduksi V 2 O 5 dengan campurn Si dan Fe Skandium Elektrolisis cairan Sc. Cl 2 yang dicampur klorida lain Titanium Mengalirkan gas klorin pada Ti. O 2 sehingga terbentuk Ti. Cl 4, kemudian direduksi dengan logam Mg Kromium Mereduksi Cr 2 O 3 dengan Aluminium Kobalt Hidroksida hujan(Na. OCl), Co(OH)3 dipanaskan untuk membentuk oksida dan ditambah Karbon Nikel • Tahap preparasi • Tahap pemisahan • Tahap dewatering Seng Pemanggangan Zn. S, kemudian oksida seng direduksi dengan karbon pijar

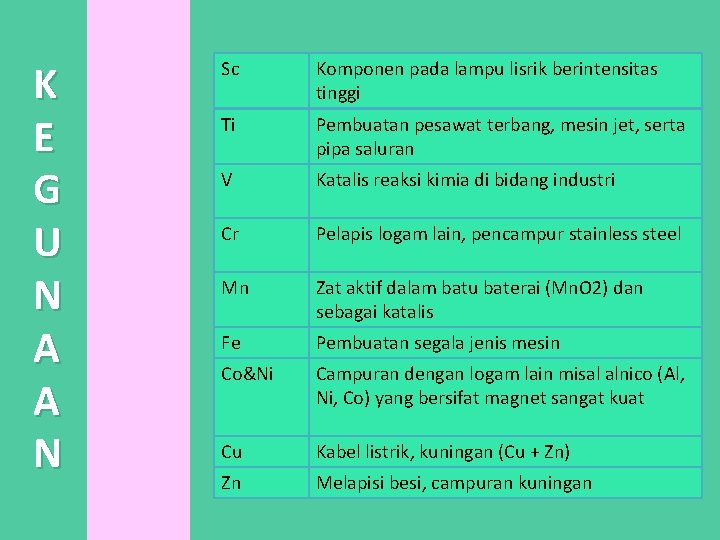
K E G U N A A N Sc Komponen pada lampu lisrik berintensitas tinggi Ti Pembuatan pesawat terbang, mesin jet, serta pipa saluran V Katalis reaksi kimia di bidang industri Cr Pelapis logam lain, pencampur stainless steel Mn Zat aktif dalam batu baterai (Mn. O 2) dan sebagai katalis Fe Pembuatan segala jenis mesin Co&Ni Campuran dengan logam lain misal alnico (Al, Ni, Co) yang bersifat magnet sangat kuat Cu Kabel listrik, kuningan (Cu + Zn) Zn Melapisi besi, campuran kuningan


 Mıknatıs demir tozlarına hangi mesafede etki etmiştir
Mıknatıs demir tozlarına hangi mesafede etki etmiştir Unsur kimia kayu
Unsur kimia kayu Bab 3 kimia unsur
Bab 3 kimia unsur Unsur unsur prosa fiksi
Unsur unsur prosa fiksi Ciri ciri finance lease
Ciri ciri finance lease Order atau perintah muncul sebagai hasil perkembangan...
Order atau perintah muncul sebagai hasil perkembangan... Apakah itu
Apakah itu Unsur unsur msdm
Unsur unsur msdm Mengapa susunan unsur unsur diberi sisipan kata periodik
Mengapa susunan unsur unsur diberi sisipan kata periodik 5 m dalam manajemen
5 m dalam manajemen Unsur unsur trapesium
Unsur unsur trapesium Asal mula terbentuknya bangsa
Asal mula terbentuknya bangsa Unsur negara secara klasik
Unsur negara secara klasik Luas selimut kerucut = 2 ∏ r t
Luas selimut kerucut = 2 ∏ r t Komponen utama sig
Komponen utama sig Angka kredit anggota pgri
Angka kredit anggota pgri Cpotb adalah
Cpotb adalah Unsur-unsur temuan kekurangan
Unsur-unsur temuan kekurangan Tangga nada lagu apuse
Tangga nada lagu apuse Kudu kung tegese
Kudu kung tegese Ruu kamnas
Ruu kamnas Unsur unsur karangan ilmiah
Unsur unsur karangan ilmiah Proposal festival band
Proposal festival band Isobar
Isobar Unsur unsur koperasi
Unsur unsur koperasi Unsur-unsur penunjang kesehatan rohani di tempat kerja
Unsur-unsur penunjang kesehatan rohani di tempat kerja Pengertian lingkaran
Pengertian lingkaran Unsur unsur penilaian kinerja
Unsur unsur penilaian kinerja Unsur unsur akor
Unsur unsur akor Unsur unsur prisma segilima
Unsur unsur prisma segilima Parameter identitas nasional
Parameter identitas nasional Unsur pembantu pimpinan muhammadiyah
Unsur pembantu pimpinan muhammadiyah Apakah yang dimaksud pancagatra
Apakah yang dimaksud pancagatra Pengertian sistem dalam akuntansi
Pengertian sistem dalam akuntansi Rusuk balok
Rusuk balok