Introduccin a la Qumica Orgnica Lic Ral Hernndez















- Slides: 43

Introducción a la Química Orgánica Lic. Raúl Hernández Mazariegos

2 Berzelius (1807) Compuestos Inorgánicos Orgánicos Sintetizados por los seres vivos Tienen “Fuerza Vital”

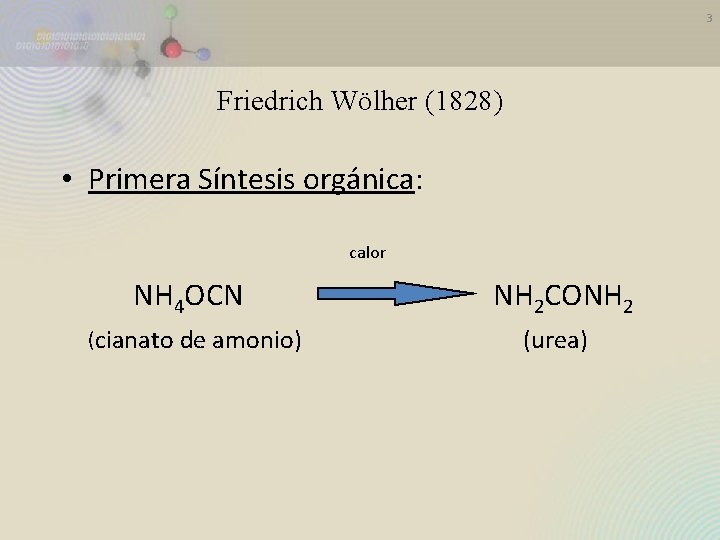
3 Friedrich Wölher (1828) • Primera Síntesis orgánica: calor NH 4 OCN (cianato de amonio) NH 2 CONH 2 (urea)

4 August Kekulé (1861) • QUÍMICA ORGÁNICA: – La Química de los “Compuestos del Carbono”.

5 Química orgánica en la actualidad: • La Química de los “Compuestos del Carbono”. • También tienen hidrógeno. • Se exceptúan CO, CO 2, carbonatos, bicarbonatos, cianuros. . . • Pueden tener otros elementos: O, N, S, P, halógenos. . .

6 Actualidad: • Número de compuestos: – Inorgánicos: – Orgánicos: unos 100. 000 unos 7. 000 (plásticos, insecticidas, jabones, medicamentos, gasolinas, fibras textiles. . . )

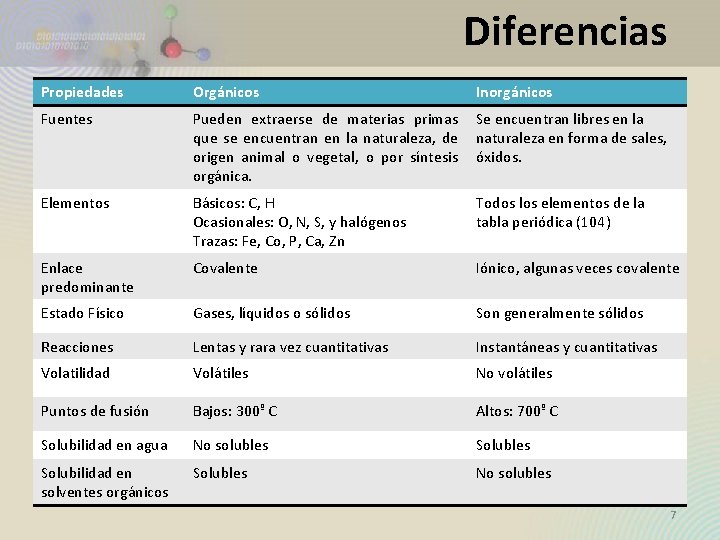
Diferencias Propiedades Orgánicos Inorgánicos Fuentes Pueden extraerse de materias primas Se encuentran libres en la que se encuentran en la naturaleza, de naturaleza en forma de sales, origen animal o vegetal, o por síntesis óxidos. orgánica. Elementos Básicos: C, H Ocasionales: O, N, S, y halógenos Trazas: Fe, Co, P, Ca, Zn Todos los elementos de la tabla periódica (104) Enlace predominante Covalente Iónico, algunas veces covalente Estado Físico Gases, líquidos o sólidos Son generalmente sólidos Reacciones Lentas y rara vez cuantitativas Instantáneas y cuantitativas Volatilidad Volátiles No volátiles Puntos de fusión Bajos: 300º C Altos: 700º C Solubilidad en agua No solubles Solubilidad en solventes orgánicos Solubles No solubles 7

La posición del carbono en la Tabla Periódica do rio Pe o p u Gr 8

Características del Carbono • Electronegatividad intermedia – Enlaza fácilmente tanto con metales como con no metales • Posibilidad de unirse a sí mismo formando cadenas. • Enlaces muy fuertes, se desprenden 830 k. J/mol al formar 2 enlaces C–H • Tamaño pequeño, por lo que es posible que los átomos se aproximen lo suficiente para formar enlaces dobles y triples (esto no es posible en el Silicio). 9

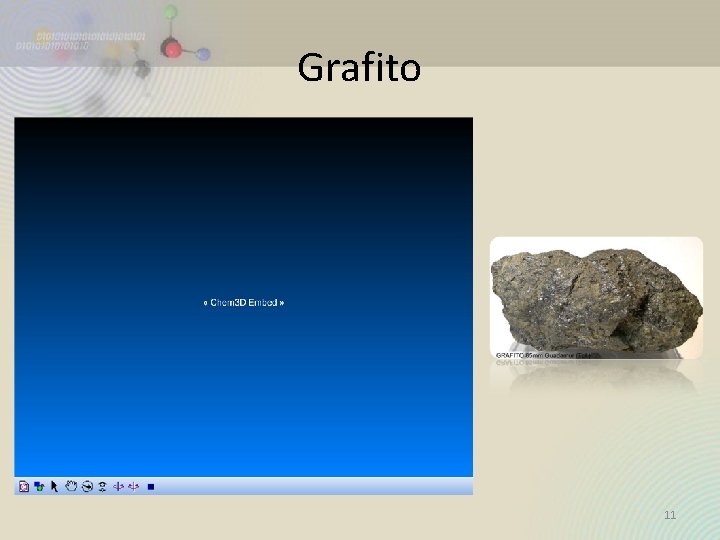
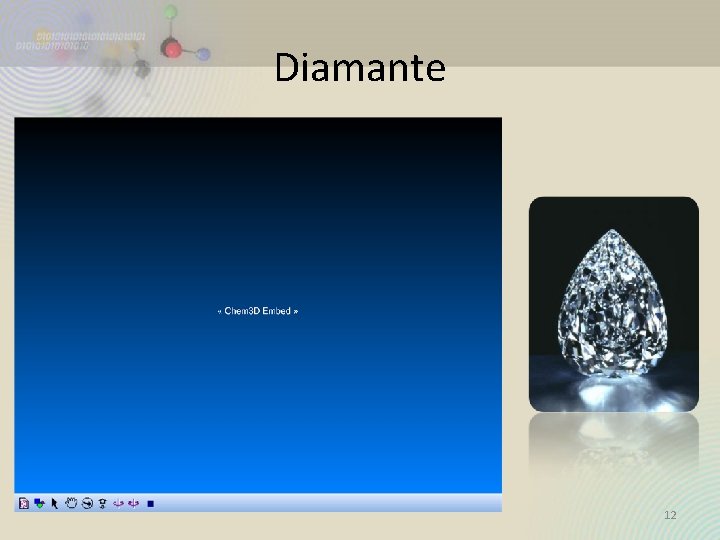
Alótropos del Carbono • Las distintas formas del mismo elemento que difieren en el enlazamiento se llaman alótropos, o formas alotrópicas • El diamante, grafito y el carbono amorfo son alótropos. • Los alótropos difieren en propiedades físicas y químicas. 10

Grafito 11

Diamante 12

Cabono Amorfo 13

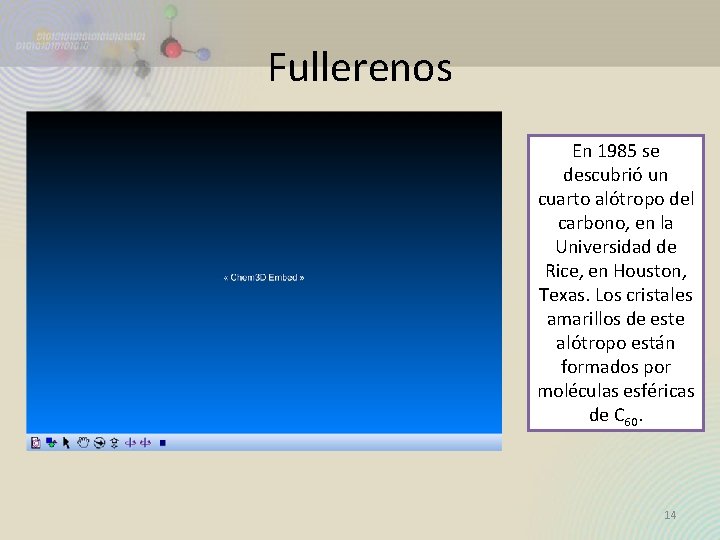
Fullerenos En 1985 se descubrió un cuarto alótropo del carbono, en la Universidad de Rice, en Houston, Texas. Los cristales amarillos de este alótropo están formados por moléculas esféricas de C 60. 14

• Actualmente, el tema de los fullerenos es uno de los más investigados porque tienen muchas propiedades interesantes y potencialmente útiles. • Por ejemplo, un compuesto soluble en agua preparado a partir de las esferas bucky tiene actividad antiviral y ha demostrado tener actividad in -vitro contra VIH. Sin embargo, las esferas bucky aún son muy costosas; su precio era de 945 dólares por gramo en 1997. 15

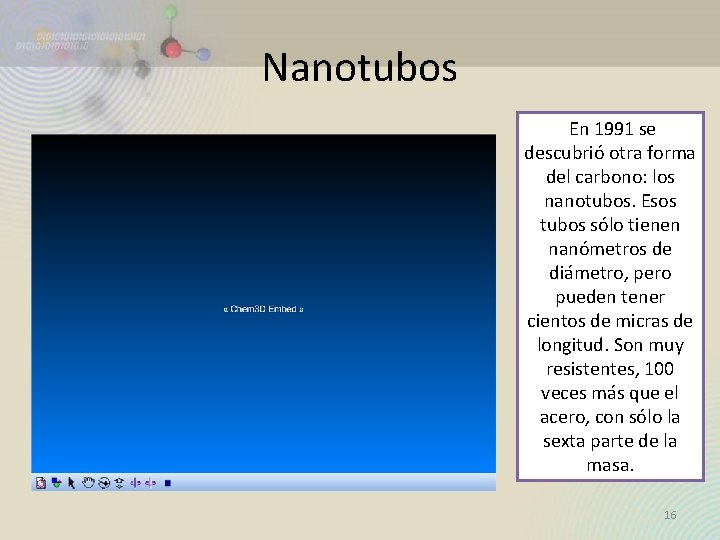
Nanotubos En 1991 se descubrió otra forma del carbono: los nanotubos. Esos tubos sólo tienen nanómetros de diámetro, pero pueden tener cientos de micras de longitud. Son muy resistentes, 100 veces más que el acero, con sólo la sexta parte de la masa. 16

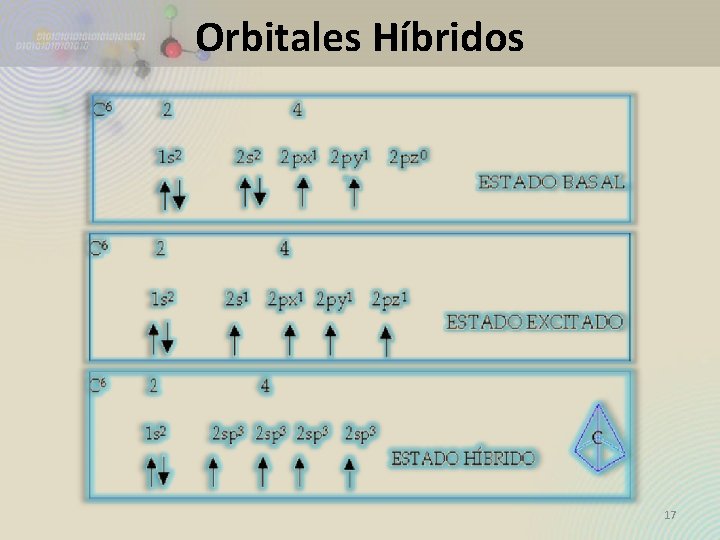
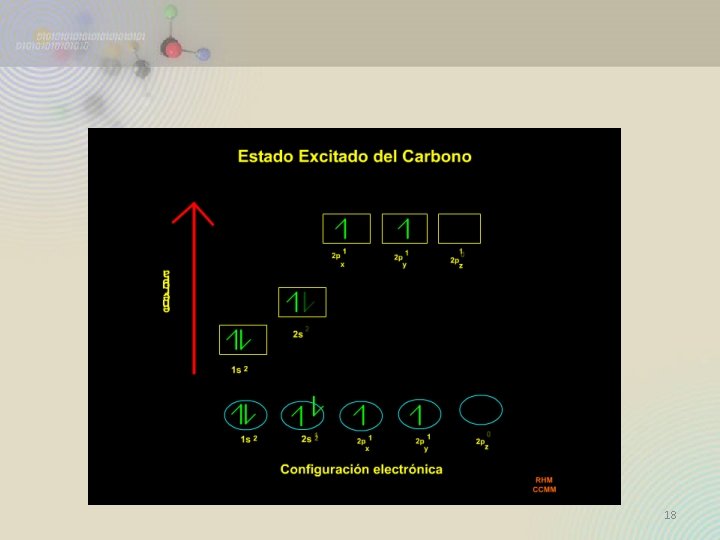
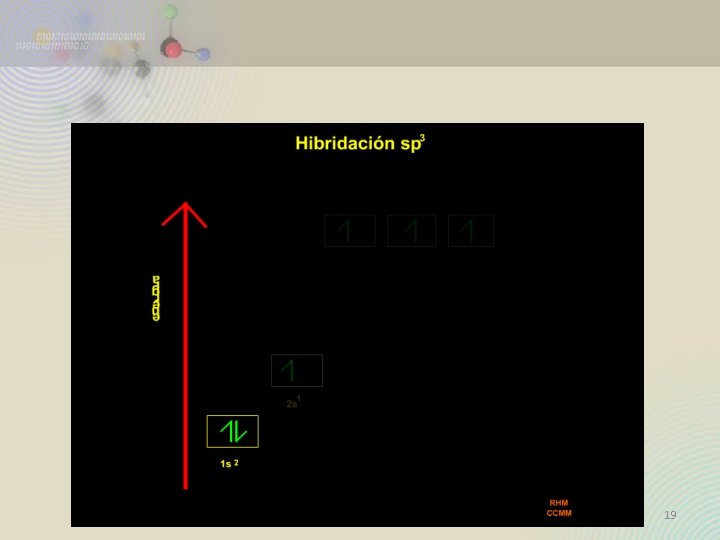
Orbitales Híbridos 17

18

19

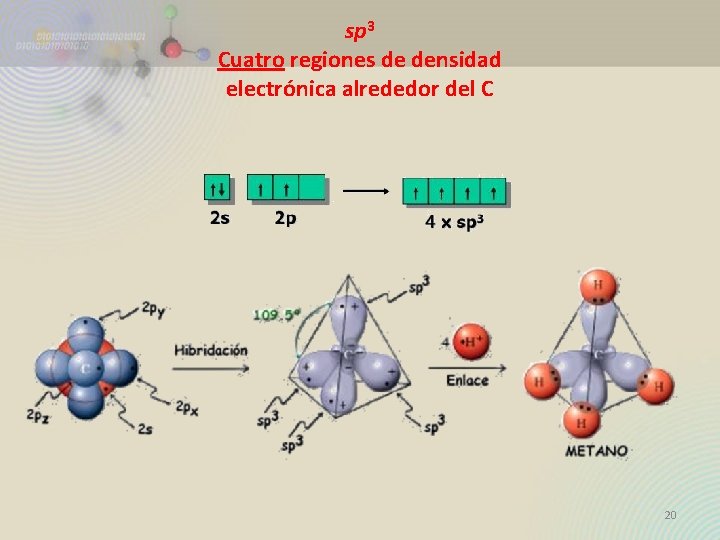
sp 3 Cuatro regiones de densidad electrónica alrededor del C 20

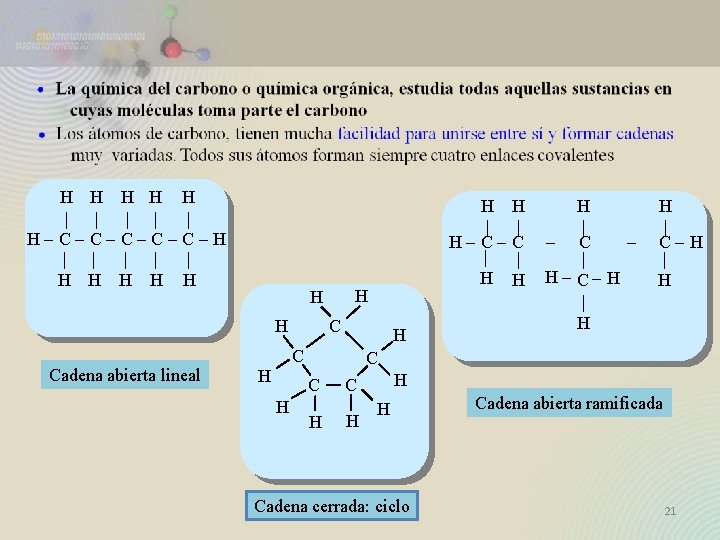
H H H | | | H-C-C-C-H | | | H H H H Cadena abierta lineal H C H H | - C | H - C- H | H H | C-H | H C C H H H | | H-C-C | | H H Cadena cerrada: ciclo Cadena abierta ramificada 21

22

23

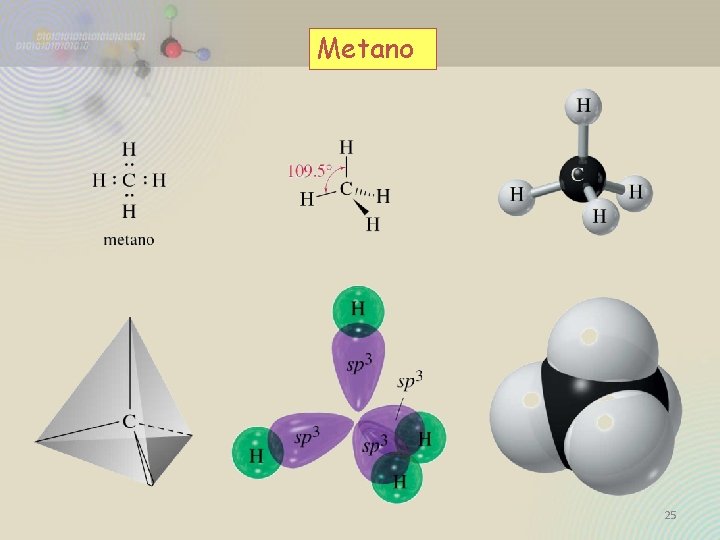
La tetravalencia del carbono se debe a que posee 4 electrones en su última capa, de modo que formando 4 enlaces covalentes con otros átomos consigue completar su octeto Metano Eteno CH 4 CH 2 = CH 2 Etino CH 24

Metano 25

26

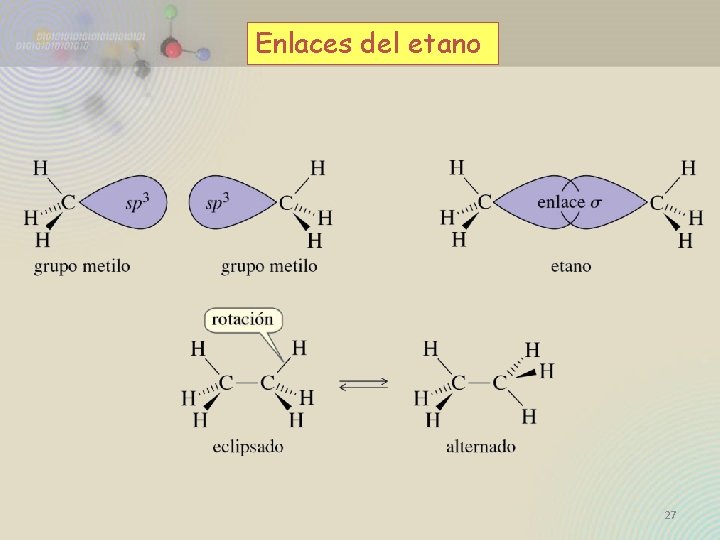
Enlaces del etano 27

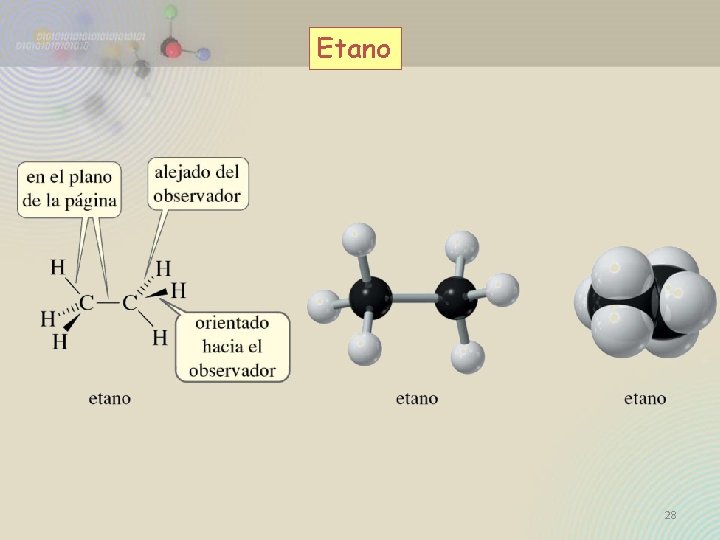
Etano 28

29

CONCEPTO DE GRUPO FUNCIONAL Un grupo funcional es un átomo o grupo de átomos presente en una molécula orgánica que determina las propiedades químicas de dicha molécula El grupo funcional es el principal responsable de la reactividad química del compuesto, por eso todos los compuestos que poseen un mismo grupo funcional, muestran las mismas propiedades H H | | H-C-C-H | | H H etanol H H | | H - C - OH | | H H 30

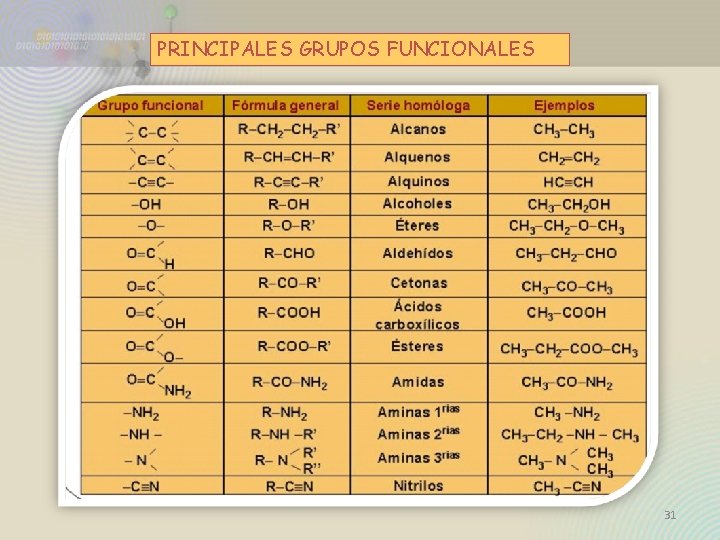
PRINCIPALES GRUPOS FUNCIONALES 31

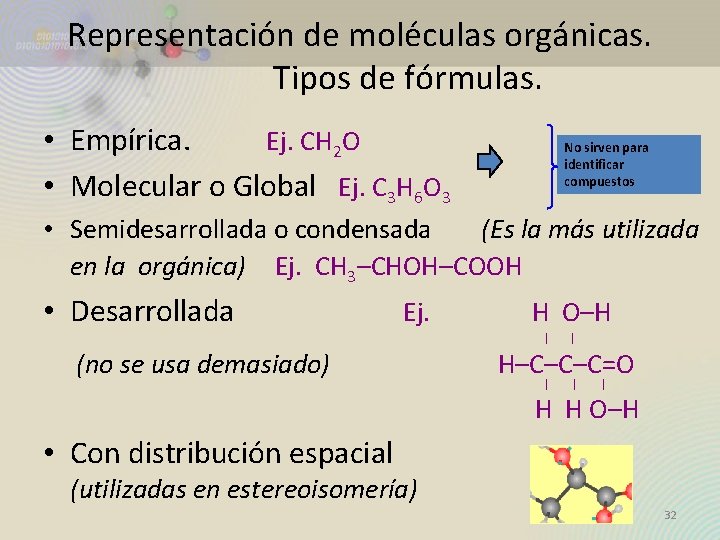
Representación de moléculas orgánicas. Tipos de fórmulas. • Empírica. Ej. CH 2 O • Molecular o Global Ej. C 3 H 6 O 3 No sirven para identificar compuestos • Semidesarrollada o condensada (Es la más utilizada en la orgánica) Ej. CH 3–CHOH–COOH • Desarrollada (no se usa demasiado) Ej. H O–H H–C–C–C=O H H O–H • Con distribución espacial (utilizadas en estereoisomería) 32

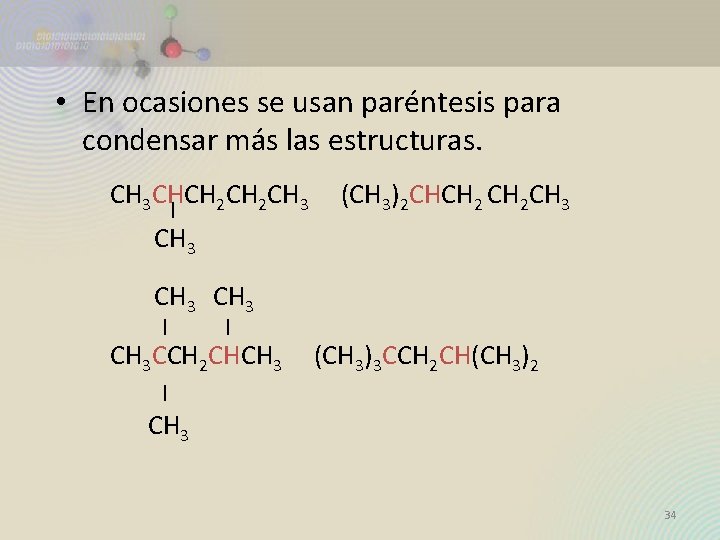
Fórmula Estructural Desarrollada y Condensada • Las fórmulas estructurales condensadas reducen el volumen con poco sacrificio de la información H H | | H—C—C—H se convierte en | | H H CH 3 —CH 3 ó Es posible “sobreentender” incluso a la mayoría de los enlaces sencillos. CH 3 CHCH 2 CH 3 | CH 3 33

• En ocasiones se usan paréntesis para condensar más las estructuras. CH 3 CHCH 2 CH 3 (CH 3)2 CHCH 2 CH 3 | CH 3 | | CH 3 CCH 2 CHCH 3 (CH 3)3 CCH 2 CH(CH 3)2 | CH 3 34

Tipos de átomos de carbono (en las cadenas carbonadas) • Primarios (a) a CH 3 CH 3 a • Secundarios (b) CH –C–CH 2–CH–CH 3 a 3 d c a b • Terciarios (c) b CH 2 • Cuaternarios (d) a CH 3 35

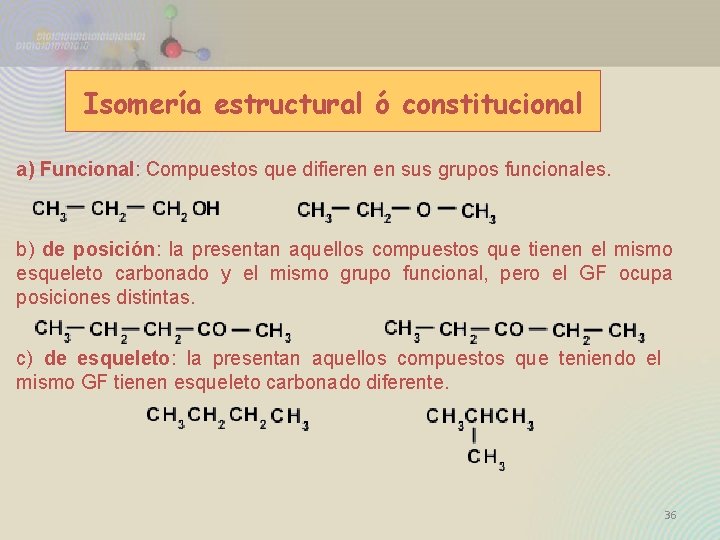
Isomería estructural ó constitucional a) Funcional: Compuestos que difieren en sus grupos funcionales. b) de posición: la presentan aquellos compuestos que tienen el mismo esqueleto carbonado y el mismo grupo funcional, pero el GF ocupa posiciones distintas. c) de esqueleto: la presentan aquellos compuestos que teniendo el mismo GF tienen esqueleto carbonado diferente. 36

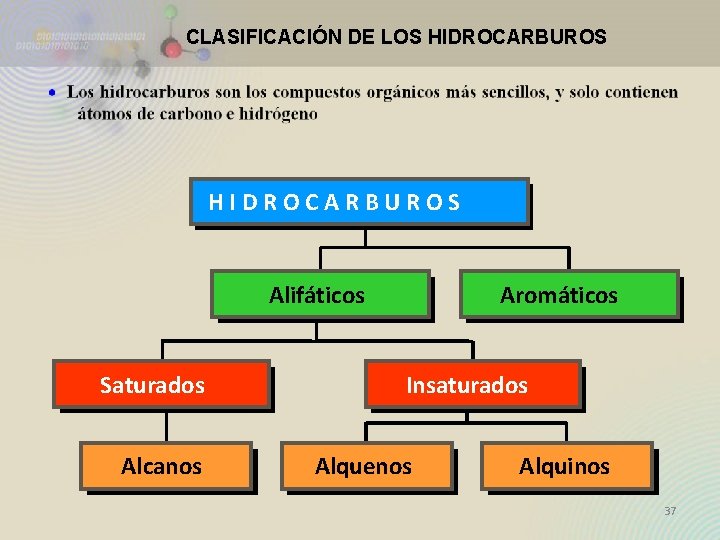
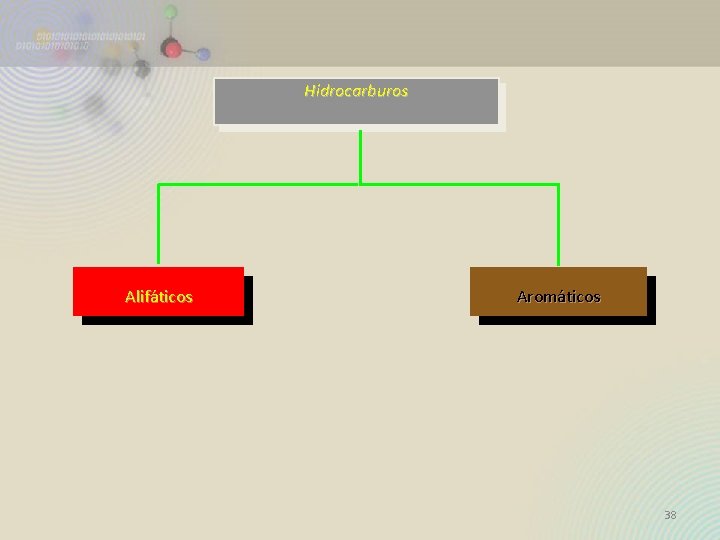
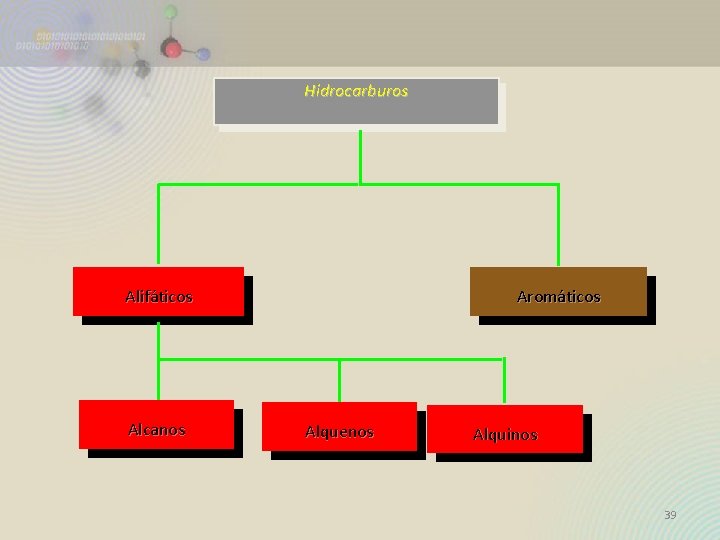
CLASIFICACIÓN DE LOS HIDROCARBUROS Alifáticos Saturados Alcanos Aromáticos Insaturados Alquenos Alquinos 37

Hidrocarburos Alifáticos Aromáticos 38

Hidrocarburos Alifáticos Alcanos Aromáticos Alquenos Alquinos 39

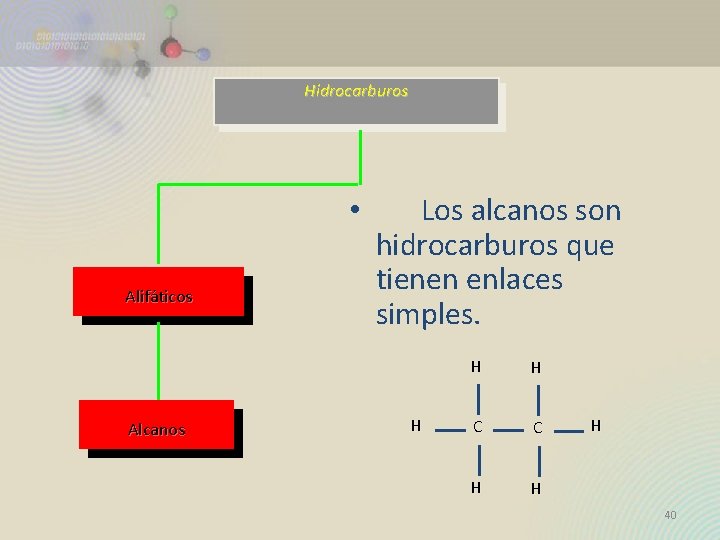
Hidrocarburos • Alifáticos Alcanos Los alcanos son hidrocarburos que tienen enlaces simples. H H H C C H H H 40

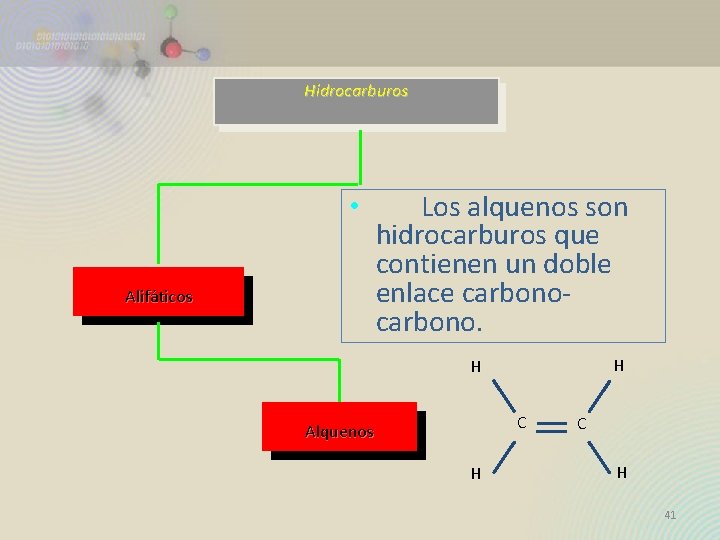
Hidrocarburos • Alifáticos Los alquenos son hidrocarburos que contienen un doble enlace carbono. H H C Alquenos H C H 41

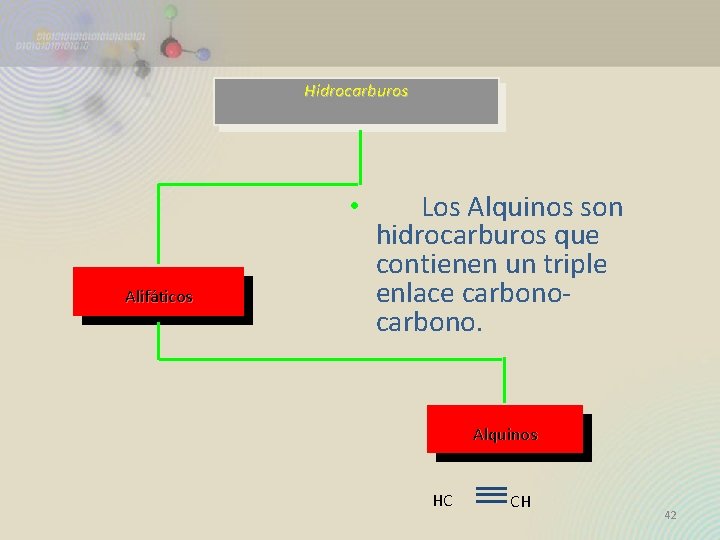
Hidrocarburos • Alifáticos Los Alquinos son hidrocarburos que contienen un triple enlace carbono. Alquinos HC CH 42

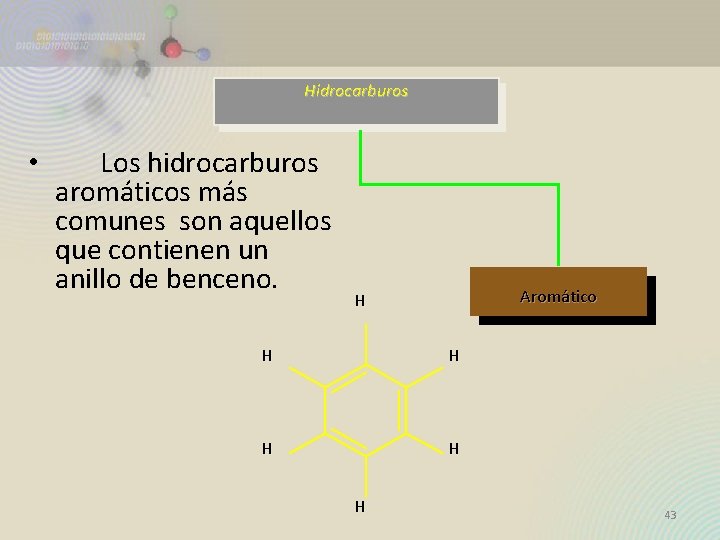
Hidrocarburos • Los hidrocarburos aromáticos más comunes son aquellos que contienen un anillo de benceno. Aromático H H H 43
 Miguel hernndez
Miguel hernndez Miguel hernndez
Miguel hernndez Mario hernndez
Mario hernndez Introduccin
Introduccin Introduccin
Introduccin Introduccin
Introduccin Introduccin
Introduccin Introducción de enzimas
Introducción de enzimas Introduccin
Introduccin Ral ronküs farkı
Ral ronküs farkı Tabel ral
Tabel ral Ian ral
Ian ral Dr. ral
Dr. ral Ral tabel
Ral tabel Uji bnt ral faktorial
Uji bnt ral faktorial Webral
Webral Ral tabel
Ral tabel Cp ral
Cp ral Rancangan split plot
Rancangan split plot Ral man
Ral man Varianza poblacional
Varianza poblacional Ral project manager
Ral project manager Tabel ral
Tabel ral Z 3
Z 3 Cp ral
Cp ral Cp ral
Cp ral Teknofest logo png
Teknofest logo png Kalp tepe atımı nerden dinlenir
Kalp tepe atımı nerden dinlenir Ral 118
Ral 118 Dr daro
Dr daro Ral project manager
Ral project manager Cloud ral
Cloud ral Ral checker
Ral checker Rancangan acak kelompok lengkap
Rancangan acak kelompok lengkap Cp ral
Cp ral Estacion semitotal
Estacion semitotal Sonor ronküs
Sonor ronküs Contoh soal ral pertanian
Contoh soal ral pertanian Ral weber
Ral weber 26000 ral
26000 ral Ral project manager
Ral project manager Tabel sidik ragam ral
Tabel sidik ragam ral Ral medicina
Ral medicina Tabel rak
Tabel rak