i Hc Cng Nghip Tp HCM Khoa Hc

































- Slides: 49

Đại Học Công Nghiệp Tp HCM Khoa Học Cơ Bản BÀI GIẢNG VLDC chủ đề: VẬT LÍ NGUYÊN TỬ Thọt Sĩ Đỗ Quốc Huy

MỤC TIÊU Sau khi học xong bài này, SV phải: Nêu được các kết luận về năng lượng, sự sắp xếp các trạng thái, cấu tạo vạch quang phổ của nguyên tử Hydro và các nguyên tử kim loại kiềm. Nêu được tính chất lượng tử hóa của mômen động lượng quĩ đạo, mômen spin. Nêu được qui luật phân bố các nguyên tố trong bảng HTTH và giải thích qui luật đó.

NỘI DUNG: *** I – NGUYE N TÖÛ HYDROGEN II – NGUYE N TÖÛ KIM LOAÏI KIEÀM III – MO MEN ÑOÄNG LÖÔÏNG VAØ MO MEN TÖØ CUÛA ELECTRON CHUYEÅN ÑOÄNG XUNG QUANH HAÏT NHA N IV – SPIN CUÛA ELECTRON V – HEÄ THOÁNG TUAÀN HOAØN MENDELEEV VI – BAØI TAÄP

I – NGUYÊN TỬ HYDROGEN: 1 - C/đ của electrong n/tử hydrogen: Thế năng tương tác giữa hạt nhân và electron là: r trong ñoù 0 = 8, 86. 10 -12 C 2/N. m 2 Vaäy phöông trình Schrodinger coù daïng:

I – NGUYÊN TỬ HYDROGEN: 1 - C/đ của electrong n/tử hydrogen: Nghiệm của (7. 2) có dạng: (r, , ) = Rnl (r) Ylm ( , ) (7. 3) Caùc soá n, , m nhaän caùc gía trò: Soá nguyeân n ñöôïc goïi laø soá löôïng töû chính. Soá nguyeân laø soá löôïng töû quyõ ñaïo (orbital) Soá nguyeân m laø soá löôïng töû töø.

I – NGUYÊN TỬ HYDROGEN: 1 - C/đ của electrong n/tử hydrogen: Naêng löôïng cuûa electron: trong ñoù laø haèng soá Rydberg.

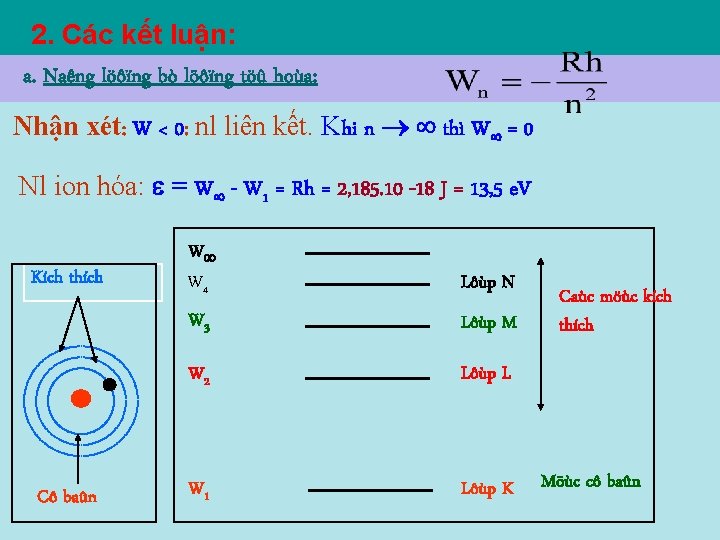
2. Các kết luận: a. Naêng löôïng bò löôïng töû hoùa: Nhận xét: W < 0: nl liên kết. Khi n thì W = 0 Nl ion hóa: = W - W 1 = Rh = 2, 185. 10 -18 J = 13, 5 e. V Kích thích Cô baûn W W 4 Lôùp N W 3 Lôùp M W 2 Lôùp L W 1 Lôùp K Caùc möùc kích thích Möùc cô baûn

2. Các kết luận: b. Haøm soùng cuûa electron vaø soá caùc traïng thaùi löôïng töû: Haøm soùng cuûa electron phuï thuoäc vaøo 3 soá löôïng töû n, vaø m: n m(r, , ) = Rn (r)Y m( , ) Có bao nhiêu trạng thái ứng với số lượng tử n? Có: traïng thaùi löôïng töû khaùc nhau. n = 1, naêng löôïng W 1, coù moät traïng thaùi löôïng töû, goïi laø traïng thaùi cô baûn. n = 2, naêng löôïng W 2, coù 4 traïng thaùi löôïng töû. n baát kyø, coù n 2 traïng thaùi löôïng töû. Ta noùi raèng möùc naêng löôïng Wn suy bieán baäc n 2.

2. Các kết luận: b. Haøm soùng cuûa electron vaø soá caùc traïng thaùi löôïng töû: Traïng thaùi öùng vôùi = 0 laø traïng thaùi s Traïng thaùi öùng vôùi = 1 laø traïng thaùi p Traïng thaùi öùng vôùi = 2 laø traïng thaùi d Traïng thaùi öùng vôùi = 3 laø traïng thaùi f

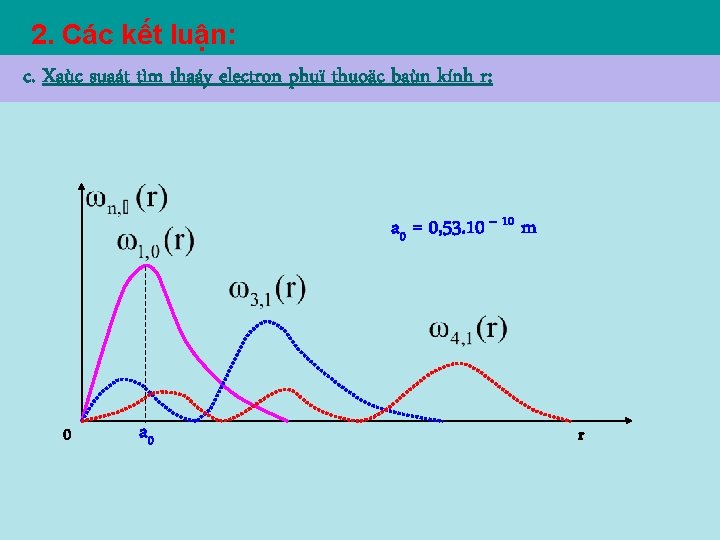
2. Các kết luận: c. Xaùc suaát tìm thaáy electron phuï thuoäc baùn kính r: a 0 = 0, 53. 10 – 10 m 0 a 0 r

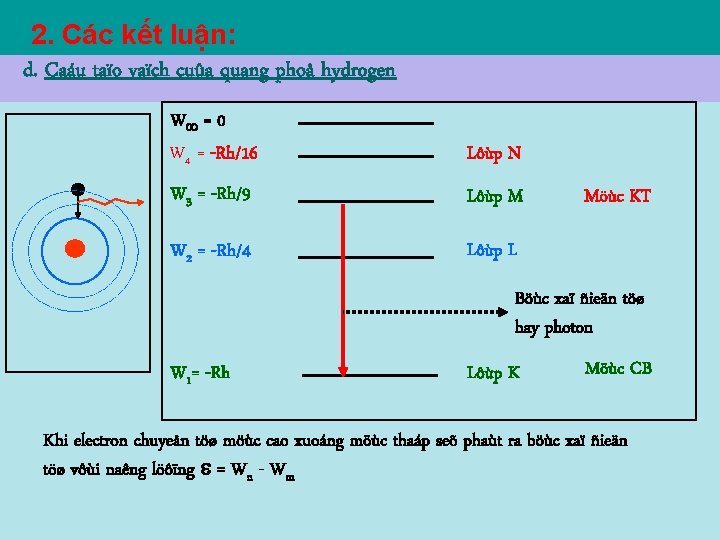
2. Các kết luận: d. Caáu taïo vaïch cuûa quang phoå hydrogen W = 0 W 4 = -Rh/16 Lôùp N W 3 = -Rh/9 Lôùp M W 2 = -Rh/4 Lôùp L Möùc KT Böùc xaï ñieän töø hay photon W 1= -Rh Lôùp K Möùc CB Khi electron chuyeån töø möùc cao xuoáng möùc thaáp seõ phaùt ra böùc xaï ñieän töø vôùi naêng löôïng = Wn - Wm

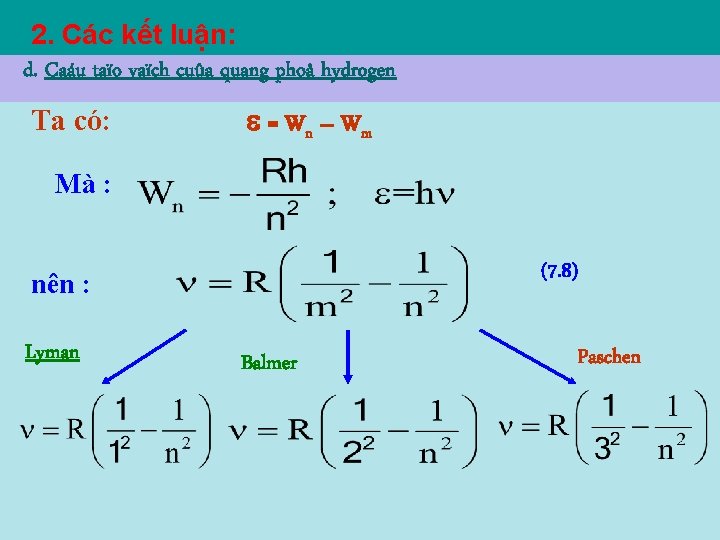
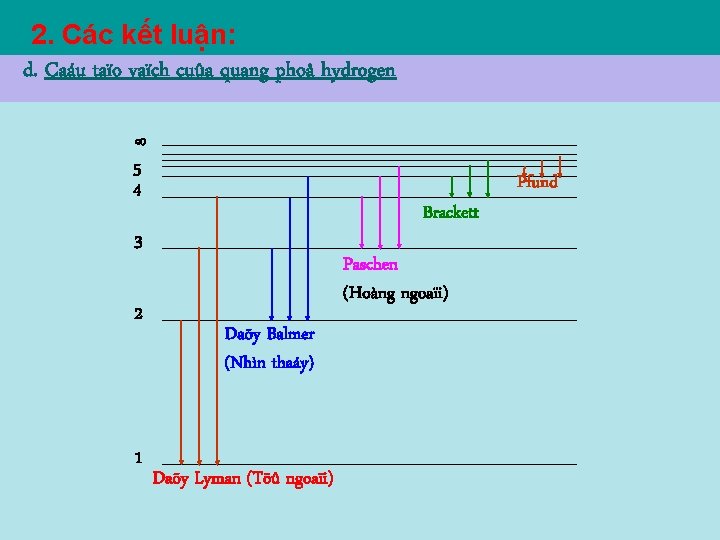
2. Các kết luận: d. Caáu taïo vaïch cuûa quang phoå hydrogen Ta có: = Wn – W m Mà : (7. 8) nên : Lyman Balmer Paschen

2. Các kết luận: d. Caáu taïo vaïch cuûa quang phoå hydrogen 5 4 Brackett 3 2 1 Paschen (Hoàng ngoaïi) Daõy Balmer (Nhìn thaáy) Daõy Lyman (Töû ngoaïi) Pfund

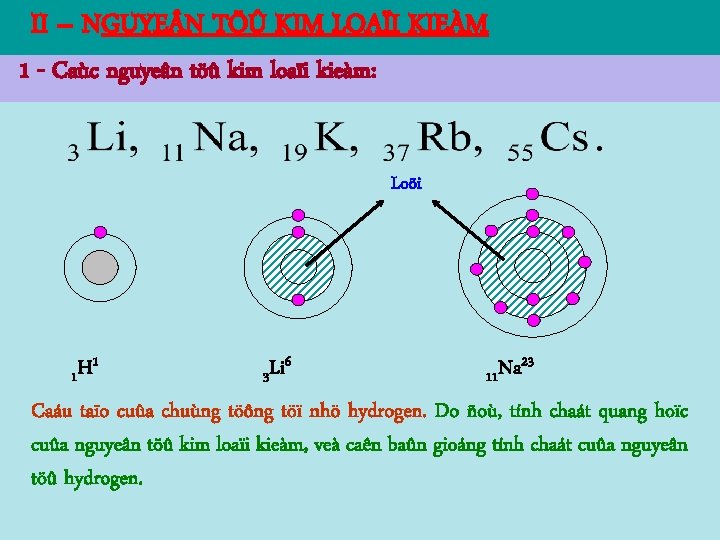
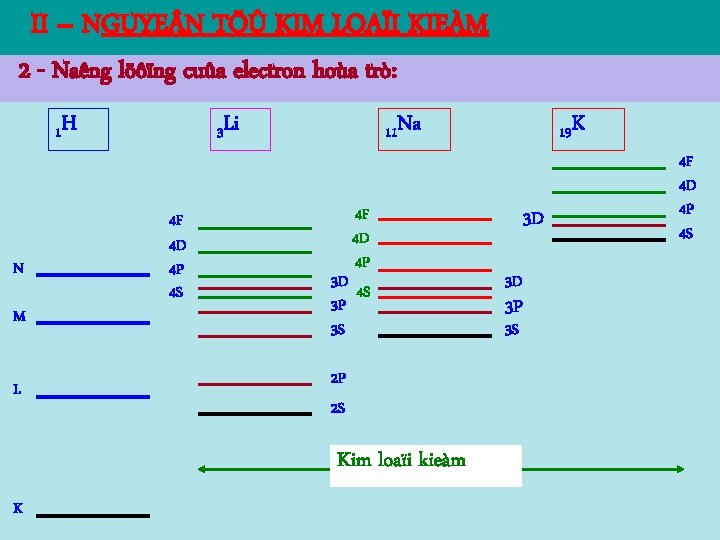
II – NGUYE N TÖÛ KIM LOAÏI KIEÀM 1 - Caùc nguyeân töû kim loaïi kieàm: Loõi 1 H 1 6 Li 3 23 Na 11 Caáu taïo cuûa chuùng töông töï nhö hydrogen. Do ñoù, tính chaát quang hoïc cuûa nguyeân töû kim loaïi kieàm, veà caên baûn gioáng tính chaát cuûa nguyeân töû hydrogen.

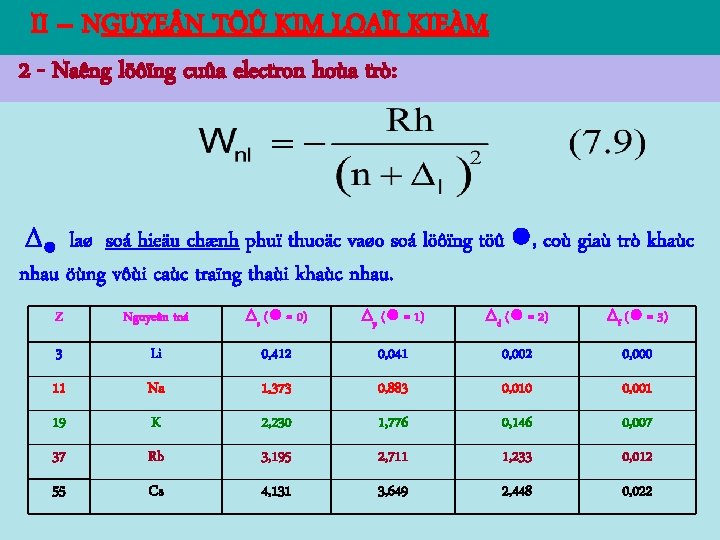
II – NGUYE N TÖÛ KIM LOAÏI KIEÀM 2 - Naêng löôïng cuûa electron hoùa trò: laø soá hieäu chænh phuï thuoäc vaøo soá löôïng töû , coù giaù trò khaùc nhau öùng vôùi caùc traïng thaùi khaùc nhau. Z Nguyeân toá s ( = 0) p ( = 1) d ( = 2) f ( = 3) 3 Li 0, 412 0, 041 0, 002 0, 000 11 Na 1, 373 0, 883 0, 010 0, 001 19 K 2, 230 1, 776 0, 146 0, 007 37 Rb 3, 195 2, 711 1, 233 0, 012 55 Cs 4, 131 3, 649 2, 448 0, 022

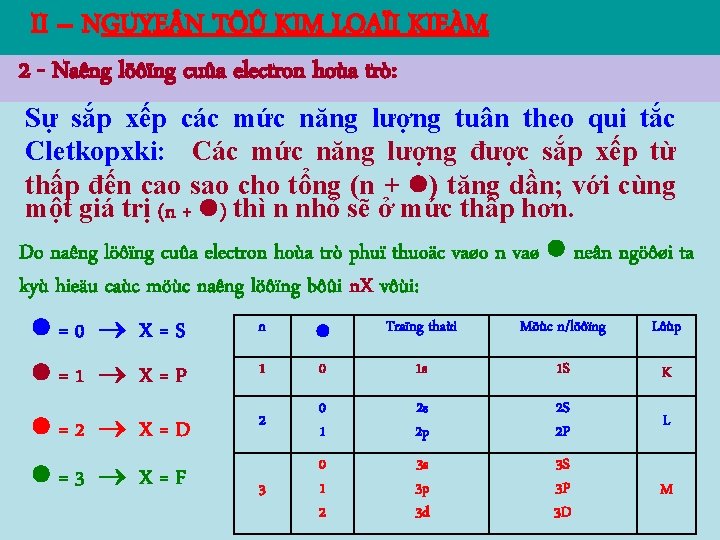
II – NGUYE N TÖÛ KIM LOAÏI KIEÀM 2 - Naêng löôïng cuûa electron hoùa trò: Sự sắp xếp các mức năng lượng tuân theo qui tắc Cletkopxki: Các mức năng lượng được sắp xếp từ thấp đến cao sao cho tổng (n + ) tăng dần; với cùng một giá trị (n + ) thì n nhỏ sẽ ở mức thấp hơn. Do naêng löôïng cuûa electron hoùa trò phuï thuoäc vaøo n vaø neân ngöôøi ta kyù hieäu caùc möùc naêng löôïng bôûi n. X vôùi: =0 X=S n Traïng thaùi Möùc n/löôïng Lôùp =1 X=P 1 0 1 s 1 S K =2 X=D 2 0 1 2 s 2 p 2 S 2 P L 3 0 1 2 3 s 3 p 3 d 3 S 3 P 3 D M =3 X=F

II – NGUYE N TÖÛ KIM LOAÏI KIEÀM 2 - Naêng löôïng cuûa electron hoùa trò: 1 H N M L 3 Li 4 F 4 D 4 P 4 S 11 Na 4 F 4 D 4 P 3 D 4 S 3 P 3 S 2 P 2 S Kim loaïi kieàm K 19 K 3 D 3 D 3 P 3 S 4 F 4 D 4 P 4 S

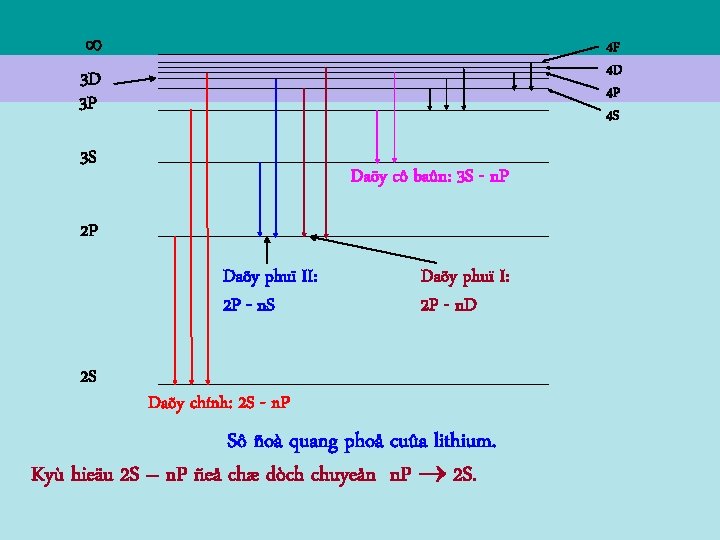
II – NGUYE N TÖÛ KIM LOAÏI KIEÀM 3 - Quang phoå cuûa nguyeân töû kim loaïi kieàm: Vieäc chuyeån möùc naêng löôïng tuaân theo caùc quy taéc: - Chuyeån töø möùc naêng löôïng cao veà möùc naêng löôïng thaáp hôn. - Tuaân theo quy taéc löïa choïn : = 1 (7. 10)

3 D 3 P 4 F 4 D 4 P 4 S 3 S Daõy cô baûn: 3 S - n. P 2 P Daõy phuï II: 2 P - n. S 2 S Daõy phuï I: 2 P - n. D Daõy chính: 2 S - n. P Sô ñoà quang phoå cuûa lithium. Kyù hieäu 2 S – n. P ñeå chæ dòch chuyeån n. P 2 S.

III – MO MEN ÑOÄNG LÖÔÏNG VAØ MO MEN TÖØ CUÛA ELECTRON CHUYEÅN ÑOÄNG XUNG QUANH HAÏT NHA N 1. Moâmen ñoäng löôïng (moâmen orbital): Tuy electron không có qũi đạo xác định, nhưng mômen động lượng của electron lại có giá trị xác định: Trong ñoù laø soá löôïng töû quyõ ñaïo (orbital). Hình chieáu cuûa moâmen ñoäng löôïng leân phöông Oz: Lz = m (7. 12) Trong ñoù m laø soá löôïng töû töø.


III. 2. Moâmen tö: ø Electron chuyeån ñoäng quanh haït nhaân taïo neân doøng ñieän. Doøng ñieän naøy coù moâmen töø ngöôïc chieàu vaø tæ leä vôùi : Vì vector khoâng coù höôùng xaùc ñònh neân moâmen töø cuõng khoâng coù höôùng xaùc ñònh. Hình chieáu cuûa moâmen töø leân moät phöông z baát kyø baèng: goïi laø manheton Bohr.

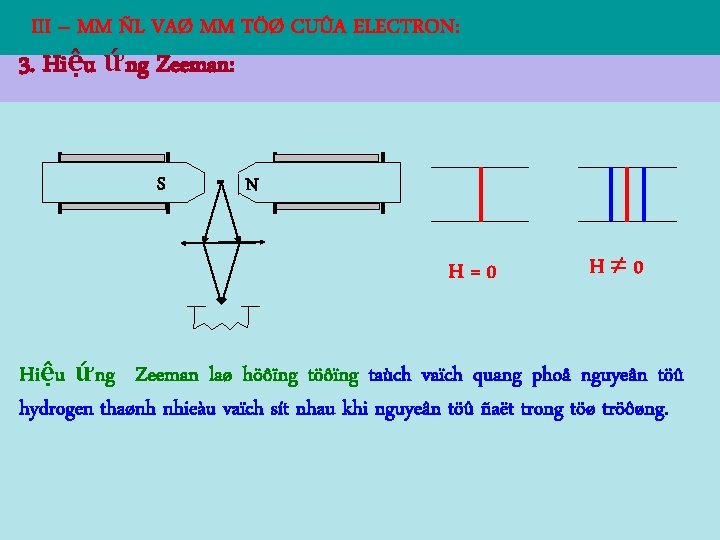
III – MM ÑL VAØ MM TÖØ CUÛA ELECTRON: 3. Hiệu ứng Zeeman: S N H=0 H 0 Hiệu ứng Zeeman laø höôïng taùch vaïch quang phoå nguyeân töû hydrogen thaønh nhieàu vaïch sít nhau khi nguyeân töû ñaët trong töø tröôøng.

Giaûi thích hiệu ứng Zeeman: Vì electron coù moâmen töø neân khi nguyeân töû hydrogen ñaët trong töø tröôøng electron coù theâm naêng löôïng phuï: Do đó, naêng löôïng cuûa electron coøn phuï thuoäc vaøo soá löôïng töû töø m: W’ = W + m BB, trong ñoù W laø naêng löôïng cuûa electron khi không có töø tröôøng. Suy ra, tần số bức xạ điện từ ’:

Giaûi thích hiệu ứng Zeeman: Do quy taéc löïa choïn ñoái vôùi m: m = 0, 1, nên H=0 H 0 nghóa laø moät vaïch quang phoå khi khoâng coù töø tröôøng seõ ñöôïc taùch thaønh 3 vaïch khi coù töø tröôøng, trong ñoù vaïch giöõa truøng vôùi vaïch cuõ.

IV – SPIN CUÛA ELECTRON 1 - Spin: Đặc trưng cho chuyển động riêng của electron là momen Spin. (coi như momen đl riêng) Cô hoïc löôïng töû ñaõ tìm ñöôïc bieåu thöùc ñoái vôùi giaù trò cuûa moâmen spin: vôùi s = , goïi laø soá löôïng töû spin, hay goïi taét laø spin. Ñaây laø moät khaùi nieäm thuaàn tuùy löôïng töû, khoâng coù trong cô hoïc coå ñieån. Hình chieáu cuûa moâmen spin leân truïc z tuøy yù baèng:

IV – SPIN CUÛA ELECTRON 2 - Mômen từ riêng của electron: vaø hình chieáu cuûa mômen từ riêng treân truïc z:

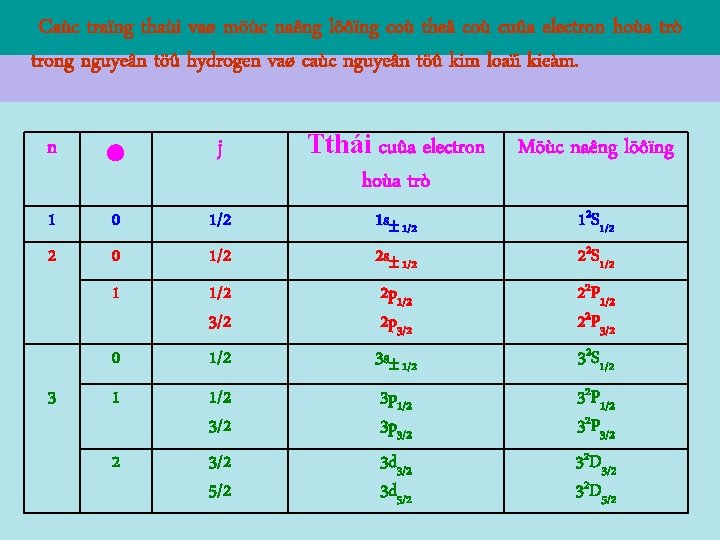
IV – SPIN CUÛA ELECTRON 3 - Traïng thaùi vaø n/l của electrong ng/töû: Do coù moâmen spin moâmen toaøn phaàn : vaø moâmen ñoäng löôïng neân electron coù vôùi j laø soá löôïng töû moâmen toaøn phaàn, xaùc ñònh bôûi:

IV – SPIN CUÛA ELECTRON Do đó, ngoài ba số lượng tử n, , m còn phải đưa vào số lượng tử ms để đặc trưng cho sự định hướng của spin. Vậy trạng thái của một electrong nguyên tử được xác định bởi 4 số lượng tử n, , m, ms. Veà möùc naêng löôïng, ngoaøi söï phuï thuoäc vaøo caùc soá löôïng töû n vaø , thì W coøn phuï thuoäc vaøo söï ñònh höôùng cuûa spin. Noùi khaùc ñi, naêng löôïng toaøn phaàn cuûa electron phaûi phuï thuoäc vaøo 3 soá löôïng töû laø n, vaø j. Một mức năng lượng bây giờ được tách làm 2 mức ứng với j = l + ½ và j = l – ½ (trừ trường hợp l = 0, chỉ có 1 mức)

IV – SPIN CUÛA ELECTRON 3 Li chöa keå ñeán spin 4 P 3 D 4 S 3 P 3 S 3 Li coù keå ñeán spin 42 P 3/2 42 P 1/2 32 D 5/2 32 D 3/2 42 S 1/2 32 P 3/2 32 P 1/2 32 S 1/2 2 P 22 P 3/2 22 P 1/2 2 S 22 S 1/2 Khoaûng caùch giöõa 2 möùc tách ra là rất nhỏ. Caáu truùc ñoù laø caáu truùc tinh teá cuûa möùc naêng löôïng

IV – SPIN CUÛA ELECTRON 3 - Traïng thaùi vaø n/l của electrong ng/töû: Kyù hieäu traïng thaùi electron hoùa trò laø nxj, trong ñoù n laø soá löôïng töû chính ; x = s, p, d, f, …; j = . Kyù hieäu möùc naêng löôïng cuûa electron hoùa trò laø n 2 Xj X = S, P, D, F, … vôùi = 0, 1, 2, 3, … Chæ soá 2 beân traùi chöõ X chæ caáu taïo boäi keùp cuûa möùc naêng löôïng.

Caùc traïng thaùi vaø möùc naêng löôïng coù theå coù cuûa electron hoùa trò trong nguyeân töû hydrogen vaø caùc nguyeân töû kim loaïi kieàm. n j Tthái cuûa electron hoùa trò Möùc naêng löôïng 1 0 1/2 1 s 1/2 12 S 1/2 2 0 1/2 2 s 1/2 22 S 1/2 1 1/2 3/2 1/2 2 p 3/2 3 s 1/2 22 P 3/2 32 S 1/2 3/2 5/2 3 p 1/2 3 p 3/2 3 d 5/2 32 P 1/2 32 P 3/2 32 D 5/2 0 3 1 2

IV – SPIN CUÛA ELECTRON 4 - Caáu tao boäi cuûa vaïch quang phoå: Söû duïng caáu truùc tinh teá cuûa möùc naêng löôïng coù theå giaûi thích ñöôïc caáu taïo boäi 2, 3 cuûa vaïch quang phoå. Do möùc naêng löôïng, ngoaøi söï phuï thuoäc n vaø , coøn phuï thuoäc vaøo j neân khi electron chuyeån töø möùc cao xuoáng möùc thaáp, ngoaøi quy taéc löïa choïn doái vôùi , electron coøn phaûi tuaân theo quy taéc löïa choïn ñoái vôùi j: j = 0, 1 (7. 26)

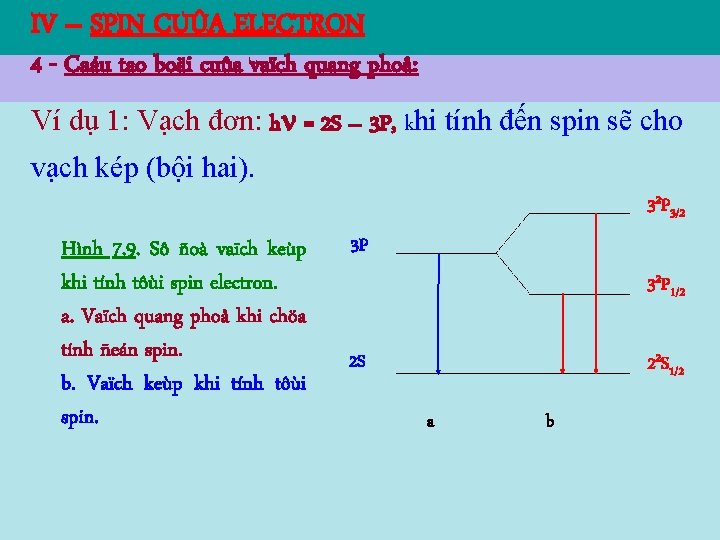
IV – SPIN CUÛA ELECTRON 4 - Caáu tao boäi cuûa vaïch quang phoå: Ví dụ 1: Vạch đơn: h = 2 S – 3 P, khi tính đến spin sẽ cho vạch kép (bội hai). 32 P 3/2 Hình 7. 9. Sô ñoà vaïch keùp khi tính tôùi spin electron. a. Vaïch quang phoå khi chöa tính ñeán spin. b. Vaïch keùp khi tính tôùi spin. 3 P 32 P 1/2 2 S 22 S 1/2 a b

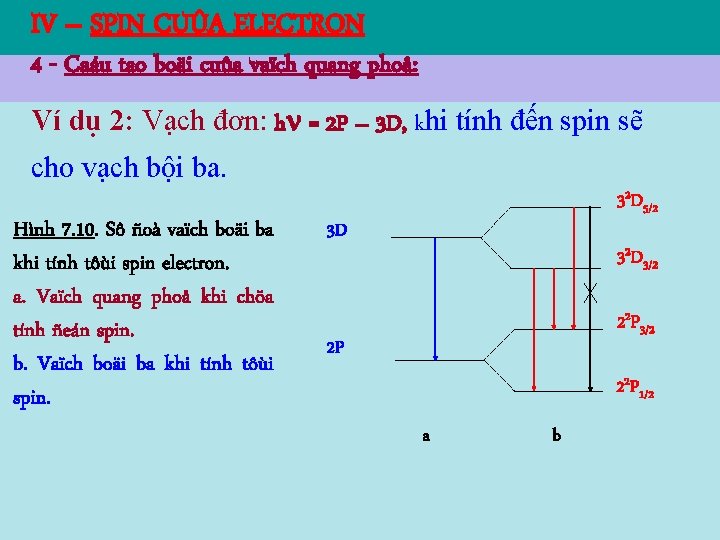
IV – SPIN CUÛA ELECTRON 4 - Caáu tao boäi cuûa vaïch quang phoå: Ví dụ 2: Vạch đơn: h = 2 P – 3 D, khi tính đến spin sẽ cho vạch bội ba. Hình 7. 10. Sô ñoà vaïch boäi ba khi tính tôùi spin electron. a. Vaïch quang phoå khi chöa tính ñeán spin. b. Vaïch boäi ba khi tính tôùi spin. 32 D 5/2 3 D 32 D 3/2 22 P 3/2 2 P 22 P 1/2 a b

V – HEÄ THOÁNG TUAÀN HOAØN MENDELEEV *** Ñeå giaûi thích quy luaät phaân boá cuûa caùc electrong baûng tuaàn hoaøn Mendeleev ta söû duïng nguyeân lyù loaïi tröø Pauli: ÔÛ moãi traïng thaùi löôïng töû xaùc ñònh bôûi 4 soá löôïng töû n, , m vaø ms chæ coù theå coù toái ña moät electron. Ta biết, neáu chöa keå ñeán spin electron, vôùi moãi trò soá cuûa n ta coù n 2 traïng thaùi löôïng töû. Khi keå ñeán 2 ñònh höôùng spin laø vaø thì vôùi moãi trò soá cuûa n ta coù 2 n 2 traïng thaùi löôïng töû, nghóa laø coù 2 n 2 electron.

V – HEÄ THOÁNG TUAÀN HOAØN MENDELEEV * Vôùi n = 1 ta coù lôùp K vôùi soá toái ña 2 electron * Vôùi n = 2 ta coù lôùp L vôùi soá toái ña 8 electron * Vôùi n = 3 ta coù lôùp M vôùi soá toái ña 18 electron * Vôùi n = 4 ta coù lôùp N vôùi soá toái ña 32 electron Maët khaùc do caùc electron bao giôø cuõng coù khuynh höôùng chieám möùc naêng löôïng thaáp nhaát neân caùc electron phaân boá trong nguyeân töû nhö sau: - Nguyeân töû H coù 1 electron ôû lôùp K - Nguyeân töû He coù 2 electron ôû lôùp K (ñuû soá electron) - Nguyeân töû Li coù 2 electron ôû lôùp K vaø 1 electron ôû lôùp L

V – HEÄ THOÁNG TUAÀN HOAØN MENDELEEV *** Moãi lôùp laïi chia thaønh caùc lôùp con öùng vôùi caùc giaù trò khaùc nhau cuûa . Moãi lôùp con coù 2(2 + 1) electron. * Lôùp K (n = 1) coù toái ña 2 electron Lôùp naøy chæ coù moät lôùp S vôùi = 0, chöùa 2(2 + 1) = 2 electron. * Lôùp L (n = 2) coù toái ña 8 electron, goàm 2 lôùp con: - Lôùp con S ( = 0) chöùa 2(2 + 1) = 2 electron - Lôùp con P ( = 1) chöùa 2(2 + 1) = 6 electron

* Lôùp M (n = 3) coù toái ña 18 electron, goàm 3 lôùp con: - Lôùp con S ( = 0) chöùa 2(2 + 1) = 2 electron - Lôùp con P ( = 1) chöùa 2(2 + 1) = 6 electron - Lôùp con D ( = 2) chöùa 2(2 + 1) = 10 electron * Lôùp N (n = 4) coù toái ña 32 electron, goàm 4 lôùp con: - Lôùp con S ( = 0) chöùa 2(2 + 1) = 2 electron - Lôùp con P ( = 1) chöùa 2(2 + 1) = 6 electron - Lôùp con D ( = 2) chöùa 2(2 + 1) = 10 electron - Lôùp con F ( = 3) chöùa 2(2 + 1) = 14 electron

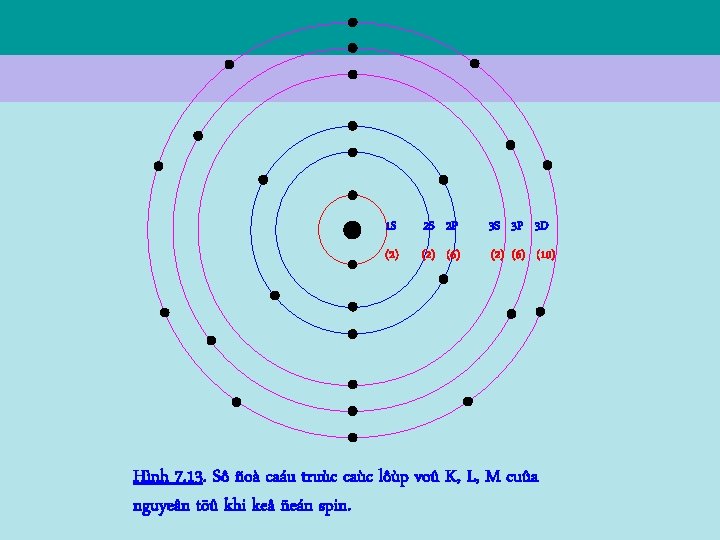
1 S 2 S 2 P 3 S 3 P 3 D (2) (6) (10) Hình 7. 13. Sô ñoà caáu truùc caùc lôùp voû K, L, M cuûa nguyeân töû khi keå ñeán spin.

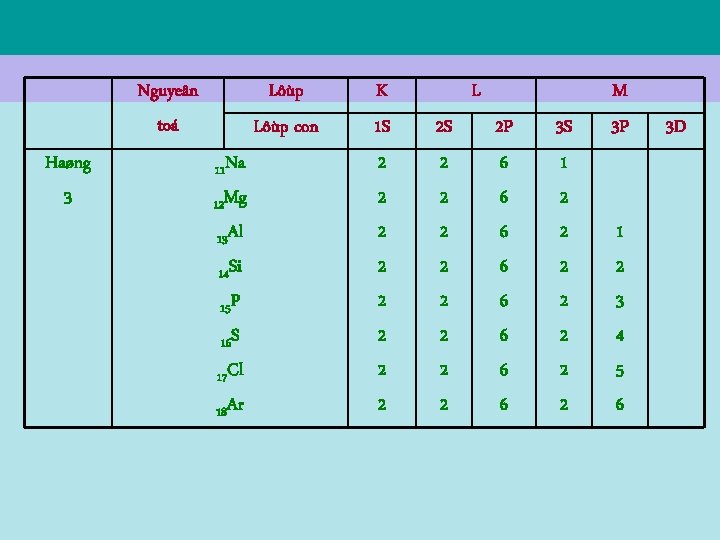
Quy luaät phaân boá caùc electron quõy ñaïo nhö treân cho pheùp saép xeáp caùc nguyeân toá theo thöù töï taêng daàn soá electron quõy ñaïo. Caáu truùc naøy ñöôïc phaûn aûnh trong baûng heä thoáng tuaàn hoaøn Mendeleev, ñöôïc xaây döïng töø naêm 1869, tröôùc khi hình thaønh moân cô hoïc löôïng töû. Baûng 7. 4 saép xeáp caùc electrong caùc nguyeân töû cuûa caùc nguyeân toá trong 3 haøng ñaàu baûng tuaàn hoaøn Mendeleev.

Baûng 7. 4. Baûng saép xeáp caùc electrong caùc nguyeân töû cuûa caùc nguyeân toá trong 3 haøng ñaàu baûng tuaàn hoaøn Mendeleev. Nguyeân toá Haøng 1 Haøng 2 1 H 2 He 3 Li 4 Be 5 B 6 C 7 N 8 O 9 F 10 Ne Lôùp K Lôùp con 1 S L M 2 S 2 P 1 2 2 2 2 1 2 3 4 5 6 1 2 2 2 2 2 3 S 3 P 3 D

Nguyeân toá Haøng 3 Lôùp con 11 Na 12 Mg 13 Al 14 Si 15 P 16 S 17 Cl 18 Ar K 1 S 2 2 2 2 L 2 S 2 2 2 2 2 P 6 6 6 6 3 S 1 2 2 2 2 M 3 P 1 2 3 4 5 6 3 D

Töø baûng 7. 4 coù theå vieát coâng thöùc caáu truùc lôùp cuûa nguyeân töû. Ví duï ñoái vôùi A coâng thöùc laø 1 s 22 p 63 s 23 p 1, coù nghóa laø ñoái vôùi nguyeân töû naøy ôû traïng thaùi 1 s coù 2 electron, traïng thaùi 2 p coù 6 electron, traïng thaùi 3 s coù 2 electron vaø traïng thaùi 3 p coù 1 electron. Cuõng töø baûng 7. 4 thaáy raèng caùc khí trô laø caùc khí coù caùc lôùp bò electron choaùng ñaày, ñoù laø caùc nguyeân töû beàn veà maët hoùa hoïc. Toång soá electron choaùng ñaày, theo baûng 7. 4, ñoái vôùi caùc khí trô laø 2 (He), 10 (Ne), 18 (Ar). Ñoái vôùi caùc khí trô khaùc ta coù soá electron choaùng ñaày laø 36 (Kr), 54 (Xe), 86 (Rn).

VII – BAØI TAÄP BT 7. 1 Tìm soá boå chính Rydberg ñoái vôùi soá haïng 3 P cuûa nguyeân töû Na bieát raèng theá kích thích ñoái vôùi traïng thaùi thöù nhaát baèng 2, 10 voân vaø naêng löôïng lieân keát cuûa electron hoùa trò ôû traïng thaùi 3 s baèng 5, 14 e. V. Baøi giaûi Möùc naêng löôïng ôû traïng thaùi n laø: W 3 p 3 P h = 2, 10 e. V 3 S W 3 s = - 5, 14 e. V

Ñoái vôùi nguyeân töû Na, electron hoùa trò thuoäc lôùp M, töùc laø n = 3. Traïng thaùi cô baûn laø 3 s öùng vôùi möùc naêng löôïng 3 S. Theo ñaàu baøi, möùc naêng löôïng cô baûn naøy baèng: Traïng thaùi kích thöù nhaát laø 3 p öùng vôùi möùc naêng löôïng 3 P, coù daïng : Theo ñaàu baøi thì: Do ñoù: h = W 3 p – W 3 s = 2, 10 e. V

Thay soá R = 3, 27. 1015 s-1 ; h = 6, 625. 10 -34 J. s ta ñöôïc: Vaäy soá boå chính Rydberg ñoái vôùi soá haïng 3 P cuûa nguyeân töû Na laø: p = - 0, 891

BT 7. 2 Trong nguyeân töû hydrogen, electron chuyeån töø traïng thaùi 3 p veà traïng thaùi cô baûn. Xaùc ñònh ñoä bieán thieân moâmen töø quyõ ñaïo cuûa electrong quaù trình ñoù. Baøi giaûi: Moâmen töø quyõ ñaïo cuûa electron : Với B = 10 - 23 A. m 2 laø manheton Bohr. 3 P h = 1 S – 3 P 1 S

BT 7. 3 Trong nguyeân töû, xaùc ñònh soá traïng thaùi electron thuoäc lôùp n = 3 coù cuøng soá löôïng töû: a) ms; b) m = 1; c) m = - 1 và ms = ½ Giải Đáp số: a) 9 b) 4 c) 2
 Bìa tiểu luận trường đại học đà lạt
Bìa tiểu luận trường đại học đà lạt Chu nghia xa hoi khoa hoc
Chu nghia xa hoi khoa hoc Hộp khóa nòng
Hộp khóa nòng Tạo thuộc tính lookup cho các trường khóa ngoại
Tạo thuộc tính lookup cho các trường khóa ngoại Tạo thuộc tính lookup cho các trường khóa ngoại
Tạo thuộc tính lookup cho các trường khóa ngoại Cng vn
Cng vn Cng decanting station
Cng decanting station Cng b
Cng b Logo qu
Logo qu Cng vs lng
Cng vs lng Cng h
Cng h Cng fyllestasjoner norge
Cng fyllestasjoner norge Kỹ thuật bào chế viên nang cứng
Kỹ thuật bào chế viên nang cứng Follettdestiny.cng
Follettdestiny.cng Lng cng
Lng cng Cng vs lng
Cng vs lng Cng cesp
Cng cesp Cng forklift
Cng forklift Manual latihan modul hcm-payroll
Manual latihan modul hcm-payroll Hcm 1985
Hcm 1985 Gfmas maklumat penerima bayaran
Gfmas maklumat penerima bayaran Ngt.edu.hcm
Ngt.edu.hcm Hcm 1985
Hcm 1985 Ualberta hcm
Ualberta hcm Talent management sap
Talent management sap Heinsohn hcm human capital management
Heinsohn hcm human capital management Charisma hcm portal
Charisma hcm portal Omes hcm
Omes hcm Singkatan hcm
Singkatan hcm Hcm meaning in hr
Hcm meaning in hr Charisma hcm
Charisma hcm Teamworks hcm
Teamworks hcm Work day at penn
Work day at penn Fusionappsoer
Fusionappsoer Hitu
Hitu

























































