Hafta VII PCR Temelli Genetik Analiz Yaklamlar PCR





















- Slides: 24

Hafta VII PCR Temelli Genetik Analiz Yaklaşımları PCR Bir reaksiyonun kurulması ve optimize edilmesi Prof. Dr. Hilâl Özdağ

F İ Z İ K İ A L T Y A P I

P C R Reaksiyonda kullanılanlar: I. Kalıp DNA a) PCR degrade olmuş DNA ile de çalışma imkanı veren bir teknik olmakla beraber özellikle hedef amplikonun boyu arttıkça kullanılacak DNA’nın bütünlüğü önem kazanır. b) Kullanılacak genomik DNA’nın A 260/A 280 oranının temizliğinin bir göstergesi olarak 1. 7 -1. 9 arasında olması gerekir. c) A 260 Nükleik asitlerin maksimum absorbans, d) A 280 Proteinlerin maksimum absorbans, e) A 230 ise fenolün maksimum absorbans verdiği dalga boyudur. f) +4 (kısa-orta süreli) veya -20 o. C’de (uzun süreli) saklanmalı. Genomik DNA esas itibariyle oda ısısında da stabil olmakla beraber daha güvenilir olan ısı ayarlı soğuk ortamlarda saklanmalıdır.

P C R Reaksiyonda kullanılanlar: II. Düz primer ve ters primer: Tasarım kriterlerine uygun olarak seçilmiş primerler genellikle 18 -24 bç arasında olan oligonükleotidlerdir. Primerler üreticilerinden 3 farklı yöntemden biri ile saflaştırılmış olarak alınır. Tuzdan arındırma (desalting)- En ucuz yöntemdir, ancak özellikle primerler dizi analizi benzeri uygulamalarda kullanılacaksa bu yöntem tercih edilmemelidir. Kolon bazlı saflaştırma (OPC/HPSF benzeri)- Çok temiz sonuç veren tuzdan arındırma yöntemine göre pahalı ancak HPLC’ye göre ekonomik olan bir seçimdir. HPLC- En başarılı saflaştırma yöntemi olmakla beraber maliyeti en yüksek olan seçimdir. Genellikle liyofilize halde gelen primerler steril ortamda 100 pmol/ul olacak şekilde sulandırıldıktan sonra bu stoktan 10 pmol/ul’lik bir dilüsyon hazırlanıp reaksiyonlarda kullanılabilir.

P C R Reaksiyonda kullanılanlar: III. d. NTP: Eşit konsantrasyondaki d. ATP, d. GTP, d. CTP ve d. TTP’nin karışımıdır. Karışım halinde veya ayrı olarak satın alınabilir. Genellikle 100 m. M konsantrasyonda satılan d. NTP karışımlarının stok halinde 10 m. M konsantrasyonda olması tercih edilir. Herhangi bir kontaminasyon riskine karşı kullanıma açılan d. NTP miktarı 200 -300 ul üzerinde olmamalıdır. Bu amaçla d. NTP hazır olarak geldiğinde veya laboratuvarda hazırlandığında küçük hacimlere bölünerek saklanmalıdır. IV. Mg. Cl 2: Taq DNA polimeraz ile beraber gelen ve enzimin çalışması için gerekli kofaktör olarak görev alan Mg iyonunu sağlar. Genellikle 25 veya 50 m. M stok konsantrasyonda gelir. Reaksiyondaki son konsantrasyonu 0. 8 -3 m. M arasında değişir. V. 10 X buffer: Taq DNA polimeraz ile beraber gelen ve enzimin çalışması için gerekli stabil p. H şartlarını sağlar. Reaksiyondaki son konsantrasyonu 1 X olacak şekilde kullanılır.

P C R Reaksiyonda kullanılanlar: VI. Taq DNA Polimeraz: Thermus aquaticus adlı termofil bir bakteriden elde edilen ve PCR reaksiyonlarında kullanılan bu DNA polimerazların hata oranı 1 x 10 -4’dir. Enzimler protein oldukları için denatüre olma riski taşırlar, ayrıca ortam şartları aktiviteleri üzerine etki eder. Bu nedenle düşük ısıda saklanmaları gerekir. Ancak düşük ısıda donacakları için denatüre olurlar. Bunu engellemek için enzim stokları gliserol içinde gelir ve -20 o. C’de saklanır. -80 o. C’de gliserol de donacağı için Taq pol’ın -80 o. C’de saklanması tercih edilmez. Amplifiye edilecek bölge klonlanacaksa hatasız olması istenir. Bu nedenle hata oranı daha az olan enzimler tercih edilir. a. Pfu polimeraz Pyrococcus furiosus’tan izole edilmiştir hata oranı 1. 5 x 10 -6 b. Vent polimeraz Thermococcus litoralis’ten izole edilmiştir hata oranı Taq ile Pfu arasında seyreder.

P C R Örnek Reaksiyon (50 ul toplam hacim için) Stok Konsantrasyon/Miktar Son Konsantrasyon Düz Primer 10 m. M; 10 pmol/µl 0. 2 pmol/µl Ters Primer 10 m. M; 10 pmol/µl 0. 2 pmol/µl d. NTP 10 m. M 200 µM Mg. Cl 2 25 m. M 0. 8 -3 m. M 10 X buffer 10 X 1 X Taq DNA Polymeraz 5 U/ µl 0. 3 µl Toplam 50 µl (steril deionize su ile hacim tamamlanır) Kalıp DNA 25 -100 ng genomik DNA 0. 5 -2 ng/µl

P C R Ø Neredeyse hiçbir zaman tek bir reaksiyon kurulmadığı için muhakkak bir reaksiyon karışımı hazırlayın. Ø Tampon, primerler, Mg. Cl 2, d. NTP, Taq pol ve sudan oluşan Ø Pipetleme hatalarını engellemek üzere karışım olması gerekenin %10 fazlası olacak şekilde hazırlanır. Ø Negatif kontrol Ø Kalıp DNA olmayan bir tüp hazırlanır. Ø Örnekler arası kontaminasyonu kontrol etmek üzere Ø Pozitif kontrol Ø PCR’da kullanılan reaktiflerin dolayısıyla sistemin işlediğinden emin olmak için çalıştığı bilinen bir DNA ve primer seti ile pozitif kontrol reaksiyon setine dahil edilmelidir.

Genel Problemler Ø Bant yok veya zayıf. Ø Kontaminasyon var. Ø Primer dimer oluşumu var. Ø Özgün olmayan bant(lar) var.

Kontaminasyon ü Pre ve post PCR alanları muhakkak birbirinden ayrılmalı. ü Mümkünse PCR laminar akışlı kabin içinde kurulmalı. ü Bütün reaksiyon setlerinde muhakkak negatif kontrol bulunmalı ü Reaktifler küçük hacimlere bölünüp saklanmalı. Problem yaşandığı takdirde atılmaları mümkün olduğunca ekonomik olmalı. ü Filtreli uç kullanılmalı ki pipetler kontamine olmasın.

Bant yoksa veya zayıf ise… ØReaksiyona koymanı gereken bütün reaktifleri ilave ettiniz mi? ØLab defterinizi kontrol edin. ØReaksiyonu tekrarlayın. ØReaktiflerin konsantrasyonları doğru mu? ØKalıp ØPrimer ØTaq ØMg. Cl 2 ØHatalı primerler ØDizileri kontrol edin. ØYeni sentez veya yeni tasarım deneyin.

Bant yoksa veya zayıf ise… Ø Kötü kalıp Ø Agaroz jelde kalıp DNA’yı kontrol edin. DNA fazla degrade olabilir. Ø Kalıp DNA PCR inhibitörü içeriyor olabilir (fazla tuz, fenol gibi). Ø Optimal olmayan PCR şartları Ø Bağlanma ısısını düşürün. Ø Mg. Cl 2 konsantrasyonunu arttırın.

Özgün olmayan amplifikasyon var ise… ØÖzgün olmayan amplifikasyonu saptamak için ØAmplikonları agaroz jelde yürütün. ØÜrünün hedeflenen boyda olup olmadığını kontrol edin. ØBunu saptamak için bir moleküler ağırlık standardı kullanın (100 bç, 1 kb merdiven, l/Hind. III gibi) ØÖzgün olmayan amplifikasyonu ortadan kaldırmak için ØAmplifikasyon şartlarını sıkılaştırın ØBağlanma ısısını arttırın ØMg. Cl 2 konsantrasyonunu düşürün ØTermal döngü koşullarını değiştirin ØUzama sürelerini ayarlayın ØDöngü sayısını azaltın ØFarklı primerler deneyin

PCR optimize ederken… ØPCR son derece hassas bir işlemdir. ØHerbir primer çiftinin ayrı optimizasyonu gerekir. ØFarklı PCR cihazlarının (marka ve/veya model) kullanımı PCR’ın sonucunu etkiler. ØOptimize edilmesi gerekenler: ØKonsantrasyonlar ØMg. Cl 2 konsantrasyonu ØPrimer ve kalıp DNA konsantrasyonu ØFazla kalıp PCR’ı engelleyebilir. Kalıp gerekiyorsa seyreltilip kullanılmalıdır. ØTermal döngü şartları ØBağlanma ısısı ØPrimer çiftinin Tm derecesine göre ayarlanır. ØUzama süreleri ØAmplikonun uzunluğu dikkate alınır.

PCR optimize ederken… Ø Gradient PCR cihazları optimizasyon sürecini kolaylaştırır ve kısaltır Ø Bu tip cihazlarda 96’lık veya 48’lik bloğun herbir 8’lik kolonuna farklı bağlanma ısıları uygulamak mümkündür.

PCR optimize ederken… Ø Touch-down (İnen) PCR Ø Özgün olmayan arttırılması ve amplikasyondan Mg. Cl 2 yalnızca bağlanma konsantrasyonunun ısısının düşürülmesi ile kurtulunamıyorsa: Ø Touch-down PCR denenir. Ø Yüksek bağlanma ısısı ile başlanır. (mesela 70 o. C) Ø Az sayıda da olsa hedef dizinin amplifiye olması beklenir. Ø Bağlanma ısısı döngü sayısı ilerledikçe düşürülür. Ø Amplifiye olmaya başlayan hedef dizinin kalıp popülasyondaki oranı arttığı için düşen ısıda artık yalnızca hedef dizi çoğalacaktır.

PCR Destek Kuvvetler… Ø DMSO %2 -10 Fazlası Taq aktivitesini düşürür. Kalıp DNA’nın oluşturduğu ikincil yapıları çözer. Özellikle GC oranı yüksek hedef bölgelerin çoğaltılması için kullanılabilir. Ø Betain 1 -1. 7 M DMSO ile aynı amaçla kullanılabilir. Ø Formamid %1 -5 Mümkün olduğunca az kullanılmalı. İkincil yapıların önlenmesinde kullanılabilir. Ø Non iyonik deterjanlar (Tween 20 -Non. Idet P 40 - Triton. X) Ø %0. 1 -1 arası kullanılabilir. %0. 1 Taq’ı stabilize eder ancak özgün olmayan amplifikasyonu teşvik edebilir. %0. 5 kullanımı daha garantilidir.

PCR optimize ederken… Ø 7 deaza-2 deoksi guanozin. Stabil ikincil yapı oluşturan GC oranı çok yüksek hedef bölgelerde amplifikasyonu d. GTP ile 1: 3 oranında ilave edilmek suretiyle verimli bir şekilde sağlar. Ø BSA (bovine serum albumin) Eski DNA materyellerinden yapılan amplifikasyonlarında kullanılabilir. PCR inhibitörlerinin etkisini azaltır.

Optimizasyon Örnekleri

Exon 1(1509 bç): Mg: 2, 2, 5, 3 m. M, %5 DMSO, 60ºC 2 m. M 2, 5 m. M 3 m. M

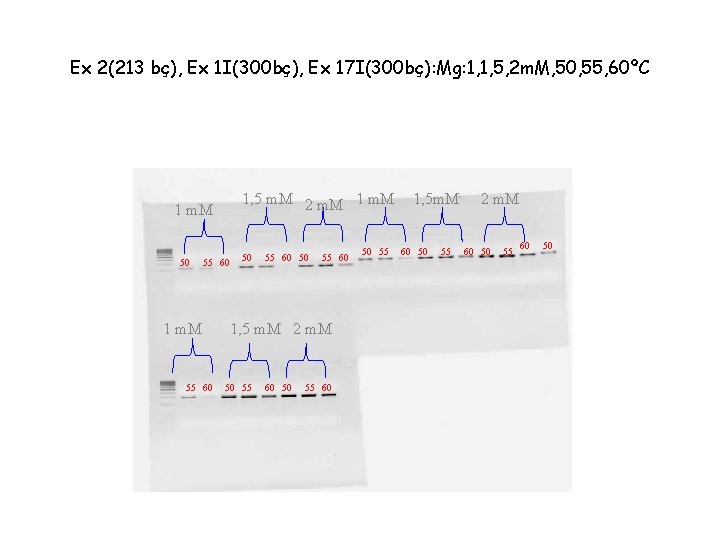
Ex 2(213 bç), Ex 1 I(300 bç), Ex 17 I(300 bç): Mg: 1, 1, 5, 2 m. M, 50, 55, 60ºC 1, 5 m. M 2 m. M 1 m. M 50 55 60 1 m. M 55 60 50 55 60 1, 5 m. M 2 m. M 50 55 60 50 55 1, 5 m. M 60 50 55 2 m. M 60 50 55 60 50

Ex 1 I (300 bç): ilk 12 örnek 60 -63 ºC, 1, 1, 5, 2 m. M Mg 60 61 62 63 55 60 64 65 1 m. M 1, 5 m M 2 m M 63 65 2 m M

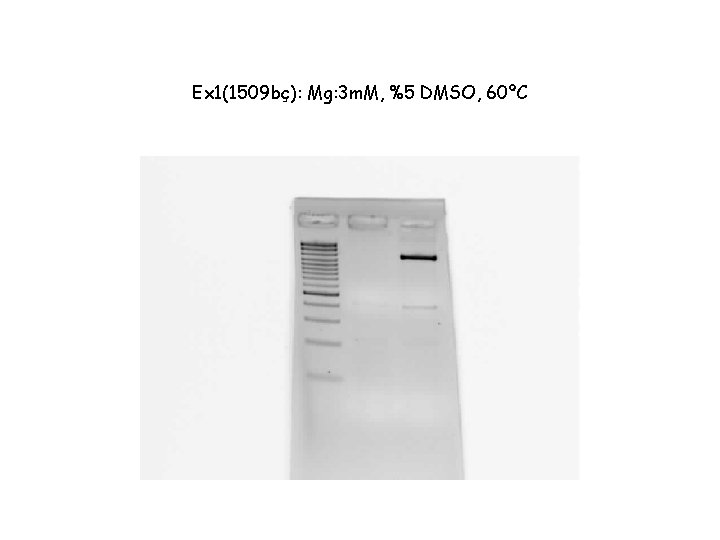
Ex 1(1509 bç): Mg: 3 m. M, %5 DMSO, 60ºC

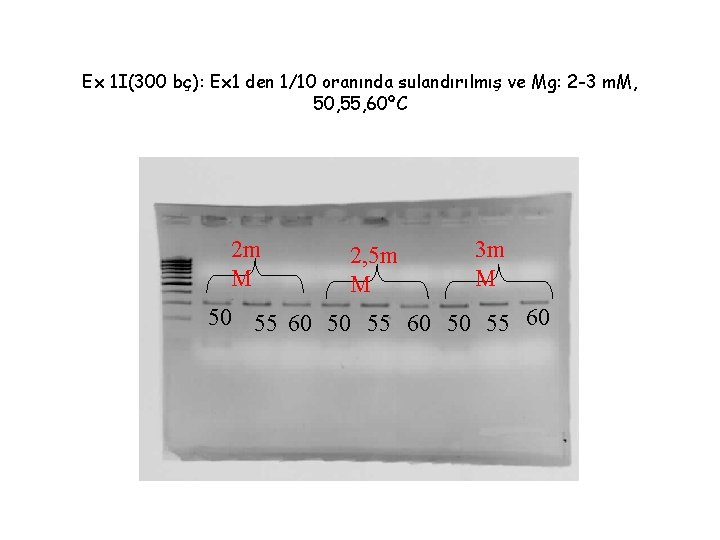
Ex 1 I(300 bç): Ex 1 den 1/10 oranında sulandırılmış ve Mg: 2 -3 m. M, 50, 55, 60ºC 2 m M 2, 5 m M 3 m M 50 55 60
 Hafta i
Hafta i Voicethread nedir
Voicethread nedir Hafta i
Hafta i Destek eğitim nedir
Destek eğitim nedir Nitrazinli ped takibi
Nitrazinli ped takibi Httpsfacebook
Httpsfacebook Kariyer tekeri
Kariyer tekeri Kuantum öğrenme ve beyin temelli öğrenme
Kuantum öğrenme ve beyin temelli öğrenme Risk analiz yöntemleri
Risk analiz yöntemleri Süreç temelli yazma yaklaşımı
Süreç temelli yazma yaklaşımı Laktosin
Laktosin Heritabilitas adalah
Heritabilitas adalah Biokemi og genetik
Biokemi og genetik Apa itu genetik
Apa itu genetik Partenogenez
Partenogenez Materi genetik sebuah sel eukariotik tersimpan di .... *
Materi genetik sebuah sel eukariotik tersimpan di .... * Genetik grundbegriffe
Genetik grundbegriffe Buta warna terpaut kromosom apa
Buta warna terpaut kromosom apa Biokemi og genetik
Biokemi og genetik Phisiognomi
Phisiognomi Canlılarda kalıtımı sağlayan genetik birim
Canlılarda kalıtımı sağlayan genetik birim Genetik kopyalama nedir
Genetik kopyalama nedir Dna komplemen
Dna komplemen Susunan genetik tanaman menyerbuk sendiri
Susunan genetik tanaman menyerbuk sendiri Poliploidi
Poliploidi