Croissance tumorale C Hennequin Service de CancrologieRadiothrapie Hpital



























- Slides: 54

Croissance tumorale C. Hennequin Service de Cancérologie-Radiothérapie, Hôpital saint-Louis

L’organisme humain est pluricellulaire et pluritissulaire Tous les tissus de régénèrent (sauf le tissu nerveux noble, les neurones) C’est à dire: Les cellules maturent puis meurent Et sont remplaçées par Division cellulaire (mitose) des cell. Jeunes (Cell. Souche) Þ Formation de cell. Identiques, dont l’une va maturer Þ Et l’autre n’évolue pas (reste cell. Souche).

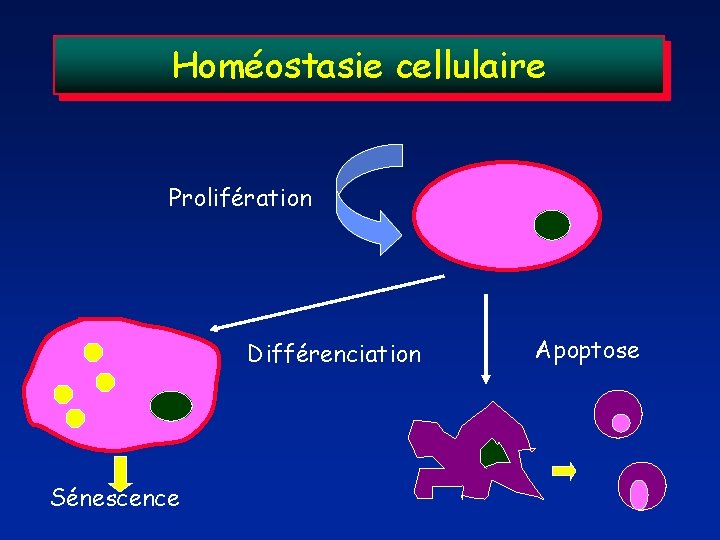
Homéostasie cellulaire Prolifération Différenciation Sénescence Apoptose

Cancérogénése: perte de l’homéostasie cellulaire Pour diverses raisons, une ou plusieurs cellules Se mettent à proliférer Et ne respectent plus les besoins normaux du tissu

Cancer: maladie de l’ADN Succession dans une même cellule de mutations: - sur des gênes normaux impliqués dans le processus de division cellulaire (proto-oncogéne ----------> oncogéne) mutation - Perte des génes « suppresseurs » (p 53; Rb) - Amplifications: multiples copies d’un géne - Délétions: perte d’un géne - Translocations d’un géne sur un autre: -=> création d’une nouvelle protéine hybride

Cancérogénése: Processus multi-étapes Initiation: Altération du génome d’une cellule normale • Pas de modifications phénotypiques • Non suffisante à la cancérogénése Promotion: Processus prolongé • Nécessitant des expositions répétées à des agents carcinogénes • Anomalies du noyau Progression: Divisions successives et dévellopement du clone malin

Les caractéristiques du cancer 1. Auto-suffisance en facteurs de croissance 2. Insensibilité aux signaux inhibiteurs de croissance 3. Absence d’apoptose 4. Potentiel réplicatif illimité 5. Capacité d’angiogénése 6. Capacité d’invasivité et de métastaser Hanahan & Weinberg, Cell, 2000

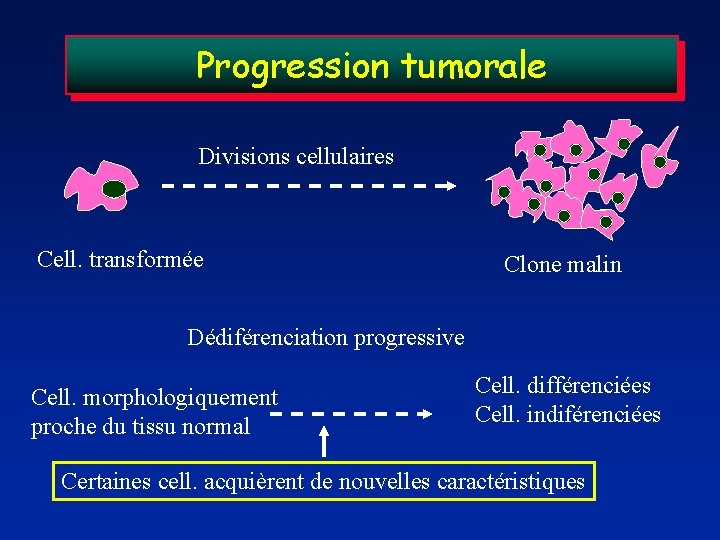
Progression tumorale Divisions cellulaires Cell. transformée Clone malin Dédiférenciation progressive Cell. morphologiquement proche du tissu normal Cell. différenciées Cell. indiférenciées Certaines cell. acquièrent de nouvelles caractéristiques

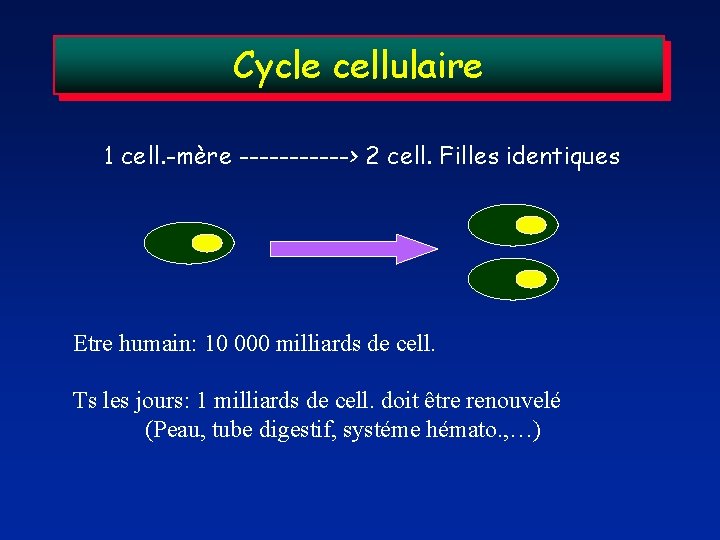
Cycle cellulaire 1 cell. -mère ------> 2 cell. Filles identiques Etre humain: 10 000 milliards de cell. Ts les jours: 1 milliards de cell. doit être renouvelé (Peau, tube digestif, systéme hémato. , …)

Croissance exponentielle Après X cyles => Nbre de cell: 2 X Après 30 cycles: 230 ou 109 cellules --> 1 gr Après 40 cycles: 1012 cell. : ---> 1 kg Si on considère que le temps de cycle (Tc) est constant: 108 N = N 0. 2 t/Tc N 0: Nbre initial de cell. t: durée de la croisance cellulaire 106 104 102 100 Nbre de Tps de doublement

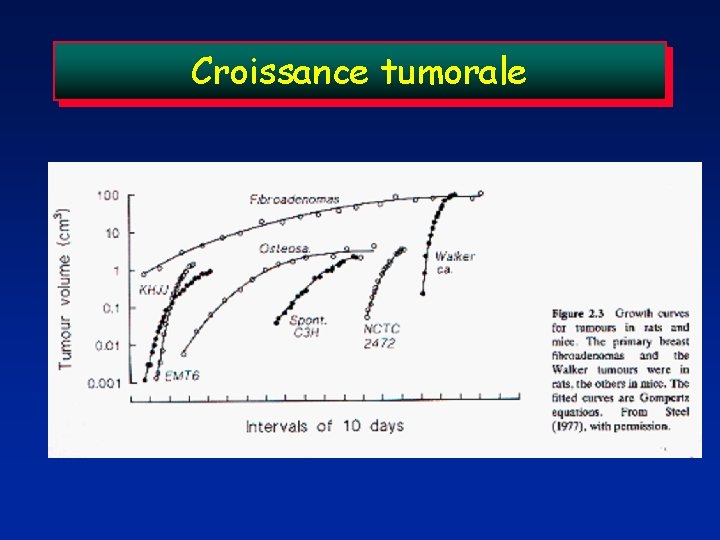
Croissance tumorale

Croissance tumorale Temps de doublement (TD): temps pendant lequel le nombre de cellules tumorales a doublé Mesure difficile Croissance exponentielle: 1 cell. --> 2 cells --> 4 cell. --> 8 cell. --> Vitesse de croissance <---> temps de cycle cellulaire Croissance non exponentielle Car: pertes cellulaires, cellules quiescentes,

Croissance tumorale: compartiments cellulaire Cellules proliférantes, En cycle Cellules stériles Ou différenciées Cellules quiescentes (G 0) Cellules mortes Pertes cellulaires: - Nécrose - Apoptose - Différenciation

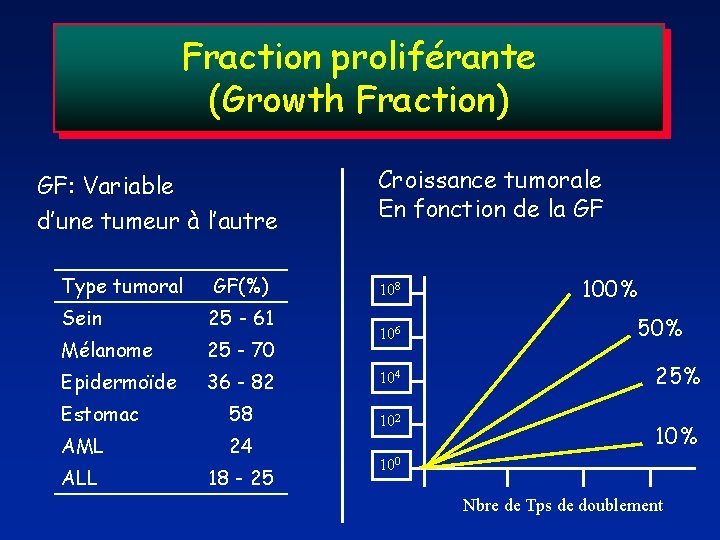
Fraction proliférante (Growth Fraction) GF: Variable d’une tumeur à l’autre Type tumoral GF(%) Sein 25 - 61 Mélanome 25 - 70 Epidermoïde 36 - 82 Estomac 58 AML 24 ALL 18 - 25 Croissance tumorale En fonction de la GF 108 106 104 102 100% 50% 25% 100 Nbre de Tps de doublement

Pertes cellulaires Exprimées en: Taux (KL) : fraction de cell. perdues par unité de temps Fraction: (cell loss factor) Nbre de cell. Perdues/Nbre de cell. naissantes Peau, Muqueuses, Intestin: en perpétuel remaniement Facteur de perte cellulaire (cell loss factor): 1. 0 ou 100%

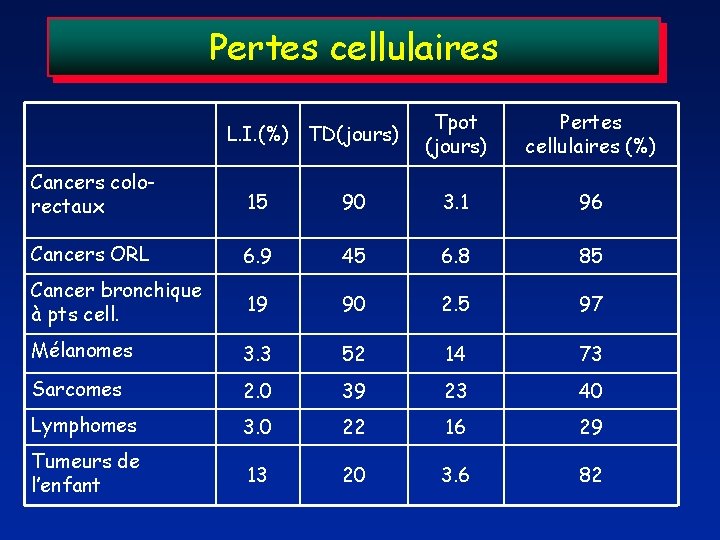
Pertes cellulaires L. I. (%) TD(jours) Tpot (jours) Pertes cellulaires (%) Cancers colorectaux 15 90 3. 1 96 Cancers ORL 6. 9 45 6. 8 85 Cancer bronchique à pts cell. 19 90 2. 5 97 Mélanomes 3. 3 52 14 73 Sarcomes 2. 0 39 23 40 Lymphomes 3. 0 22 16 29 Tumeurs de l’enfant 13 20 3. 6 82

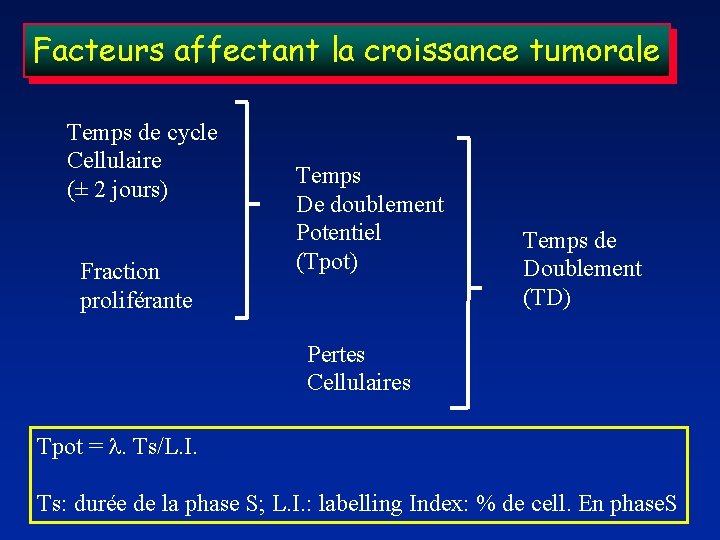
Facteurs affectant la croissance tumorale Temps de cycle Cellulaire (± 2 jours) Fraction proliférante Temps De doublement Potentiel (Tpot) Temps de Doublement (TD) Pertes Cellulaires Tpot = l. Ts/L. I. Ts: durée de la phase S; L. I. : labelling Index: % de cell. En phase. S

Croissance tumorale Si GF et Cell loss factor restent constants => croissance exponentielle En fait, GF et pertes cellulaires varient en fonction du volume tumoral – GF diminue avec le temps – Les pertes cellulaires augmentent

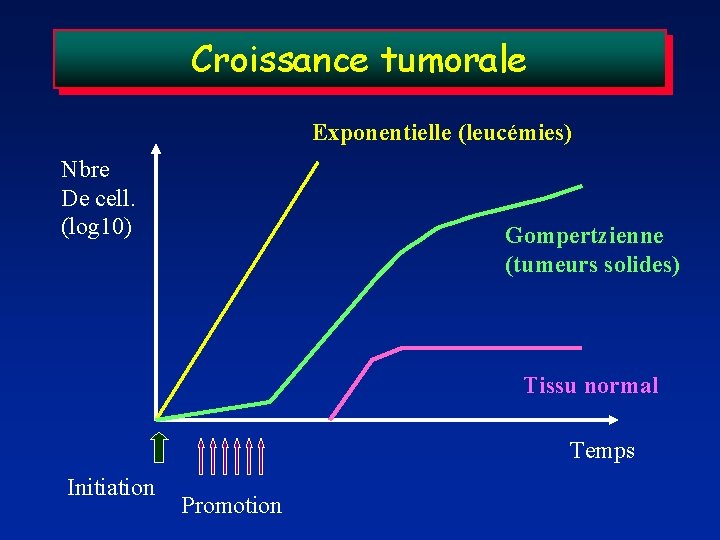
Croissance tumorale Exponentielle (leucémies) Nbre De cell. (log 10) Gompertzienne (tumeurs solides) Tissu normal Temps Initiation Promotion

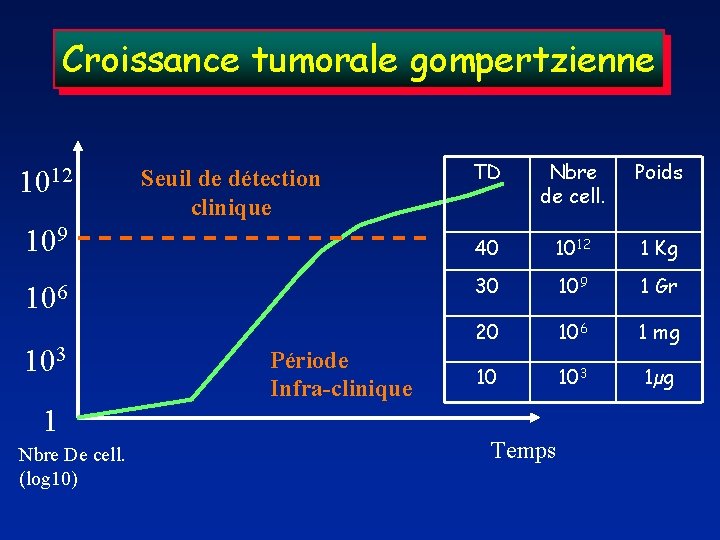
Croissance tumorale gompertzienne 1012 Seuil de détection clinique 109 106 103 1 Nbre De cell. (log 10) Période Infra-clinique TD Nbre de cell. Poids 40 1012 1 Kg 30 109 1 Gr 20 106 1 mg 10 103 1µg Temps

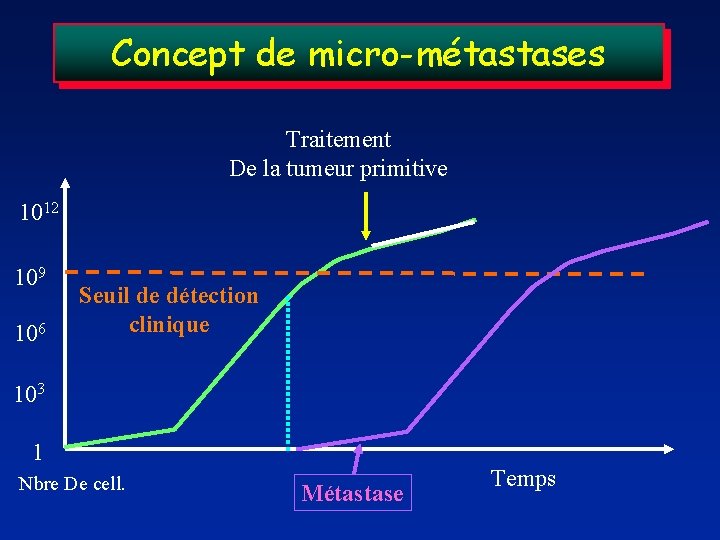
Concept de micro-métastases Traitement De la tumeur primitive 1012 109 106 Seuil de détection clinique 103 1 Nbre De cell. Métastase Temps

Croissance tumorale: evaluation en pratique clinique 1. Clinique: Mesure des nodules cutanés, des ganglions Ø Schéma daté 2. Radiologique: Ø mesure des masses tumorales au scanner 3. Biologique: Marqueurs tumoraux Ø Myélome: secrétion d’immunoglobulines Ø Tumeurs solides: ACE, CA 15 -3; CA 125; PSA Ø BHCG; a foetoprotéine

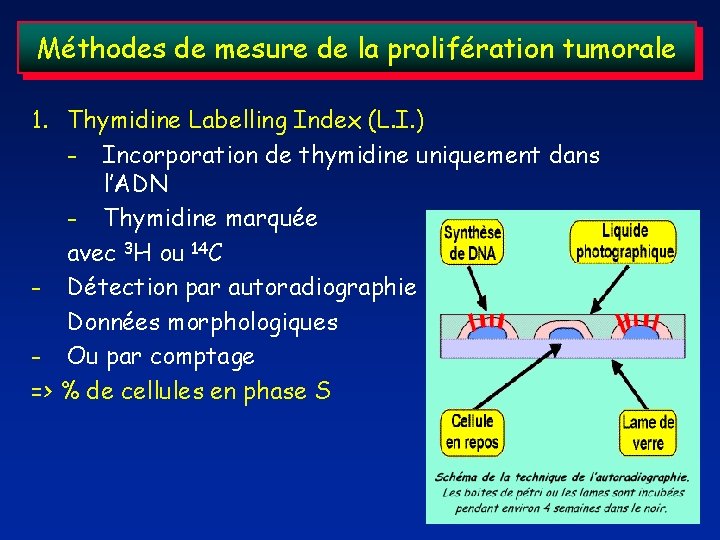
Méthodes de mesure de la prolifération tumorale 1. Thymidine Labelling Index (L. I. ) - Incorporation de thymidine uniquement dans l’ADN - Thymidine marquée avec 3 H ou 14 C - Détection par autoradiographie Données morphologiques - Ou par comptage => % de cellules en phase S

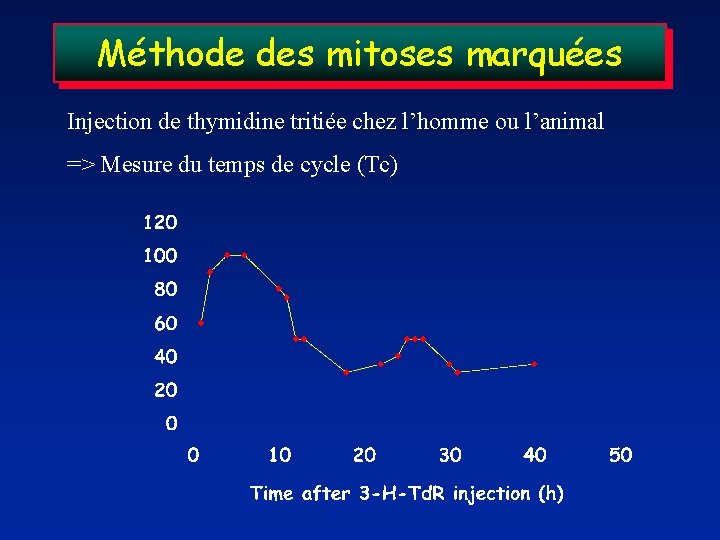
Méthode des mitoses marquées Injection de thymidine tritiée chez l’homme ou l’animal => Mesure du temps de cycle (Tc)

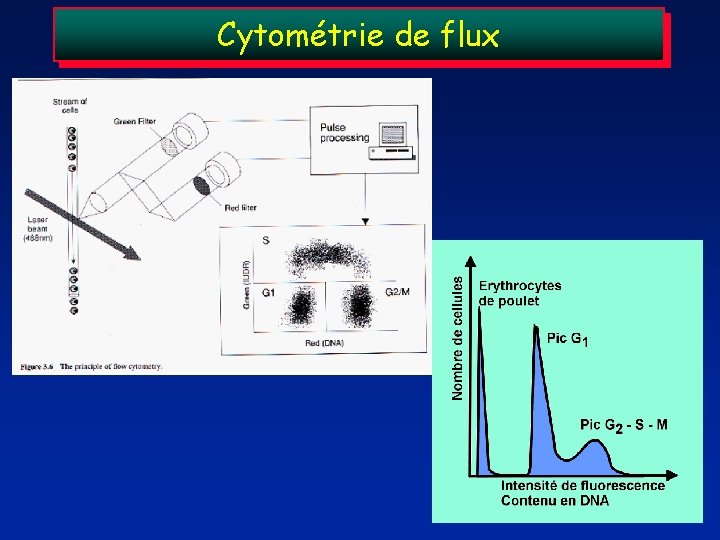
2. Cytométrie de flux Les cell. Passent une par une dans un faisceau laser (jusqu’à 10 000 cell. /sec) Information sur la taille cellulaire Marquage par Iodure de Propidium : colorant rouge => se fixe sur l’ADN => Qtte d’ADN Nbre de cell. En phase S Index de l’ADN (ploïdie)

Cytométrie de flux

Marquages aux analogues de la thymidine - Dérivés halogénés: ü Bromo-deoxy. Uridine (Brd. Ur) ü Iodo-deoxy. Uridine (IUd. R ü même métabolisme que la thymidine ü Détectés par Ac. Monoclonaux marqués Par un colorant Þ Couleur verte en Cyto. Fluo. Þ Nbre de Cell. En phase S Þ Avec des mesures répétées dans le temps: mesure du Tc

Mesure du Tpot chez l’homme (relative movement) Mesure du Ts, LI et Tpot avec une seule biopsie Injection IV de Br. Udr ou Id. Urd Quelques heures (temps t) après biopsie tumorale Analyse mathématique en fonction du temps t en assumant que la progression dans le cycle est linéaire pour toutes les cellules

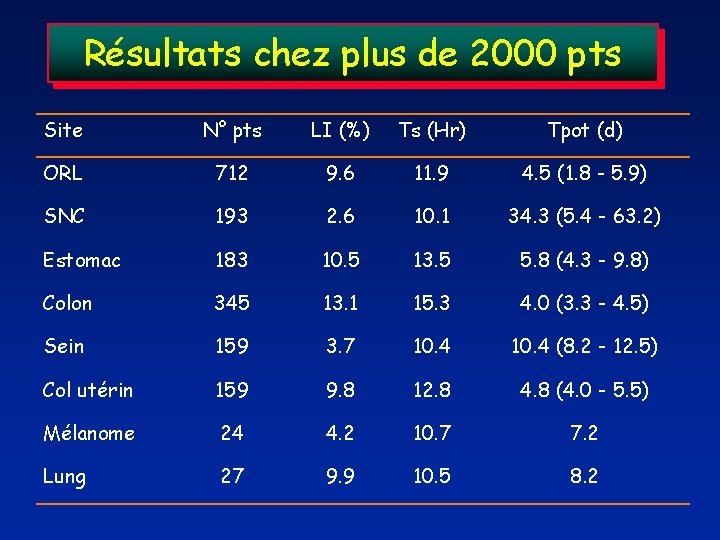
Résultats chez plus de 2000 pts Site N° pts LI (%) Ts (Hr) Tpot (d) ORL 712 9. 6 11. 9 4. 5 (1. 8 - 5. 9) SNC 193 2. 6 10. 1 34. 3 (5. 4 - 63. 2) Estomac 183 10. 5 13. 5 5. 8 (4. 3 - 9. 8) Colon 345 13. 1 15. 3 4. 0 (3. 3 - 4. 5) Sein 159 3. 7 10. 4 (8. 2 - 12. 5) Col utérin 159 9. 8 12. 8 4. 8 (4. 0 - 5. 5) Mélanome 24 4. 2 10. 7 7. 2 Lung 27 9. 9 10. 5 8. 2

Marqueurs de proliferation – Détectés par IHC – Ki 67 • proteine nucléaire associée aux cell. proliférantes • Facteur pronostique – DNA polymérases – PCNA, auxillaire de la DNA polymérase • Mesure de la fraction de cell. En phase S – Cyclines, en particulier la cycline D 1 (Cancer du sein) – Histones H 3 (Phase S) et H 4 – Marquage des régions organisatrices du nucléoles (argyrophiles)

Hétérogénéité de la prolifération au sein d’une même tumeur La prolifération cellulaire est différente d’une région tumorale à l’autre Dépend étroitement de la vascularisation (Tannock, 1968) – Les cell. Proches des Vx prolifèrent – et la GF diminue au fur et à mesure qu’on s’éloigne des capillaires

Implications cliniques Cinétique tumorale: facteur pronostique ? Implications pour les traitements

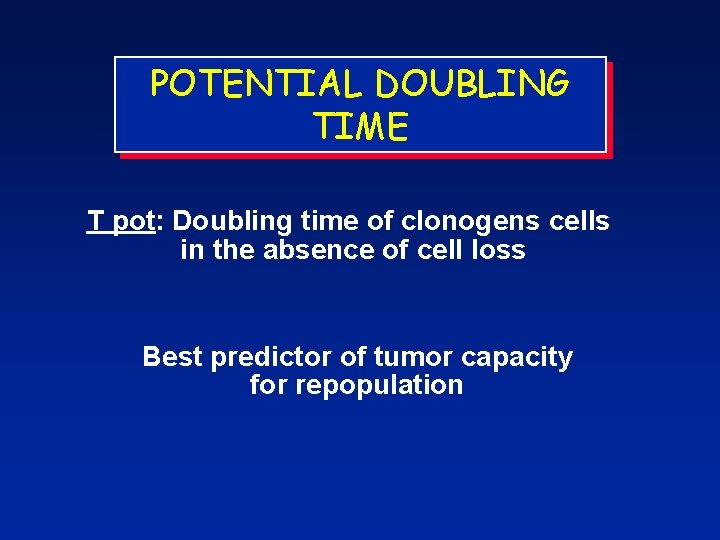
POTENTIAL DOUBLING TIME T pot: Doubling time of clonogens cells in the absence of cell loss Best predictor of tumor capacity for repopulation

MEASURE OF THE T pot In vivo measurement IV Infusion of Brd. Urd Biopsy of the tumor 4 to 8 hours after Brd. Urd Cellular preparation with anti-Brd. Urd Mo. Ab and propidium iodide Flow cytometry LI: Labelling index: % of cells incorporating Brd. Urd Ts: duration of DNA phase S T pot: Ts/LI

EORTC STUDY Begg, IJROBP, 1990 Randomized study beetween Conventional RT and hyperfractionation T pot was analysed in 53 pts Results: • Ts = 10, 7 hours (± 4. 7) • LI = 11. 7% • T pot = 4, 5 days

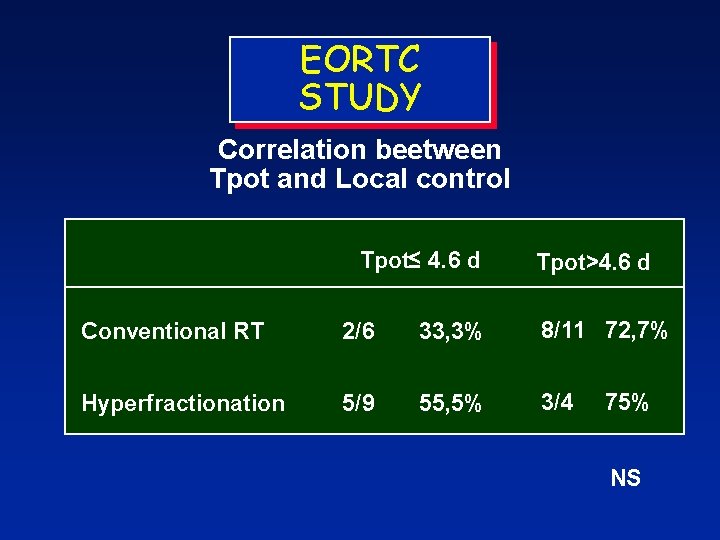
EORTC STUDY Correlation beetween Tpot and Local control Tpot≤ 4. 6 d Tpot>4. 6 d Conventional RT 2/6 33, 3% 8/11 72, 7% Hyperfractionation 5/9 55, 5% 3/4 75% NS

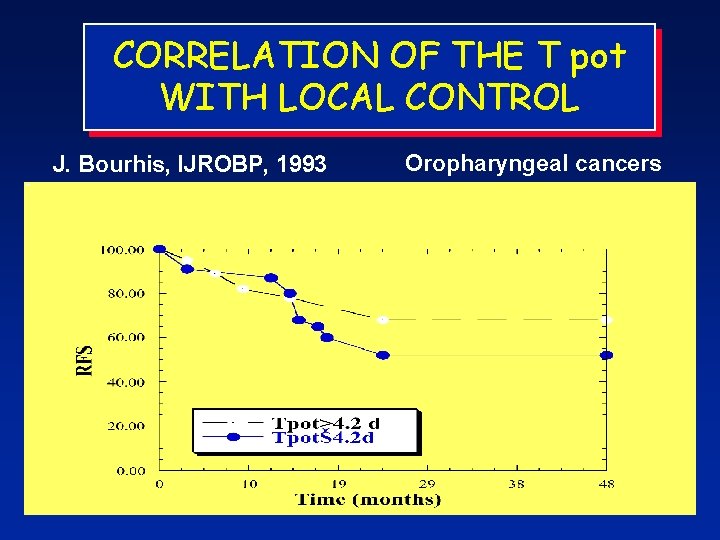
CORRELATION OF THE T pot WITH LOCAL CONTROL J. Bourhis, IJROBP, 1993 Oropharyngeal cancers 48 Pts ns

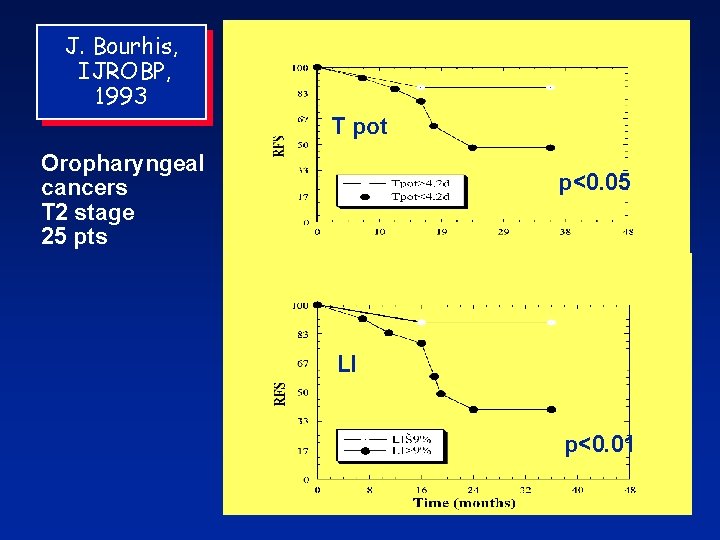
J. Bourhis, IJROBP, 1993 T pot Oropharyngeal cancers T 2 stage 25 pts p<0. 05 LI p<0. 01

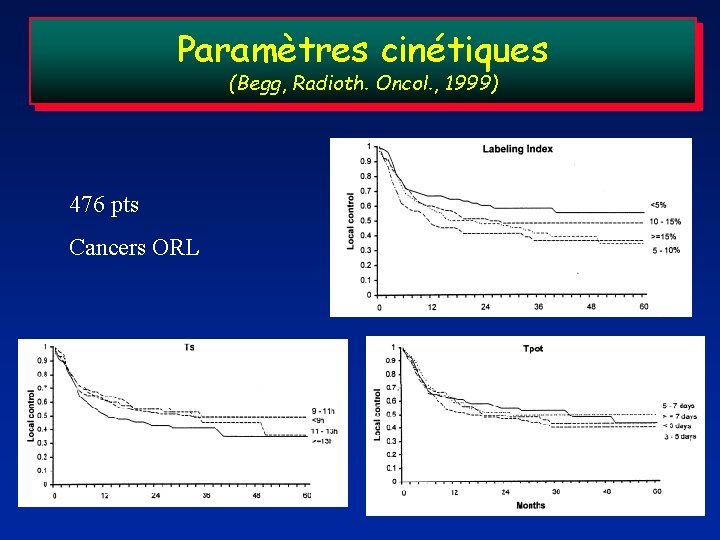
Marqueurs cinétiques: une réelle valeur pronostique ? Compilation des séries de 11 centres dans les cancers ORL (Begg, Radioth. Oncol. , 1999) Tpot: aucune valeur pronostique LI: valeur pronostique en univariée – Qui disparaît en multivariée Abandon de la technique

Paramètres cinétiques (Begg, Radioth. Oncol. , 1999) 476 pts Cancers ORL

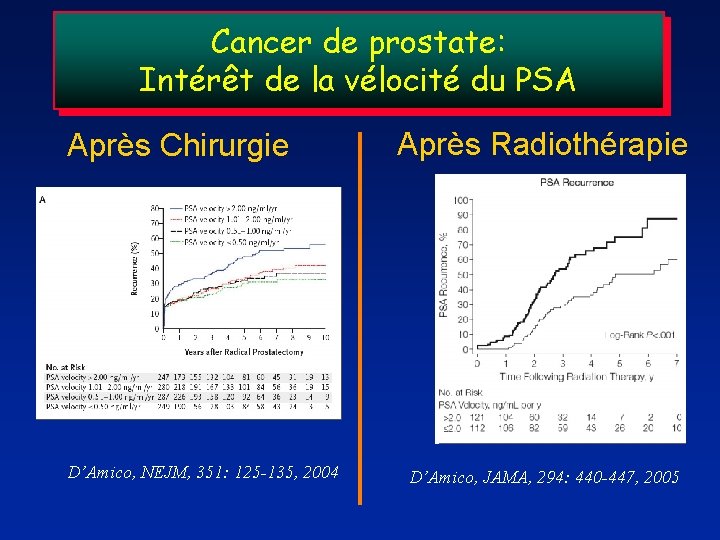
Cancer de prostate: Intérêt de la vélocité du PSA Après Chirurgie D’Amico, NEJM, 351: 125 -135, 2004 Après Radiothérapie D’Amico, JAMA, 294: 440 -447, 2005

Implications pour les traitements Chimiothérapie Radiothérapie Durée de traitement Permet à la tumeur de croître entre les cycles ou les séances Chimiothérapie: concept de dose-intensité Radiothérapie: étalement

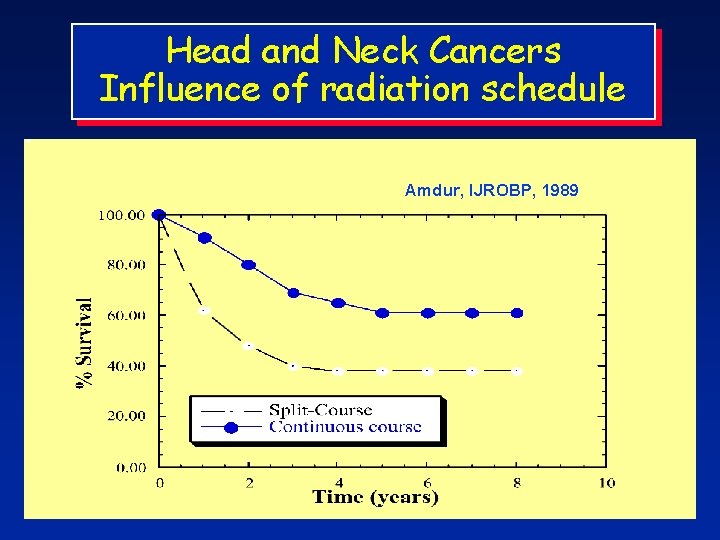
Carcinoma of the Larynx J. Overgaard, Acta Oncologica, 1988 Frequency of local tumour control and late radiation morbidity Schedule Tumour control Late oedema Fistula 57 Gy daily rad. 63± 3% 2± 1% 23± 6% 60 Gy daily rad. 74± 4% 6± 2% 21± 9% 68 Gy split-course 61± 8% 24± 7% 75± 21% 72 Gy split-course 73± 6% 53± 6% 92± 8%

Head and Neck Cancers Influence of radiation schedule Amdur, IJROBP, 1989

LITTERATURE REVIEW OF CORRELATION BEETWEEN LOCAL CONTROL AND OVERALL TREATMENT TIME JF. Fowler, IJROBP, 1992 12 published clinical results have been reviewed A significant loss of local control was observed with prolongation of radiotherapy Loss of local control per week: 14% [3 -25%]

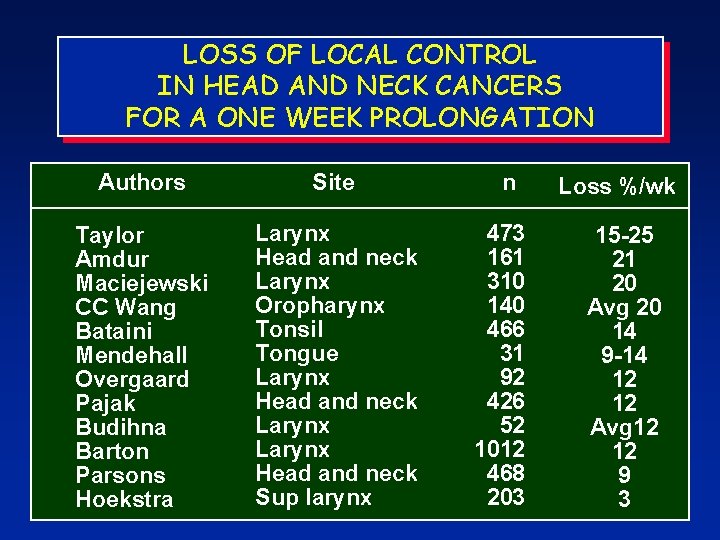
LOSS OF LOCAL CONTROL IN HEAD AND NECK CANCERS FOR A ONE WEEK PROLONGATION Authors Site Taylor Amdur Maciejewski CC Wang Bataini Mendehall Overgaard Pajak Budihna Barton Parsons Hoekstra Larynx Head and neck Larynx Oropharynx Tonsil Tongue Larynx Head and neck Sup larynx n 473 161 310 140 466 31 92 426 52 1012 468 203 Loss %/wk 15 -25 21 20 Avg 20 14 9 -14 12 12 Avg 12 12 9 3

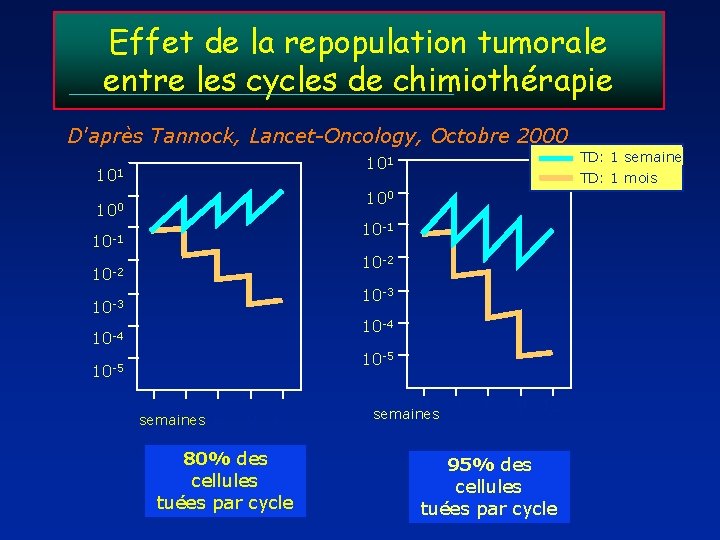
Effet de la repopulation tumorale entre les cycles de chimiothérapie D'après Tannock, Lancet-Oncology, Octobre 2000 101 TD: 1 mois 100 10 -1 10 -2 10 -3 10 -4 10 -5 semaines 0 3 6 9 12 80% des cellules tuées par cycle TD: 1 semaine 0 semaines 3 6 9 12 95% des cellules tuées par cycle

Modifications du fractionnement Fractionnement standard: 5 x 2 Gy/ semaine 70 Gy <------> 7 semaines Fractionnement accéléré: Dose identique, en moins de temps But: combattre la repopulation tumorale Hyperfractionnement: Augmentation de la dose totale en diminuant la dose par fraction (utiliser au maximum l ’effet différentiel) Tumeur/tissu sain Etalement identique

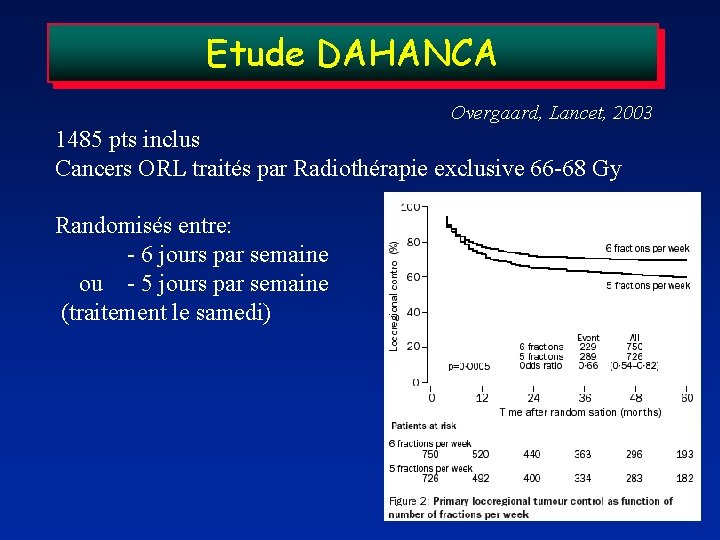
Etude DAHANCA Overgaard, Lancet, 2003 1485 pts inclus Cancers ORL traités par Radiothérapie exclusive 66 -68 Gy Randomisés entre: - 6 jours par semaine ou - 5 jours par semaine (traitement le samedi)

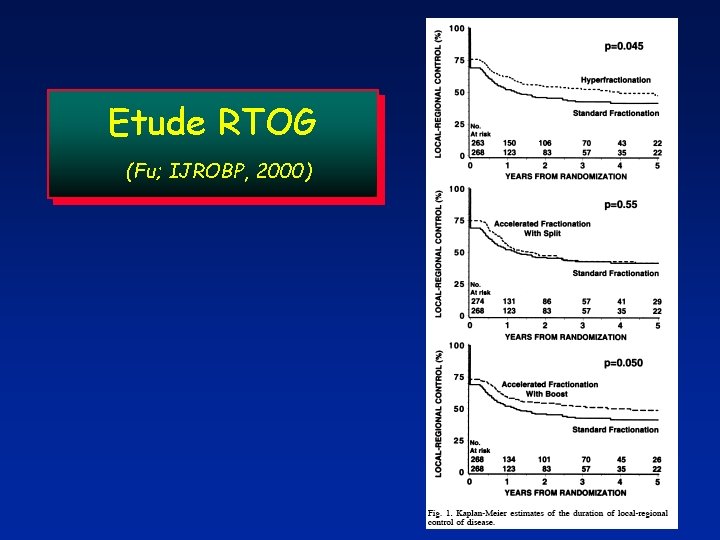
Etude RTOG (Fu; IJROBP, 2000) 70 Gy; 35 F; 7 wks CF 81. 6 Gy; 68 F; 6. 8 wks HFX 67. 2 Gy; 42 F; 6 wks AFX-S AFX - CB 72 Gy; 42 F; 6 wks

Etude RTOG (Fu; IJROBP, 2000)

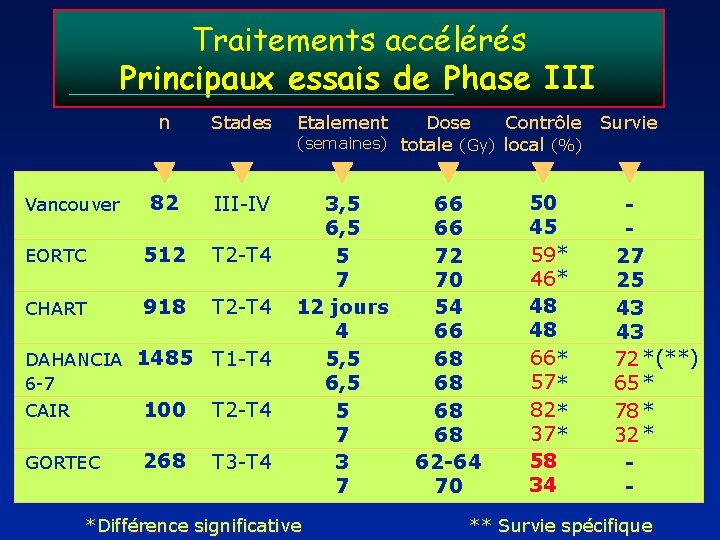
Traitements accélérés Principaux essais de Phase III n Stades Etalement 82 III-IV EORTC 512 T 2 -T 4 CHART 918 T 2 -T 4 3, 5 6, 5 5 7 12 jours 4 5, 5 6, 5 5 7 3 7 Vancouver DAHANCIA 1485 6 -7 T 1 -T 4 CAIR 100 T 2 -T 4 GORTEC 268 T 3 -T 4 Dose Contrôle Survie (semaines) totale (Gy) local (%) *Différence significative 66 66 72 70 54 66 68 68 62 -64 70 50 45 59* 46* 48 48 66* 57* 82* 37* 58 34 27 25 43 43 72 *(**) 65 * 78 * 32 * - ** Survie spécifique

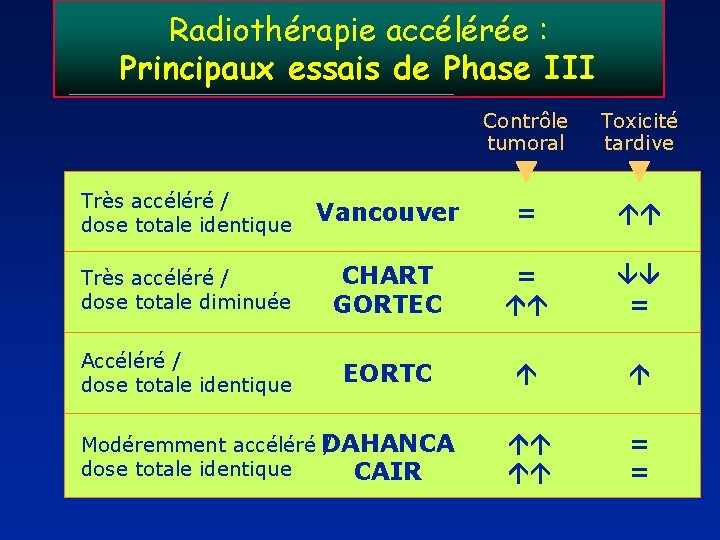
Radiothérapie accélérée : Principaux essais de Phase III Contrôle tumoral Toxicité tardive Très accéléré / dose totale identique Vancouver = Très accéléré / dose totale diminuée CHART GORTEC = = Accéléré / dose totale identique EORTC = = Modéremment accéléré DAHANCA / dose totale identique CAIR

Cinétique cellulaire Un composant fondamental de la réflexion en cancérologie
 Embolo neoplastico
Embolo neoplastico Gica marker tumorale
Gica marker tumorale Tps marcatore tumorale
Tps marcatore tumorale Contribution à la croissance
Contribution à la croissance Croissance somatique
Croissance somatique Contribution à la croissance
Contribution à la croissance Croissance
Croissance Portefeuille chorus ii croissance
Portefeuille chorus ii croissance La croissance intensive
La croissance intensive Triangle de croissance sijori
Triangle de croissance sijori Croissance intensive
Croissance intensive Abeille croissance continue ou discontinue
Abeille croissance continue ou discontinue Stagnation poids bébé
Stagnation poids bébé Facteurs de croissance hématopoïétiques
Facteurs de croissance hématopoïétiques Gligot
Gligot Les sources de la croissance
Les sources de la croissance Class of service vs quality of service
Class of service vs quality of service Adp self pay
Adp self pay Continual service improvement 7 steps
Continual service improvement 7 steps New service development process cycle
New service development process cycle Zones of tolerance are a source of desired expectations.
Zones of tolerance are a source of desired expectations. Service owner vs service manager
Service owner vs service manager Itil service lifecycle model
Itil service lifecycle model Soa architecture
Soa architecture Service improvement plan for service desk
Service improvement plan for service desk Itil service lifecycle service strategy
Itil service lifecycle service strategy Azure service fabric
Azure service fabric Laundry service dialogue
Laundry service dialogue Kontorskaffe service
Kontorskaffe service Need a service chapter 15
Need a service chapter 15 Nutritive subsystem
Nutritive subsystem Croatian meteorological and hydrological service
Croatian meteorological and hydrological service Fido metadata service
Fido metadata service Implicit service
Implicit service Unacknowledged connectionless service
Unacknowledged connectionless service Verbal communication in customer service
Verbal communication in customer service Automated valuation service
Automated valuation service Customer as productive resources
Customer as productive resources Mef epl
Mef epl купить trio ancillaries
купить trio ancillaries Contoh kartu aset tetap
Contoh kartu aset tetap Advantages of food service system
Advantages of food service system Service rendered on credit
Service rendered on credit Achch
Achch Organigrama
Organigrama Criterion online writing evaluation service
Criterion online writing evaluation service Service oriented architecture notes
Service oriented architecture notes Aligning service design and standards
Aligning service design and standards Best prepaid legal services
Best prepaid legal services Airmec instal
Airmec instal Service delivery manager itil definition
Service delivery manager itil definition Fundamentals of food and beverage service operation
Fundamentals of food and beverage service operation Rater service quality
Rater service quality Amazon aws enterprise service bus
Amazon aws enterprise service bus Julie daubié
Julie daubié