Cellules souches et cellules prolifrantes Rgulation de la






















- Slides: 68

Cellules souches et cellules proliférantes. Régulation de la différenciation cellulaire Master Physiopathologie cellulaire et moléculaire 29 septembre 2010 L. Mauvieux

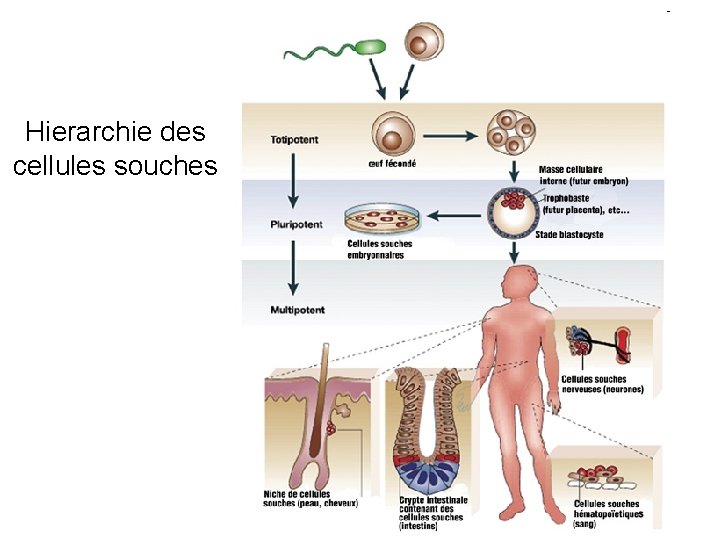
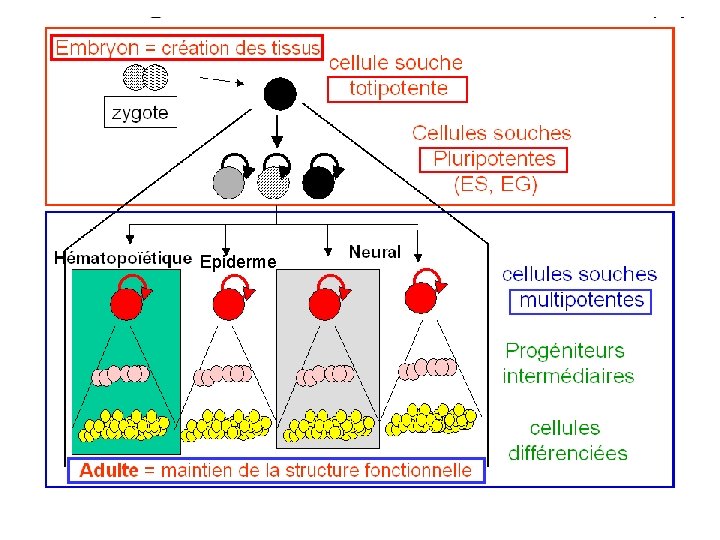
Concept de la cellule souche • Cellule à longue durée de vie • Capable d’auto-renouvellement (duplication sans perte des capacités de développement) • Pouvant donner naissance à de multiples types cellulaires (différenciation) • Dans les conditions adéquates, peuvent se différencier en cellules originaires normalement des 3 couches embryonnaires: endoderme, mésoderme ectodermes • Capables de Prolifération • De régénérer des tissus après blessure • De plasticité dans ces différentes options

Hierarchie des cellules souches

Epiderme

Jargon des cellules souches Potence définit la capacité à se différencier en différents types cellulaires Pluripotent pouvant donner naissance à tous les types cellulaires adultes Les cellules souches embryonnaires sont pluri-potentes Multipotent pouvant se différencier en de multiples types de cellules spécialisées, mais pas toutes les cellules souches tissulaires (adultes) sont multipotentes

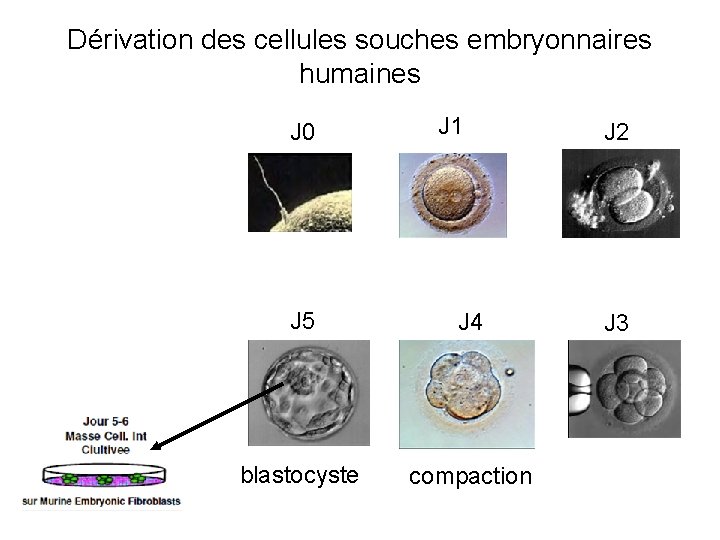
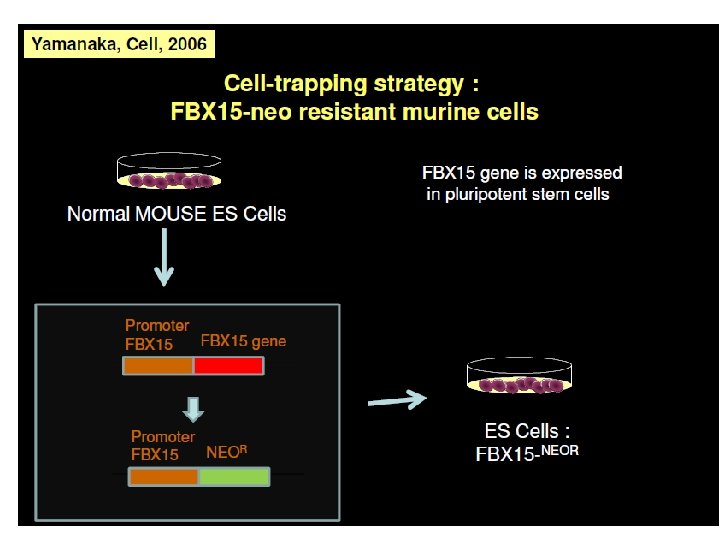
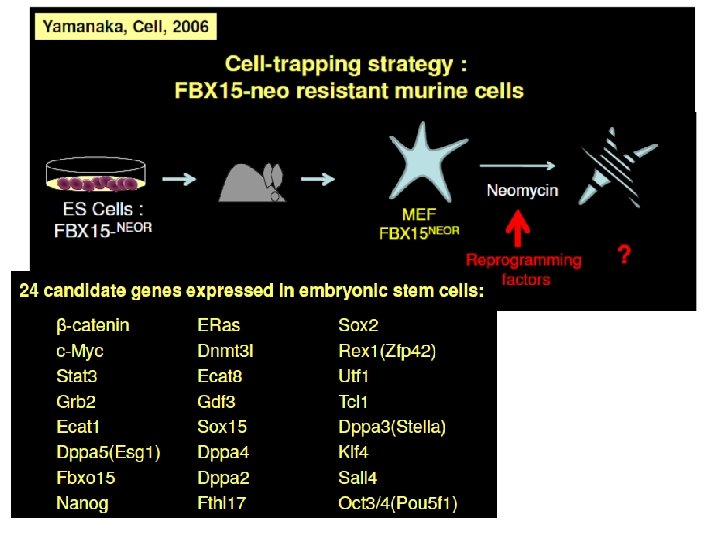
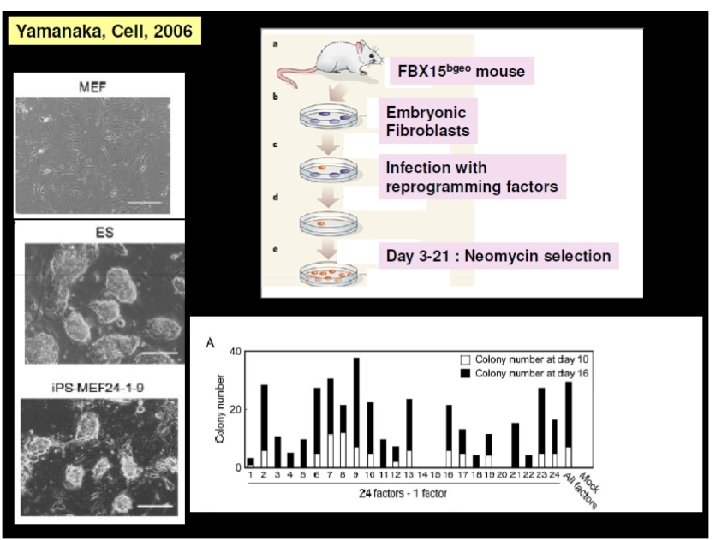
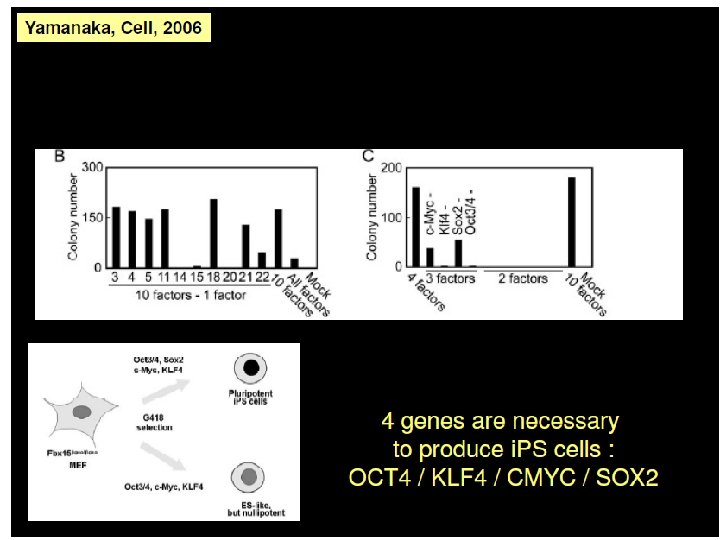
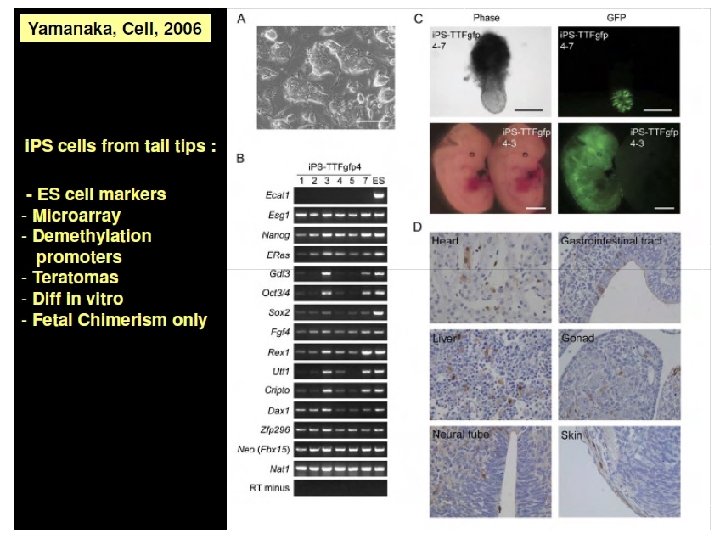
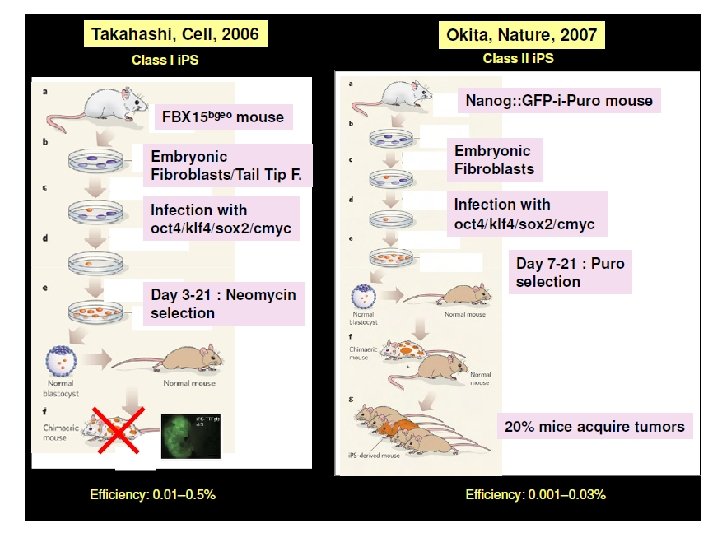
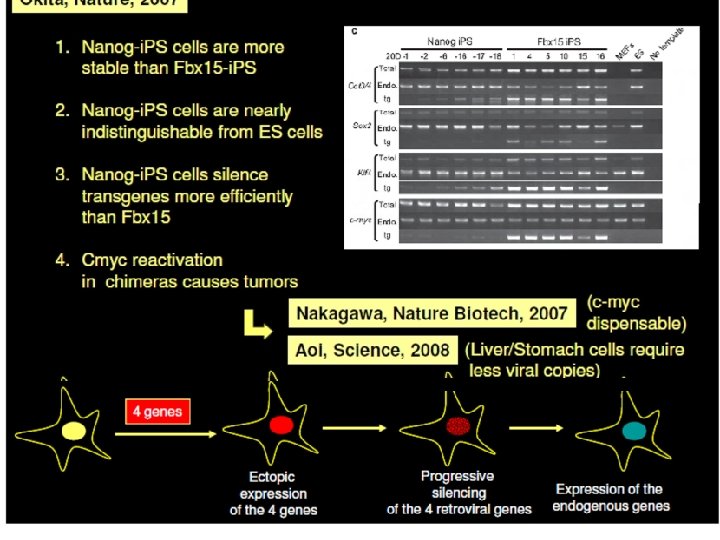
Cellules souches embryonnaires: – 1) Cellules ES • Dérivées du blastocyste en culture • Par transfert nucléaire d’une cellule somatique dans un œuf énucléé – 2) Cellules somatiques « reprogrammées » • « induced pluripotent stem cells » (i. PS) – TFs, Oct 4, Sox 2, c. Myc and Klf 4 – Sox 2 et Hox 4

Dérivation des cellules souches embryonnaires humaines J 0 J 1 J 5 J 4 blastocyste compaction J 2 J 3

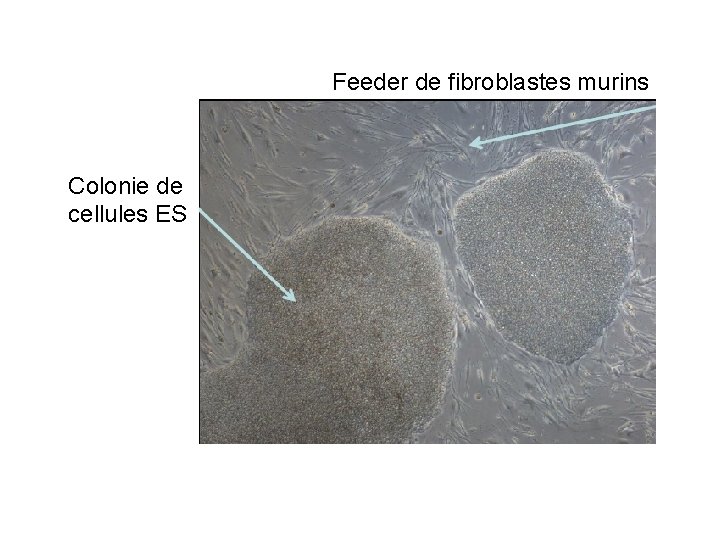
Feeder de fibroblastes murins Colonie de cellules ES

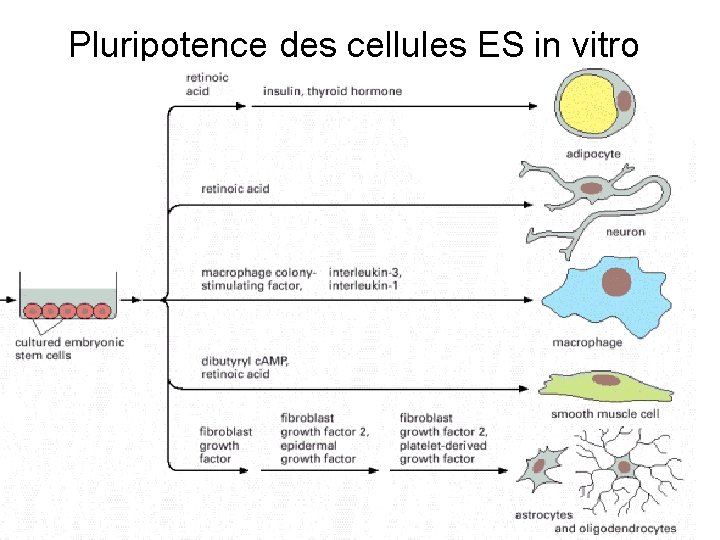
Critères pour caractériser le caractère de cellule souche ( « stemness » ) • Auto-renouvellement: – Potentiel de renouvellement illimité in vitro – Expression de facteurs de transcription caractérisant la cellule souche (nano. G, oct 4, SOX 2, TERT…) • Pluripotence in vitro: – Formation de tératomes dans la souris imunocompétente (potentiel tumoral) – Pluripotence in vitro

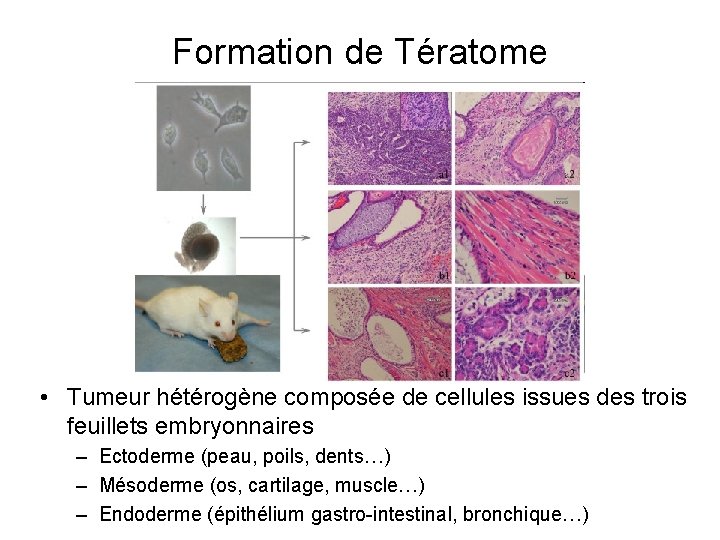
Formation de Tératome • Tumeur hétérogène composée de cellules issues des trois feuillets embryonnaires – Ectoderme (peau, poils, dents…) – Mésoderme (os, cartilage, muscle…) – Endoderme (épithélium gastro-intestinal, bronchique…)

Pluripotence des cellules ES in vitro

Cellules souches embryonnaires: – 1) Cellules ES • Dérivées du blastocyste en culture • Par transfert nucléaire d’une cellule somatique dans un œuf énucléé – 2) Cellules somatiques « reprogrammées » • « induced pluripotent stem cells » (i. PS) – TFs, Oct 4, Sox 2, c. Myc and Klf 4 – Sox 2 et Hox 4








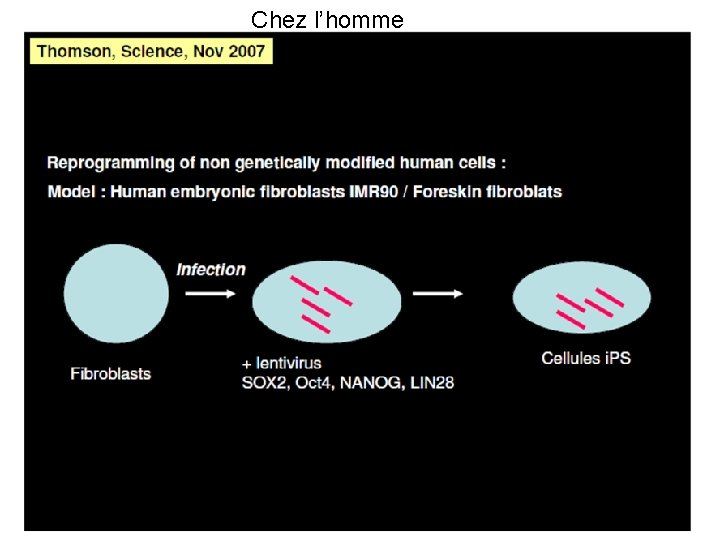
Chez l’homme

Cellules souches « adultes »

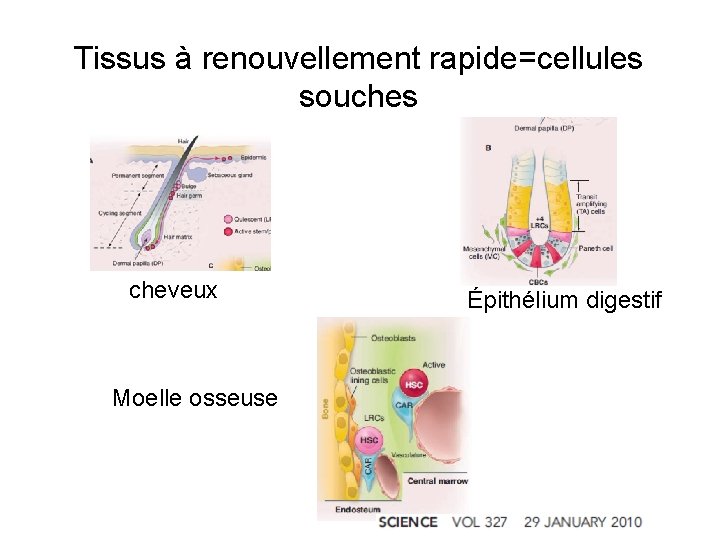
Tissus à renouvellement rapide=cellules souches cheveux Moelle osseuse Épithélium digestif

Cellules souches adultes • Les cellules souches adultes sont cruciales pour le renouvellement tissulaire • Ces cellules sont capables d’auto-renouvellement et de différenciation • L’homéostasie d’un organisme adulte résulte de l’équilibre entre: – l’état quiescent de ces cellules souches (pool de réserve) – et leur mise en cycle (amplification cellulaire pour le renouvellement tissulaire) • Modèle des cellules souches hématopoïétiques (CSH)

Modèle CSH • Durent toute la vie… • Hématopoïèse • À la base des greffes de moelle allogéniques: thérapie cellulaire de loin la plus utilisée

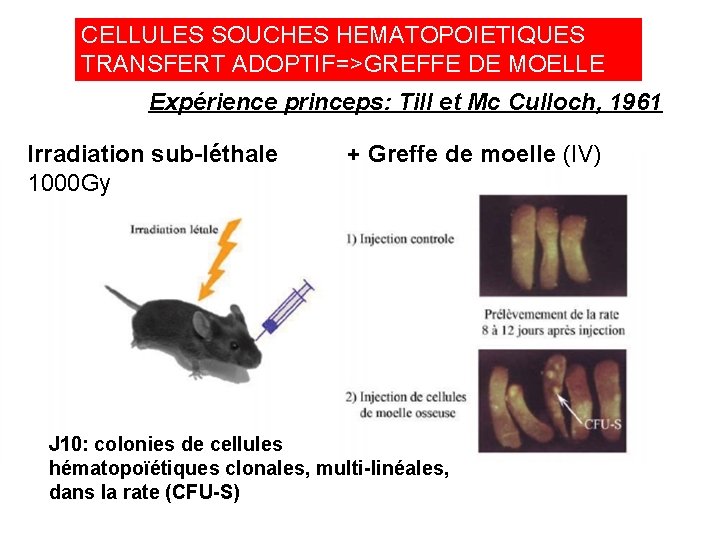
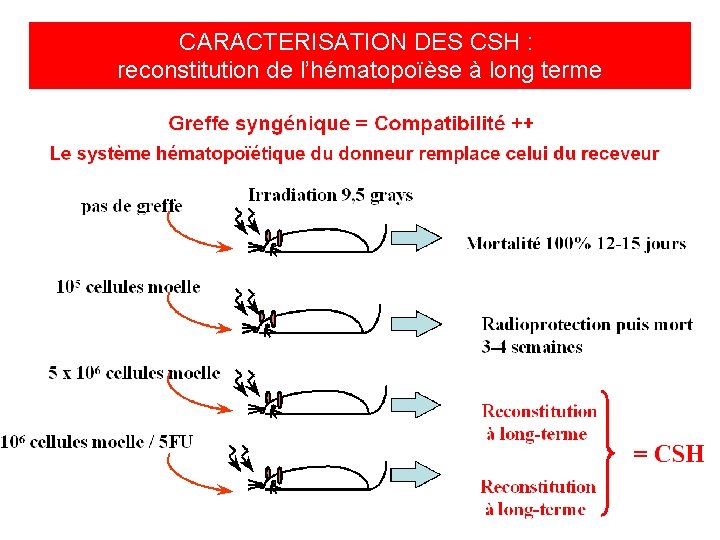
CELLULES SOUCHES HEMATOPOIETIQUES TRANSFERT ADOPTIF=>GREFFE DE MOELLE Expérience princeps: Till et Mc Culloch, 1961 Irradiation sub-léthale 1000 Gy + Greffe de moelle (IV) J 10: colonies de cellules hématopoïétiques clonales, multi-linéales, dans la rate (CFU-S)

CARACTERISATION DES CSH : reconstitution de l’hématopoïèse à long terme

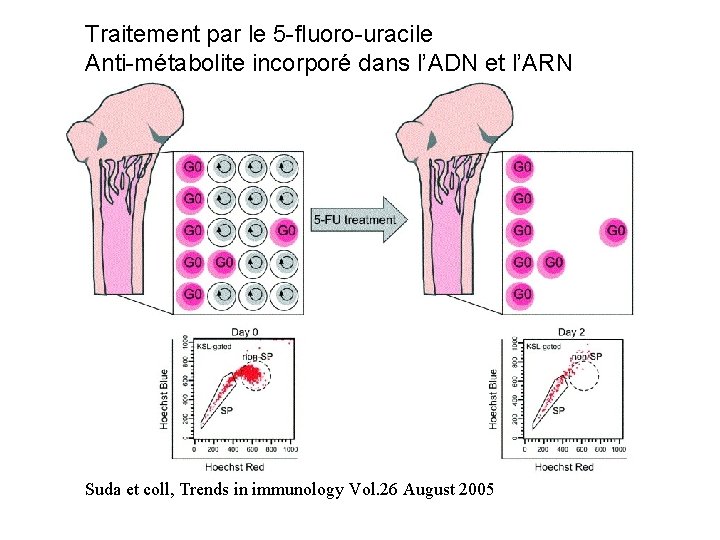
Traitement par le 5 -fluoro-uracile Anti-métabolite incorporé dans l’ADN et l’ARN Suda et coll, Trends in immunology Vol. 26 August 2005

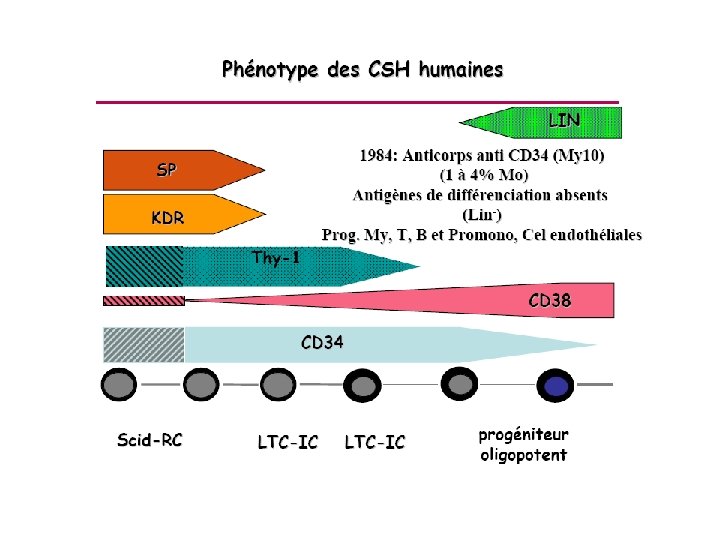
Tri des cellules par cytomètre en flux • Identification d’une fraction cellulaire capable de reconstituer l’hématopoïèse : contient les cellules souches – Cellules quiescentes – Très rares: ~1/10. 000 cellules – Indifférenciées: « lineage negatives » (Lin-) – Capables d’effluer des colorants (Rhodamine, Hoechst) par des transporteurs ABC: ABSG 2 et MDR 1 – Expriment (CD 34+), CD 133, c-kit

• Dans la M. O , le nombre de CSH reste Caractéristiques des CSH relativement constant en l’absence de perte de sang ou d’autres traumatismes • L’état de quiescence corrèle avec leur caractère multipotent • 2 modèles pour expliquer l’homéostasie de l’hématopoïèse

Modèle A: • Dans des conditions normales, ces CSH sont quiescentes (G 0 du cycle cellulaire), mais se divisent régulièrement, – pour assurer la maintenance du pool de CSH – Permet d’éviter d’acquérir des mutations conduisant à leur transformation maligne – Division asymétrique: • 1 CSH => 1 CSH + 1 cellule qui va s’engager dans la différencation Linheng

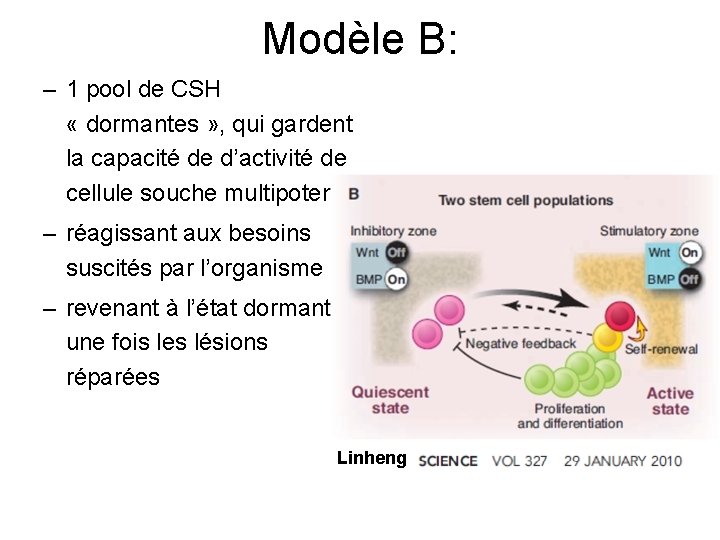
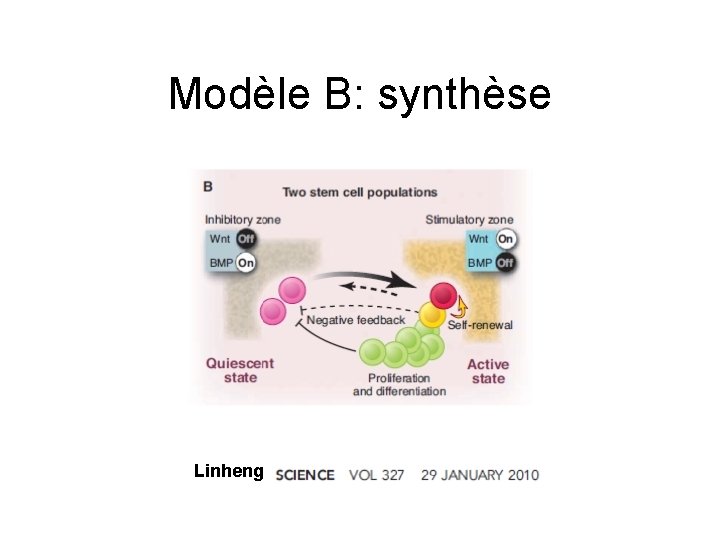
Modèle B: – 1 pool de CSH « dormantes » , qui gardent la capacité de d’activité de cellule souche multipotentes – réagissant aux besoins suscités par l’organisme – revenant à l’état dormant une fois les lésions réparées Linheng

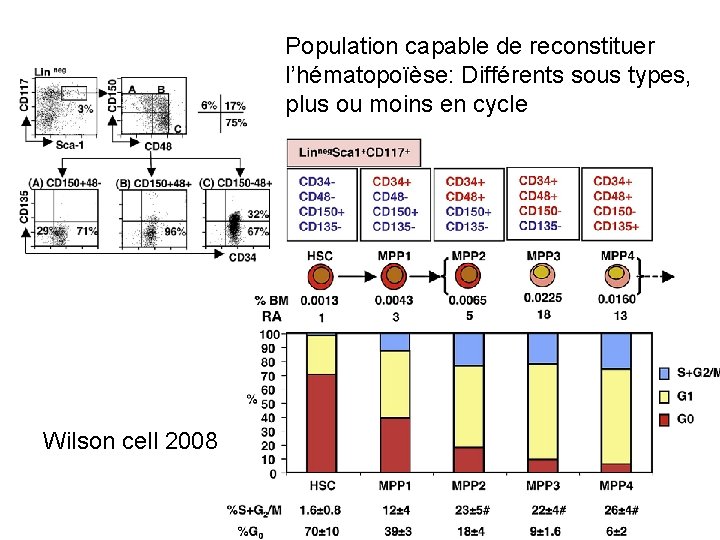
Population capable de reconstituer l’hématopoïèse: Différents sous types, plus ou moins en cycle Wilson cell 2008

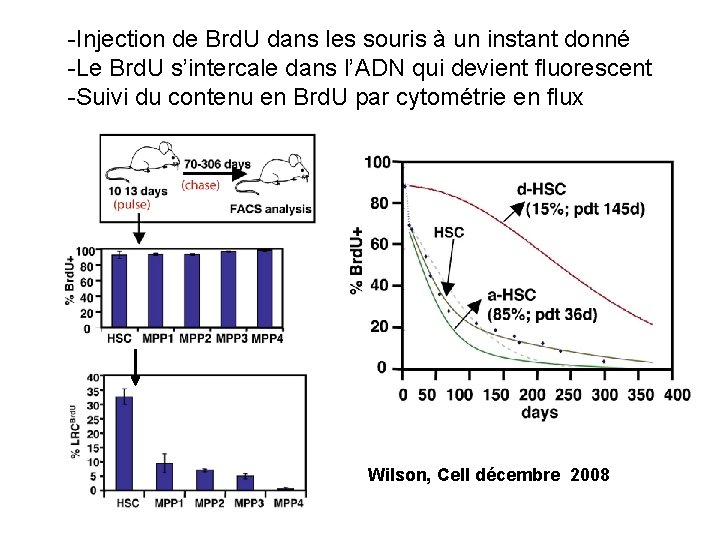
-Injection de Brd. U dans les souris à un instant donné -Le Brd. U s’intercale dans l’ADN qui devient fluorescent -Suivi du contenu en Brd. U par cytométrie en flux Wilson, Cell décembre 2008

Modèle B: synthèse Linheng

Organisation de la moelle hématopoïétique


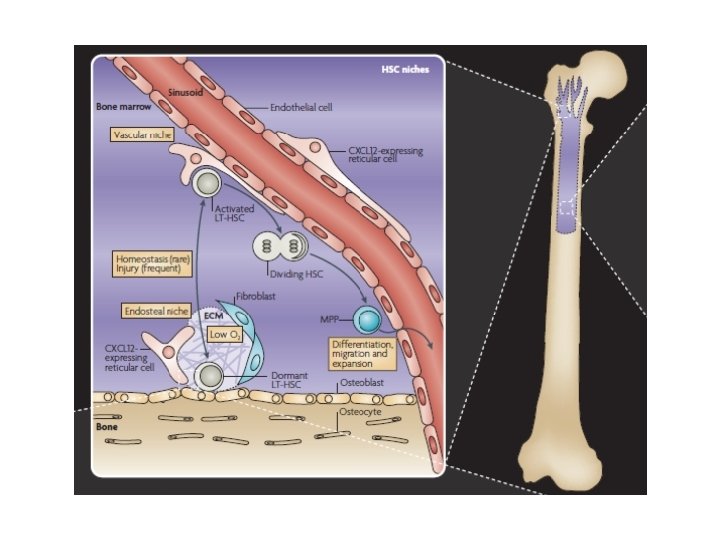
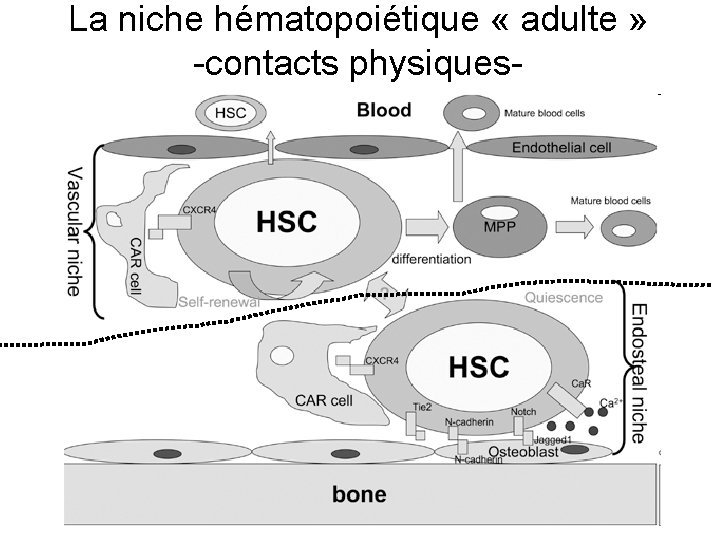
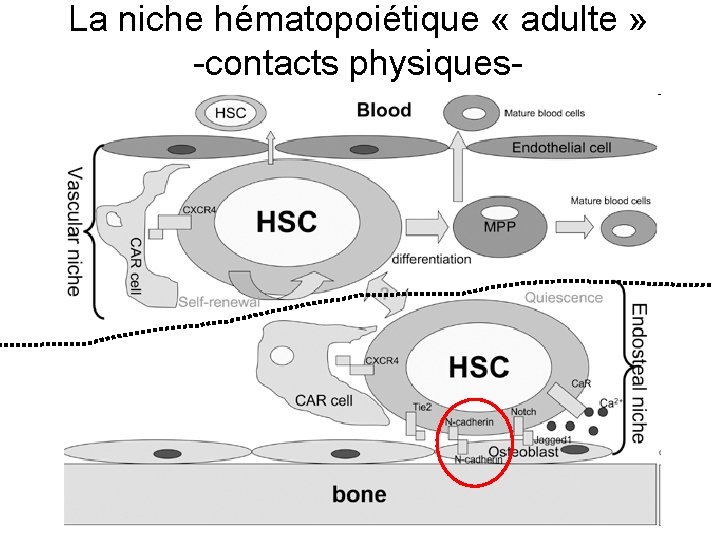
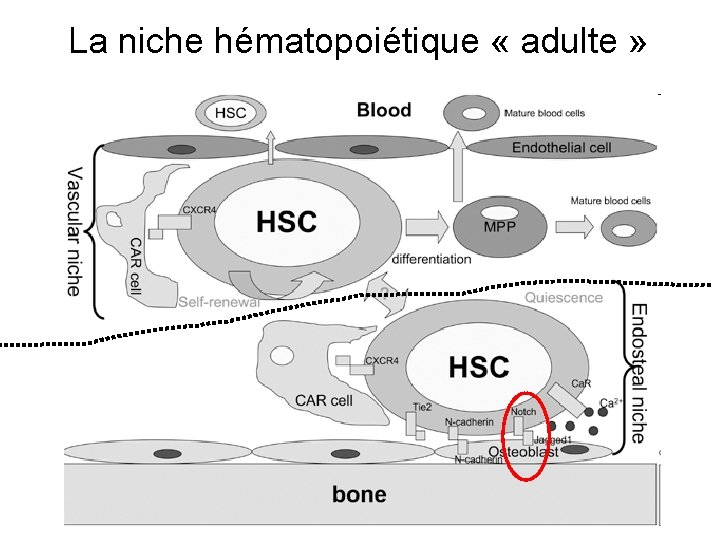
Niche ostéoblastique À l’interface os/moelle: Les ostéoblastes: -fabriquent la trame osseuse -supportent le développement des CSH: *Un déficit ostéoblastique entraîne une diminution importante de l’hématopoïèse (Visnjic, 2004) *La co-transplantation de d’ostéoblastes avec les cellules souches augmente la prise de greffe (Tachman, Hematology 2000) Cellules souches Lin- : -marquées à la fluorescéine - Injectée à une souris témoin -analyse 15 h après Localisation des cellules souches au niveau de l’endostéum, au contact des ostéoblastes => Interactions préférentielles Nilsson, S. K. et al. Blood 2001

La niche hématopoiétique « adulte » -contacts physiques-

La niche hématopoiétique « adulte » -contacts physiques-

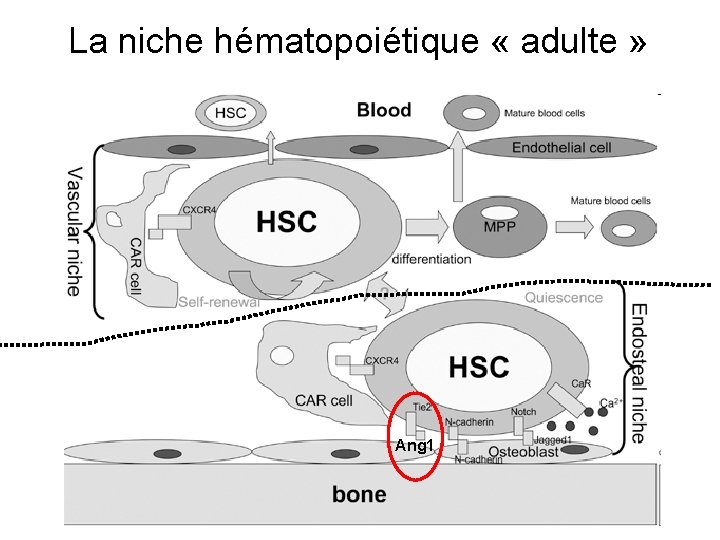
La niche hématopoiétique « adulte » Ang 1

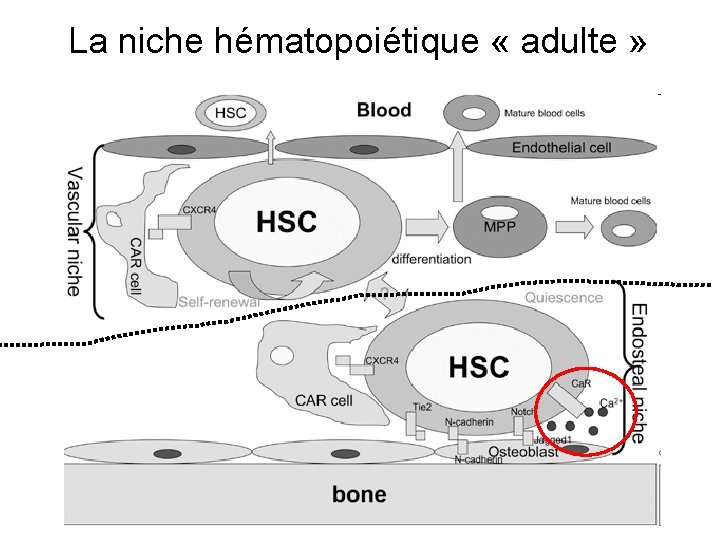
La niche hématopoiétique « adulte »

La niche hématopoiétique « adulte »

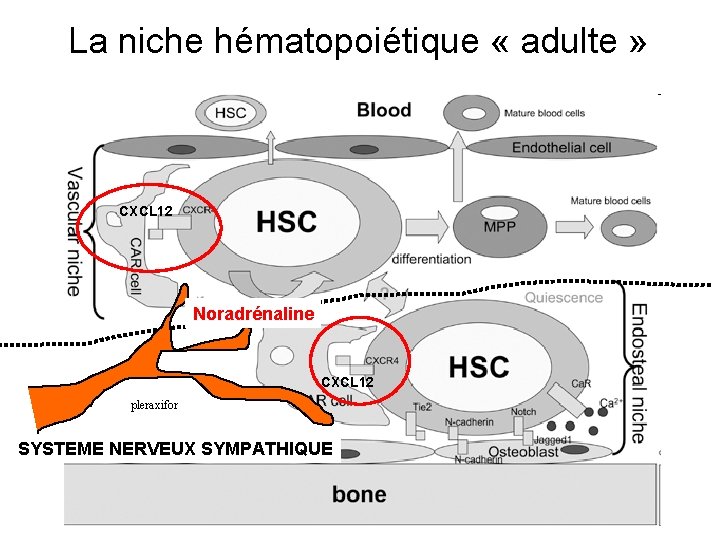
La niche hématopoiétique « adulte » CXCL 12 Noradrénaline CXCL 12 pleraxifor SYSTEME NERVEUX SYMPATHIQUE

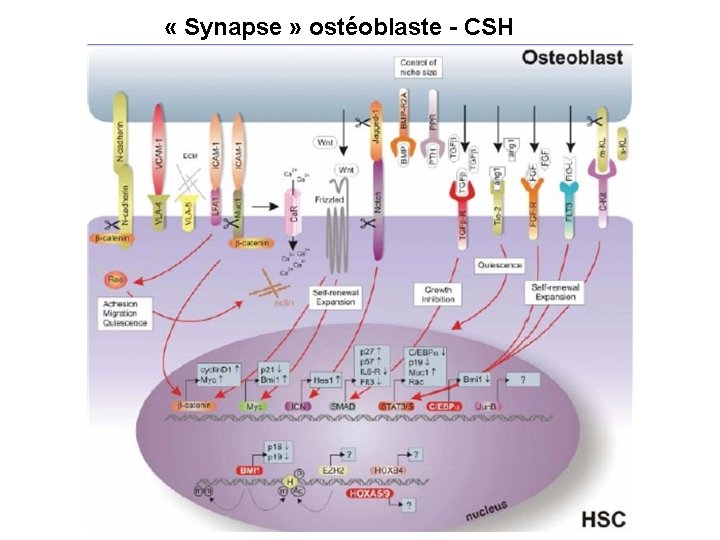
« Synapse » ostéoblaste - CSH

Synthèse • Les CSH intègrent des signaux qui proviennent de l’interaction avec: – les ostéoblastes, les cellules réticulaires (mésenchymateuses) – mais aussi du micro-environnement médullaire qui est ouvert notamment en raison de la riche vascularisation de la moelle osseuse – Les cellules en cours de différenciation • comment peut s’opérer la différenciation et l’expansion des cellules hématopoïétiques?

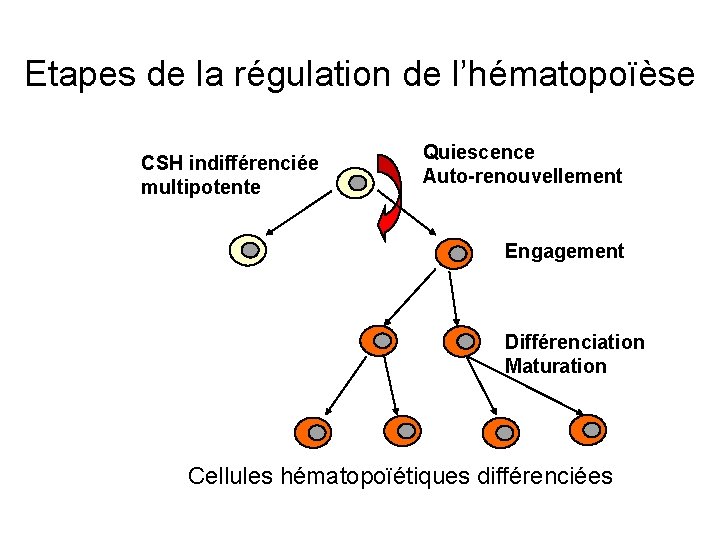
Etapes de la régulation de l’hématopoïèse Quiescence Auto-renouvellement CSH indifférenciée multipotente Engagement Différenciation Maturation Cellules hématopoïétiques différenciées

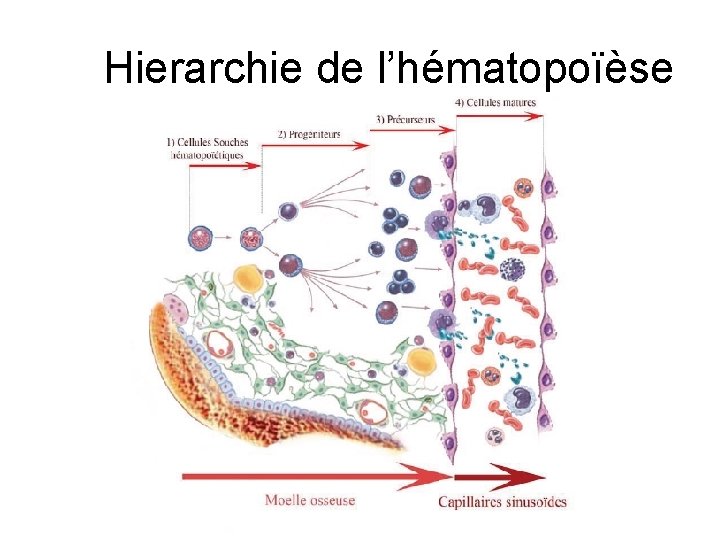
Hierarchie de l’hématopoïèse

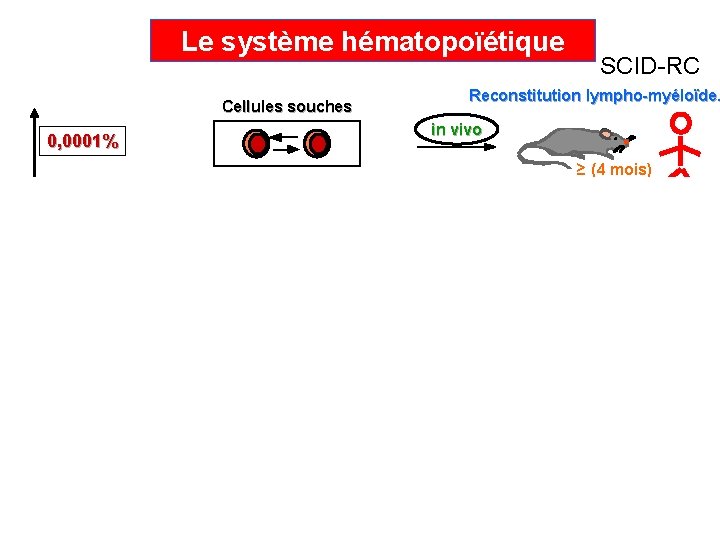
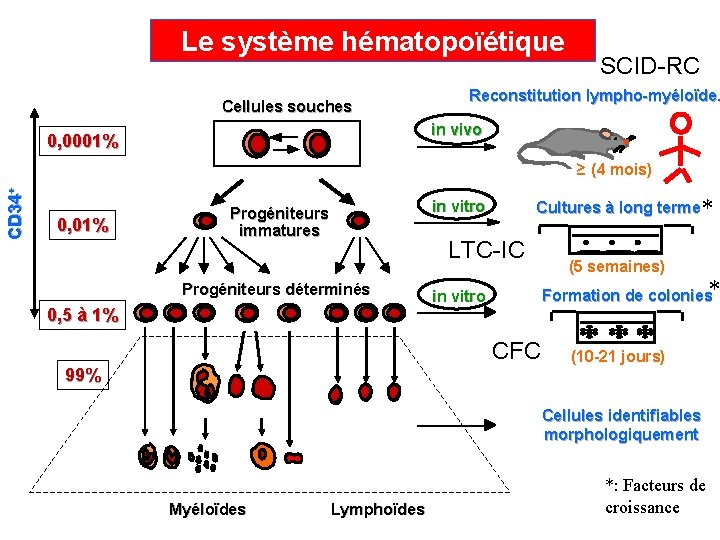
Le système hématopoïétique Cellules souches SCID-RC Reconstitution lympho-myéloïde. in vivo 0, 0001% CD 34+ ≥ (4 mois) 0, 01% Cultures à long terme* in vitro Progéniteurs immatures LTC-IC Progéniteurs déterminés 0, 5 à 1% Formation de colonies* in vitro CFC 99% (5 semaines) (10 -21 jours) Cellules identifiables morphologiquement Myéloïdes Lymphoïdes *: Facteurs de croissance

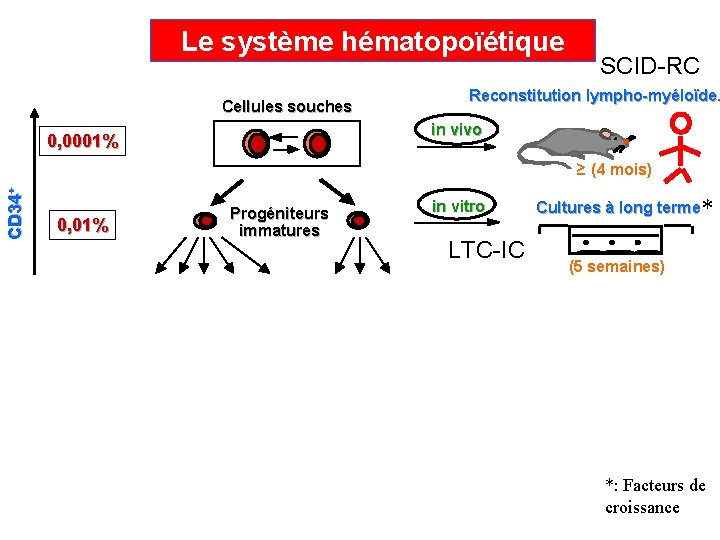
Le système hématopoïétique Cellules souches SCID-RC Reconstitution lympho-myéloïde. in vivo 0, 0001% CD 34+ ≥ (4 mois) 0, 01% Cultures à long terme* in vitro Progéniteurs immatures LTC-IC Progéniteurs déterminés 0, 5 à 1% Formation de colonies* in vitro CFC 99% (5 semaines) (10 -21 jours) Cellules identifiables morphologiquement Myéloïdes Lymphoïdes *: Facteurs de croissance

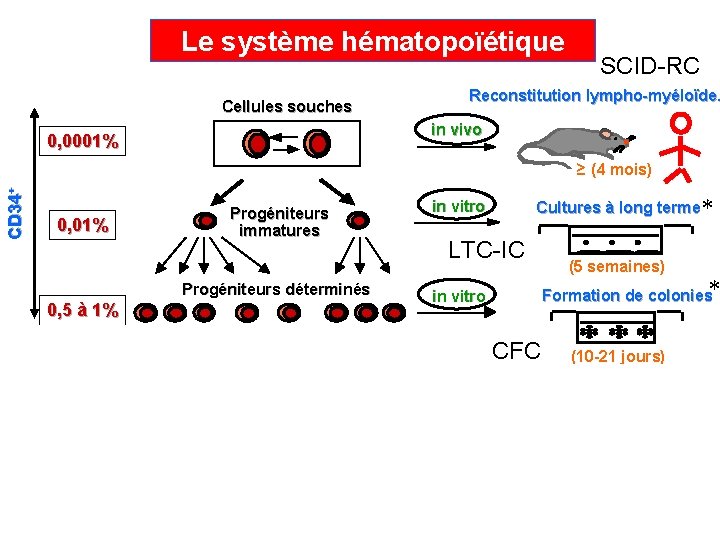
Le système hématopoïétique Cellules souches SCID-RC Reconstitution lympho-myéloïde. in vivo 0, 0001% CD 34+ ≥ (4 mois) 0, 01% Cultures à long terme* in vitro Progéniteurs immatures LTC-IC Progéniteurs déterminés 0, 5 à 1% Formation de colonies* in vitro CFC 99% (5 semaines) (10 -21 jours) Cellules identifiables morphologiquement Myéloïdes Lymphoïdes *: Facteurs de croissance

Le système hématopoïétique Cellules souches SCID-RC Reconstitution lympho-myéloïde. in vivo 0, 0001% CD 34+ ≥ (4 mois) 0, 01% Cultures à long terme* in vitro Progéniteurs immatures LTC-IC Progéniteurs déterminés 0, 5 à 1% Formation de colonies* in vitro CFC 99% (5 semaines) (10 -21 jours) Cellules identifiables morphologiquement Myéloïdes Lymphoïdes *: Facteurs de croissance


Comment ces mécanismes se mettent-ils en place? • Régulation simultanée: – – Auto-renouvellement de la CSH Engagement dans la différenciation Spécification de la lignée Homéostasie • Mécanismes: – Machinerie transcriptionnelle (intrinsèque) – Signaux extrinsèques: cytokines, facteurs de croissance

INDUCTION ET MISE EN ROUTE DU PROGRAMME DE DIFFERENTIATION

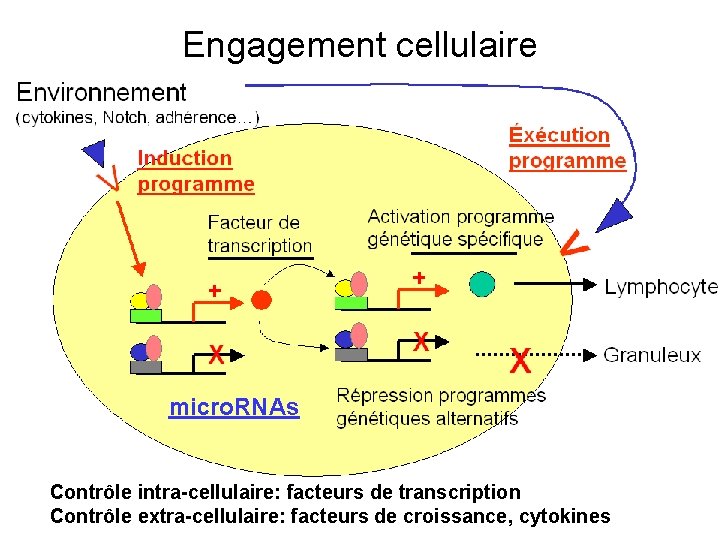
Engagement cellulaire micro. RNAs Contrôle intra-cellulaire: facteurs de transcription Contrôle extra-cellulaire: facteurs de croissance, cytokines

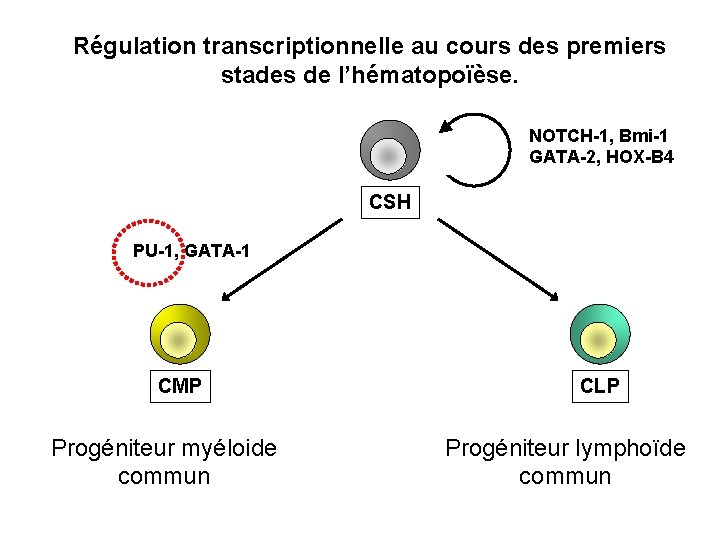
Régulation transcriptionnelle au cours des premiers stades de l’hématopoïèse. NOTCH-1, Bmi-1 GATA-2, HOX-B 4 CSH PU-1, GATA-1 CMP Progéniteur myéloide commun CLP Progéniteur lymphoïde commun

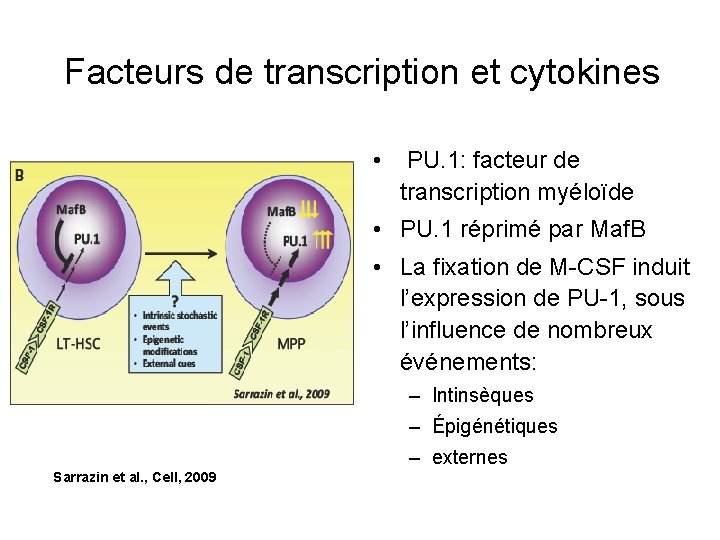
Facteurs de transcription et cytokines • PU. 1: facteur de transcription myéloïde • PU. 1 réprimé par Maf. B • La fixation de M-CSF induit l’expression de PU-1, sous l’influence de nombreux événements: – Intinsèques – Épigénétiques – externes Sarrazin et al. , Cell, 2009

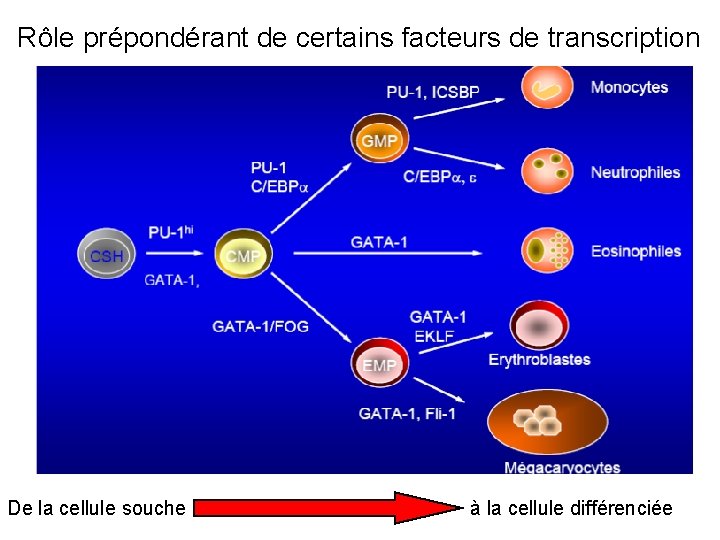
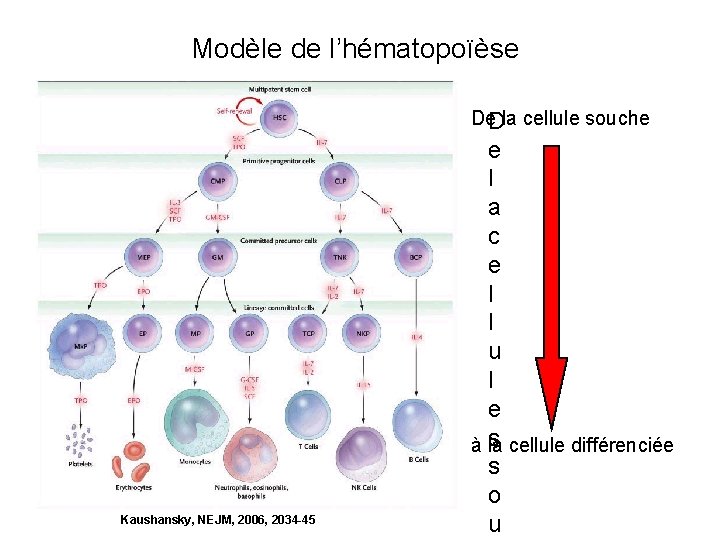
Rôle prépondérant de certains facteurs de transcription De la cellule souche à la cellule différenciée

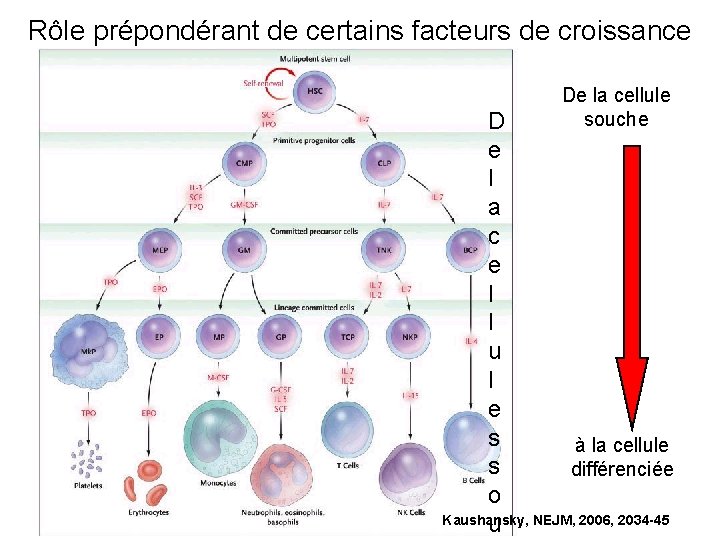
Rôle prépondérant de certains facteurs de croissance De la cellule souche D e l a c e l l u l e s à la cellule s différenciée o Kaushansky, NEJM, 2006, 2034 -45 u

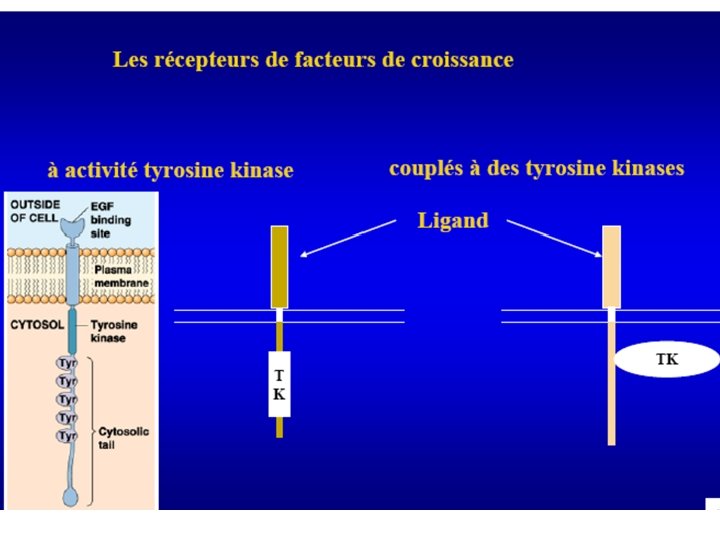
Facteurs de croissance hématopoïétiques • • glycoprotéines monomères (sauf IL-5 et M-CSF, dimères) • • Redondance synthèse par un grand nombre de cellules (sauf l'érythropoïétine ou EPO, qui n'est élaborée que par le rein): Lymphocytes, fibroblastes, monocytes, cellules endothéliales, lymphocytes T et B, d' ou leur nom « cytokines » Synergies : – Nécessité de plusieurs signaux différents pour la mise en cycle des progéniteurs – Réponses prolifératives additives – Effets distincts et multiples d'une cytokines sur des cibles cellulaires différentes. • • action locale ( hormone): endocrine, paracrine, autocrine. Agissent sur un récepteur spécifique: – Niveau d'expression des récepteurs régulé (+ ou -). – dimérisation du récepteur – transduction d ’un signal via la phosphorylation du récepteur et des protéines associées vers le noyau – activation de la transcription de gènes donnés



Facteurs de croissance Hématopoïétiques (1) • Facteurs de promotion et de survie cellulaire, ex: – Stem cell factor (SCF) = kit ligand: – Viabilité des progéniteurs immatures et myéloïdes – Croissance des progéniteurs immatures myéloides et erythroblastiques avec d’autres cytokines – Indispensable à l’erythropoièse fœtale (foie) – FLT-3 ligand: – Croissance des progéniteurs immatures myéloides et mégacaryocytaires

Facteurs de croissance Hématopoïétiques (2) • Facteurs de prolifération et de différenciation, ex: – Non spécifiques de lignée: – Interleukine -3 (IL-3) : action sur toute la myélopoïèse – Interleukine 6 sur tous les progéniteurs – Spécifiques de lignée: – Granuleux/macrophagiques: GM-CSF, G-CSF, M-CSF – – lignée éosinophile : IL-5 lignée érythroïde : érythropoïétine (Epo) lignée méga : thrombopoïétine (Tpo) lignée lymphocytaire : – maturation : IL-2, IL-4, – croissance : IL-7 – différenciation plasmocytaire : IL-6

Modèle de l’hématopoïèse De la cellule souche D Kaushansky, NEJM, 2006, 2034 -45 e l a c e l l u l e s à la cellule différenciée s o u

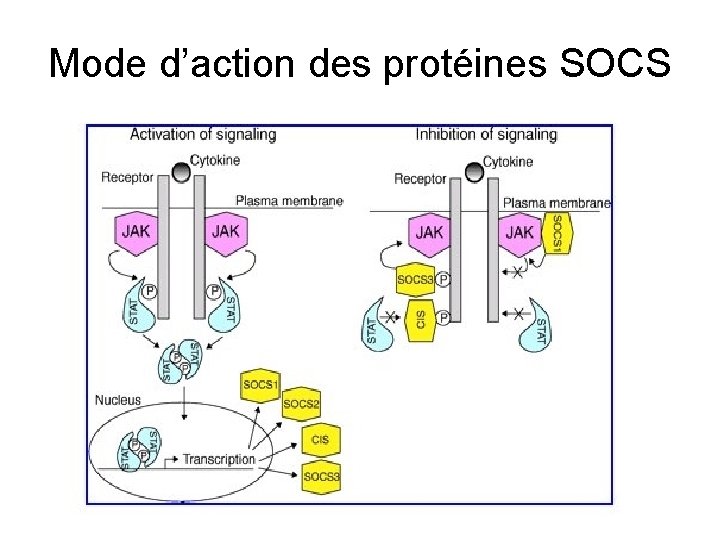
Régulation négative de l’hématopoièse • TGF b (Transforming Growth Factor b ): un inhibiteur de l'entrée en cycle cellulaire des progéniteurs primitifs • TNF a (Tumour Necrosis Factor a ) agit en fait de manière différente (action inhibitrice ou stimulante) suivant les facteurs de croissance • MIP 1 a (Macrophage-Inflammatory Protein 1 a ) ne limite pas son action au tissu hématopoïétique et se trouve impliqué dans de nombreux processus inflammatoires. • Protéines SOCS (Suppressors Of Cytokine Signaling: SOCS 1 -3, CIS) – La synthèse des SOCS est induite très rapidement in vivo et in vitro (apparition de m. RNA) en réponse à la stimulation des cellules cibles par les cytokines comme IL 2, IL-3, IL-4, IL-6, interferon-g, EPO, GCSF, GM-CSF, Prolactine, Hormone de croissance.

Mode d’action des protéines SOCS

Synthèse de la différenciation des CSH • CSPH médullaires qui vont se différentier vers – – polynucléaires PNN ou PNE ou PNB, Globules rouges (GR) Mégacaryocytes (plaquettes) Lymphocytes (B, T, NK) • action intriquée de nombreux facteurs – Facteurs de croissance, interleukines – Molécules d’adhésion – Facteurs de transcription • 2 modèles d’étude: – Par les gènes spécifiques de la lignée – Par les déficits • Pathologies • Souris KO