Chemische Reaktion und Zeichensprache Massenerhaltung Auch wenn wir




































- Slides: 37

Chemische Reaktion und Zeichensprache

Massenerhaltung • Auch wenn wir das Gefühl haben, Materie verschwinde, zum Beispiel beim Verbrennen eines Stoffes wie Holz, wird sie dies nie tun. • Die Masse der Ausgangsstoffe einer chemischen Reaktion stimmt mit der Masse der Reaktionsprodukte überein. Chemie M. Hügli

Massenerhaltung • Beim Verbrennen von Holz geht die Masse des Holzes in die Masse des Wassers und des Kohlenstoffdioxids über. • Die Stoffe verbinden sich immer nur in einem bestimmten MAssenverhältnis: • Wasserstoff H 2 und Sauerstoff O 2 im Verhältnis 2: 1 H 2 O • Kupfer Cu und Schwefel S 4: 1 Chemie M. Hügli

Atomvorstellung nach Dalton • Dalton stellte sich die kleinsten Teilchen (Atome) wie folgt vor: • Kleine Kugeln • Unzerstörbar • Alle Atome eines Elements sehen gleich aus • Andere Elemente haben andere Atome Chemie M. Hügli

Dalton-Atommodell • Chemische Reaktionen: Atome werden nicht zerstört, sondern nur anders gruppiert. • Erhaltung der Masse Chemie M. Hügli

Masse von Atomen • Atome haben eine unvorstellbar kleine Masse. • Die Masse eines einzelnen Wasserstoffatoms H beträgt: 0, 000 000 001 674 g • = 1, 674 * 10 -23 • Weil es zu kompliziert wäre mit so kleinen Mengen zu rechnen führte Dalton das u= „unit“ ein. Chemie M. Hügli

Atommasse • 1 u= 0, 000 000 001 661 g • Diese Masse entspricht dem 12. Teil der Masse des Kohlenstoffatoms C. Chemie M. Hügli

Atommassenbestimmung • Als Modell: Kugeln mit verschiedener Masse werden unterschiedlich stark von ihren Bahn durch ein Luftgebläse abgelenkt. • Atome werden aufgrund ihrer unterschiedlichen Grösse aufgrund elektrischer Kräfte verschieden stark von der Bahn abgelenkt. Chemie M. Hügli

Edelgase und Moleküle • Edelgase kommen immer als einzelne Atome vor, weil sie sich mit keinem anderen Stoff, also auch nicht mit sich selber verbinden. • Andere bei RT gasförmige Stoffe kommen als Moleküle (2 Atome) vor. Chemie M. Hügli

Moleküle • Moleküle sind Verbindungen von mehreren Atomen. • Es sind immer Atome von Nichtmetallen. • Es können auch mehrere Atome des gleichen Elements sein. Chemie M. Hügli

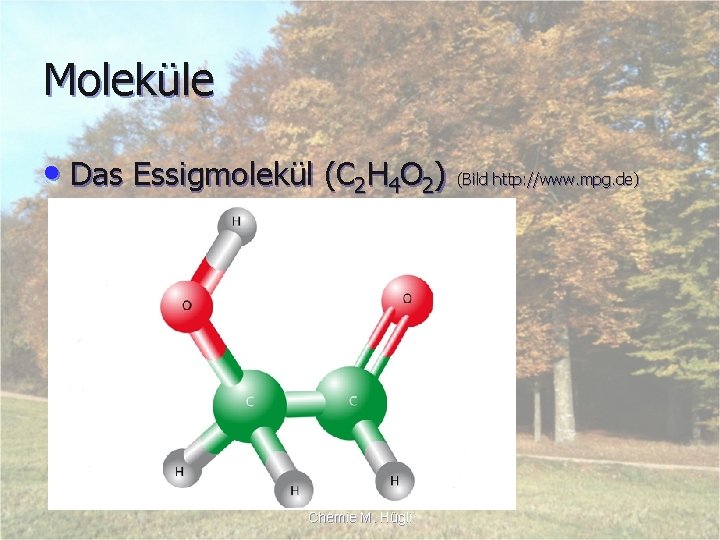
Moleküle • Das Essigmolekül (C 2 H 4 O 2) (Bild http: //www. mpg. de) Chemie M. Hügli

Symbollehre • H 2 = Wasserstoff 1 NM Chemie M. Hügli

Symbollehre • O 2 = Sauerstoff 8 NM Chemie M. Hügli

Symbollehre • N 2 = Stickstoff 7 NM • Hauptbestandteil unserer Atemluft Chemie M. Hügli

Symbollehre • C = Kohlenstoff 6 NM Chemie M. Hügli

Symbollehre • Cu = Kupfer 29 M Chemie M. Hügli

Symbollehrer • Ca = Calcium 20 M (Bild: http: //de. wikipedia. org) Chemie M. Hügli

Symbollehre • Cr = Chrom 24 M Chemie M. Hügli

Symbollehre • Fe = Eisen 26 M Chemie M. Hügli

Symbolehre • S = Schwefel 16 NM Chemie M. Hügli

Symbollehre • Ag = Silber 47 M Chemie M. Hügli

Symbollehre • Au = Gold 79 M Chemie M. Hügli

Symbollehre • Al = Aluminium 13 M Chemie M. Hügli

Symbollehre • Na = Natrium 11 M Chemie M. Hügli

Symbollehre • F 2 = Fluor 9 NM Chemie M. Hügli

Molekülschreibweise • Man kann bei der Molekülschreibweise immer ablesen, wieviele Atome beteiligt sind. • H 2 O bedeutet: Ein Wassermolekül besteht aus 2 Wasserstoffatomen (H 2) und einem Sauerstoffatom (O) • 4 H 2 O bedeutet: 4 Wassermoleküle (4 H 2 O). Es sind also gesamthaft 8 Wasserstoffatome. Chemie und 4 Sauerstoffatome. M. Hügli

Atomzahlenverhältnis • Das Atomzahlenverhältnis gibt immer an, in welchem Verhältnis die Atome zueinander in einer Verbindung vorkommen. • Diese Zahl wird immer tief geschrieben: C 2 H 4 O 2 • Beim Essigmolekül Atomverhältnis: 2 Kohlenstoff : 4 Wasserstoff : 2 Sauerstoff Chemie M. Hügli

Atomzahlenverhältnis • Man darf hier nicht wie in der Mathematik die Verhältnisse kürzen! • CH 2 O wäre ein anderer Stoff! (Formaldehyd) Chemie M. Hügli

Verhältnisformel • Eine Verhältnisformel gibt also an, wie die Verhältnisse der Atome der einzelnen Verbindungen sind. Chemie M. Hügli

Molekül- vs Ionenbindungen • Molekülbindungen bestehen immer aus Verbindungen von Nichtmetallen. • Ionenbindungen bestehen immer aus einem Metall und einem Nichtmetall. • Bei Ionenbindungen schreibt man das Metall immer zuerst. Na. Cl = Natriumchlorid (Natrium das Metall, Chlor das Nichtmetall) Chemie M. Hügli

Ionenbindungen • Beispiele von Ionenbindungen: • Magnesiumoxid Mg. O • Kupfersulfid Cu 2 S • Natriumoxid Na 2 O • Natriumchlorid Na. Cl Chemie M. Hügli

Wertigkeit • Die Wertigkeit gibt an, wie viele Wasserstoffatome H an das jeweilige Atom gebunden werden können. • Oder anders gesagt, wie viele Elektronen verschoben werden können. • Ein Chloratom kann 1 Wasserstoff an sich binden, es ist also einwertig. HCl (Chlorwasserstoff, als Säure: Salzsäure) Chemie M. Hügli

Wertigkeit • Ein Sauerstoffatom O kann 2 Wasserstoffatome an sich binden. Sauerstoff ist also zweiwertig. • H 2 O: Wasser • Ein Stickstoffatom N kann 3 Wasserstoffatome an sich binden. Stickstoff ist dreiwertig. • NH 3 : Ammoniak Chemie M. Hügli

Wertigkeit • Werden zweiwertige Atome mit einem anderen Atom verbunden und es geht auf, dann muss es sich bei diesem um ein vierwertiges Atom handeln. • Beispiel: O kann 2 H an sich binden, ist also zweiwertig. Werden nun 2 O mit C verbunden, so muss C vierwertig sein. CO 2. Chemie M. Hügli

Wertigkeit • Vor allem Metalle der Nebengruppen können mehrer Wertigkeiten haben. • Kommt in einem Molekülnamen die Silbe „mono“ vor deutet dies auf einzelnes Atom hin. Beispiel Kohlenstoffmonoxid CO (ein Sauerstoffatom) • Die Silbe „di“ steht für zwei Atome. Beispiel: Kohlenstoffdioxid CO 2. Chemie M. Hügli

Massenverhältnisse • Versuch mit Silberoxid: • Im Silberoxid konstantes Massenverhältnis: Silber Ag / Sauerstoff O = 13, 5 • 13, 5 g Ag kommen auf 1 g O • Atommassen im PSE Ag: 108 u / O: 16 u = 6, 75/1 • Vom Ag braucht es also zwei. Formel: Ag 2 O Chemie M. Hügli

Reaktionsgleichung • Eisen (III)-oxid + Aluminium Eisen +Aluminiumoxid • Fe 2 O 3 + Al Fe + Al 2 O 3 • Fe 2 O 3 + 2 Al 2 Fe + Al 2 O 3 Chemie M. Hügli
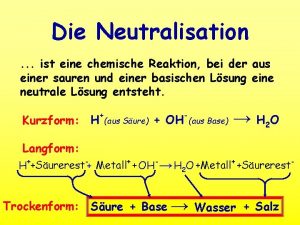
 Was ist die neutralisation
Was ist die neutralisation Zünden wir ein lichtlein an
Zünden wir ein lichtlein an Zünden wir ein lichtlein an
Zünden wir ein lichtlein an Wir sind nicht mehr was wir mal waren
Wir sind nicht mehr was wir mal waren Teloglia
Teloglia Bindung
Bindung Voorbeelden van chemische energie
Voorbeelden van chemische energie Exotherme reactie grafiek
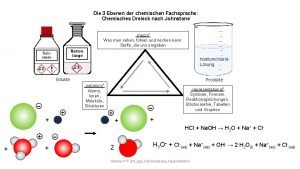
Exotherme reactie grafiek Dreieck chemie
Dreieck chemie Chemische formel schokolade
Chemische formel schokolade Mefigyn
Mefigyn Avogadros konstant
Avogadros konstant Aufbau hühnerei
Aufbau hühnerei Fenton reaktion
Fenton reaktion Radikalische substitution
Radikalische substitution Beskriv fotosyntesen med ord
Beskriv fotosyntesen med ord Reaktionsgleichung kalkwasserprobe
Reaktionsgleichung kalkwasserprobe Cola mentos
Cola mentos Bornträger reaktion
Bornträger reaktion Energiediagramm exotherme reaktion mit und ohne katalysator
Energiediagramm exotherme reaktion mit und ohne katalysator Ureaplasma selbstheilung
Ureaplasma selbstheilung Spændingsrækken metaller
Spændingsrækken metaller Kupferoxid ethanol reaktionsgleichung
Kupferoxid ethanol reaktionsgleichung Chemie einfach alles
Chemie einfach alles Briggs rauscher reaktion
Briggs rauscher reaktion Geschwindigkeitskonstante
Geschwindigkeitskonstante Sag bloß du hast auch noch ein motorrad dabei
Sag bloß du hast auch noch ein motorrad dabei Auch dornteufel genannte australische echse
Auch dornteufel genannte australische echse Wohin gehts du
Wohin gehts du Nicht nur sondern auch
Nicht nur sondern auch Wer nicht arbeiten will soll auch nicht essen
Wer nicht arbeiten will soll auch nicht essen Es ist nicht genug zu wissen
Es ist nicht genug zu wissen Deshalb slovosled
Deshalb slovosled Reale bedingungssätze
Reale bedingungssätze Wenn du ein dach über dem kopf hast
Wenn du ein dach über dem kopf hast Wenn die vorhaut zuhaut
Wenn die vorhaut zuhaut Wenn's um geld geht
Wenn's um geld geht Und wenn morgen die welt untergeht
Und wenn morgen die welt untergeht